基于网络药理学和体外实验探析盐酸药根碱对人骨肉瘤的机制研究*
2024-01-12赵冰洁宁志丰
赵冰洁,阮 英,宁志丰
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院临床医学院皮肤科教研室;3.湖北科技学院医学部基础医学院)
人骨肉瘤(human osteosarcoma,HOS)又名成骨肉瘤,好发于儿童和青少年,可以直接产生骨样组织的原发性骨恶性肿瘤,其发病率在原发性恶性骨肿瘤中占据首位[1]。其初期症状为间断性的疼痛和肿胀,随后发展为无法缓解的持续性疼痛,并伴有局部炎性反应、病理性骨折等多种临床表现[2]。目前,临床尚无确切的预防和治疗措施。
盐酸药根碱(jatrorrhizine hydrochloride,JH)又名药根碱盐酸盐,是中药黄连中的主要有效成分之一,用于防治代谢紊乱,研究[3]显示JH具有抗心律失常及调节脂肪细胞糖脂代谢的作用。研究[4]表明,JH具有多种抗肿瘤作用,尤其以抗黑色素瘤、前列腺癌、乳腺癌和白血病作用显著。本文基于网络药理学,确定了JH抗HOS的潜在靶点,并通过体外细胞实验初步阐明了JH的药效,为HOS的治疗提供了思路及科学理论依据。
1 材料与方法
1.1 网络药理预测及分子对接
1.1.1 JH靶点的筛选
以“Jatrorrhizine hydrochloride”为关键词,应用药物靶点数据库BATMAN (http://bionet.ncpsb.org.cn/batman-tcm),搜索获得JH药物结构,通过PubChem、SwissTargetPrediction、Targetnet、PharmMapper数据库预测JH的作用靶点,合并各个药物数据库靶点后,删除重复数据。所有目标蛋白名称均经过UniProt数据库校正,校正后的靶点名称为JH的潜在靶点。
1.1.2 HOS疾病靶点的筛选
以“Human osteosarcoma”为关键词,基于Gene Cards(https://www.genecards.org)、OMIM(http://www.omim.org)数据库查找HOS相关靶点,并且以HOS靶点和JH预测靶点绘制韦恩图,得到药物-疾病共同靶点。
1.1.3 构建JH靶点网络及构建蛋白相互作用网络和拓扑学分析
运用STRING数据库构建药物-靶点-疾病可视化网络和蛋白质相互作用PPI网络图,用Cytoscape软件得到PPI网络图,连线越密集,说明作用越大,进而进行拓扑分析,计算出度值(degree)、接近中心性(closeness centrality,CC)和中介中心性(betweenness centrality,BC),作为筛选条件,通过筛选得到关键靶点,并对关键靶点进行排序,以上值越高表明靶标越重要。
1.1.4 GO功能富集与KEGG通路富集分析
为了挖掘JH对癌症的干预机制,将交集靶点导入DAVID(http://david.ncifcrf.gov)数据库,设置物种为“Homo sapiens”,获取靶点-通路信息,设置(P<0.05),使用微生信在线网站(https://www.bioinformatics.com.cn)对交集靶点进行GO与KEGG通路富集分析,并对JH主要抗癌通路进行分析。GO富集分析包括3个不同的生物学方面,即生物过程(BP)、分子功能(MF)和细胞成分(CC)。
1.1.5 JH与关键作用靶点分子对接
关键作用靶点蛋白从蛋白质数据库PDB(https://www.rcsb.org)中获得。使用AutoDock vina 1.5.6软件进行JH与关键作用靶点的分子对接,选择结合能最低的结合模式进行进一步分析。用Autodock-vi-na进行分子对接,使用Pymol软件对最佳结果进行绘图。
1.2 细胞实验
1.2.1 实验材料
人骨肉瘤(HOS,湖南丰晖生物),JH来自于成都仪睿生物科技有限公司(HPLC检测纯度在98%以上),DMEM高糖培养基(Gibco公司),牛血清白蛋白(Gibco公司),Hochest细胞染色试剂盒(中国碧云天生物公司),CO2培养箱(ESCO公司,CCL-170T-8);全自动酶标仪(BioTek公司,SYN-ER-GY/HIX)。
1.2.2 细胞培养
将HOS常规在T25瓶贴壁培养,加含有10%血清和1%青霉素-链霉素的DMEM高糖培养基,放在无菌恒温箱,待细胞状态较好时进行实验。
1.2.3 细胞增殖能力检测
取对数生长期的HOS,将细胞每孔7000个均匀铺在96孔板中,每组设6个复孔。当培养到每孔密度为80%时,加入浓度为0、40、60、80、120、150、200μmol/L的JH处理48h,之后每孔加入0.5%MTT溶液10μL,放入培养箱孵育4h,之后加入150μL/孔的DMSO溶液放置于摇床上震荡25min,用酶标仪于490nm波长处测吸光度。细胞存活率=[(A试验孔-A空白孔)/(A对照孔-A空白孔)]×100%。
1.2.4 细胞平板克隆形成
取对数生长期的HOS细胞,将HOS细胞以每孔1500个均匀铺到6孔板中,次日按照JH 0、7.5、12、22.5、30、40μmol/L的浓度梯度配制含药培养基,放培养箱内10~14d,待显微镜下观察未加药的空白组细胞长满时可终止培养,每孔加1mL多聚甲醛4℃固定20min,弃固定液,每孔加入0.5%结晶紫1mL至室温避光染色30min,之后将6孔板在流动水下缓慢冲洗,晾干后拍照。
1.2.5 Transwell小室侵袭与迁移实验
取对数生长期的HOS细胞,加入无血清培养饥饿12h,侵袭组上室加入基质胶,迁移组不加,取HOS细胞以每孔2×105个铺在24孔板Transwell小室的上室,在侵袭与迁移的Transwell下室分别加入JH浓度为0、40、80、150μmol/L且含20%血清的DMEM培养基,放培养箱24h。结束后,取出小室,弃培养基,擦去上室基质胶及未穿膜的细胞,多聚甲醛固定后,结晶紫染色,晾干后拍照并计数。
1.3 统计学方法
实验结果主要使用Image J、Graphpad prism 8.0软件进行数据分析。实验分别进行3次,组间采用t检验。P<0.05具有统计学差异。
2 结 果
2.1 JH抗HOS作用靶点
在Gene Cards数据库检索,将筛选收集的69个JH作用靶点和5373个HOS靶点通过韦恩图取交集,获得共同交集靶点26个,即预测为JH抗HOS的潜在作用靶点,见图1、图2。

图1 JH与HOS靶点交集韦恩图
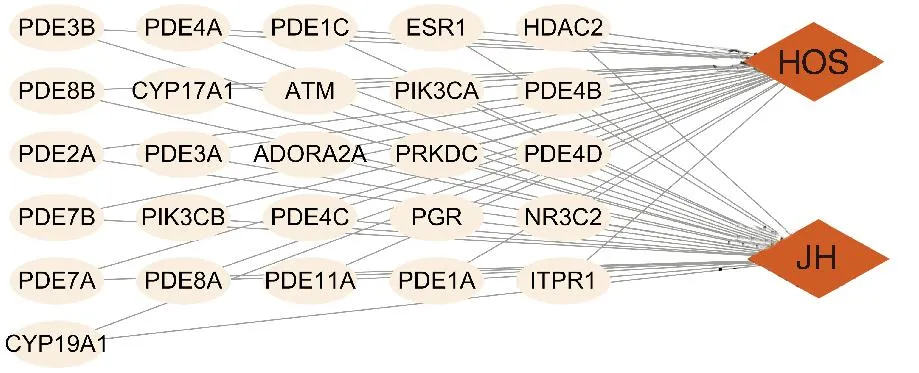
图2 JH抗HOS的靶点网络
2.2 共同靶点蛋白质互作网络
将JH与HOS的26个交集靶点导入STRING数据库,结果保存为TSV格式文件,获得JH与HOS交集靶点蛋白质相互地作用关系,并通过将其输入Cytoscape程序中,构建JH与HOS相关靶点的PPI网络图,见图3。网络中包含了节点有26个、82条边、平均节点度为11.3。蛋白互作图中节点越大、颜色越深表示该节点的度值较高,结合分数越大,见图4。根据度值>2、CC>0.005和BC>0.003提取核心靶点构建网络,通过拓扑分析得到26个关键靶点,见表1。Top10的基因按MCC算法评分顺序为:PDE2A、PDE11A、PDE4A、PDE7A、PDE7B、PDE1A、PDE4D、PDE8A、PDE8B、PDE3A。

表1 JH抗HOS核心作用靶点的拓扑学参数

图3 JH抗HOS的PPI网络
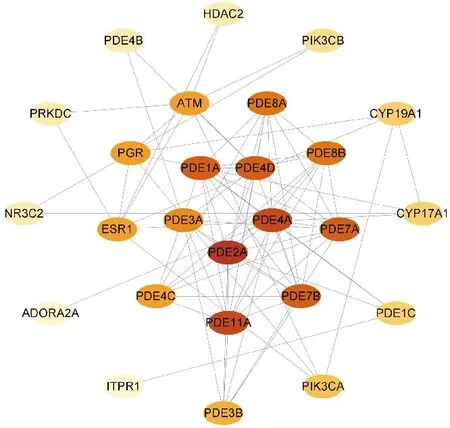
图4 JH抗HOS作用核心靶点网络(PPI网络前26位靶点)
2.3 GO功能富集分析
将疾病和药物交集的26个共同靶点导入DAVID数据库进行GO功能富集分析,根据设定阈值P<0.01进行筛选,按照P值升序排列结果前10条显著富集的条目,见图5。结果表明,涉及多项生物调控机制(BP),包括cAMP分解代谢过程、信号转导、cAMP介导的信号传导的负调控、cAMP介导的信号传导等生物过程;涉及细胞膜、细胞质核周区、胞质溶胶等细胞组成(CC);分子功能(MF)涉及环核苷酸磷酸二酯酶活性、金属离子结合、类固醇结合等分子功能。
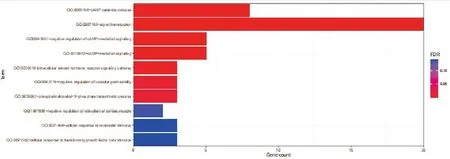
图片从上往下依次为:BP.生物过程;CC.细胞组分;MF.分子功能。图5 JH抗HOS的GO功能富集分析
2.4 KEGG通路富集分析
通过David数据库进行KEGG通路富集分析,根据P值排序,筛选出与HOS相关度最高的前10条通路。富集结果显示代谢途径信号通路(metabolic pathways)、嘌呤代谢(purine metabolism)、吗啡成瘾(morphine addiction)、cAMP信号通路(cAMP signaling pathway)等通路上富集较多,见图6。

点的大小表示通路富集到的靶点数目,颜色越深代表KEGG富集越显著,与JH抗HOS的关系更密切。图6 JH抗HOS的KEGG通路富集分析
2.5 JH与核心靶点的分子对接分析
将JH与核心靶点PDE2A进行分子对接,结合能数据为-6.82kcal/mol。结合能越小,说明对接效果越好。一般认为,结合能<-5.0kcal/mol,表明这种成分与核心靶点蛋白结合性较好,分子对接模型RMSD值均小于2A,认为能够较好地重现原配体与蛋白的结合模式,对接结果具有较高可靠性。用PyMOL软件对对接结果进行可视化,见图7。
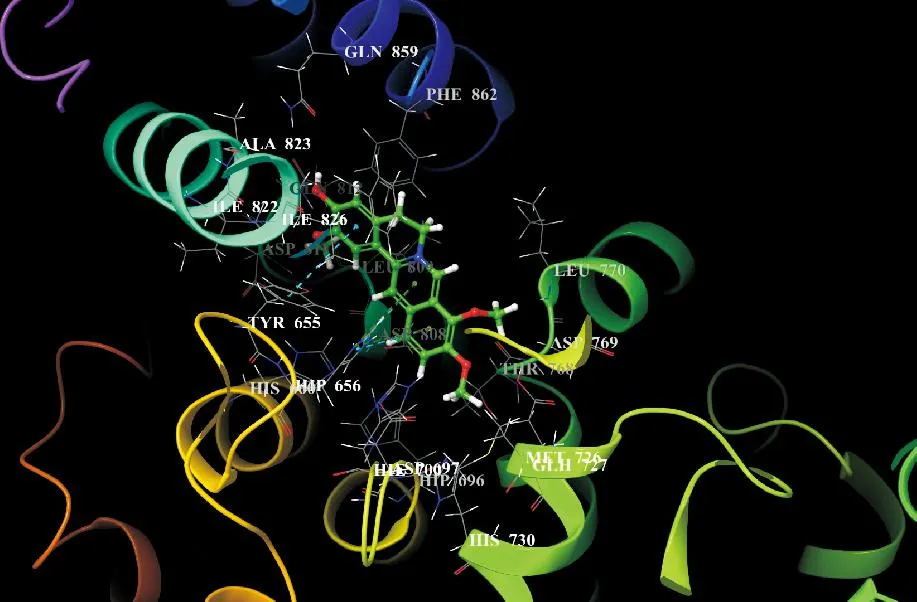
图7 JH与抗HOS关键靶点PDE2A分子对接复合物成键信息三维图
2.6 JH抑制HOS的增殖
为探讨JH对HOS增殖能力的影响,采用MTT实验。实验结果如图8所示,当JH给药浓度逐渐增多时,细胞数量明显减少,细胞活力变差,符合实验预期。说明JH可抑制HOS的增殖,且具有时间-浓度依赖性(未给药组的细胞作为空白组,其细胞活力为100%,P<0.05)。

A.不同浓度的JH处理HOS的增殖抑制图(×10);B.JH对HOS的48h后细胞增殖活力统计图(与空白组相比,*P<0.05,n=6)。图8 JH对HOS细胞增殖能力的影响
2.7 JH抑制HOS的克隆形成
为探讨JH对HOS克隆形成能力的影响,采用平板克隆形成实验。它是检测单个肿瘤细胞集落形成能力的常规实验方法。实验结果如图9所示,不同浓度的JH处理HOS后,随着浓度增加其克隆形成能力逐渐降低。表明JH以剂量依赖性的方式抑制HOS的克隆形成能力。

A.不同浓度JH对HOS的克隆形成图;B.不同浓度JH对HOS的克隆数统计图(与空白组相比,*P<0.05,n=3)。图9 JH对HOS克隆形成能力的影响
2.8 JH抑制HOS的纵向迁移
我们采用Transwell迁移实验来探讨JH对HOS细胞纵向迁移的影响。在24孔板Transwell小室上室中每孔铺2×105个细胞,下室按JH浓度为0、40、80、150μmol/L分别加入。CO2培养箱培养24h后加多聚甲醛固定,结晶紫染色后显微镜下拍照观察细胞的迁移情况。结果如图10显示,相比空白组,给药组细胞的纵向迁移能力随药物浓度的增加而不断下降,表明JH以剂量依赖性的方式抑制HOS细胞的纵向迁移能力。

A.不同浓度的JH对HOS纵向迁移能力效果图(×20);B.JH对HOS纵向迁移能力统计图(与空白组相比,*P<0.05,n=3)。图10 JH对HOS细胞纵向迁移的影响
2.9 JH抑制HOS的侵袭
我们采用Transwell侵袭实验来探讨JH对HOS细胞侵袭的影响。在Transwell侵袭实验中将小室上室加入基质胶。在24孔板Transwell小室上室中每孔接种2×105个细胞,下室按JH浓度为0、40、80、150μmol/L的梯度加入。于CO2培养箱培养24h后,于显微镜下拍照观察细胞的侵袭情况。结果如图11所示,相比空白组,给药组细胞的侵袭能力随药物浓度的增加而不断下降,表明JH可以抑制HOS细胞的侵袭能力。
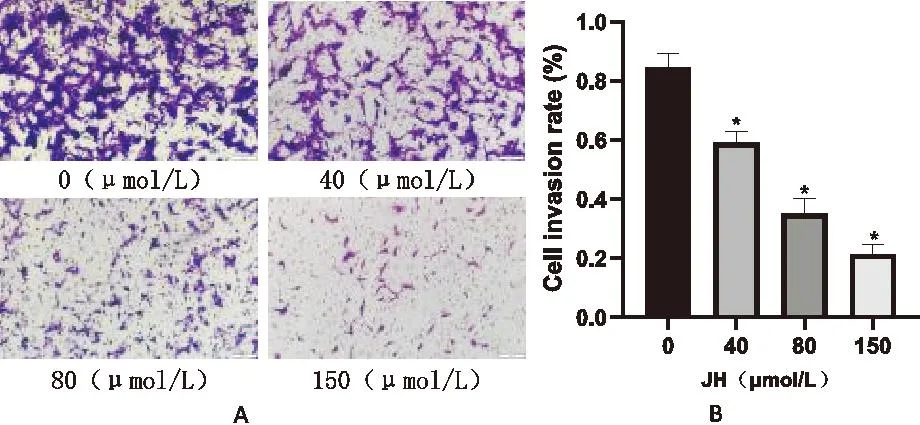
A.不同浓度的JH对HOS侵袭能力效果图(20×);B.JH抑制HOS的侵袭能力统计图(与空白组相比,*P<0.05,n=3)。图11 JH对HOS细胞侵袭的影响
3 讨 论
HOS是儿童和青少年中最常见的原发性恶性骨肿瘤。该病起源于间叶组织,早期隐匿,易复发,由于微转移扩散,单独根治性手术很少能治愈。然而,在1970年代引入联合化疗,将总生存率从20%显着提高到约70%。不幸的是,在过去几十年中,旨在加强治疗的大型临床试验未能实现更高的治愈率[5]。因此,急需寻找新的临床药物来提高HOS的治疗效果为患者解除痛苦。JH的多种药理活性近年来引起了广泛关注,该化合物是一种四氢异喹啉生物碱,具有与小檗碱相似的化学结构[6]。报道的JH有益作用包括抑菌[7]、肿瘤细胞生长抑制[8]、逆转多药耐药性[9]和降低血糖水平[10]。在本研究中,我们首先基于TCMSP数据库筛选JH的成分靶点,其次通过GO富集与KEGG通路分析可知,共26个JH治疗HOS的潜在靶点,说明JH可通过多个靶点发挥抗肿瘤作用。JH对黑色素瘤具有生长抑制作用,Liu等[11]发现p21、p27以及肿瘤抑制因子p53,通过抑制CDK2活性和G1/S期转变,在调节细胞周期进程中发挥关键作用,JH通过上调p21,p27以及p53蛋白抑制黑色素瘤的增殖和新生血管的形成。刘洋等[12]发现JH通过下调Snail、N-cadherin和MTA1的表达,上调E-cadherin的表达来抑制MTA1的蛋白以及影响细胞内转录因子Snail进而对EMT进程调控,增强细胞与细胞之间粘附,降低了前列腺癌细胞PC-3的能动性,逆转EMT进程。
此外,通过STRING数据库构建相互作用靶点PPI网络,得到关键的几个排名靠前的基因:PDE2A、PDE11A、PDE4A、PDE7A、PDE7B、PDE1A、PDE4D、PDE8A、PDE8B、PDE3A。
JH与核心靶点PDE2A结合性较好。近年来,研究认为磷酸二酯酶(phosphodiesterases,PDEs)可能是肿瘤治疗中的一个理想靶点[13],PDEs是细胞对激素、神经递质及内泌素的刺激进行反应的基本物质,它通过水解cGMP和cAMP在细胞的信号转导过程中扮演了重要的角色。PDEs超家族共分为I和II两大类,目前共发现11种,分别命名为PDE1-PDE11[14]。PDE2是PDEs家族中的一个重要成员,截止到目前为止,PDE2A是PDE2中唯一被鉴定的单基因,它通过cGMP(cyclic guanosine monophosphate)被激活。目前认为PDE2A的主要作用是通过心钠素(ANP)调节血压和液体内环境的稳定[15]。PDE2A在人类的大脑组织中高表达,在心脏、肝脏、骨骼肌、肾脏以及胰腺组织中有中度表达,在胎盘与肺组织中的表达水平最低[16]。其他文献[17]报道,PDE2A在脉络膜新生血管小鼠视网膜中表达升高,Ding等[18]的研究结果提示PDE2A在宫颈癌组织和HeLa细胞中呈高表达。
本研究对参与JH治疗HOS的关键基因进行了GO与KEGG富集分析,结果表明,这些靶基因主要与cAMP分解代谢过程、cAMP介导的信号传导、环核苷酸磷酸二酯酶活性、cAMP磷酸二酯酶活性、cGMP磷酸二酯酶活性、代谢途径信号通路、嘌呤代谢、cAMP信号通路等相关密切。
经体外实验研究表明,HOS随着JH浓度的升高,细胞活性明显下降。我们观察不同浓度的JH作用于HOS后对细胞增殖活力的影响,发现其随着JH药物浓度的升高而降低。进一步通过平板克隆形成实验验证了JH对HOS的抑制作用。此外,通过Transwell实验中,得出HOS细胞的伤口侵袭能力以及迁移能力均受到抑制,侵袭和迁移的细胞数量减少。
总之,本研究利用网络药理学探索出JH的靶点,也成功地挖掘了治疗HOS的潜在靶点。并通过PPI网络获得了治疗HOS的关键基因,之后构建基因相互作用网络。然而,关于JH对HOS的作用机制仅处于探索的早期阶段。JH的抗癌机制有待进一步研究,在临床应用前景上,JH作为潜在的抗HOS药物提供了一定的科学依据。
