NaCl 胁迫对甜玉米幼苗生长的影响
2024-01-12段旭旋管小妮刘家奇赵欣悦陈青春锋刘鹏飞张姿丽
段旭旋 管小妮 刘家奇 赵欣悦 宁 丹 陈青春 蒋 锋刘鹏飞 张姿丽*
(1仲恺农业工程学院农业与生物学院,广东 广州 510225;2广州市特色作物种质资源研究与利用重点实验室,广东 广州 510225)
甜玉米是重要的粮食作物,是普通玉米隐性基因突变而产生的玉米品种[1],因其良好口感和风味受到广泛喜爱。据统计,全世界范围内的盐碱地面积约为9.544×108m2,其中我国盐碱地面积为9.13×107m2,约占全世界盐碱地面积的1/10[2],土地盐碱化影响了作物的生长及发育,故如何把盐碱地资源利用好成为亟待解决的问题之一。
土地的盐碱化是土壤不同程度的盐化和碱化的总称,盐碱化的土壤中含有大量对植物有害的离子,使得植物生长过程中根系吸水困难,造成生理干旱,从而抑制植物的生长[3-4]。盐碱化主要从渗透胁迫、离子毒害、组织耐受性3 个方面影响作物生长发育[5]。Maas 等[6]对16 个玉米品种进行发芽试验,研究玉米从萌发到幼苗生长不同阶段的耐盐性,并指出玉米在营养阶段对盐胁迫最敏感。袁海等[7]研究发现,盐胁迫对玉米地上部分生长的抑制作用大于地下部分,对盐敏感型玉米的抑制作用大于耐盐型玉米,说明耐盐型植物在抵抗逆境胁迫中有更大的优势。王婧泽等[8]探讨了玉米幼苗在盐胁迫下的生理响应及耐盐机制,其研究结果表明,3个玉米自交系的生理指标随盐浓度的增加而降低。玉米对盐胁迫属于中度敏感[9],其幼苗时期是生长发育的重要阶段,也是作物在盐碱环境下能否生长的关键时期,这决定了后期甜玉米幼苗的生长和品种选育[6]。
本研究用不同盐度的盐土栽培6 份甜玉米材料,通过观察幼苗生长指标的变化来筛选出盐敏感和盐耐受材料,为盐碱化地区高产耐盐新品种的选育和甜玉米幼苗时期耐盐性机制探究提供一定参考。
1 材料与方法
1.1 试验材料
甜玉米材料选用广州市特色作物种质资源研究与利用重点实验室自主选育的国审品种仲鲜甜102(ZXT102)和甜玉米自交系D117、D110、D96、D87 和D79为试验材料。
1.2 试验方法
1.2.1 NaCl盐土配制本次试验共设3个重复、1个对照和5个处理。5个处理分别为T1(NaCl 1 g/kg)、T2(NaCl 浓度2 g/kg)、T3(NaCl 浓度3 g/kg)、T4(NaCl 浓度4 g/kg)和T5(NaCl浓度5 g/kg),对照组用CK表示。土壤农业化学分析以鲁如坤[10]方法为依据,用NaCl(分析纯,上海生工生物工程股份有限公司生产)和基质土配制5个处理所需的盐土,并放入塑料盆中(采用底部打孔,高11.5 cm、上口径16 cm、底径12 cm的花盆),配制好盐土后在每个塑料盆中施入等量的底肥,放置盆中备用。
1.2.2 种子处理将6份甜玉米种子催芽后种植于育苗盘中,待玉米长到2 叶1 心时,挑选长势一致的甜玉米幼苗植株移栽到配制好的盆栽盐土中进行NaCl 胁迫试验。6 种甜玉米材料,分别设置5 组NaCl 不同梯度处理和一组对照(CK),3 次重复。试验开始后,分别在处理第5、9、13、17 和21 天进行指标的测定,并观察玉米幼苗的生长状态。
1.2.3 指标测定 (1)株高:用直尺测量植株从土壤表面到最高生长点的长度。
(2)茎粗:用游标卡尺测量植株在土壤上面2~3 cm部分宽面茎秆的粗细。
(3)根长:用直尺测量植株的主根长度。
(4)叶面积[11]:叶长×叶宽×0.75。
(5)SPAD 值:用SPAD 仪测定甜玉米幼苗第二片叶子的4个点测SPAD值,然后取其平均值作为单株叶绿素的含量值。
(6)植株、茎叶及根鲜重:用蒸馏水冲洗干净,用滤纸吸干水分称量,分别标记处理鲜重和对照鲜重。
(7)植株、茎叶及根干重:在105 ℃下杀青15 min,转入80 ℃烘箱中烘至恒重,再分别称其干重。
(8)植株相对含水量:(鲜重-干重)/鲜重×100%。
1.2.4 数据分析方法利用Microsoft Office Excel进行数据整理,利用IBM SPSS Statistics 20.0进行方差分析,利用Duncan法进行多重比较分析。
2 结果与分析
2.1 NaCl胁迫对甜玉米幼苗性状的影响
2.1.1 株高和茎粗生长量不同NaCl 胁迫处理对甜玉米材料幼苗的株高和茎粗生长量进行方差分析(表1),结果显示,不同时间段玉米幼苗生长量在NaCl 胁迫处理中差异显著(P<0.05和P<0.01),在甜玉米材料之间差异显著(P<0.05)。分别对材料的株高和茎粗生长量进行多重比较,如图1 所示,不同NaCl 胁迫处理下甜玉米幼苗的株高、茎粗的生长量表现为低浓度促进幼苗的生长,高浓度抑制幼苗株高、茎粗的发育。T1、T2处理会促进幼苗株高的发育,在17~21 d,T3、T4和T5处理株高生长量与CK 相比差异逐渐显著,T4、T5处理下的株高生长量低于CK。这说明,高盐环境可以显著抑制幼苗发育。幼苗茎粗生长量在处理第5~9 天时无显著差异,处理第13~21 天时,T4、T5处理茎粗生长量会逐渐与CK 表现出显著差异,茎粗生长量在各NaCl 盐胁迫下呈现出高盐胁迫降低茎粗生长,低NaCl 胁迫会随着时间的推移促进幼苗茎粗的发育。这与幼苗株高生长量值的变化趋势类似,说明低NaCl 胁迫对幼苗株高、茎粗的发育有促进作用,高NaCl 胁迫会抑制植株幼苗株高及茎粗的发育。
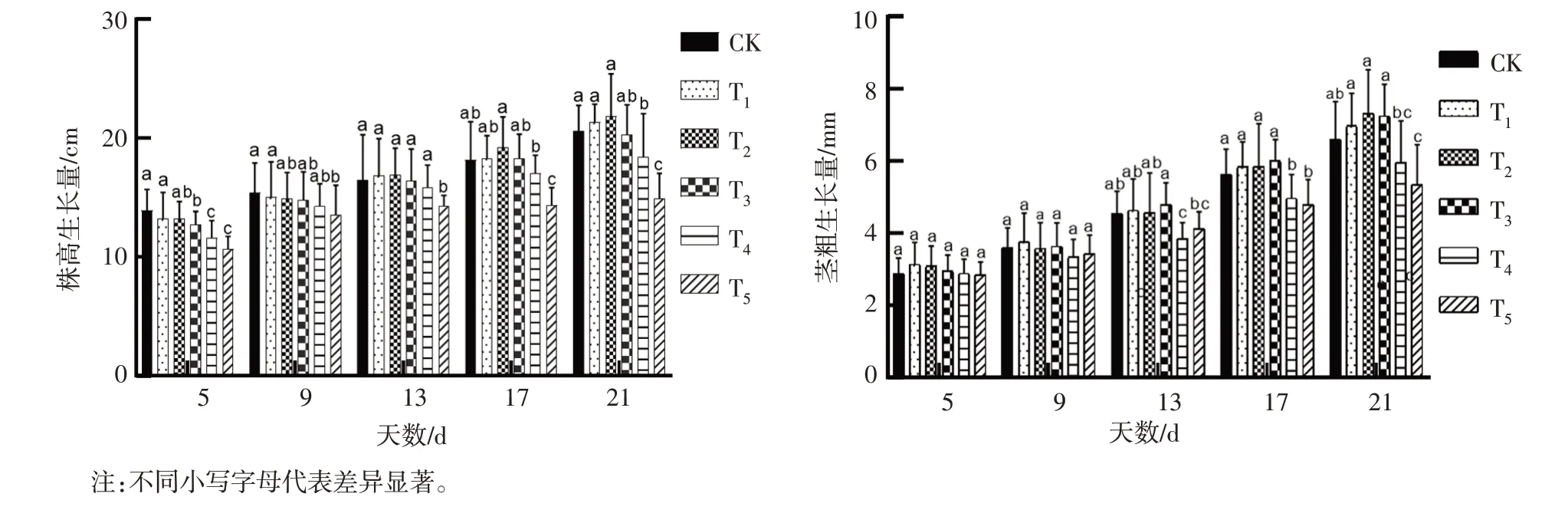
图1 盐胁迫处理对株高生长量和茎粗生长量的影响
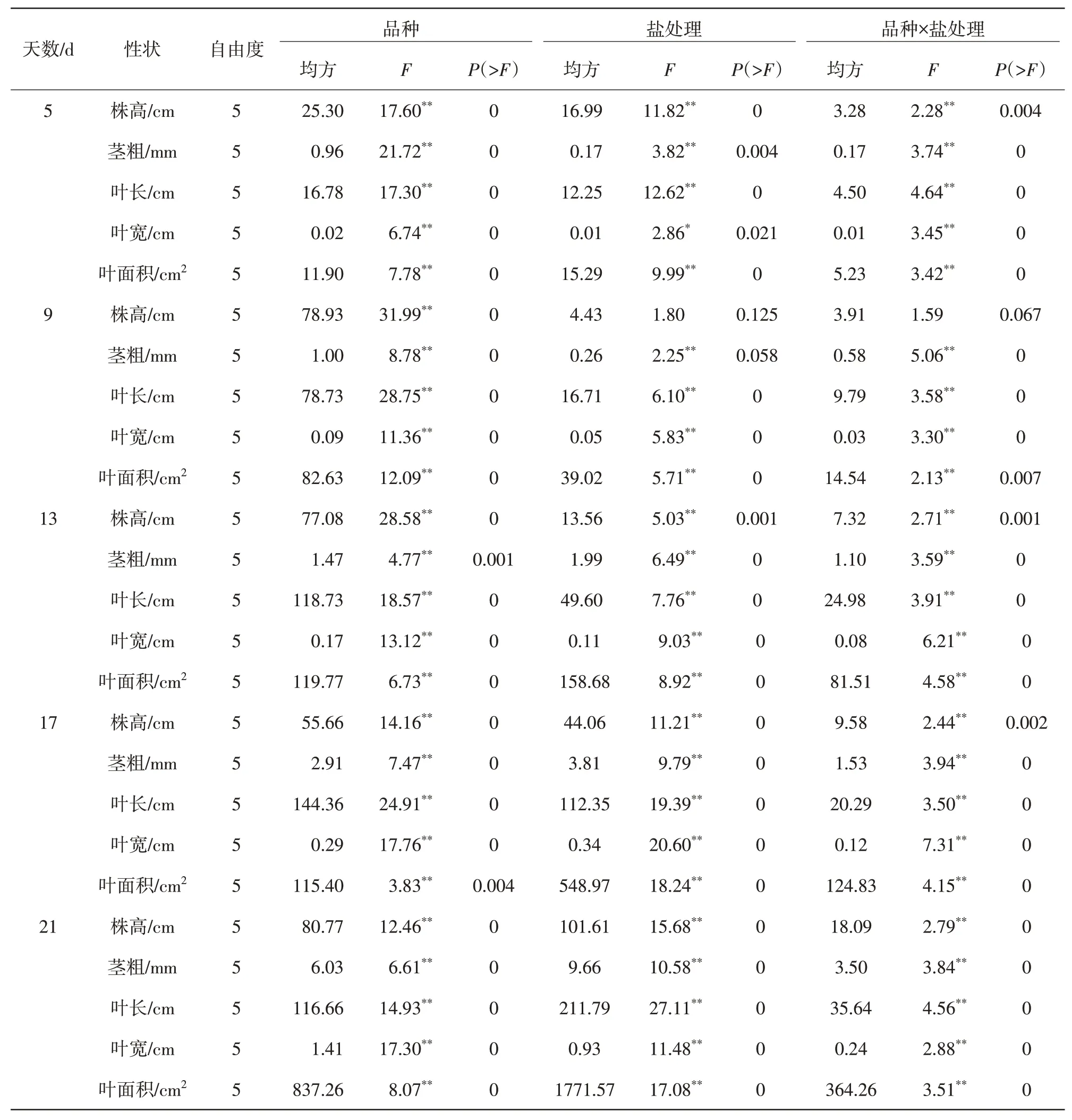
表1 NaCl胁迫处理时间对玉米幼苗生长量的方差分析
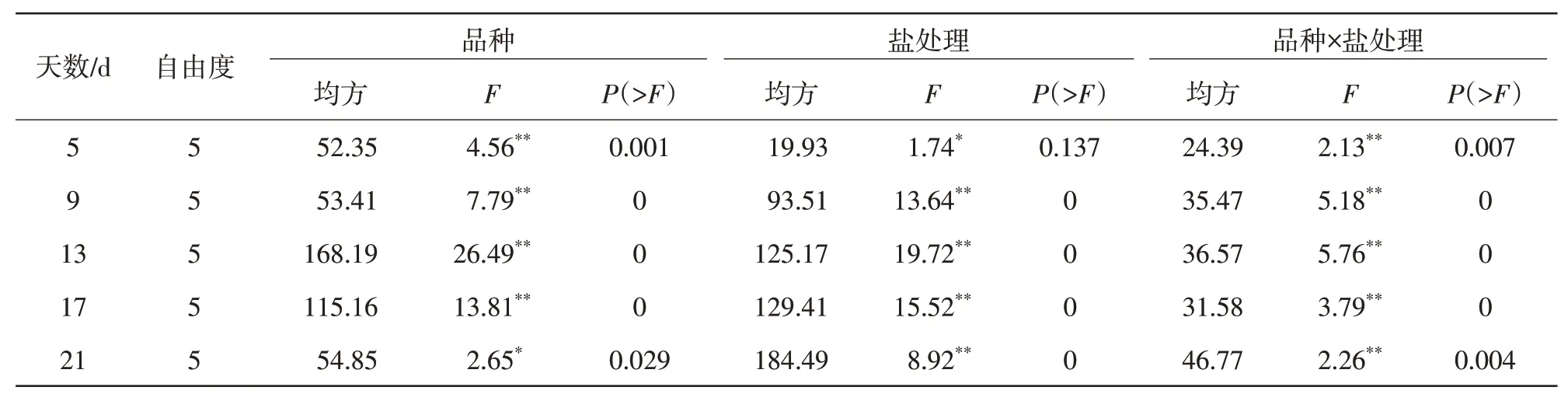
表2 NaCl胁迫处理对玉米幼苗叶片SPAD值的方差分析
2.1.2 叶面积生长量及SPAD 值如表1—2 所示,不同NaCl胁迫下甜玉米幼苗的叶面积生长量及叶片SPAD值在盐胁迫处理中差异显著(P<0.05),在甜玉米材料之间差异显著(P<0.05)。分别对材料的叶面积生长量和叶片SPAD值进行多重比较,如图2所示,不同NaCl 胁迫处理下甜玉米幼苗在5~21 d叶面积生长量呈上升趋势,在17~21 d 叶面积发育最为显著,第21天时幼苗叶面积生长量达到最大;在5~13 d,T2、T3处理同CK 相比叶面积生长量差异不显著(P>0.05),在5~21 d 幼苗在T5处理的叶面积生长量最小,抑制作用最显著(P<0.05),可以得出结论:高NaCl 胁迫严重抑制幼苗叶面积的发育,低NaCl 胁迫对幼苗叶面积生长量有促进作用。在甜玉米幼苗发育过程中,幼苗叶片的SPAD 值在处理第5 天时无显著差异(P>0.05),在第17、21天时T1、T2和T3处理的SPAD 值高于CK、T4和T5,同时CK 与T4、T5处理相比差异不显著(P>0.05),T5处理的SPAD 值低于CK,分析得出低NaCl 胁迫对幼苗叶片SPAD 值促进作用显著,高盐胁迫对幼苗SPAD 值抑制作用显著。
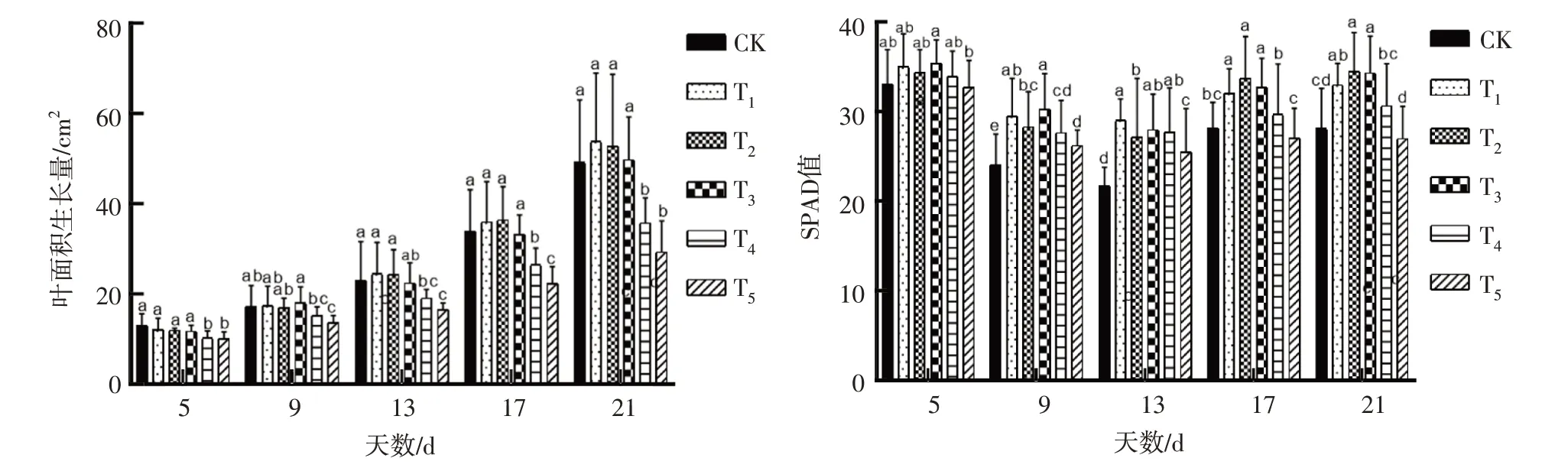
图2 NaCl胁迫处理对叶面积增长量及SPAD值的影响
2.1.3 幼苗根长对NaCl 处理的甜玉米幼苗17、21 d 的根长进行方差分析,如表3 所示,第17 天NaCl 胁迫处理的幼苗根长在品种间和盐处理间的差异不显著(P>0.05),第21 天NaCl 胁迫处理的幼苗根长在品种间差异显著(P<0.05),但在盐处理间的差异不显著(P>0.05)。NaCl 盐胁迫对根长性状的影响进行多重比较,结果如表4 所示。第17 天时,不同NaCl 胁迫对根长的影响不显著(P>0.05),其中T1处理下根长最大;第21天时,不同NaCl胁迫下对根长的影响有较大差异,CK 与T1的差异显著(P<0.05),T1与T2、T3、T4和T5没有显著差异。可以看出,T1对甜玉米幼苗根长有着促进作用。
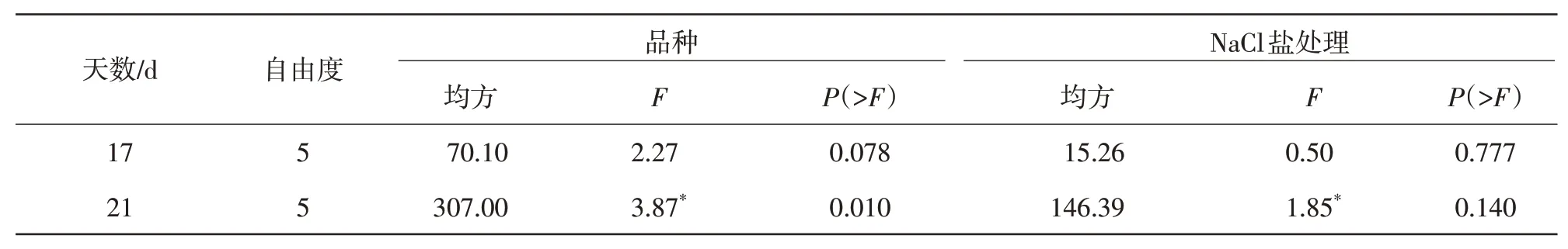
表3 NaCl胁迫处理对玉米幼苗根长的方差分析
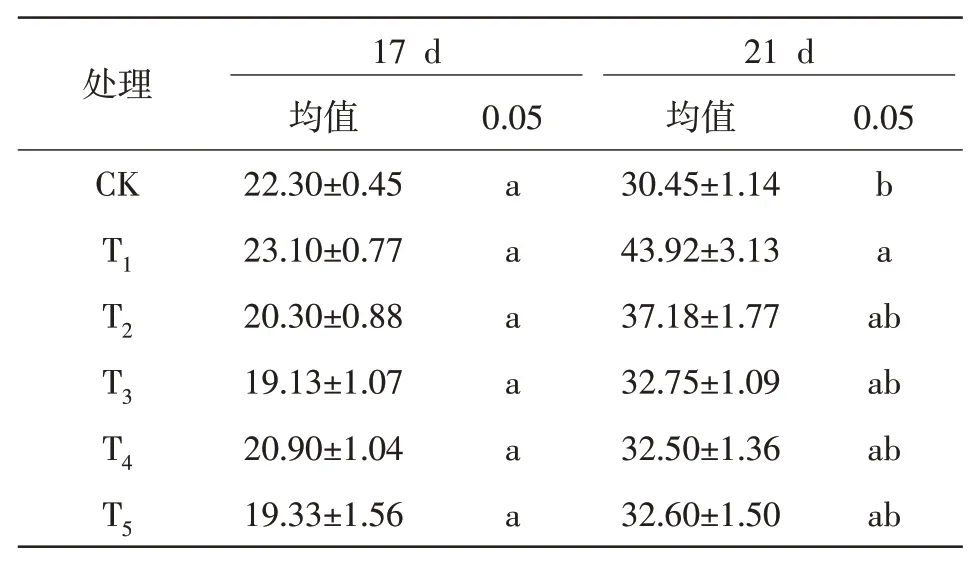
表4 NaCl盐胁迫处理对根长的影响多重比较
2.1.4 幼苗生物量对NaCl 胁迫处理的甜玉米幼苗21 d的鲜重和干重进行方差分析,如表5所示。在第21天时,NaCl胁迫处理的植株鲜重、根鲜重、植株干重、根干重和茎叶干重在品种间、盐处理间和品种×盐处理交互效应间的差异显著(P<0.05)。茎叶鲜重和植株相对含水量在品种间差异不显著(P>0.05),但在盐处理间和品种×盐处理交互效应间检测出显著差异(P<0.05)。对NaCl 胁迫下鲜重和干重的影响进行多重比较,结果如图3 所示。不同NaCl 胁迫处理下甜玉米幼苗的鲜重差异显著,在植株鲜重中,T1、T2和T3处理同CK 相比有显著差异(P<0.05),且T2处理下植株鲜重最大,T4、T5处理同CK 相比差异显著(P<0.05),且T5处理的植株鲜重值最小,根鲜重同植株鲜重生长发育值的变化趋势类似;茎叶鲜重中T1、T2和T3处理同CK 相比无显著差异(P>0.05),且T1处理的鲜重最大,CK同T4、T5处理有显著差异(P<0.05),且T5处理的鲜重最小,可以得出低NaCl 胁迫促进幼苗鲜重的发育,高NaCl胁迫对幼苗鲜重有显著抑制作用。

图3 NaCl胁迫处理对玉米幼苗鲜重、干重的影响
不同NaCl 胁迫处理下甜玉米幼苗的干重有显著差异,在植株干重中,T1、T2和T3处理同CK相比差异显著(P<0.05),且T2处理的植株干重最大,T4、T5处理同CK相比差异显著(P<0.05),且T5处理的植株干重最小,根干重同植株干重生长发育的值变化趋势类似;在茎叶干重中,T1、T2处理同CK相比差异显著(P<0.05),且T1处理的茎叶干重最大,T5处理同CK相比差异显著(P<0.05),且T5处理的茎叶干重最小;在植株含水量中,T5处理同CK、T1、T2、T3和T4处理相比有显著差异(P<0.05),且T5处理的植株含水量最小,通过分析得出高NaCl胁迫处理对甜玉米幼苗的抑制作用显著,低NaCl胁迫处理对甜玉米幼苗促进作用显著。
2.2 NaCl胁迫下材料对甜玉米性状的影响
2.2.1 株高和茎粗生长量如图4 所示,在NaCl胁迫下,各甜玉米幼苗的株高、茎粗的生长量呈上升趋势。对不同甜玉米材料间的株高、茎粗的生长量进行多重比较,结果显示D117、D79 和D96 在第5~13天,株高和茎粗生长量无显著差异(P>0.05),在第17~21天,D117、D79株高生长量显著高于D96;材料D110在第5~17天,株高生长量最为显著,在第21天,D87 的株高生长量高于D110,从株高生长量可以得出NaCl胁迫对材料D96的抑制程度更强;ZXT102茎粗生长量变化同D96 相比差异显著(P<0.05),D96显著低于ZXT102,在第21 天时D117 茎粗生长量最大,D96 最小。综上,ZXT102、D117 受NaCl 胁迫的影响较小,D96 受NaCl 胁迫的抑制较为显著,D79、D87 和D110 在茎粗生长量性状上较D117、ZXT102敏感。
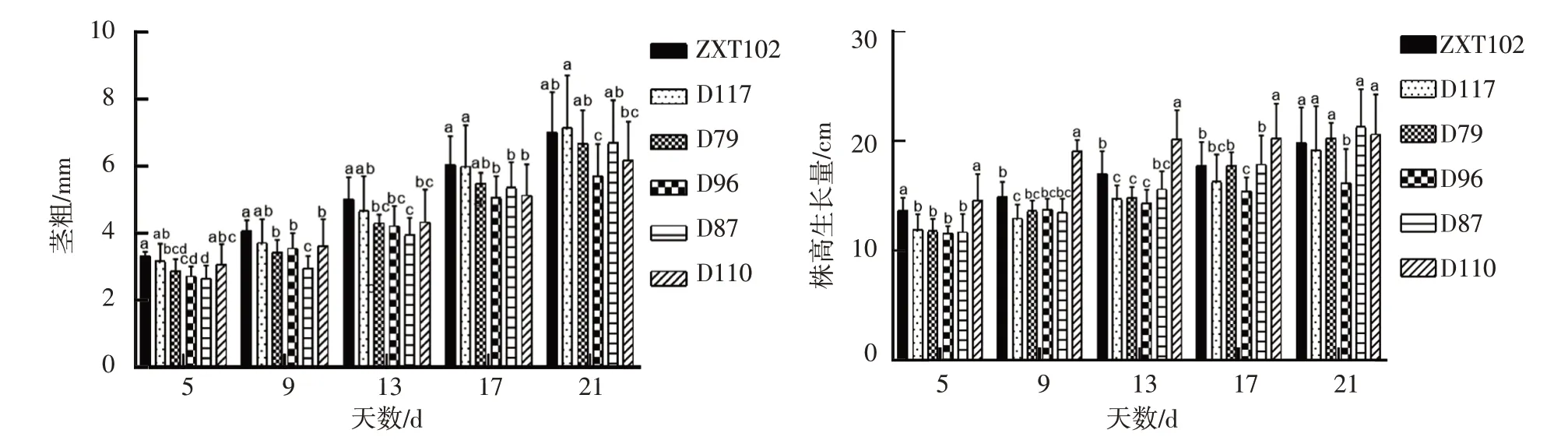
图4 NaCl胁迫下材料对甜玉米株高生长量和茎粗生长量的影响
2.2.2 叶面积及叶片SPAD值如图5所示,在不同NaCl 胁迫处理下各材料的叶面积生长量呈上升趋势,对不同甜玉米材料进行多重比较,结果发现,在第5~13天,D117、D79、D96和D87的叶面积生长量差异不显著,第21天时各材料出现显著差异,D87叶面积生长量最大,D96 叶面积生长量最小,ZXT102、D87 叶面积生长量同D79、D96 相比差异显著(P<0.05),分析得出NaCl胁迫处理时间越长,D96受到NaCl 胁迫的抑制作用越显著。各材料叶片SPAD值在NaCl胁迫处理下呈下降趋势,第5天时各材料SPAD 值最大,在第21 天时材料ZXT102、D117和D79 的SPAD 值无显著差异(P>0.05),D87 叶片SPAD 值最大,D96 叶片SPAD 值最小,分析得出在NaCl 胁迫处理下D96叶片SPAD 值受到的抑制作用最显著,对D87叶片SPAD值影响较小。

图5 NaCl胁迫下材料对甜玉米幼苗叶面积、SPAD值的影响
2.2.3 幼苗根长NaCl 胁迫处理后不同甜玉米材料根长的差异,如表6 所示。在第17 天甜玉米幼苗根长中,D117 根长值最大,D110 根长值最小,ZXT102、D117、D79、D96 和D87 的差异不显著(P>0.05),D110 与D117、D79 和D87 的差异显著(P<0.05);在第21 天时,D117 的根长值最大,D110 根长值最小,ZXT102、D79、D96 和D110 的差异不显著(P>0.05),D117与ZXT102、D79、D96和D110的差异显著(P<0.05)。可以看出,材料D117根长的生长发育在NaCl胁迫处理下影响较小,D110根长的生长发育对NaCl胁迫较为敏感。
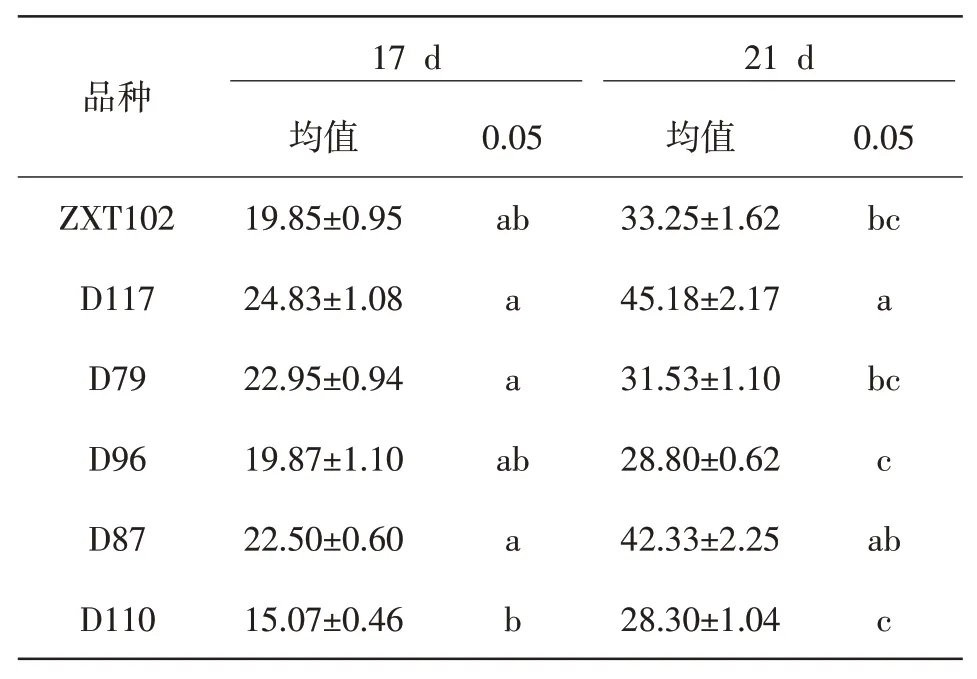
表6 NaCl胁迫下材料对甜玉米根长的影响多重比较
2.2.4 幼苗生物量NaCl 盐胁迫处理后不同甜玉米材料间鲜重的差异如图6 所示。在植株鲜重中,D96 同ZXT102、D117、D79、D87 相比差异显著(P<0.05),且D96 植株鲜重最小,ZXT102、D117 和D87同D79、D96和D110差异显著(P<0.05),且D117植株鲜重值最大;在根鲜重中,D117 同其他材料相比差异显著(P<0.05),且D117 根鲜重最大,D96 同ZXT102、D117 和D87 相比差异显著(P<0.05),且D96根鲜重值最小;在茎叶鲜重中,各材料间无显著差异(P>0.05),D96 茎叶鲜重值最小,D79 茎叶鲜重值最大,分析得出NaCl胁迫对D96幼苗鲜重值的抑制作用较大,对D117幼苗鲜重抑制作用较小。在植株干重中,D96、D110同其他材料相比差异显著(P<0.05),且D96 植株干重值最小,ZXT102、D117 同D79、D96和D110 相比差异显著(P<0.05),且D117 植株干重值最大;在根干重中,ZXT102、D117 和D79 同D96、D110相比差异显著(P<0.05),且ZXT102根干重值最大,D96根干重值最小;在茎叶干重中,ZXT102、D117和D87同D79、D96相比差异显著(P<0.05),且D87茎叶干重值最大;在植株相对含水量中,ZXT102、D79和D87同D96的比值差异显著(P<0.05),且D87植株相对含水量最大,D96植株相对含水量最小,分析得出NaCl胁迫处理对D96的抑制作用较大,对D117的幼苗干重的抑制作用较小。
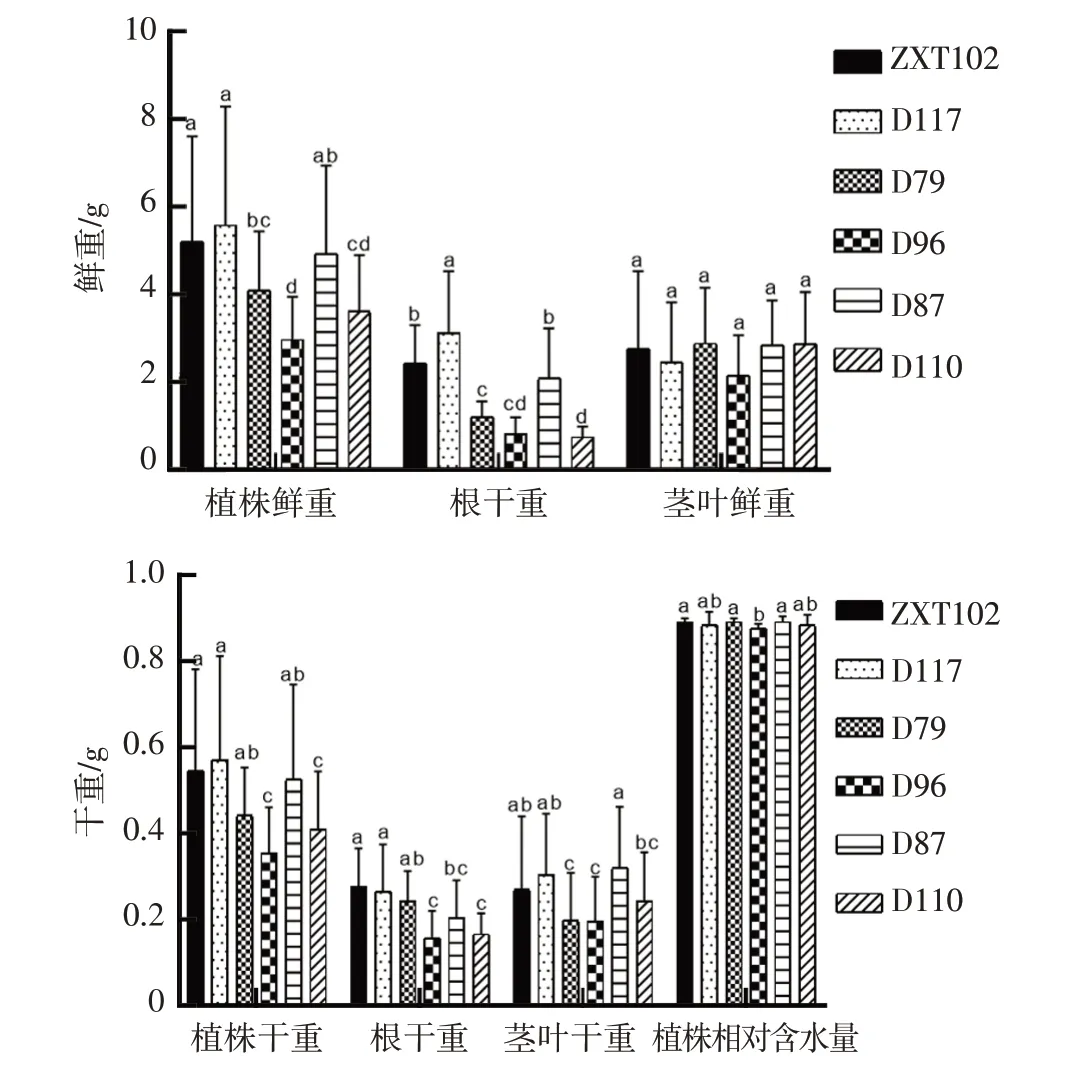
图6 NaCl胁迫下材料对甜玉米生物量的影响
3 结论与讨论
土地的盐碱化是影响作物生长发育的主要因素之一,Maqbool等[12]研究表明盐胁迫显著降低了玉米的植株形态和性状;李文阳[13]等研究指出盐胁迫会显著降低苗期玉米的地上部鲜重及株高;Zhu 等[14]研究得出非生物胁迫严重抑制植物的生长发育,高NaCl 胁迫会破坏植物体内的平衡。因此提高作物的耐NaCl 性是降低土壤盐碱化负面影响的有效途径。
株高、根长、幼苗鲜重和幼苗干重能反映出植株的生长发育的好坏,本研究分析得出甜玉米幼苗的株高、根长、幼苗鲜重及地上部鲜重在低盐胁迫下会促进植株的生长,高NaCl 胁迫会抑制植株的生长,这与宫庆友等[15]、汤华等[16]的研究结果相同;甜玉米幼苗叶片SPAD 值从一定程度上可以反映幼苗的生长及光合作用能力的强弱,此次研究结果得出低NaCl胁迫处理使玉米幼苗叶片叶绿素含量升高,高NaCl胁迫处理则使幼苗叶片叶绿素含量降低,这与付长方等[17]、位杰等[18]的研究结果吻合;植物的相对含水量是反映植株生理状态的一个指标,本研究结果分析得出高NaCl 胁迫处理导致玉米幼苗水分流失,从而影响玉米幼苗的生长,这与彭云玲等[19]、马东方等[20]的研究结果相同。
本次研究数据显示,甜玉米幼苗的各项指标随NaCl 胁迫浓度的升高先增加后降低,分析得出高浓度的盐土会抑制甜玉米幼苗的生长发育,低浓度的盐土对甜玉米幼苗的生长有促进作用。在此次研究过程中,ZXT102、D117 在生长后期出现苗枯萎死亡;D96 在生长后期出现幼苗的玻璃化,幼苗濒临死亡;D110 在生长过程中植株长势随NaCl 含量的增加呈现阶梯式下降;D87 和D79 的生长则表现相对稳定。综合甜玉米幼苗生长情况和数据进行分析,6 个材料的甜玉米幼苗在NaCl 盐胁迫下差异显著,其中D96 对NaCl 高度敏感,ZXT102、D117 和D110 表现中NaCl 敏感,D79 表现轻度NaCl 敏感,D87表现耐NaCl性。
NaCl胁迫作为一种主要的非生物胁迫,会对玉米的生长发育造成不利影响,在解决土地盐碱化问题上,玉米耐盐品种的培育成为一种可持续的和具有经济效益的方法之一[21-25]。玉米的耐NaCl 性在植株性状和分子生理等方面都有涉及,不同玉米品种在应对逆境胁迫的反应也不同[26-28]。此外,随着分子标记技术和现代育种工具的成熟,研究者们可以深入了解玉米耐NaCl性的遗传机制,这对玉米品种的选育起到了重要作用[29-30],有助于维持玉米在NaCl胁迫下的生产力水平。
