COFs材料磁固相萃取-HPLC-MS/MS法测定烘焙食品中两种主要晚期糖基化终末产物
2024-01-11余晶晶史莉莉刘雨欣陈满堂刘瑞红刘伟
余晶晶,史莉莉,刘雨欣,陈满堂,刘瑞红,刘伟
1.中国烟草总公司郑州烟草研究院,河南 郑州 450001;2.河南工业大学 粮油食品学院,河南 郑州 450001
0 引言
食品中晚期糖基化终末产物(Advanced Glycation Endproducts, AGEs)是美拉德反应的终产物[1-3],根据其来源可分为内源性AGEs和外源性AGEs。外源性AGEs在人体内逐渐累积[4-6]容易诱发机体产生内源性AGEs[7],并与多种疾病的发生密切相关,如糖尿病慢性并发症、动脉粥样硬化、老年痴呆症等[8-16]。羧甲基赖氨酸(Nε-(carboxymethyl)lysine),CML)和羧乙基赖氨酸(Nε-(carboxyethyl)lysine, CEL)是两种主要的AGEs,常被作为食品中AGEs生成的考查指标[17-19]。烘焙食品一般由高温烘焙加工而成,富含碳水化合物、脂肪和蛋白质,被认为是膳食中AGEs的重要来源之一[20-21]。高效液相色谱-串联质谱(High Performance Liquid Chromatography-Tandem Mass Spectrometry, HPLC-MS/MS)法因灵敏度和定性准确度较高,是目前分析AGEs较为常用的技术手段[22-26]。然而,由于CML和CEL的极性和水溶性较强,采用反相色谱分离时存在色谱保留效果较差、分离度较低等问题;同时,食品基质非常复杂,尽管使用了同位素内标,HPLC-MS/MS法基质效应仍然较强,定量分析准确性较差,Y.Nomi等[25]的研究结果也证实了该问题的存在。可见,食品基质中AGEs的准确定量分析是一个具有挑战性的课题。
磁固相萃取(Magnetic Solid Phase Extraction, MSPE)技术具有操作简单快速、吸附剂可重复使用等优点。共价有机骨架聚合物(Covalent Organic Frameworks, COFs)材料具有比表面积大、热稳定性高、密度小等优点。基于磁性COFs材料的MSPE技术结合了二者的优势,在复杂样品基质中痕量化学成分的富集和分析领域得到了广泛应用[27-29]。为改善CML和CEL的色谱分离效果,同时降低HPLC-MS/MS法的基质效应,本文拟建立一种可准确分析烘焙食品中CML和CEL的新方法,该方法采用9-芴基甲基氯甲酸酯(9-Fluorenylmethyl Chloroformate, FMOC-Cl)对二者进行衍生化反应,然后采用磁性COFs材料((TpTph)@Fe3O4)对二者的9-芴基甲氧羰基(9-Fluorenyl Methoxycarbonyl,FMOC)衍生产物进行MSPE,再结合HPLC-MS/MS法对二者进行定量分析考查,以期为因基质效应造成的AGEs难以准确定量分析的问题提供解决方案。
1 材料与方法
1.1 主要材料与试剂
烘焙食品样品,郑州永辉超市(万和城店)。
CML、CEL、氘代羧甲基赖氨酸(d4-CML)和氘代羧乙基赖氨酸(d4-CEL)标准品(纯度≥99.9%),加拿大Toronto Research Chemicals公司;FMOC-Cl(色谱纯,纯度≥97.0%),梯希爱(上海)化成工业发展有限公司;2,4,6-三羟基-1,3,5-苯三甲醛(Tp,纯度为95%)、对苯二胺(Pa-1,纯度为99.9%),北京伊诺凯科技有限公司;FeCl3·6H2O(ACS级试剂,纯度为97%)、1,6-己二胺(纯度为98%),美国Sigma-Aldrich公司;乙二醇(分析纯),天津科密欧试剂公司;无水乙酸钠(纯度为99%),天津阿法埃莎化学有限公司;无水乙醇(分析纯),天津风船化学试剂科技有限公司;乙腈、甲醇、正己烷、二氯甲烷、N,N-二甲基甲酰胺(DMF),均为色谱纯,美国Dikama公司;甲酸(色谱纯),美国TEDIA公司;HCl、NaOH、H3BO3、NaBH4,均为分析纯,国药化学试剂北京有限公司;氨水(分析纯),德国CNW Technologies公司。
1.2 主要仪器与设备
API 4000型质谱仪,美国AB SCIEX公司;1200型高效液相色谱仪,美国Agilent公司;Milli-Q50型超纯水仪,美国Millipore公司;CP2245型电子天平(精度为0.000 1 g),德国Sartorius公司;THS-10精密型超级恒温槽,宁波天恒仪器厂;Turbovap Ⅱ型氮吹浓缩仪,美国Caliper lifesciences公司;Multi Reax型多位试管涡旋振荡混匀器,德国Heidolph公司;Waters C18型色谱柱(100 mm×2.1 mm×2.7 μm),沃特世科技(上海)有限公司;Tristar Ⅱ3020型全自动比表面积和孔隙分析仪,美国麦克仪器公司;TENSOR 27型傅里叶变换红外光谱(FT-IR)仪,德国BRUKER公司;TECNAI G2 F20型高分辨透射电镜(HTEM),美国FEI公司;PPMS-9型综合物性测量系统,美国Quantum Design公司。
1.3 实验方法
1.3.1 磁性COFs材料合成参考文献[30],采用水热反应法制备氨基功能化磁性Fe3O4纳米颗粒(Fe3O4-NH2)。称取4.0 g FeCl3·6H2O至500 mL三口烧瓶中,加入120 mL乙二醇,置于50 ℃水浴中机械搅拌使其溶解;依次加入8.0 g无水乙酸钠和26.0 g 1,6-己二胺,继续机械搅拌0.5 h得均一溶液;将溶液转移至200 ℃水热反应釜中反应6 h后,将液体全部转移至烧杯中,利用磁铁分离,弃去上层溶液,分别用去离子水和95%(若无特指,百分数均指体积分数,下同)的乙醇溶液洗涤 Fe3O4-NH23~5次(体积均约50 mL);所得Fe3O4-NH2置于通风橱约4~8 h后,置于50 ℃真空干燥箱中干燥12 h,得到干燥的Fe3O4-NH2,备用。
参考文献[31-32]报道的合成方法,以Tp为固定单体,与单体Tph,通过Sciff-Base作用合成COFs。在合成过程中加入Fe3O4-NH2粒子,其氨基与Tp上的醛基发生Sciff-Base作用,从而合成磁性COFs材料(见图1),合成步骤如下:称取0.063 0 g Tp于250 mL三口烧瓶中,加入10 mL无水乙醇,超声溶解;加入0.105 0 g Fe3O4-NH2,超声振荡10 min后,置于50 ℃水浴中机械搅拌30 min;另称取0.117 1 g Tph于小烧杯中,加入10 mL无水乙醇使其溶解,常温机械搅拌下将其缓慢逐滴加入上述混合溶液中,继续搅拌12 h;将溶液置于45 ℃旋转蒸发仪中蒸干,依次采用DMF、95%的乙醇溶液、甲醇洗涤;置于50 ℃真空干燥箱中干燥12 h,即得磁性COFs材料((TpTph)@Fe3O4)。
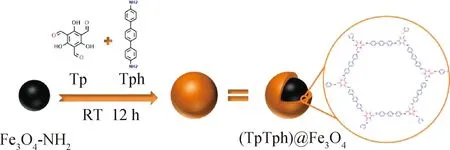
图1 磁性COFs材料的合成示意图Fig.1 Synthesis scheme of magnetic COFs materials
1.3.2 磁性材料表征采用全自动比表面积和孔隙分析仪检测材料比表面积和孔结构:材料经100 ℃预干燥16 h;氮气吸附-脱附实验选择meso-micro模板进行。
采用溴化钾压片法,利用傅里叶变换红外光谱仪表征材料的官能团。
采用HTEM表征材料表面形貌,加速电压300 kV,无水乙醇分散,超声10 min,普通铜网制样。
采用综合物性测量系统检测材料磁性,室温条件,磁场范围±2T。
1.3.3 样品前处理1)衍生化反应。准确称取40 mg研磨粉碎的烘焙样品,使用5 mL正己烷脱脂3次,N2吹干;加入1.5 mL硼酸钠溶液(0.2 mol/L,pH值为9.2),然后缓慢加入1 mL 0.1 mol/L的硼氢化钠溶液,置于4 ℃冰箱中还原12 h;将反应液倒入水解管中,加入2.6 mL 12 mol/L浓HCl溶液,于N2保护下110 ℃水解反应24 h,过滤,用KOH溶液(10 mol/L)调节反应液pH值为8.0~9.0,超纯水定容至10 mL,得到样品酸解溶液。取1 mL样品酸解溶液加入100 μL内标溶液(d4-CML和d4-CEL的质量浓度均为1.0 μg/mL),混匀;取上述溶液500 μL,加入500 μL乙腈,混匀后加入200 μL硼酸盐缓冲溶液(pH值为 9.0)和200 μL的FMOC-Cl(质量浓度为15 g/L)乙腈溶液,涡旋混匀,于40 ℃水浴反应10 min,冷却至室温后,加入5 μL甲酸终止反应,再用50%的乙腈溶液稀释至3 mL,得到样品衍生化溶液[33]。
2)MSPE方法。在样品衍生化溶液中加入20 mg磁性COFs材料,涡旋萃取20 min,利用磁铁实现相分离,弃去溶液;分别使用5 mL超纯水和二氯甲烷对磁性材料进行洗涤;加入4 mL 5%的氨水/甲醇溶液,涡旋萃取洗脱15 min,洗脱液经N2吹干,用1 mL 超纯水复溶后,进行HPLC-MS/MS分析。
1.3.4MSPE条件优化分别对吸附剂用量(10 mg、20 mg、30 mg、40 mg、50 mg)、涡旋萃取时间(5 min、10 min、15 min、20 min、25 min、30 min)、洗脱溶剂种类(甲醇、1%氨水/甲醇、5%氨水/甲醇、10%氨水/甲醇)、洗脱溶剂体积(2 mL、4 mL、5 mL、6 mL)和洗脱时间(5 min、10 min、15 min、20 min、30 min)进行优化。当优化其中一个因素时,其他因素均设定为最优。
1.3.5 磁性COFs材料循环实验依次利用DMF、95%的乙醇溶液、甲醇对使用过的磁性COFs材料((TpTph)@Fe3O4)进行洗涤,置于50 ℃真空环境中干燥12 h后,再次进行MSPE,考查磁性材料的循环使用效果。
1.3.6 本文方法表征1)标准工作曲线绘制。将CML和CEL标准品配制成质量浓度均为10 μg/mL的混合标准溶液,将d4-CML和d4-CEL标准品配制成质量浓度均为1 μg/mL的混合内标溶液;准确移取混合标准溶液50 μL、100 μL、200 μL、400 μL、800 μL,分别加入1 mL混合内标溶液,用超纯水定容至10 mL,得到系列标准工作溶液;按照1.3.3中的方法进行衍生化处理后,进行HPLC-MS/MS分析,采用内标法绘制标准曲线。
2)基质效应考查。选择烘焙食品样品中的饼干和坚果为典型基质,按照1.3.3进行样品前处理,并加入系列标准工作溶液,配制基质标准工作溶液,进行HPLC-MS/MS分析,采用内标法绘制标准曲线。
3)加标回收实验。分别以饼干和坚果为典型基质,在低、中、高3个水平下进行加标回收实验。
4)日内、日间精密度(RSD)、检出限(LOD)和定量限(LOQ)测定。日内精密度为同一天测定,平行测定5次;日间精密度为不同天测定,平行测定5次;取最低质量浓度标准工作溶液,采用HPLC-MS/MS法平行测定10次,计算标准差(SD),3倍SD为LOD,10倍SD为LOQ。
1.3.7 测试条件Waters C18型色谱柱;柱温35 ℃;进样量10 μL;流速0.3 mL/min。流动相:A相为0.5%甲酸的水溶液,B相为乙腈。梯度洗脱条件:0~5.0 min,50%~41% A;5.1~9.0 min,41%~5% A;9.1~11.0 min,5%~50% A。
离子源为电喷雾离子源(ESI);扫描模式为正离子扫描;检测方式为多反应监测(MRM);电喷雾电压5500 V;气帘气压力206.85 kPa;辅助气1压力482.65 kPa;辅助气2压力482.65 kPa;离子源温度500 ℃;驻留时间50 ms;各化合物的定量离子对、定性离子对、驻留时间、碰撞能量(CE)及去簇电压(DP)见表1。
表1 CML-FMOC、CEL-FMOC及其内标溶液的MRM参数Table 1 Specic parameters of CML-FMOC, CEL-FMOC and internal standards for MRM analysis

表1 CML-FMOC、CEL-FMOC及其内标溶液的MRM参数Table 1 Specic parameters of CML-FMOC, CEL-FMOC and internal standards for MRM analysis
化合物定量离子对(m/z)定性离子对(m/z)驻留时间/msCE/VDP/VCML-FMOC649.4/427.2649.4/179.55019100CEL-FMOC663.3/441.5663.3/179.55020100d4-CML-FMOC653.4/431.2653.4/179.55019100d4-CEL-FMOC667.3/445.5667.3/179.55020100
1.4 数据处理
每组进行3次重复实验,数据均以(平均值±标准差)表示;采用Analyst®1.6 Software进行AGEs数据分析;使用Origin 2021制图。
2 结果与分析
2.1 磁性COFs材料表征结果分析
2.1.1 比表面积和孔结构采用全自动比表面积和孔隙分析仪对所合成的磁性COFs材料进行氮气-吸附脱附实验,结果表明,Fe3O4-NH2的比表面积为32.83 m3/g,孔体积为0.15 cm3/g,平均孔径为113 nm;磁性COFs材料((TpTph)@Fe3O4)的比表面积为115.43 m3/g,孔体积为0.63 cm3/g,平均孔径为3.7 nm。因此,所合成的磁性COFs材料呈多孔结构,且比表面积较大,适合复杂基质中痕量成分的富集分离。
2.1.2 形貌表征图2为磁性COFs材料的HTEM图。由图2可知,Fe3O4-NH2粒径均匀,平均粒径约为50 nm;而磁性COFs材料除了有COFs材料包裹在Fe3O4-NH2粒子外,还存在树枝状生长的COFs材料,粒径不均匀。

图2 磁性COFs材料的 HTEM图Fig.2 HTEM images of magnetic COFs materials

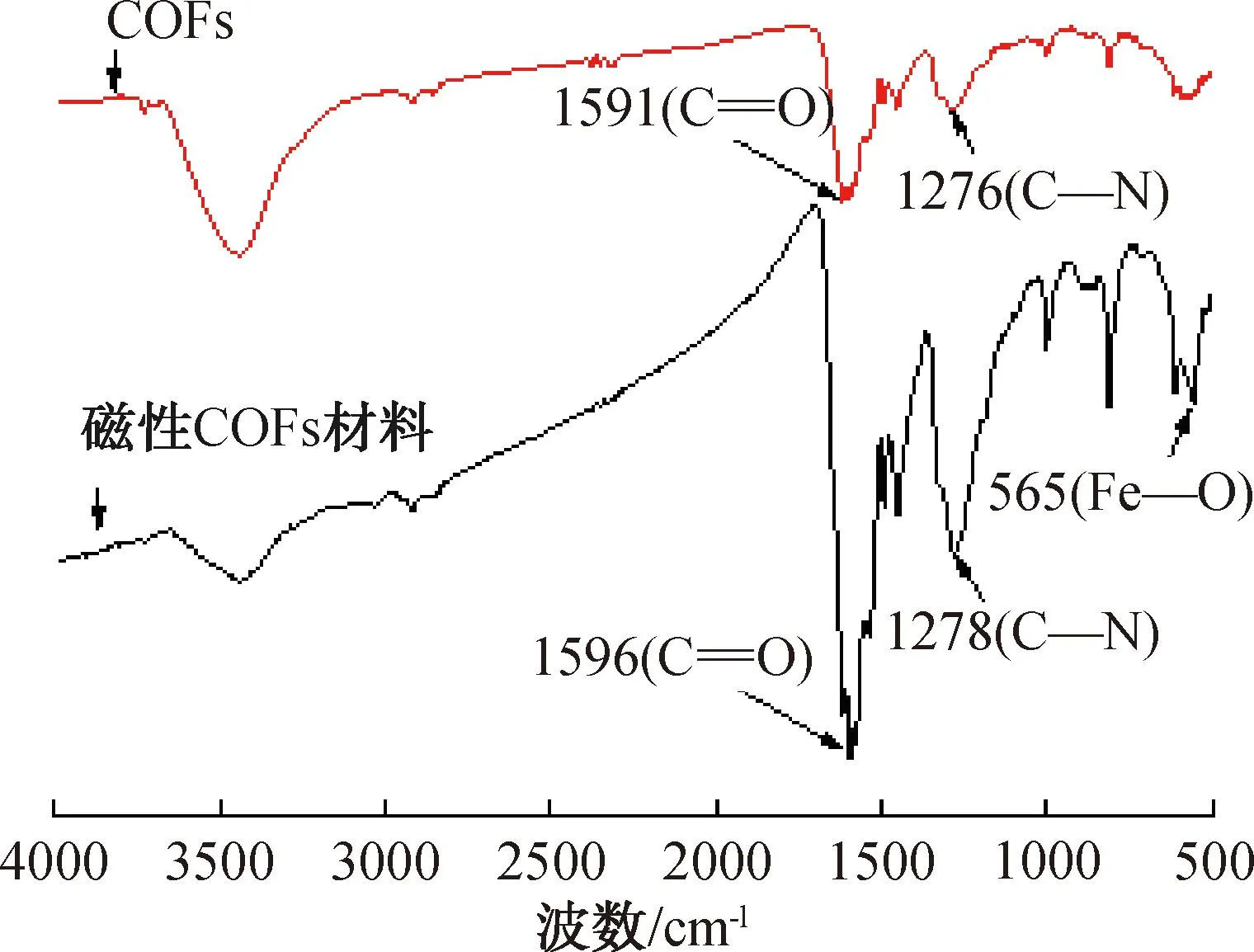
图3 磁性COFs材料的FT-IR谱图Fig.3 FT-IR spectrum of magnetic materials
2.1.4 磁性分析图4为磁性COFs材料的磁滞回线。由图4可知,Fe3O4-NH2和磁性COFs材料的饱和磁化强度分别为40.1 emu/g和30.3 emu/g,这可能是COFs聚合物对Fe3O4-NH2粒子的包覆所致。磁性COFs材料保持较高的饱和磁化强度有助于其在外部磁场中快速响应,适用于MSPE技术。
2.2 前处理条件优化结果分析
2.2.1 衍生化反应条件优化结果由于CML和CEL的极性和水溶性均较强,在反相液相色谱柱上出峰较早(3.0 min之前),且二者分离度较差[25]。因此,本文采用FMOC-Cl对CML和CEL进行衍生化反应,降低二者极性,推迟色谱出峰时间。图5为MRM模式下CML-FMOC和CEL-FMOC及其内标衍生物的HPLC-MS/MS色谱图。由图5可知,CML-FMOC和CEL-FMOC的保留时间分别为7.43 min和7.73 min,二者实现了基线分离;氘代内标衍生物同样实现了基线分离。
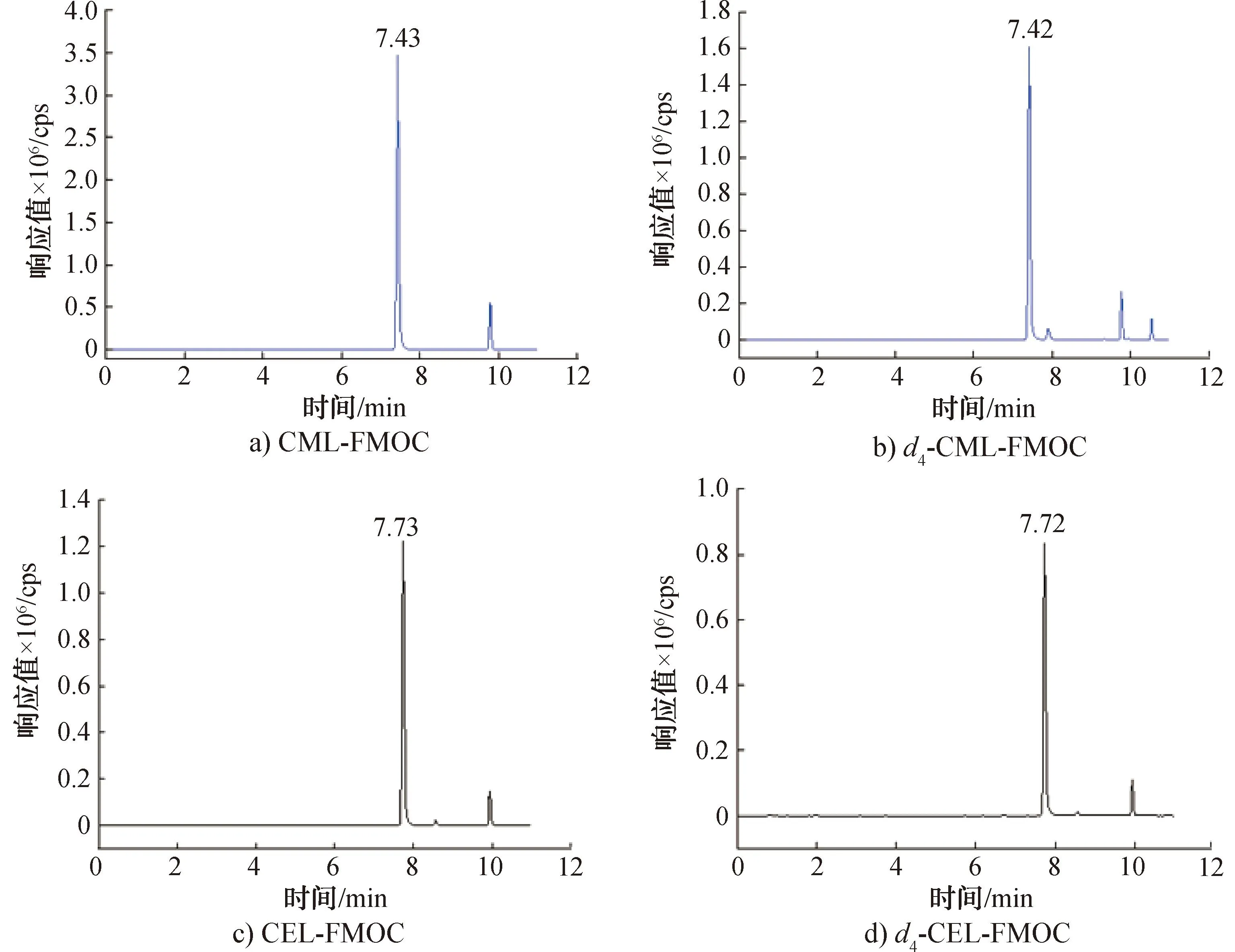
图5 MRM模式下CML-FMOC、CEL-FMOC及其内标衍生物的HPLC-MS/MS色谱图Fig.5 Chromatograms of CML-FMOC, CEL-FMOC and their internal standards in MRM mode
2.2.2MSPE条件优化结果图6为不同萃取条件对目标物萃取量的影响。由图6a)可知,CML和CEL衍生物的萃取量均随吸附剂用量增大呈先升高后降低再稳定的变化趋势,当吸附剂用量为20 mg时,CML和CEL衍生物的萃取量均达最大值。因此,选择20 mg为适宜的吸附剂用量。
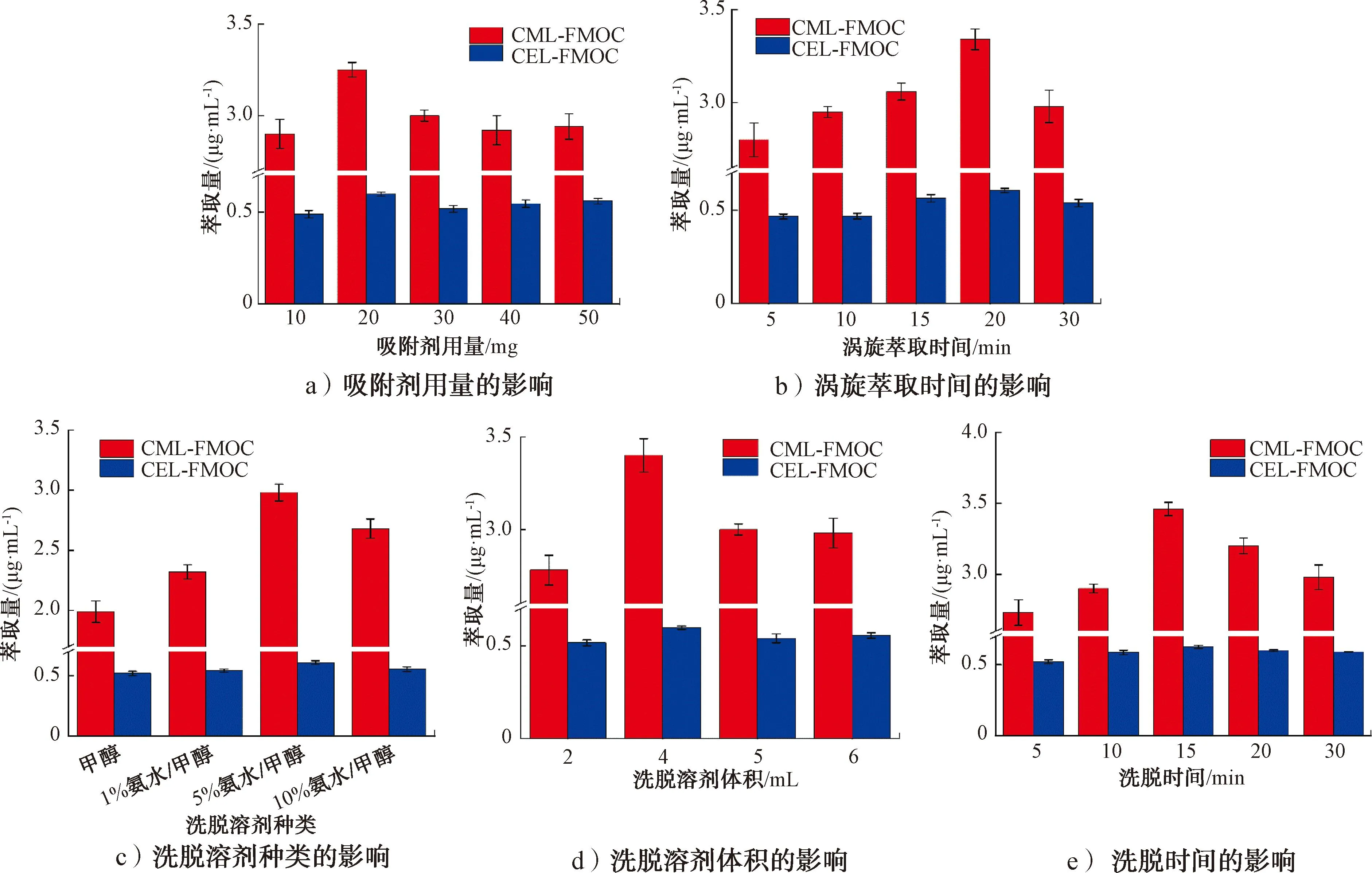
图6 不同萃取条件对目标物萃取量的影响Fig.6 The effect of different extraction conditions on the extraction quantity of target substance
由图6b)可知,随着涡旋萃取时间的延长,目标物萃取量均先增加后降低。当涡旋萃取时间为20 min时,CML和CEL衍生物的萃取量均达到最大值。因此,选择20 min为适宜的漩涡萃取时间。
由图6c)可知,5%氨水/甲醇的洗脱效果最好。因此,选择5%氨水/甲醇为适宜的洗脱溶剂。
由图6d)可知,随着洗脱溶剂体积增加,目标物萃取量均呈先升高后降低再稳定的变化趋势,当洗脱溶剂体积为4 mL时,目标物萃取量均达到最大值。因此选择4 mL为适宜的洗脱溶剂体积。
由图6e)可知,随着洗脱时间的延长,目标物萃取量均先升高后降低,当洗脱时间为15 min时,目标物即能被洗脱完全。因此,选择15 min为适宜的洗脱时间。
综上可知,本文MSPE的适宜条件如下:吸附剂用量为20 mg,涡旋萃取时间为20 min,洗脱溶剂选用5%氨水/甲醇溶液,洗脱溶剂体积为4 mL,洗脱时间为15 min。
2.3 磁性COFs材料循环使用效果
图7为磁性COFs材料循环使用效果图,其中不同小写字母表示差异显著(P<0.05)。由图7可知,磁性COFs材料再生5次,目标物萃取量仍保持在90%以上;当磁性COFs材料再生第6次时,目标物的萃取量低于90%。因此,本文合成的磁性COFs材料能循环使用5次。
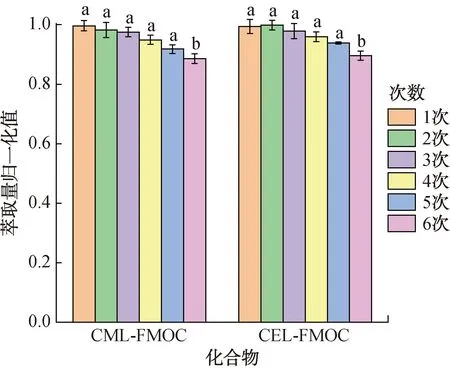
图7 磁性COFs材料循环使用效果图Fig.7 Reuse performance of magnetic COFs materials
2.4 分析方法表征
表2为本文方法的标准曲线方程和基质效应,其中斜率比指基质配标线性方程与溶剂配标线性方程的斜率比。由表2可知,斜率比在1.04~1.15之间,低于文献 [25-26]的结果,表明本文方法能有效地降低基质效应,提高定量分析的准确性。因此,可将溶剂配标的标准工作曲线用于烘焙食品样品分析。

表2 本文方法的标准曲线方程和基质效应Table 2 Standard curves and matrix effects of the method
表3为本文方法加标回收率、RSD、LOD和LOQ测定结果。由表3可知,饼干基质中CML和CEL的加标回收率分别为90.70%~108.74%和85.50%~105.60%;坚果基质中CML和CEL的加标回收率分别为91.80%~105.40%和92.45%~113.00%;日内和日间精密度均良好(RSD日内≤4.74%,RSD日间≤5.38%)。CML和CEL的LOD分别为2.05 ng/mL和2.31 ng/mL,LOQ分别为6.83 ng/mL和7.71 ng/mL,适用于烘焙食品中的CML和CEL的定量分析。
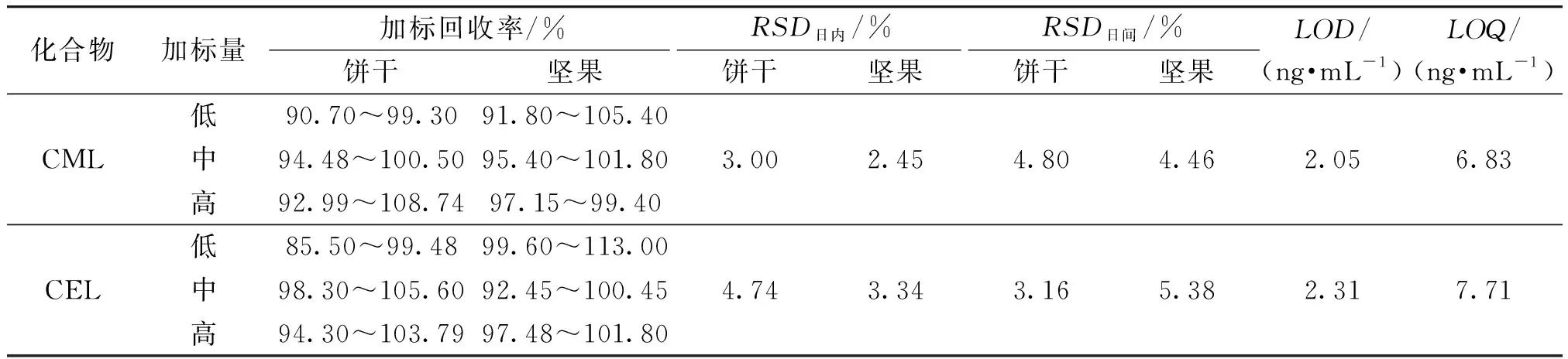
表3 本文方法加标回收率、RSD、LOD和LOQ测定结果Table 3 Recoveries, precisions, limits of detection and limits of quantification of method
2.5 实际样品分析
采用本文方法对市售的26种烘焙食品中CML和CEL的含量进行测定,结果见表4。由表4可知,饼干、糕点类烘焙食品中二者含量范围分别为(9.60±0.16)~(78.10±1.12)mg/kg、(4.37±0.23)~(26.70±1.27)mg/kg;坚果类烘焙食品中二者含量范围分别为(6.49±0.13)~(82.00±0.98)mg/kg、(6.65±0.30)~(55.90±0.67)mg/kg,与文献[21-22]报道的结果接近。可见,不同类型烘焙食品及同类烘焙食品不同品牌之间,CML和CEL的含量均存在明显差异。另外,烘焙食品中CML和CEL的含量普遍偏高,长期食用存在一定的健康风险。

表4 市售烘焙食品样品中CML和CEL含量测定结果Table 4 Determination results of CML and CEL content in commercially available baked food samples
3 结论
本文合成了一种磁性COFs材料((TpTph)@Fe3O4),并建立了基于磁性COFs材料的MSPE技术用于烘焙食品样品中CML和CEL的高效、选择性富集,并采用HPLC-MS/MS法对CML和CEL进行定量分析,得出如下结论:1)所合成的磁性COFs材料具有较大的比表面积和较高的磁化强度,适合应用于MSPE技术。2)MSPE的适宜条件为:吸附剂用量20 mg,涡旋萃取时间20 min,洗脱溶剂选用5%氨水/甲醇溶液,洗脱溶剂体积4 mL,洗脱时间15 min。3)所合成的磁性COFs材料可再生循环使用5次。4)CML和CEL的LOD分别为2.05 ng/mL、2.31 ng/mL,LOQ分别为6.83 ng/mL、7.71 ng/mL;日内精密度(RSD日内≤4.74%)和日间精密度(RSD日间≤5.38%)良好;在饼干、坚果2种典型样品基质中,CML和CEL的加标回收率较好,分别为90.70%~108.74%、85.50%~113.00%。5)对于市售的26种烘焙食品,饼干、糕点类中CML和CEL含量范围分别为(9.60±0.16)~(78.10±1.12) mg/kg、(4.37±0.23)~(26.70±1.27)mg/kg;坚果类中二者含量范围分别为(6.49±0.13)~(82.00±0.98)mg/kg、(6.65±0.30)~(55.90±0.67)mg/kg。本文所建立的方法能显著降低基质效应,有效提高样品定量分析准确性,为复杂食品基质中AGEs定量分析提供了新思路。
