1 例重度低氧血症患者行急诊剖腹探查术的麻醉管理
2024-01-11陈添雅宋芬刘玥张伟
陈添雅 宋芬 刘玥 张伟
患者男,31 岁。因“间断血便4 d 余”于2020 年9 月16 日在南京大学医学院附属鼓楼医院急诊拟“下消化道出血”收住入院,拟在全麻下行“急诊剖腹探查术”。患者既往有阑尾手术史。查体:贫血貌,腹部膨隆,余无殊。心率110 次/min,血压88/38 mmHg(1 mmHg=0.133 kPa),脉搏血氧饱和度(saturation of peripheral oxygen,SpO2)波动于80%左右,血气分析示PaO271.3 mmHg,PaCO231.6 mmHg,Hb 46g/L,氧合指数(oxygenation index,OI)339.5 mmHg。予输血补液、鼻导管吸氧(2 L/min)等处理。胸腹部CT 检查提示双侧胸膜轻度增厚,两肺胸膜下少量索条及渗出(图1A);心腔密度减低,考虑贫血(图1B);直肠及乙状结肠积血可能,中腹部腹腔肠系膜渗出,肠系膜上动脉周围渗出(图1C)。术前心电图检查提示窦性心动过速,心率104 次/min,T波低平。血Hb 54 g/L,中性粒细胞百分率83.8%,Fib 1.0 g/L,血浆白蛋白19.6 g/L。患者入手术室时神志清,精神萎,贫血貌,口唇严重紫绀,体温37 ℃,心率125 次/min,无创血压110/70 mmHg,经鼻吸氧流量(2 L/min)下SpO2为59%,听诊双肺呼吸音低,未闻及干湿啰音。开放外周静脉通道,监测有创动脉血压、置入胃管行胃肠减压。10 L/min 面罩吸氧5 min后SpO2上升至70%。血气分析结果示PaO240 mmHg,PaCO230 mmHg,SpO280%,OI 66.7 mmHg,K+2.8 mmol/L,红细胞压积20%,Hb 69 g/L,提示Ⅰ型呼吸衰竭、低钾血症、低钙血症、贫血,给予补钾、补钙、地塞米松10 mg 静脉推注及输血处理。行肺部超声检查快速排除气胸、胸腔积液。麻醉诱导采取快诱导,分别给予咪达唑仑0.5 mg、1%丙泊酚70 mg、芬太尼0.2 mg、维库溴铵8 mg静脉注射,2 min 后可视喉镜下气管插管并连接呼吸机进行机械通气,设定潮气量(tidal volume,VT)6 mL/kg、通气频率(frequency,f)14 次/min,呼气末正压(positive end expiratory pressure,PEEP)5 cmH2O,吸入氧浓度(fracion of inspiration oxygen,FiO2)29%,此时SpO2波动于80%~85%,听诊双肺呼吸音低。经颈内静脉穿刺置双腔管测得中心静脉压(central venous pressure,CVP)为18 mmHg,予限制液体输入。
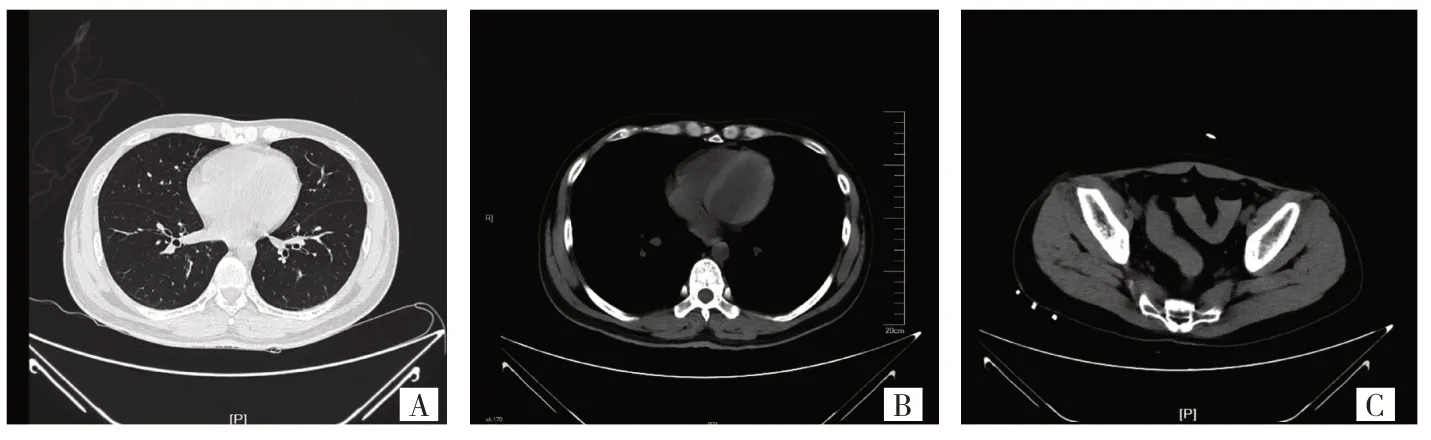
图1 患者腹胸部CT 检查影像图(A:双侧胸膜轻度增厚,两肺胸膜下少量索条及渗出;B:心腔密度减低,考虑贫血;C:直肠及乙状结肠积血可能,中腹部腹腔肠系膜渗出,肠系膜上动脉周围渗出)
麻醉维持予以2%丙泊酚5~12 mL/h、顺式阿曲库铵10 mg/h、瑞芬太尼0.1~0.3 mg/h、右美托咪定20 μg/h 静脉泵注,芬太尼0.1 mg/次间断静脉推注共计0.6 mg。手术开始后患者血流动力学指标波动,收缩压116~177 mmHg,舒张压55~84 mmHg,心率93~141 次/min,予以去氧肾上腺素20 μg 间断静脉推注、输血、限制性液体复苏及调整麻醉深度处理后情况改善,收缩压115~146 mmHg,舒张压73~92 mmHg,心率79~94 次/min。术中血气分析PaCO232~40 mmHg,PaO250~148 mmHg,SpO287%~99%。术中诊断为:(1)下消化道出血;(2)急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)(重度);(3)失血性休克;(4)重度贫血;(5)重度低蛋白血症;(6)阑尾炎(术后)。行“肠粘连松解+小肠部分切除+小肠小肠吻合术”,总手术时间4 h 50 min,液体总输入量3 625 mL,其中胶体液1 000 mL、输血2 625 mL(包括悬浮少白红细胞1 800 mL、血浆625 mL 及冷沉淀200 mL);液体总排出量2 600 mL,其中出血200 mL、尿量1 400 mL、血便1 000 mL。根据患者术中氧合情况调整呼吸机参数为FiO250%~100%,VT550 mL,f 14 次/min,PEEP 10 cmH2O,手术结束前1 h 复查血气分析PaCO232.5 mmHg,PaO295.2 mmHg,SpO299%,Hb 99g/L,OI 328.3 mmHg。患者带气管导管呼吸机辅助通气下[同步间歇指令通气模式,FiO2100%,VT550 mL,f 12 次/min,压力支持(pressure support,PS)10 cmH2O ,PEEP 10 cmH2O]转入ICU。
术后第1 天予液体负平衡治疗,pH 7.472,PaCO232.5 mmHg,PaO2194.3 mmHg,OI 388.6 mmHg。床旁胸部X 线检查未见明显异常(图2A)。予肺保护性通气策略(同步间歇指令通气模式,FiO2100%,VT550 mL,f 12 次/min,PS 10 cmH2O,PEEP 10 cmH2O)并尝试将FiO2逐步降至60%,患者无法耐受,SpO2从100%降至90%,血压从135/84 mmHg降至108/66 mmHg,CVP 从9 mmHg 升至20 mmHg,予恢复纯氧通气、输注白蛋白20 mg 联合呋塞米10 mg 静脉注射。待患者氧合及血流动力学指标好转后再逐步将FiO2降至50%,考虑患者氧合较不稳定PEEP 暂未下调,此时患者氧合维持于SpO295%~100%,血流动力学维持于血压111/69~150/87 mmHg、CVP 12~18 mmHg。术后第2 天,机械通气参数FiO2降至40%、PEEP 降至6 mmHg、f 降至10 次/min,患者可耐受。血气分析pH 7.406,PaCO231.7 mmHg,PaO2159.8 mmHg,OI 399.5 mmHg,提示氧合较前明显改善。床旁胸部X 线检查示双肺渗出,两肺纹理增多模糊,尤其双下肺,呈絮状(图2B)。术后第3 天,机械通气参数调整为压力支持通气模式其余设定不变,行自主呼吸试验后血气分析提示pH 7.527,PaCO225.1 mmHg,PaO282.6 mmHg,OI 215.5 mmHg,顺利撤机拔管过渡至鼻导管吸氧5 L/min。术后第4 天,复查床边胸部X 线检查示两肺纹理清晰,右肺透亮度稍减低,右肺渗出可能(图2C)。术后第5 天,停止液体负平衡治疗,患者体温37.6℃,CRP 43.5 mg/L,CT 检查提示两侧胸腔积液伴前缘肺组织膨胀不全(图2D),考虑为由于久卧床所致患者存在感染,予以抗感染治疗并进行呼吸功能锻炼。术后第8 天,患者转入普通病房,并于术后第10 天痊愈出院。

图2 患者术后胸部X 线及胸部CT 检查影像图(A:术后第1 天床旁胸部X 线正位片未见明显异常;B:术后第2 天床旁胸部X 线正位片示双肺渗出,两肺纹理增多模糊,尤其双下肺,呈絮状;C:术后第4 天床边胸部X 线正位片示两肺纹理清晰,右肺透亮度稍减低,右肺渗出可能;D:术后第5 天胸部CT 提示两侧胸腔积液伴前缘肺组织膨胀不全)
讨论本例患者入手术室时即存在重度低氧血症,结合麻醉诱导前血气分析结果考虑外呼吸功能障碍中的肺换气功能障碍导致的低张性缺氧,病因首先考虑为ARDS。
ARDS 诊断需肺部影像学(如X 线、CT 等)支持,针对该患者重症超声可帮助诊断及鉴别诊断ARDS。2012 年Berlin标准指出可用心脏超声辨别肺水肿类型以排除心源性肺水肿及静水压升高性肺水肿[1]。2016 年Riviello 等[2]提出的Kigali修改的Berlin 标准中建议在资源有限的情况下使用LUS 或胸部X 线替代Berlin标准使用的胸部CT 或胸部X 线确定双肺浸润影。该患者急性起病,术中肺部超声排除气胸、胸腔积液,术后胸部影像学检查提示肺部透亮度减低、渗出影;患者无心功能不全病史,消化道出血致重度贫血,循环容量欠缺,可排除心源性肺水肿;予充分吸氧后仍存在重度低氧血症,且氧合指数为66.7 mmHg,符合ARDS Berlin 诊断标准,可明确诊断为重度ARDS。
针对该患者病情,麻醉过程中机械通气策略与液体管理是两大挑战。ARDS 患者机械通气的目标是在提供维持生命气体交换的前提下最大幅度减少呼吸机相关性肺损伤,即使用肺保护性通气策略[3]。ARDS 患者适用的最佳VT目前建议使用VT=4~8 mL/kg 理想体重[4]。使用PEEP 可以防止小潮气量导致的呼气末肺泡塌陷引起的萎陷伤,但过高的PEEP 会影响静脉回流并造成肺泡过度膨胀,需进行个体化PEEP 滴定寻找最佳PEEP。评估肺通气状态对于肺部病变不均匀分布的ARDS 患者实施个体化肺保护性通气策略至关重要,重症超声在这方面具有一定价值。一项ARDS 患者的随机交叉研究证明,不论评价局部或整体肺复张状态,肺部超声和金标准胸部CT 检查均具有一致性[5]。有研究结果显示在ARDS 患者中肺部超声滴定PEEP组比最大氧合法组肺通气改善更多且肺异质性显著降低[6-7]。综上所述,肺部超声是评价肺复张状态的有效工具,但肺部超声能否用于指导个体化肺保护性通气还有待更多研究证明。
液体管理方面,失血性休克的液体复苏观念已从传统的早期快速液体复苏逐渐转变为限制性液体复苏(limited fluid resuscitation,LFR)[8]。一项荟萃分析结果表明,对失血性休克患者进行LFR 可减少输血需求、降低ARDS 和多脏器功能衰竭的发生率并能显著降低死亡率[9]。对ARDS 患者的液体管理策略目前尚无统一意见,一项随机对照试验结果表明限制性液体管理策略比开放性液体管理策略可能更有益,但该试验仅对未合并休克的ARDS 患者进行液体管理[10]。本例患者在维持生命体征前提下使用液体负平衡治疗以减少肺水肿。液体复苏的血压目标应根据患者的容量反应性个体化制定,动态指标如每搏变异率、脉压变异率比静态指标如CVP 在评估患者容量反应性指导个体化液体复苏方面更有价值[11],但通过有创操作监测动态指标存在并发症风险。超声检查也许是无创评估容量反应性的潜在工具,研究证明通过经食管超声心动图测量的下腔静脉变异率可预测腹部手术后患者和部分呼吸困难患者的容量反应性[12-13]。
综上所述,低氧血症患者的麻醉应在保证患者通气氧合维持生命体征平稳的同时分析造成低氧血症的病因,针对病因采取相应的处理措施。合并失血性休克的ARDS 患者在麻醉管理上存在巨大挑战,关键在于早期识别诊断ARDS和失血性休克,难点在于恰当的通气策略和液体管理策略,重症超声检查是诊断、治疗ARDS 过程中的有效工具。
