MMP-9抑制剂对人口腔鳞状细胞癌细胞系CAL27生物学行为影响机制的研究
2024-01-11王静璇刘红悦庄志征杨英顺
王静璇, 刘红悦, 庄志征, 胡 燕, 杨英顺
(1.保定市第一中心医院口腔二科,保定 071000;2.衡水市第二人民医院口腔二科,衡水 053099;3.河北大学附属医院口腔科,保定 071030)
口腔鳞状细胞癌(OSCC)的定义为具有不同分化程度的浸润性上皮肿瘤,是口腔颌面部最常见的恶性肿瘤[1]。目前在治疗方面取得了技术进步,大多数早期OSCC 患者可通过手术、化学疗法及放射疗法治疗,但随着诊断延迟,其5 年生存率不足60%;此外,继发性肿瘤每年3%~7%的形成率是其他恶性肿瘤所无法比拟的,并可能导致疾病复发[2-3]。据报道[4],肿瘤转移是癌症患者死亡的主要原因,上皮间质转化(EMT)和细胞外基质(extracellular matrix,ECM)降解过程涉及肿瘤迁移和侵袭,已成为近年来肿瘤转移研究的热点,积极探索癌症转移过程中的关键调控分子并加以干预可能是OSCC 治疗的潜力选择。基质金属蛋白酶(MMPs)在此过程中发挥积极作用,其还参与促生长信号释放、抗细胞凋亡、控制血管生成和新血管形成等促进恶性肿瘤发展过程[5],提示MMPs 可能是OSCC 治疗的潜在靶点。BB-94 是一种广谱MMP 抑制剂,其可抑制基质金属蛋白酶-9(MMP-9)的活性。研究[6]发现,BB-94 的治疗降低了食管鳞状癌细胞的生长、迁移和EMT,但关于BB-94 对OSCC 的相关报道较少。PI3K/Akt 通路在调节细胞生长和代谢中起关键作用,研究[7]发现,该通路失活可抑制OSCC 细胞EMT。为探究BB-94 对OSCC 的干预作用及是否涉及PI3K/Akt 通路,本实验以体外培养的人OSCC 细胞系CAL27 为研究载体,并探讨BB-94 对CAL27 细胞恶性生物学行为的影响及可能的作用机制,以期为OSCC 发病机制及治疗手段提供一定的参考。
1 材料和方法
1.1 材料
1.1.1 细胞系 人OSCC 细胞系CAL27 购自武汉普诺赛生命科技有限公司。
1.1.2 试剂和仪器 BB-94(APExBIO 公司,美国);Matrigel 基质胶(BD 公司,美国);明胶(Sigma 公司,美国);AnnexinV-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)流式细胞凋亡检测试剂盒(南京凯基生物科技公司,中国);DMEM 培养液、胎牛血清(Gibco 公司,美国);磷脂酰肌醇3-激酶(PI3K)、磷酸化蛋白激酶B(p-Akt)、N-钙黏蛋白(N-cad)、MMP-9、E-钙黏蛋白(E-cad)、波形蛋白(Vim)抗体(Abcam 公司,美国);全自动酶标仪(Bio-Rad 公司,美国);实时定量聚合酶链反应(RT-qPCR)仪(赛默飞世尔科技有限公司,美国)。
1.2 方法
1.2.1 细胞培养 DMEM 完全培养液(含10%胎牛血清、100 μg/mL 链霉素、100 U/mL 青霉素)复苏CAL27细胞,以1×105个/mL密度接种至培养瓶中,于37 ℃、5% CO2及饱和湿度环境条件下的培养箱中培养,待细胞生长至80%左右时即进行传代,传代2~3 次。
1.2.2 明胶酶谱实验检测MMP-9 活性 利用不含胎牛血清的DMEM 条件培养液(200 μL)以每孔1×105个的细胞密度将CAL27 细胞接种至24 孔板,培养48 h 后,收集细胞上清液。7 μL 上清液与2×样品缓冲液[pH 8.0、125 mmol/L Tris-HCl、20%甘油、4%十二烷基磺酸钠(sodium dodecyl sulfate,SDS)及0.05%溴酚蓝]室温孵育10 min,加样至含1 mg/mL 明胶的10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electro-phoresis,SDS-PAGE)凝胶中,125 V 恒压分离蛋白至示踪染料到凝胶底部,孵育凝胶于复性缓冲液后置于显影缓冲液中平衡,考马斯亮蓝R-250 染色30 min,后用10%乙酸和10%的异丙醇脱色。用凝胶成像分析系统进行扫描,以0 μg/mL BB-94 组细胞做对照,以条带面积×平均吸光度值反映MMP-9 活性。
1.2.3 细胞计数试剂盒-8(CCK-8)实验检测BB-94对CAL27 细胞存活率的影响 收集对数期细胞,利用含0(对照组)、0.125、0.25、0.5 及1.0 μg/mL BB-94(实验组)的DMEM 条件培养液重悬,并以2×104个/mL 密度接种100 μL 细胞悬液于96 孔板中,每个浓度各5 个复孔。培养箱内培养48 h 后,弃去培养液加入含10 μL CCK-8 溶液的DMEM 完全培养液,继续培养2 h。全自动酶标仪测定450 nm 处的吸光度值,细胞存活率(%)=实验组吸光度值/对照组吸光度值×100%,重复3 次。
1.2.4 流式细胞仪检测细胞凋亡率 收集对数期细胞,利用含0、0.125、0.25、0.5、1.0 μg/mL BB-94 的DMEM 条件培养液重悬,以1×105个/mL 的密度接种2 mL 细胞悬液于6 孔板中,每个浓度各5 个复孔。培养箱内培养48 h 后收集细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3 次,结合缓冲液重悬,5 μL Annexin V-FITC 溶液、5 μL PI 溶液避光染色15 min,流式细胞仪检测细胞凋亡率,重复3 次。
1.2.5 伤口愈合实验检测细胞迁移能力 收集对数期细胞,DMEM 完全培养液重悬,以1×105个/mL 密度接种2 mL 细胞悬液于6 孔板中。待培养至汇合,10 μL 移液枪头制造划痕,PBS 洗涤细胞3 次后利用含0、0.125、0.25、0.5、1.0 μg/mL BB-94 的无血清DMEM 培养液培养48 h,在划痕后0 h 和48 h 时拍照并利用Image J 软件(Rawak Software 公司,德国)测量划痕宽度,划痕愈合率代表细胞迁移能力,划痕愈合率=(0 h 划痕宽度-48 h 划痕宽度)/0 h 划痕宽度×100%,重复3 次。
1.2.6 Transwell 实验检测细胞侵袭能力 以每孔1×105个细胞密度接种CAL27 细胞至Transwell 6孔板上室(涂布有matrigel 基质胶),加入1 mL 对应无血清培养液;于Transwell 6 孔板下室加入2 mL含10%胎牛血清的对应培养液,48 h后弃去培养液,4%多聚甲醛固定,PBS 洗涤后结晶紫染色10 min,PBS 洗涤3 次,镜下观察并计数侵袭细胞数量,重复3 次。
1.2.7 RT-qPCR 技术检测PI3K、Akt mRNA 相对表达水平 细胞分组及培养同步骤1.2.3。TRIzol试剂提取各组细胞总RNA,检测其浓度及纯度后逆转录为cDNA。制备RT-qPCR 反应体系,反应条件为95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,40 个循环,72 ℃ 60 s。以GAPDH 为内参,2-ΔΔCt法计算目的基因的相对表达量。用Primer Premier 5.0 软件(Premier 公司,加拿大)设计引物,送至河北华大基因细胞科技有限公司合成。引物序列PI3K:正向引物5'-ACGCTTTCAAACGCTATCTCC-3',反向引物5'-CTGATGAGGTATGCTAGG CGA-3';Akt:正向引物5'-GAGGATCTTCATGGCGTAGTAG-3',反向引物5'-TG ACCATGAACGAGTTTGAGTA-3';β-actin:正向引物:5'-CAGGAGGCATTGCT GATGAT-3',反向引物5'-GAAGGCTGGGGCTACTTT-3'。
1.2.8 Western blotting 检测相关蛋白相对表达情况 细胞分组及培养同步骤1.2.3。PBS 洗涤2~3 次,收集细胞沉淀,裂解缓冲液振荡裂解,4 ℃下12 000 r/min 离心10 min 后取上清液。测定细胞全蛋白浓度,12.5% SDS-PAGE 凝胶电泳分离蛋白,蛋白转移至PVDF 膜,1×TBST 洗膜3 次,每次10 min,0.05 g/mL 脱脂牛奶室温封闭2 h,一抗(均1︰1 000 稀释)于4 ℃下孵育过夜,洗膜,二抗(1︰8 000 稀释)室温孵育2 h,洗膜,增强化学发光(enhanced chemiluminescence,ECL)液与PVDF 膜反应1~2 min,化学发光凝胶成像系统曝光并拍照记录。用Image J 软件分析条带灰度值,以目的蛋白与内参β-actin 灰度值比值表示蛋白相对表达量。
1.3 统计学分析
利用SPSS 26.0 软件进行数据统计学处理,多计量资料比较采用单因素方差分析,2 组间比较采用LSD-t检验,计量结果均以平均数±标准差(x±s)表示。P<0.05 为差异有统计学意义。
2 结果
2.1 BB-94 对CAL27 细胞MMP-9 相对活性的影响
不同浓度BB-94 作用下的CAL27 细胞MMP-9相对活性比较,差异具有统计学意义(P<0.05)。CAL27 细胞MMP-9 相对活性均随BB-94 作用浓度增大而降低(P<0.05)。详见图1、表1。
表1 CAL27 细胞MMP-9 相对活性比较()Table 1 Comparison of MMP-9 relative activity of CAL27 cells()

表1 CAL27 细胞MMP-9 相对活性比较()Table 1 Comparison of MMP-9 relative activity of CAL27 cells()
①表示P<0.05,与0 μg/mL 组比较;②表示P<0.05,与0.125 μg/mL组比较;③表示P<0.05,与0.25 μg/mL 组比较;④表示P<0.05,与0.5 μg/mL 组比较。

图1 各浓度BB-94 作用下的CAL27 细胞MMP-9 明胶酶谱Figure 1 MMP-9 gelatinase spectrum of CAL27 cells at different concentrations of BB-94
2.2 BB-94 对CAL27 细胞增殖的抑制情况
不同浓度BB-94 作用下CAL27 细胞存活率比较,差异具有统计学意义(P<0.05)。CAL27 细胞存活率随BB-94 浓度增大而降低(P<0.05)。详见表2。
表2 不同浓度BB-94 培养下CAL27 细胞存活率比较()Table 2 Comparison of survival rates of cal27 cells cultured with different concentrations of BB-94 ()
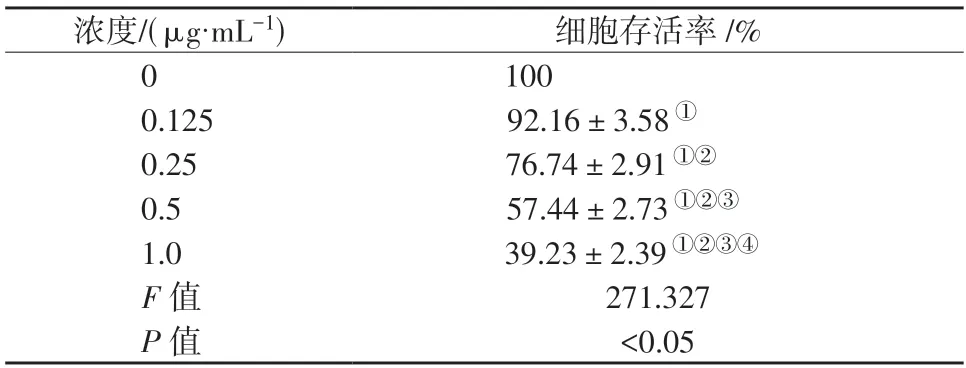
表2 不同浓度BB-94 培养下CAL27 细胞存活率比较()Table 2 Comparison of survival rates of cal27 cells cultured with different concentrations of BB-94 ()
①表示P<0.05,与0 μg/mL 组比较;②表示P<0.05,与0.125 μg/mL组比较;③表示P<0.05,与0.25 μg/mL 组比较;④表示P<0.05,与0.5 μg/mL 组比较。
2.3 BB-94 对CAL27 细胞凋亡的影响
不同浓度BB-94作用下CAL27细胞凋亡率比较,差异具有统计学意义(P<0.05)。CAL27 细胞凋亡率随BB-94 浓度增大而升高(P<0.05)。详见图2、表3。
表3 不同浓度BB-94 培养下CAL27 细胞凋亡率比较()Table 3 Comparison of apoptosis rates of CAL27 cells cultured with different concentrations of BB-94 (()

表3 不同浓度BB-94 培养下CAL27 细胞凋亡率比较()Table 3 Comparison of apoptosis rates of CAL27 cells cultured with different concentrations of BB-94 (()
①表示P<0.05,与0 μg/mL 组比较;②表示P<0.05,与0.125 μg/mL组比较;③表示P<0.05,与0.25 μg/mL 组比较;④表示P<0.05,与0.5 μg/mL 组比较。

图2 流式细胞仪检测各浓度BB-94 作用下CAL27 细胞的凋亡情况Figure 2 Apoptosis of CAL27 cells at different concentrations of BB-94 detected by flow cytometry
2.4 BB-94 对CAL27 细胞迁移能力的影响
不同浓度BB-94 作用下CAL27 细胞划痕愈合率比较,差异具有统计学意义(P<0.05)。CAL27细胞划痕愈合率随BB-94 作用浓度增大而降低(P<0.05)。详见图3、表4。
表4 不同浓度BB-94 培养下CAL27 细胞划痕愈合率比较()Table 4 Comparison of wound healing rates of CAL27 cells cultured with different concentrations of BB-94 (()

表4 不同浓度BB-94 培养下CAL27 细胞划痕愈合率比较()Table 4 Comparison of wound healing rates of CAL27 cells cultured with different concentrations of BB-94 (()
①表示P<0.05,与0 μg/mL 组比较;②表示P<0.05,与0.125 μg/mL组比较;③表示P<0.05,与0.25 μg/mL 组比较;④表示P<0.05,与0.5 μg/mL 组比较。
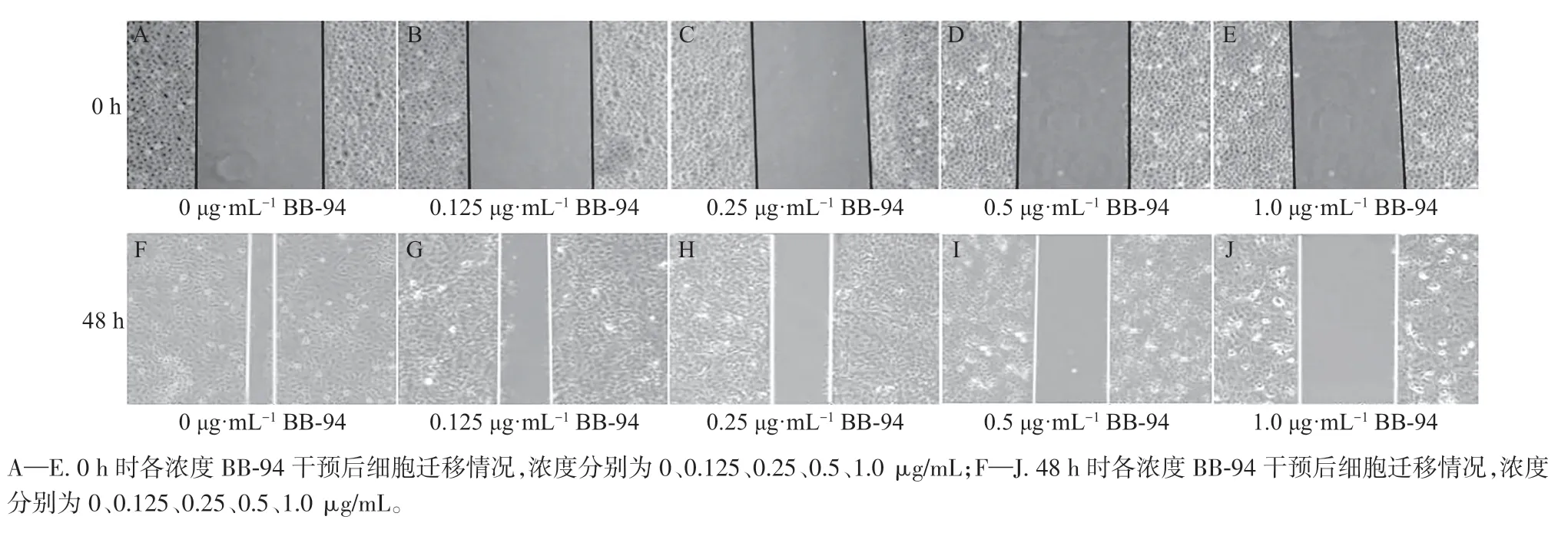
图3 各浓度BB-94 作用下CAL27 细胞迁移情况(×20)Figure 3 Migration of CAL27 cells at various concentrations of BB-94 (×20)
2.5 BB-94 对CAL27 细胞侵袭能力的影响
不同浓度BB-94 作用下CAL27 侵袭细胞数比较,差异具有统计学意义(P<0.05)。CAL27 侵袭细胞数随BB-94 作用浓度增大而减少(P<0.05)。详见图4、表5。
表5 不同浓度BB-94 培养下CAL27 侵袭细胞数比较()Table 5 Comparison of CAL27 invasive cells cultured with different concentrations of BB-94 (()

表5 不同浓度BB-94 培养下CAL27 侵袭细胞数比较()Table 5 Comparison of CAL27 invasive cells cultured with different concentrations of BB-94 (()
①表示P<0.05,与0 μg/mL 组比较;②表示P<0.05,与0.125 μg/mL组比较;③表示P<0.05,与0.25 μg/mL 组比较;④表示P<0.05,与0.5 μg/mL 组比较。

图4 各浓度BB-94 作用下CAL27 细胞侵袭情况(×200)Figure 4 Invasion of CAL27 cells at various concentrations of BB-94 (×200)
2.6 BB-94 对CAL27 细胞PI3K、Akt mRNA 表达的影响
不同浓度BB-94 作用下CAL27 细胞PI3K、Akt mRNA 相对表达水平比较,差异具有统计学意义(P<0.05)。CAL27 细胞PI3K、Akt mRNA 相对表达水平均随BB-94 作用浓度增大而降低(P<0.05)。详见表6。
表6 CAL27 细胞PI3K、Akt mRNA 相对表达水平比较()Table 6 Comparison of relative expression levels of PI3K and Akt mRNA in CAL27 cells ()
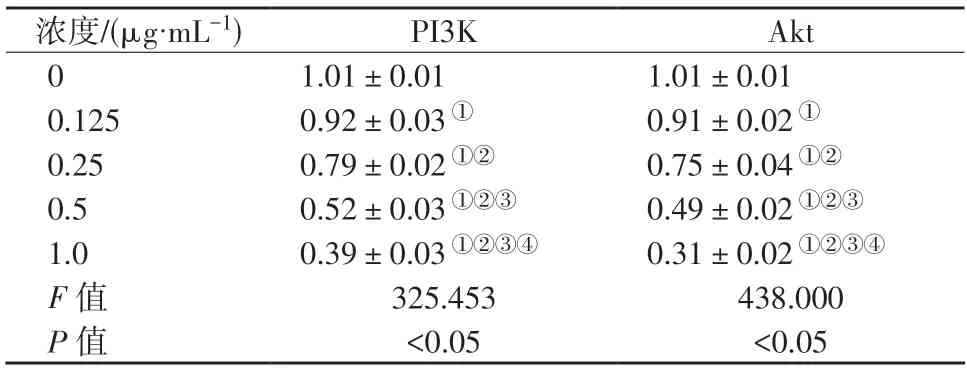
表6 CAL27 细胞PI3K、Akt mRNA 相对表达水平比较()Table 6 Comparison of relative expression levels of PI3K and Akt mRNA in CAL27 cells ()
①表示P<0.05,与0 μg/mL 组比较;②表示P<0.05,与0.125 μg/mL组比较;③表示P<0.05,与0.25 μg/mL 组比较;④表示P<0.05,与0.5 μg/mL 组比较。
2.7 BB-94 对CAL27 细胞中相关蛋白表达的影响
不同浓度BB-94 作用下CAL27 细胞中PI3K、p-Akt、Vim、N-cad、MMP-9 及E-cad 蛋白相 对表达水平比较,差异具有统计学意义(P<0.05)。CAL27细胞中PI3K、p-Akt、Vim、N-cad 及MMP-9 蛋白相对表达水平随BB-94 作用浓度增大而降低,E-cad蛋白相对表达水平随BB-94 作用浓度增大而升高。详见图5、表7。
表7 CAL27 细胞PI3K 等蛋白相对表达水平比较()Table 7 Comparison of relative expression levels of PI3K and other proteins in CAL27 cells (())

表7 CAL27 细胞PI3K 等蛋白相对表达水平比较()Table 7 Comparison of relative expression levels of PI3K and other proteins in CAL27 cells (())
①表示P<0.05,与0 μg/mL 组比较;②表示P<0.05,与0.125 μg/mL 组比较;③表示P<0.05,与0.25 μg/mL 组比较;④表示P<0.05,与0.5 μg/mL组比较。

图5 各浓度BB-94 作用下CAL27 细胞相关蛋白Western blotting 条带图Figure 5 Western blotting banding of CAL27 cell related proteins at various concentrations of BB-94
3 讨论
恶性肿瘤的特征之一是具有内在的ECM 降解活性,ECM 是肿瘤转移的重要组织屏障,其基底膜屏障被破坏将支持侵袭发生[8]。MMPs 为锌依赖性内切蛋白酶家族,可参与ECM 中各种蛋白质的组织重塑和降解过程,为胶原蛋白降解中的主要ECM酶[9],其失调可导致癌症标志的关键信号通路失衡,维持增殖信号转导,逃避生长抑制因子和细胞死亡抗性,从而实现复制永生,因而被视为潜在的抗癌药物靶标[10]。
MMP-9 是由旁分泌癌细胞分泌的明胶酶,与另一种明胶酶MMP-2 不同,MMP-9 是可诱导的,且在正常成人组织中检测不到其活性,它的表达被视为肿瘤侵袭的主要先决条件[11]。有研究[12]发现,MMP-9 表达存在于所有OSCC 病例中,且实质中MMP-9 的染色强度强于肿瘤基质。在OSCC 中,MMP-9 可通过破坏基底膜促进肿瘤进展并实现转移,其过表达被证明在OSCC 中具有预后价值[13]。BB-94 为广谱MMPs 抑制剂,可显著抑制MMP-9 活性及表达[14]。研究[15]发现,BB-94 可降低肝肿瘤动物模型射频消融后的肿瘤生长并抑制其侵袭性,可通过下调MMP-9 表达抑制胰腺癌细胞的增殖和迁移[16]。本研究结果显示,BB-94 可显著抑制OSCC细胞系CAL27 细胞中MMP-9 活性,抑制CAL27 细胞增殖并促进其凋亡,并可降低CAL27 细胞伤口愈合及迁移能力,提示BB-94 可能通过下调MMP-9活性降低癌细胞对ECM 穿透能力及屏障降解损伤作用,进而抑制OSCC 癌细胞的恶性生物学行为。
EMT 是癌症发展和转移第一阶段的关键机制,可启动和维持涉及一系列关键转录因子、MMPs 及下游途径的有序激活,从而利于改变细胞间黏附和ECM 重塑,并最终导致ECM 内的侵入性迁移[17]。EMT 特征是细胞的上皮特性丧失,如黏附和上皮标志物E-cad 的表达,而获得间充质特性,如增加细胞运动和间充质标志物N-cad 和Vim 的上调[18]。MMP-9 通过其对E-cad 的蛋白水解作用和伴随的Vim 和N-cad 丧失而作为EMT 诱导剂[10]。本研究结果显示,BB-94 可显著抑制CAL27 细胞中Vim 及N-cad 蛋白表达,上调E-cad 蛋白相对表达水平,提示BB-94 可能通过抑制MMP-9 表达抑制CAL27 细胞的EMT 转化。研究[19]发现,抗EMT 特性与抑制MMP-9 相关信号通路激活有关。PI3K/Akt 通路被认为是参与肺癌细胞转移和EMT 关键机制之一,与肾细胞癌细胞增殖和转移有关,另可调节人咽部鳞状细胞癌细胞凋亡,据报道抑制该信号通路可减轻OSCC 的发展[20]。Liu 等[21]的研究结果显示,肿瘤相关巨噬细胞分泌的MMP-9 通过PI3K/Akt 通路促进胃癌转移;Jiang 等[22]研究表明,PI3K/Akt 通路可激活EMT 并促进OSCC 进展。本研究结果显示,BB-94 可显著降低PI3K、Akt mRNA 相对表达水平,并下调PI3K 及p-Akt 蛋白表达,提示BB-94 可能通过下调MMP-9 表达抑制PI3K/Akt 信号通路激活,减缓EMT 进展,进而发挥一系列抗CAL27 细胞恶性生物学行为作用。
综上所述,BB-94 可抑制人OSCC 细胞系CAL27细胞的恶性生物学行为,其作用机制可能与下调MMP-9 表达,进而抑制PI3K/Akt 信号通路激活的EMT 进展有关。
