Lmo7对MC3T3-E1细胞增殖、迁移及成骨分化影响的实验研究
2024-01-11毛佳奕王佐林
毛佳奕, 王佐林
(同济大学口腔医学院,同济大学附属口腔医院口腔种植科,上海牙组织修复与再生工程技术研究中心,上海 200072)
Lmo7 是一类蛋白质编码基因,其编码的同名蛋白是一类存在于细胞核、细胞质、细胞膜中的多功能蛋白,隶属于 PDZ-LIM 蛋白家族,广泛分布在从蠕虫到人类的动物界[1-2]。现有研究[3-4]中,Lmo7被证实作为转录激活因子与emerin 结合并调控成肌细胞的分化,与心肌和骨骼肌的发育密切相关[5]。另一方面,Lmo7 被证实其定位于细胞间的黏附连接,是2 种F-肌动蛋白——afadin 和α-actinin 的结合蛋白[6],这提示Lmo7 可能参与多种细胞生物学功能,包括形态发生、分化、增殖[7]和迁移。近年来,有学者[8]研究发现Lmo7 由转化生长因子β1(transforming growth factor-β1,TGF-β1)诱导产生,并且通过负反馈调节TGF-β1 信号通路来限制血管纤维化反应。基于TGF-β1 在促进骨祖细胞增殖、早期分化过程中发挥了重要作用[9-10],Lmo7 与成骨过程是否存在联系,发挥了怎样的功能,目前尚无文献报道。
本研究采用小鼠胚胎成骨细胞前体细胞(MC3T3-E1 cells),通过慢病毒介导的RNA 干扰技术敲低Lmo7 的表达,观察其对细胞增殖、迁移和成骨分化的影响,初步探索Lmo7 在成骨过程中的作用。
1 材料和方法
1.1 实验试剂及仪器
MC3T3-E1 细胞(亚克隆 14;普诺赛公司,中国);α-MEM 培养液(hyclone 公司,美国);血清(BI公司,以色列);胰蛋白酶(Gibco 公司,美国);青链霉素双抗(hyclone 公司;美国);成骨诱导液(赛业公司,中国);慢病毒载体(北京擎科生物科技有限公司,中国);siRNA(北京擎科生物科技有限公司,中国);逆转录试剂盒(TaKaRa 公司,日本);实时定量 PCR 试剂盒(上海翊圣生物科技有限公司,中国);PCR 引物(北京擎科生物科技有限公司,中国);Lmo7 抗体(Santa Cruz 公司,美国);GAPDH 抗体(Cell Signaling Technology 公司,美国);碱性磷酸酶(ALP)显色试剂盒(上海碧云天生物技术有限公司,中国);荧光定量 PCR 仪(Roche 公司,瑞士);Al 680 超灵敏多功能成像仪(GE 公司,美国);倒置荧光显微镜(蔡司公司,德国)。
1.2 实验方法
1.2.1 MC3T3-E1 细胞的成骨诱导培养 将MC3T3-E1 细胞加入10%胎牛血清、1%青霉素-链霉素的α-MEM 培养液中,在37 ℃、5%CO2的环境下培养至细胞汇合度为60%。再将其加入成骨诱导培养液中进行诱导分化,每2~3 天更换1 次培养液,分别在成骨诱导0、3、7、14 d 时收集细胞样品以进行后续实验。
1.2.2 慢病毒转染构建稳定干扰Lmo7 的MC3T3-E1 细胞株 MC3T3-E1 细胞以2.5×105个/孔铺板至6 孔板中,次日更换培养液为含10 μg/mL 聚凝胺(polybrene)的完全培养液,加入慢病毒pLVshLmo7-mCherry(干扰组)或pLV-mCherry(对照组)进行转染,24 h 后更换为含10%胎牛血清的α-MEM 培养液,待细胞生长状况恢复后加入10 μg/mL 嘌呤霉素筛选,得到稳定干扰Lmo7 表达的MC3T3-E1 细胞株。
1.2.3 实时定量聚合酶链反应(RT-qPCR)检测mRNA 表达水平 收集细胞样本,用磷酸盐缓冲液(phosphate buffered saline,PBS)清 洗2 次,TRIzol提取总RNA 后,使用紫外分光光度计测定RNA 纯度与浓度,调平后逆转录合成cDNA,进行RT-qPCR检测,反应体系:正、反引物各0.5 μL,cDNA 模板1 μL,SYBR Green Master mix 5 μL,二次蒸馏水(ddH2O)补足至10 μL,每组样本设3 个复孔。所使用的引物序列如表1。

表1 RT-qPCR 引物序列Table 1 Primer sequences used for RT-qPCR
1.2.4 Western blotting 检测蛋白表达水平 收集细胞样品,用PBS 清洗2 次,使用RIPA 裂解液充分裂解细胞提取总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)试剂盒测定蛋白浓度,调平后上样行10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),再转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜 上,5% 脱脂奶 粉封闭1 h,一抗 4 ℃下孵育过夜。隔天加入辣根过氧化物酶(horseradish peroxidase,HRP)偶联的二抗室温孵育1 h,放入超灵敏多功能成像仪,扫描成像。
1.2.5 CCK-8 实验 将处于对数生长期的MC3T3-E1 细胞用胰蛋白酶消化后制备成细胞悬液,以2 000 个/孔接种至96 孔板中,每组设5 个复孔。培养1~6 d,每孔加入100 μL 含10% CCK-8 溶液的完全培养液孵育2 h,再用酶标仪测定450 nm 波长处下每孔的吸光度值。
1.2.6 EdU 实验 将MC3T3-E1 细胞以3 000 个/孔接种于96 孔板中,至次日细胞贴壁后,加入EdU培养液继续孵育5 h。标记完成后用PBS 洗脱多余的EdU,4%多聚甲醛室温固定30 min,用2 mg/mL甘氨酸与PBS 各清洗1 遍。加入渗透剂(含0.5%TritonX-100 的PBS)室温通 透10 min,PBS 清 洗后每孔加入100 μL Apollo 反应液,室温避光孵育30 min。渗透剂再次清洗2~3 次,使用Hoechst 溶液对DNA 染色,室温避光孵育10 min,PBS 清洗3 次后在荧光显微镜下观察并采集图像。
1.2.7 细胞划痕实验 将MC3T3-E1细胞以1×105个/孔接种至12 孔板,待细胞生长至100%的汇合状态后,尽量垂直于细胞皿底用无菌枪头划出一条直线,PBS 清洗去除漂浮细胞,加入无血清培养液,置于37 ℃、5%CO2培养箱中培养24 h,分别拍摄记录0、12、24 h 时的细胞迁移情况。
1.2.8 Transwell 实验 用无血清培养液重悬MC3T3-E1 细胞并调整细胞密度为5×105个/mL,取100 μL细胞悬液接种于Transwell 小室上室,下室加入600 μL 含20%胎牛血清的α-MEM 培养液,置于37 ℃、5%CO2培养箱培养24 h 后取出,再使用4%多聚甲醛固定15 min 后,用PBS 清洗,结晶紫溶液染色10 min,用棉签擦去上室未迁移细胞,PBS 清洗后在显微镜下观察拍照。
1.2.9 碱性磷酸酶(ALP)染色 收集成骨诱导7 d后的细胞,用4%多聚甲醛固定15 min,PBS 清洗,ALP 染色液孵育3 h,PBS 清洗后拍照。
1.3 统计学分析
使用SPSS 20.0 软件进行统计学分析,数据以均数±标准差()表示,组间差异采用单因素方差分析进行比较,P<0.05 表示差异有统计学意义。统计绘图使用Graphpad Prism 8 软件(Graphpad公司,美国)。
2 结果
2.1 Lmo7 基因在成骨诱导过程中表达上调
对MC3T3-E1 细胞成骨诱导0、3、7、14 d 后,收集细胞样品提取总RNA和蛋白,RT-qPCR和Western blotting 结果显示,与未进行成骨诱导的对照组相比,Lmo7 的表达水平在14 d 内持续上调(图1)。

图1 RT-qPCR 和Western blotting 检测Lmo7 在成骨诱导过程中的表达Figure 1 RT-qPCR and Western blotting detection of Lmo7 expression during osteogenic induction
2.2 构建稳定干扰Lmo7 的MC3T3-E1 细胞株
通过慢病毒转染,嘌呤霉素筛选后获得稳定干扰Lmo7 的MC3T3-E1 细胞株及对照组MC3T3-E1细胞株,进行传代培养,荧光显微镜下观察到mCherry 红色荧光标记。收集细胞样品,对转染后细胞中Lmo7 的mRNA 及蛋白表达水平进行检测,RT-qPCR 及Western blotting 结果显示(图2A、B),与对照组相比,干扰组Lmo7 mRNA 的相对表达敲低约80%(P<0.01),蛋白水平的表达也显著下调,荧光显微镜下观察带有红色荧光标记的细胞与明场细胞基本重合,证明2 组稳转株构建成功(图2C)。
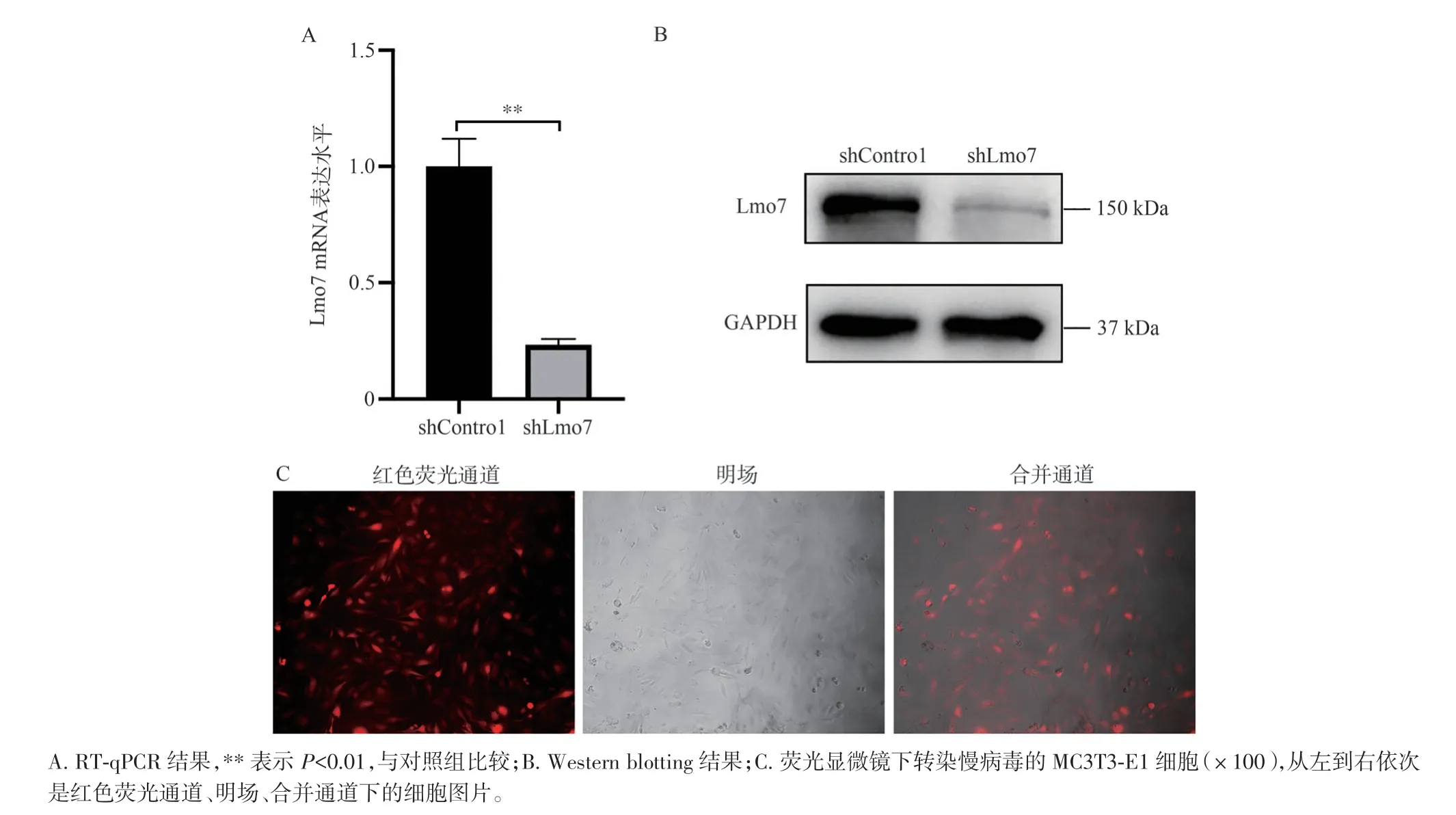
图2 慢病毒转染MC3T3-E1 细胞后Lmo7 的表达Figure 2 Expression of Lmo7 after lentivirus transfection to MC3T3-E1 cells
2.3 干扰Lmo7 对MC3T3-E1 细胞增殖能力的影响
如图3 所示,第2 天时干扰组细胞的吸光度值显著高于对照组,2 组间的差异在第3、4 天时更加明显,并一直维持到第6 天,表明干扰组细胞的增殖活性得到了促进。EdU 实验也验证了这一结论,荧光显微镜下观察到相同的细胞接种数和孵育时间下,干扰组细胞被EdU 标记的数量要多于对照组,计算2 组的阳性率,其差异具有统计学意义(P<0.05)。
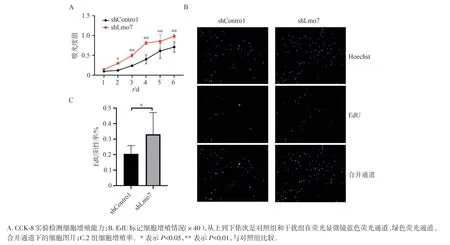
图3 慢病毒转染后MC3T3-E1 细胞的增殖情况Figure 3 Proliferation of MC3T3-E1 cells after lentivirus transfection
2.4 干扰Lmo7 对MC3T3-E1 细胞迁移能力的影响
如图4 所示,划痕实验显示在12、24 h 时,干扰组迁移到划痕区域的细胞明显少于对照组,用Image J 软件(美国国家卫生研究院,美国)测量2 组细胞划痕面积,并统计愈合率,结果显示干扰组的细胞迁移能力较低,且差异具有统计学意义(P<0.01)。进一步通过Transwell 实验验证上述结论,培养24 h 后的结晶紫染色情况可以看出,干扰组迁移到下室的细胞数量更少。
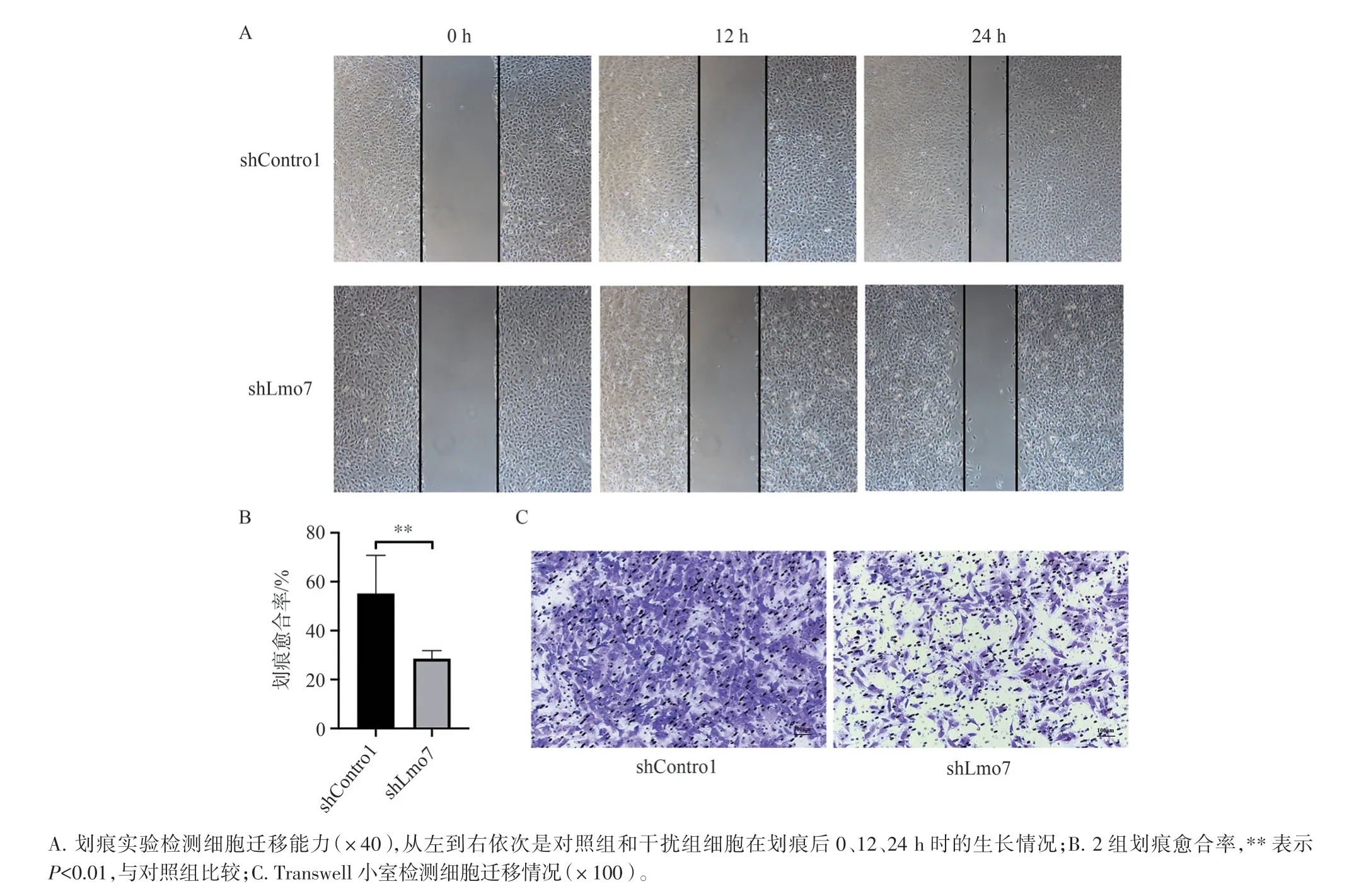
图4 慢病毒转染后MC3T3-E1 细胞的迁移情况Figure 4 Migration of MC3T3-E1 cells after lentivirus transfection
2.5 干扰Lmo7 对MC3T3-E1 细胞成骨分化能力的影响
对慢病毒转染并筛选后的稳转细胞株进行成骨诱导,第7 天时,RT-qPCR 检测了2 组细胞中成骨相关基因Runt 相关转录因子2(Runx2)、Osterix、ALP、骨钙素(OCN)的相对表达水平。结果如图5A—D 所示,干扰组Runx2、Osterix、ALP、OCN 基因的mRNA 相对表达量均低于对照组,差异具有统计学意义(P<0.01)。ALP 染色结果(图5E、F)显示,干扰组着色较浅且着色细胞数量少,光学显微镜下可见干扰组着色细胞数量较少且着色较浅。
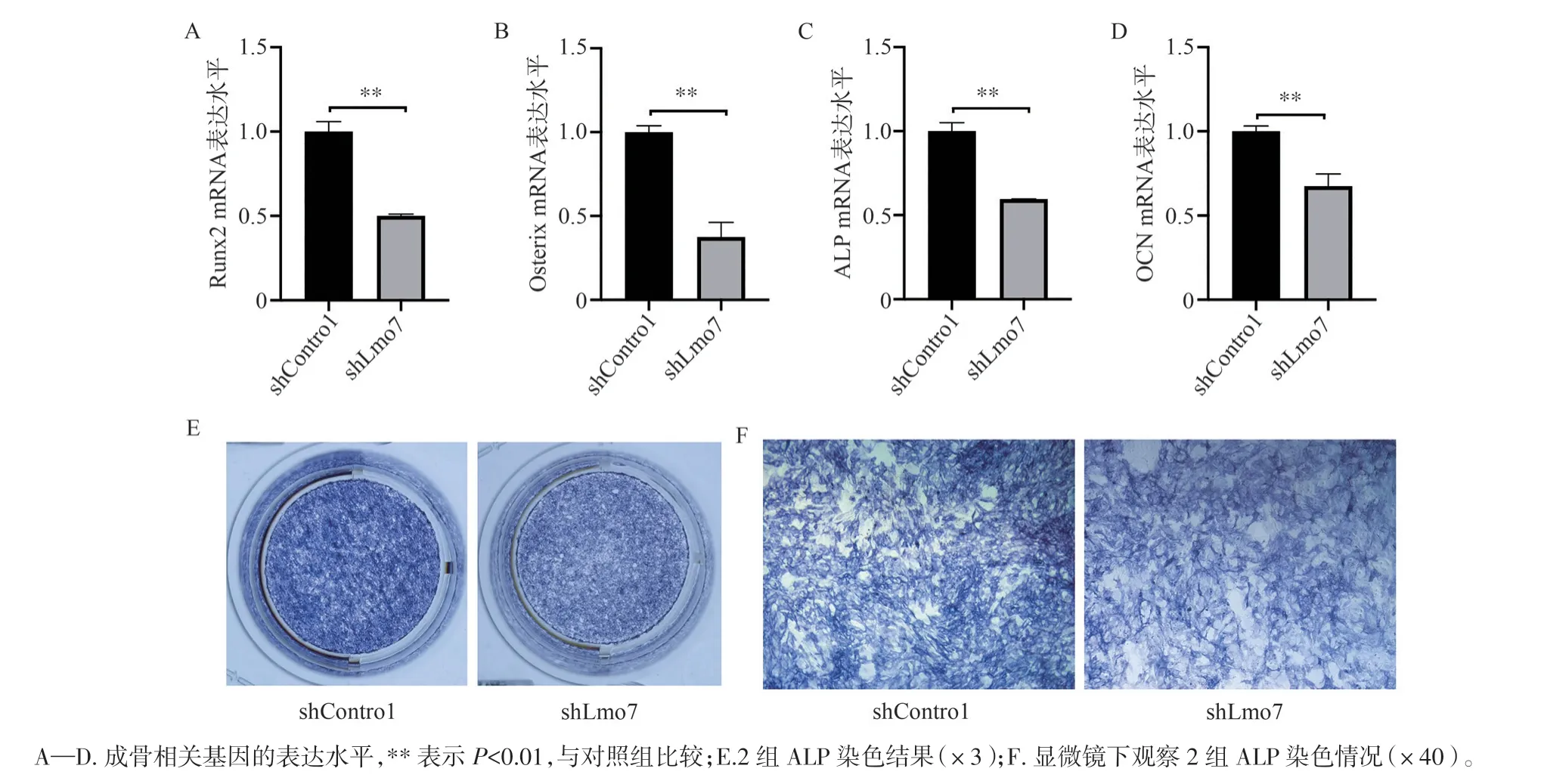
图5 慢病毒转染后MC3T3-E1 细胞的成骨分化情况Figure 5 Osteogensis of MC3T3-E1 cells after lentivirus transfection
3 讨论
Lmo7 隶属于PDZ-LIM 蛋白家族,是一类在进化上具有高度保守性的蛋白,主要包含了钙调蛋白同源性(calmodulin homology,CH)结构域、LIM 结构域和 PDZ 结构域[11-12]。作为常见的蛋白质-蛋白质相互作用结构域,LIM 结构域可以结合高度多样性的蛋白,包括信号分子、细胞骨架及转录因子,能够支持包括肌动蛋白组装、整合素依赖性黏附及信号传递在内的细胞功能,并使该家族有机会参与许多生物学功能,包括在骨形成中的表达。LIM 矿化蛋白1(LIM mineralization protein-1,LMP-1)被认为是骨形成的细胞内调节剂,其关键机制是通过上调骨形态生成蛋白(bone morphogenetic protein,BMP)和稳定BMP/Smad 信号通路来增强成骨作用[13-14]。并且在牙周膜干细胞中,LMP-1 作为TGF-β1 的下游靶基因,是前成骨细胞增殖和分化中的关键早期信号[15]。在动物模型中,LIMK1-/-小鼠表现出与成骨细胞和破骨细胞功能缺陷相关的骨质减少表型[16]。鉴于这些蛋白与Lmo7 同属PDZ-LIM 家族并拥有相同的结构域,我们猜测在其功能上可能具有类似之处。本课题组在前期研究中发现,Lmo7在小鼠上颌窦早期成骨前后有表达差异,但其功能仍需进一步验证。
本实验中,在成骨诱导0、3、7、14 d 的MC3T3-E1 细胞中检测了Lmo7 的表达变化,发现Lmo7 的mRNA 与蛋白表达水平均随着诱导时间的增加而持续上调,提示Lmo7 可能参与体外培养细胞的成骨分化过程。为了进一步研究Lmo7 在成骨细胞分化过程中的具体作用,本实验运用慢病毒介导的基因转导技术检测Lmo7 表达水平变化后对细胞分化及生物学行为的影响。该技术是以人类免疫缺陷Ⅰ型病毒(human immunodeficiency virus type 1,HIV-1)为基础的基因载体,可以将shRNA 整合到细胞的基因组内,实现体内转录siRNA,从而可以长期稳定干扰RNA 表达,获得高质量的稳转株[17]。相较于使用siRNA 转染细胞,慢病毒载体能够整合较长外源性目的基因片段,更适合Lmo7 这样的长片段基因。
成骨是一个复杂且有序的生理过程,从位于骨髓和骨膜中的间充质干细胞局部增殖开始,在每个阶段表达不同的标志基因。其中,前成骨细胞向成骨细胞进一步分化需要表达 Runx2、Osterix,成熟的成骨细胞表达Ⅰ型胶原蛋白(collagenⅠ,ColⅠ)、OCN 及矿化过程中的关键酶ALP[18]。因此,我们选择了Runx2、Osterix、ALP、OCN 这几个成骨相关基因作为观察Lmo7 对细胞成骨分化影响的指标。成骨诱导7 d 时,RT-qPCR 结果显示,小鼠前成骨细胞低表达Lmo7 时,成骨相关基因Runx2、Osterix、ALP、OCN 的mRNA 表达水平明显低于对照组(P<0.01)。与此同时,ALP 染色结果显示,敲低Lmo7 的细胞着色较浅,即Lmo7 的低表达抑制了ALP 活性。Runx2是最重要的成骨主开关,它通过激活骨表型基因来促进多能间充质干细胞向前成骨细胞分化,也是成骨过程中最早发挥功能的转录激活因子[19]。现有文献[20]证实,Runx2 是TGF-β1 和BMP-2 的共同靶点,TGF-β1 可以通过Smad 非依赖途径MAPK 通路正向调控Runx2 的表达和功能,以促进间充质干细胞的分化。通过Xie 等[8]的研究可知,Lmo7 是TGF-β1 的下游靶基因,因此我们猜测Lmo7 可能在TGF-β1 调控成骨的过程中发挥了一定的作用。
Lmo7 被证实通过其LIM 结构域与激活蛋白-1(activator protein-1,AP-1)、转录因子亚基 c-FOS 和c-JUN 相互作用,并促进它们的泛素化和降解[8]。其中,c-FOS 和c-JUN 是由原癌基因编码的蛋白,其具有正向调控细胞增殖的作用[21-22]。这可能解释了该研究中,敲低Lmo7 后,细胞增殖能力得到促进的情况。此外,在本实验中,细胞划痕实验与Transwell 实验均显示,敲低Lmo7 后,细胞迁移能力受到抑制,这与现有文献的结论一致。有研究[23-24]发现,Lmo7 能够协同Rho 或直接通过降低G-肌动蛋白/F-肌动蛋白比率来调节肌动蛋白动力学,在胰腺癌、乳腺癌细胞中,Lmo7 的敲低均减弱了细胞的迁移能力。
综上所述,本实验探讨了Lmo7 对MC3T3-E1细胞增殖、迁移及成骨分化的影响,初步证明体外敲低Lmo7 能正向调控细胞的增殖活性,同时抑制细胞的迁移和成骨分化的能力。本实验为研究Lmo7 在成骨领域的作用提供了新的见解,其机制有待进一步探讨。
