变应性鼻炎患者TNF-α、Tim-1及TLR4变化与病情程度的相关性研究
2024-01-11李增沛李靖
李增沛,李靖
(1.南阳市第一人民医院 耳鼻咽喉科,河南 南阳 473000;2.河南省人民医院 耳鼻咽喉科,河南 郑州 450000)
变应性鼻炎(allergic rhinitis,AR)作为临床常见慢性变态反应性疾病,是易感机体接触致敏变应原后出现的变应原感应性增高的应激反应,以鼻黏膜变态反应性疾病为主要表现[1]。研究显示,随社会生活方式改变及环境污染加重,AR临床发病率呈现上升趋势,且多数患者出现鼻塞、头晕、头疼等临床症状,此外其反复发作或迁延致使病情难以痊愈,影响其身心健康及生活质量[2-3]。目前学界主要根据病情变化评估AR病情程度,发病初期缺乏客观的识别生物指标。因此,发病初期寻求有效的生物标志物评估AR病情程度,对患者综合治疗及对预后改善尤为重要[4]。有研究显示,AR或与炎症因子及免疫因子活化等多种细胞因子共同释放与刺激相关[5]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可通过作用于粒细胞和淋巴细胞等免疫细胞对机体免疫产生调节作用,在炎症反应的发生发展过程中发挥重要作用,并对呼吸系统疾病产生一定促进作用[6]。T细胞免疫球蛋白域黏蛋白域蛋白-1(T cell, immunoglobulin domain and mucin domain protein-1,Tim-1)作为AR、哮喘等特应性疾病易感因子,可表达于分化后的Th2细胞上,激活Th2型免疫应答,据此推测Tim-1在AR发病机理中的可能作用[7]。Toll样受体4(toll-like receptor 4,TLR4)作为机体内重要的信号转导通路因子,参与影响细胞的炎性反应、氧化应激等病理生理过程[8]。目前临床中有关TNF-α、Tim-1、TLR4在AR中的作用机制研究较少,为明确血清TNF-α、Tim-1、TLR4在AR中的变化及与病情程度的相关性,本研究随机选取77例AR患者进行研究。现报道如下。
1 对象与方法
1.1 研究对象
随机选取南阳市第一人民医院2021年10月—2022年10月接收的77例AR患者为研究组,其中男36例,女41例;平均年龄(44.00±22.10)岁。按照《变应性鼻炎及其对哮喘的影响》[9]中相关标准,分为轻度15例,中度28例,重度34例。同期选取100例健康者为对照组,其中男54例,女46例;年龄20~67岁,平均年龄(43.50±19.98)岁。两组临床资料相比,差异无统计学意义(P>0.05)。研究严格遵循伦理原则,并经我院伦理会批准。纳入标准:符合《变应性鼻炎诊断和治疗指南》[10]中相关标准;存在鼻塞、流涕、咳嗽及伴嗅觉消失等症状;经血清IgE检查确诊;经变应原检测对尘螨过敏;鼻分泌物镜检结果显示嗜酸性粒细胞占比>5%;对照组无过敏史及哮喘病史;签署知情同意书。
排除标准:肝肾功能障碍;患局部或全身感染性疾病;伴血液系统、自身免疫性疾病;伴鼻息肉、鼻中隔严重偏曲或其他过敏性疾病;患其他鼻咽部疾病;恶性肿瘤;妊娠或哺乳期女性;短期内接受激素药物治疗;存在鼻部手术史;过敏体质者。
1.2 指标观察
1.2.1 生化指标 于入组次日采集两组受检者空腹外周静脉血5 mL,常温静置,高速离心,静置,分离上清,-20 ℃冰箱保存待检。血清TNF-α、Tim-1、TLR4水平检测均采用双抗体夹心酶联免疫吸附法,分别采用TNF-α检测试剂盒(上海乔羽生物科技有限公司)、Tim-1检测试剂盒(北京奥维亚生物技术有限公司)、TLR4检测试剂盒(杭州联科生物科技有限公司)进行。设酶标板为空白孔、标准孔、待测样品孔,各加入50 μL稀释液及样品稀释液、标准品、待测样品,混匀,覆膜,孵育2 h。弃孔内液体,甩干,清洗反应板。加入100 μL TNF-α、Tim-1、TLR4检测液,覆膜,孵育1 h,弃孔内液体,甩干、洗涤反应板,加入100 μL底物溶液,遮光显色0.5 h,加入终止液,轻弹酶标板终止反应。酶标仪(型号iMark,Bio-RAD公司)450 nm处测定吸光值,由高资历检验医生严格遵循试剂说明书进行。
1.2.2 指标评估 采用AR评分量表(score for allergic rhinitis,SFAR)从鼻痒、鼻塞、喷嚏、流涕4方面评估患者病情严重程度,每项0~3分,总分为4项之和,SFAR分值与病情程度呈正比。
1.3 统计学处理
使用SPSS 20.0软件分析。应用Kolmogorov-Smirnov检验数据是否符合正态分布,符合正态分布的计量资料采用 描述,两组间比较采用独立样本t检验,多组间行F值数据计算,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组TNF-α、Tim-1、TLR4水平比较
如表1所示,研究组血清TNF-α、Tim-1、TLR4水平高于对照组,组间差异具有统计学意义(P<0.05)。

表1 两组TNF-α、Tim-1、TLR4水平比较
2.2 不同病情程度TNF-α、Tim-1、TLR4水平及SFAR评分比较
如表2所示,不同病情程度AR患者血清TNF-α、Tim-1、TLR4水平及SFAR评分整体比较,差异具有统计学意义(P<0.05)。重度患者血清TNF-α、Tim-1、TLR4水平及SFAR评分显著高于轻度、中度,组间差异具有统计学意义(P<0.05)。

表2 不同病情程度TNF-α、Tim-1、TLR4水平及SFAR评分比较
2.3 TNF-α、Tim-1、TLR4与SFAR评分的关系
如表3、图1所示,以TNF-α、Tim-1、TLR4进行相关性研究,结果显示TNF-α、Tim-1、TLR4与SFAR评分呈正相关。

图1 TNF-α、Tim-1、TLR4与SFAR评分的关系

表3 TNF-α、Tim-1、TLR4与SFAR评分的关系
2.4 AR患者疾病严重程度多因素Logistic回归分析
如表4所示,以SFAR评分为因变量,将TNF-α、Tim-1、TLR4作为自变量,赋值升高设为1,正常设为0,纳入二分类多因素Logistic回归模型分析,结果显示,TNF-α、Tim-1、TLR4是影响AR病情程度的危险因素(P<0.05)。
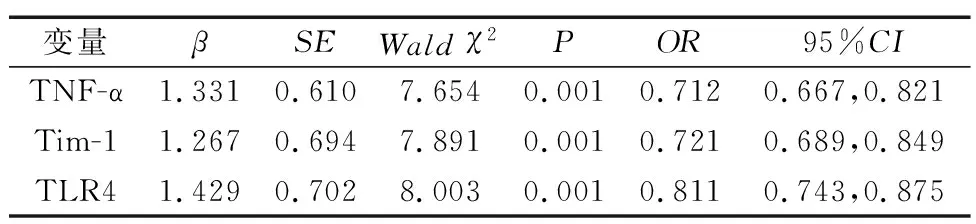
表4 AR患者疾病严重程度多因素Logistic回归分析
3 讨论
AR作为耳鼻咽喉科常见过敏性病变,受遗传因素及环境因素影响,随工业化程度发展,其发病率呈逐年递增趋势。AR发病后主要表现为鼻塞、鼻痒、流涕等;此外还可致鼻窦炎、气管炎、咽炎、哮喘等耳鼻咽喉科疾病,且病情受变应原刺激可反复发作,病情迁延,患者身心健康及生活质量受到严重影响,是临床研究的重点及热点问题,因此寻找AR早期识别指标及影响因素,对改善患者症状及预后尤为重要[11-12]。
学界认为AR发病机制复杂,有研究显示,AR的发生发展过程与患者体内多种血液指标异常波动相关,其中炎性介质及免疫调节因子指标异常在其中发挥关键作用[13]。TNF-α作为巨噬细胞分泌生成的系统性炎症细胞因子,与B淋巴细胞增殖和成熟关系密切,TNF-α通过作用于B淋巴细胞上相关受体激活、促进B淋巴细胞增殖分化,产生大量具有抗体分泌功能的效应性B淋巴细胞,参与炎症反应及体液免疫过程[14-15]。研究显示,TNF-α还可增加肥大细胞和嗜酸性粒细胞释放,对AR发病及炎性介质释放具有促进作用[16]。本文研究结果显示,TNF-α在AR患者血清中呈现异常波动,且其水平变化与AR病情程度变化相关,并随疾病加重而升高,表明监测AR患者TNF-α变化可对疾病进展作出判断。分析其原因或与变应原作用致使患者机体TNF-α水平升高,其通过作用于B淋巴细胞激活信号通路,活化B淋巴细胞,致使大量变应原特异性IgE抗体产生,导致鼻黏膜组织遭受免疫细胞浸润,产生相应AR症状。
Tim-1基因家族主要表达于Th2细胞,可调节Th2细胞因子表达及增强其分化、生成,提示Tim-1可通过刺激Th2细胞参与促炎症反应,介导变态反应性疾病的发病过程[17]。研究显示,Th1/Th2免疫反应失衡是导致AR的免疫学基础;同时研究显示,AR患儿血清Tim-1呈异常波动,并显著高于健康儿童,推测Tim-1在AR发病机制中的可能作用[18]。通过对比两组研究结果,Tim-1在AR血清中呈异常高表达,且其水平变化随疾病发展而升高,并与SFAR评分呈正相关性。
TLRs通过结合相应病原相关分子模式,激活信号传导途径,诱导免疫效应分子表达[19]。研究显示,抗体相关信号通路激活致组胺、炎症因子及免疫活性因子等多因子递质传递,加重呼吸道黏膜分泌,抑制TLR4信号通路对机体炎症蔓延抑制,减轻炎性递质产生,降低黏膜损害等具有积极作用,由此认为TLR4是免疫反应中固有的关键组分[20-21]。通过对比两组研究结果,AR患者血清中TLR4呈现异常波动,且其水平变化与AR病情程度变化相关,并随疾病加重而升高,表明监测AR患者TLR4变化可对疾病进展作出判断。本研究通过多因素Logistic回归模型分析显示TNF-α、Tim-1、TLR4是影响AR病情的独立危险因素,临床可通过测定上述指标水平为AR病情程度评估提供信息支持。
综上所述,随病情严重程度发展AR患者机体内血清TNF-α、Tim-1、TLR4水平升高,血清TNF-α、Tim-1、TLR4变化与SFAR评分呈正相关性,同时TNF-α、Tim-1、TLR4水平是影响AR严重程度的影响因素,为临床判断AR病情程度提供信息支持,利于基层医院推广。故TNF-α、Tim-1、TLR4在AR病情程度判断中具有潜在广阔的应用前景,有望发展为AR病情判断的重要辅助指标,为临床治疗方案确定提供更为准确的量化参考。
