两种方法检测先天性心脏发育异常胎儿的染色体结果分析
2024-01-10赵丹阳杨微微王文靖鞠明艳任晨春
赵丹阳,杨微微,王文靖,鞠明艳,任晨春
(1.天津医科大学研究生院,天津 300070;2.天津市中心妇产科医院检验科,天津 300199)
先天性心脏发育异常(CHD)是最常见的人类先天性畸形之一[1],是新生儿发病和死亡的主要原因。随着超声诊断技术和外科技术的提高,越来越多的胎儿期CHD 得到早期诊断和治疗,如何尽早确定胎儿CHD 的病因,进行个性化处理是产前诊断面临的主要问题。虽然CHD 的病因存在异质性,但仍有大约20%的CHD 可以归因于染色体异常、单基因缺陷或环境因素[2]。本研究探讨拷贝数变异测序(copy number variation sequencing,CNV-seq)技术联合核型分析技术在产前诊断胎儿期CHD 染色体异常的应用价值,为临床决策提供技术支持。
1 对象与方法
1.1 研究对象 收集2019 年2 月至2022 年8 月在超声科诊断为胎儿CHD 的单胎孕妇60 例,孕妇年龄18~45 岁,平均年龄(30.58±4.97)岁,孕周18~24 周,平均孕周为(21.70±2.25)周。所有孕妇均接受羊膜腔穿刺,对胎儿进行核型分析,同时行CNV-seq检测。纳入标准:(1)超声科由一名具有副高及以上职称的专业医师进行超声心动检查,检测房室与大血管的关系,提示胎儿存在心脏及大血管结构异常。(2)夫妻双方均在医院产前诊断门诊进行遗传咨询,了解有创产前诊断的风险并签署知情同意书。(3)术前进行血常规、血生化、血凝及传染病病原体筛查,无穿刺禁忌证。此项目经院级专家伦理委员会审批通过,伦理编号为2020KY080。
1.2 研究方法
1.2.1 羊膜腔穿刺术 严格遵循无菌操作,在超声引导下行羊膜腔穿刺术,分别抽取2 管10 mL 羊水和1 管3 mL 羊水。
1.2.2 胎儿羊水细胞培养及核型分析 将获得的2 管10 mL 羊水,1 500×g离心10 min 后分离羊水细胞,留取1 mL 沉淀混匀后分别接种于两瓶含3 mL 培养基的培养瓶中,7~9 d 后换液,继续培养48 h,加入0.3 mL 秋水仙素(20 μg/mL),培养2 h 后采用胰酶消化法收获,进行G 显带染色,必要时进行C 显带或者N 显带,按照ISCN2020 版标准,计数30个,分析5 个分散好、中等长度的中期分裂相。
1.2.3 胎儿羊水细胞CNV-seq 检测 将抽取的1管3 mL 羊水,使用北京贝瑞和康公司提供的科安试剂盒,按照标准流程进行操作:DNA 提取→酶反应→纯化→文库纯化→文库质控→测序→生物信息分析。结果判读参照人类基因组hg19 版本和DGV、DECI-PHER、OMIM、UCSCS 及PubMed 等数据库,判定为良性CNVs、可疑良性CNVs、临床意义不明确的CNVs(VOUS)、可疑致病性CNVs 和致病性CNVs。对检测到亚显微结构异常的致病性CNVs和可疑致病的CNVs,建议胎儿父母行CNV-seq 检测,以明确变异的遗传性质及相关临床意义。
1.3 统计学处理 对于临床数据采用SPSS 25 软件分析,组间比较采用χ2检验,P<0.05 差异具有统计学意义。
2 结果
2.1 胎儿超声检测结果 60 例CHD 胎儿中,23 例是独立性CHD,其中10 例为室间隔缺损;37 例不仅有CHD,还伴有心外结构/软指标异常,其中合并脑部异常10 例,泌尿系统异常3 例,消化系统异常2 例,其他畸形包括合并唇腭裂、长骨短小、多指/趾或并指/趾共16 例,单脐动脉6 例(表1)。

表1 60 例CHD 胎儿超声结果分类表Tab.1 Ultrasound results of 60 fetuses with CHD
2.2 两种方法检测CHD 胎儿染色体结果分析 60例CHD 胎儿均行核型分析和CNV-seq 检测,发现染色体异常20 例,染色体异常检出率33.3%。其中核型分析与CNV-seq 结果一致检出11 例,包括9 例数目异常和1 例衍生染色体及1 例嵌合体;两种方法检出不一致9 例,其中核型分析检出2 例平衡性结构异常,CNV-seq 未能检出;7 例CNV-seq 检出为微缺失/微重复综合征,核型分析未见明显异常(表2)。
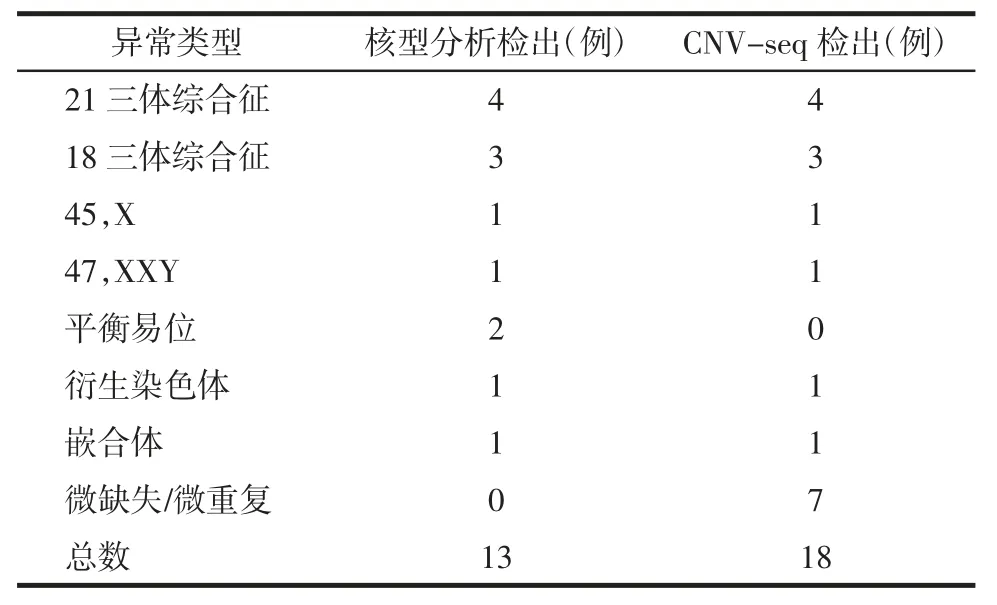
表2 两种方法检测染色体异常CHD 胎儿结果分析Tab.2 Analysis of the results of chromosome abnormality of fetus with CHD by two methods
核型分析检出染色体异常例数为13 例,其中数目异常9 例,包括4 例47,XX/XY,+21,3 例47,XX/XY,+18,1 例45,X,1 例47,XXY;结构异常4例,包括罗氏易位45,XY,der(14;21)(q10;q10)1例,平衡易位46,XY,t(8;15)(p10;q10)1 例,衍生染色体1 例,核型为46,XY,der(18)dup(18)(q11.2-q23),嵌合体1 例,47,XY,+mar[16]/46,XY[19]。
CNV-seq 检测异常CNVs 例数为18 例,其中数目异常9 例,同核型结果一致。存在微缺失/微重复异常9 例,1 例核型结果为衍生染色体的患者CNV-seq 检测结果为dup(18)(q11.2q23)6.7 Mb;1例核型分析为47,XY,+mar[16]/46,XY[19]嵌合体,经CNV-seq 证实为dup(22)(q11.1q11.21)1.7 Mb,确定了核型分析中marker 来源于22 号染色体;7例核型分析结果正常的患者CNV-seq 表现为微缺失/微重复,分别为dup(18)(q23)1Mb,dup(1)(p36.13)1.1 Mb,dup(22)(q11.21)2.55 Mb,4 例为del(22)(q11.21)2.65-2.7 Mb。所有CNVs 结果通过检索UCSC、DECIPHER、OMIM、Clin Var、DGV、PUB -MED数据库,发现致病性CNVs 6 例,可疑致病性CNVs 3 例(表3)。

表3 7 例CNV-seq 微缺失/微重复患者临床表现Tab.3 Clinical manifestations of CNV-seq microdeletion/microduplication in 7 patients
2.3 不同类型CHD 胎儿的染色体异常结果分析伴心外结构/软指标异常CHD 组染色体异常率高于独立性CHD 组,但两组间比较差异无统计学意义[37.8%(14/37)vs.26.1%(6/23),χ2=1.76,P>0.05],见表4。

表4 两组CHD 胎儿染色体异常检出率比较Tab.4 Comparison of detection rates of fetal chromosomal abnormalities in CHD between the two groups
23 例独立性CHD 中6 例有染色体异常:4 例表型为室间隔缺损,染色体结果分别为2 例21 三体,1 例罗氏易位,1 例平衡易位;1 例左心发育不良,染色体结果为1p36.13 存在1.1 Mb 重复;1 例三尖瓣狭窄、肺动脉瓣闭锁,染色体结果为18q23 存在1 Mb 重复。
37 例CHD 合并心外结构/软指标异常中14 例有染色体异常:染色体数目异常占7 例,染色体结果分别为18 三体3 例,21 三体2 例,45,X 和47,XXY 各1 例,这7 例中5 例表现为神经系统异常(脉络丛囊肿或脑积水),2 例为消化系统畸形。染色体结构异常7 例,1 例核型46,XY,der(18)dup(18)(q11.2q23),胎儿表型为复杂性先心病,同时合并肾囊肿;1 例核型47,XY,+mar[16]/46,XY[19],CNVseq 证实为dup(22)(q11.1q11.21)1.7 Mb,结合核型分析结果,考虑marker 为2 倍的22q11.1q11.21 结合后形成的新的染色体片段,表型为室间隔缺损伴消化系统畸形;其余5 例中4 例为22q11.2 微缺失综合征,心脏畸形均为圆锥动脉干异常,心外异常表现为脉络丛囊肿/脑积水、唇腭裂、长骨短小、单脐动脉,1 例为22q11.2 微重复综合征,重复片段大小为2.55 Mb,CHD 类型为三尖瓣狭窄,心外异常为脉络丛囊肿。
3 讨论
CHD 胎儿染色体异常率在10%~30%[3-4]。本研究中胎儿CHD 染色体异常率为33.3%(20/60)。染色体异常包括数目异常和结构异常。其中21 三体、18 三体和13 三体是造成CHD 的染色体数目异常最常见病因,其他常见病因还包括染色体微缺失/微重复综合征等[5-6]。
本研究CHD 胎儿检出染色体异常共20 例,其中核型分析与CNV-seq 结果一致检出11 例,包括9 例数目异常、1 例衍生染色体及1 例嵌合体;两种方法检出不一致9 例,其中核型分析独立检出2 例平衡性结构异常,CNV-seq 独立检出7 例微缺失/微重复综合征。两种方法检出率不一致与其方法局限性有关。在胎儿染色体检测方面,核型分析是检测的“金标准”,对染色体数目异常和大片段结构缺失或重复有较高的诊断率,特别是可以检出易位、倒位、插入等平衡性结构异常,相对于分子诊断具有绝对性优势[7]。但是核型分析也存在很多短板,比如检测周期长,无法检测5~10 Mb 以下微缺失/微重复,存在羊水培养失败可能,受到从业人员经验水平限制,存在一定的误差。而CNV-seq 作为第二代低深度高通量测序技术检测样本范围广,无需培养,可发现小片段微缺失/微重复,2 周左右即可出具报告,节约时间成本。所以CNV-seq 技术是核型分析的有效补充,提高染色体异常的检出率。
本研究60 例CHD 胎儿中,分为伴心外结构/软指标异常CHD 组和独立性CHD 组,染色体异常率在两组间差异没有统计学意义,可能与本研究选取样本量过小相关。23 例独立性CHD 中染色体异常6 例,2 例为21 三体,1 例为罗氏易位,1 例平衡易位,另外2 例微重复综合征,通过CNV-seq 检测得出。37 例CHD 合并心外结构/软指标中14 例有染色体异常,核型检出率为64.3%(9/14),明显低于CNV-seq 检出的检出率100%(14/14)。其中值得注意的是,1 例核型结果为18 号染色体的衍生染色体,核型为46,XY,der(18),通过CNV-seq 检测确定是18 号染色体的重复,重复片段为q11.2q23。1 例核型分析存在低比例嵌合,并发现标记染色体,核型47,XY,+mar[16]/46,XY[19],CNV-seq 结果为22q11.1q11.21 长度为1.7 Mb 的微重复,通过核型嵌合比例结合CNV-seq 结果,可推测该患儿marker染色体为2 倍的22q11.1q11.21 片段重合组成,该片段包含TUBA8、PEX26、USP18 等16 个蛋白编码基因或基因片段,其中6 个OMIM morbid 基因,该重复片段与猫眼综合征有关,该综合征临床表型多种多样,如双眼虹膜下方垂直性缺损、白内障、脉络膜缺损、视网膜发育不全、类似猫眼、双眼距离增宽、睑裂小而斜、小眼球、斜视、轻度智力低下、心脏缺陷、肛门闭锁等,确定为致病性CNVs。虽然核型分析较CNV-seq 在大片段结构变异中更为直观,但CNV-seq 较核型分析断裂位点定位更为精确,两者在胎儿CHD 患者病因诊断中相互结合,能够有效提高CHD 的确诊率,明确染色体异常类型和断裂位点,为临床做出进一步诊疗提供依据。
本研究有4 例CHD 胎儿存在22q11.2 微缺失,22q11.2 微缺失综合征被认为是与CHD 最相关的微缺失/微重复综合征。它的表型变异谱比较宽,携带相同异常片段的个体表型不尽相同,可以从正常到生长发育迟缓、智力障碍、自闭症、先天性心脏病、唇腭裂、小头畸形、肌张力减弱等,片段缺失大小与表型之间不存在正相关,其外显率约21.9%[8-11]。Thomas 等[12]报道,22q11.2 微缺失综合征在胎儿CHD核型结果正常者中占6.4%。王瑾等[13]报道64%的22q11.2 微缺失综合征患者有CHD 表型,以圆锥动脉干畸形最为多见。这4 例CHD 胎儿心脏表型主要为永存动脉干、房室间隔缺损、肺动脉瓣狭窄、法洛氏四联症,心外表现为唇腭裂、单脐动脉、脉络丛囊肿和胎儿发育迟缓。它们父母表型正常,经CNV-seq 检测均为正常,证实胎儿为新发突变。除微缺失综合征以外,本研究经CNV-seq 检测发现1例22q11.2 微重复综合征,表型为三尖瓣狭窄,伴有心外异常(脉络丛囊肿)。由此可见22q11.2 微缺失/微重复是胎儿CHD 的另一主要病因。
综上所述,两种方法在检测CHD 胎儿染色体异常中各有利弊,联合应用可提高染色体异常检出率,从而明确胎儿CHD 的病因,为后续的遗传咨询提供可靠的病因学依据,指导患儿家庭做出最优选择。
