静磁场通过促进骨重建和血管生成治疗股骨头坏死
2024-01-10王芮琦张云龙方彦雯李心乐卫敏廖钟财张平
王芮琦,张云龙,方彦雯,李心乐,4,卫敏,廖钟财,张平,4,5
(1.天津医科大学基础医学院人体解剖与组织胚胎学系,天津 300070;2.天津医科大学口腔医院口腔综合科,天津 300070;3.和也健康科技有限公司,安吉 313399;4.国家卫生健康委员会激素与发育重点实验室,天津市代谢性疾病重点实验室,朱宪彝纪念医院,天津医科大学,天津 300134;5.天津市脊柱脊髓重点实验室,天津 300052)
股骨头坏死(ON)是指由于股骨头发生缺血、缺氧而引起骨细胞及骨髓坏死,导致股骨头结构改变,最终使股骨头塌陷的一种慢性疾病,是骨科领域一种常见的难治性疾病[1]。缺血性股骨头坏死多发生于青壮年,致残率高,是目前国内外研究的重点、难点[2]。研究表明,在股骨头坏死发生时,由于组织内部缺血、缺氧,可能有利于成骨细胞和破骨细胞的活性变化,导致正常骨代谢进程被破坏,进而导致股骨头坏死[3]。因此,调节坏死区成骨细胞和破骨细胞的活性,可能是延缓股骨头坏死疾病进展的有效方法之一。
静磁场也称稳态磁场或稳恒磁场,是具有恒定磁感应强度和方向的磁场[4]。根据磁场强度,静磁场可分为亚磁场(<5 μT)、弱磁场(5 μT~1 mT)、中强磁场(1 mT~1 T)和强磁场(>1 T)[5]。前期研究表明,中等强度静磁场可用于临床实践,是直接治疗损伤部位、疼痛、炎症以及各种类型疾病的无创、安全、简单的方法[6]。目前静磁场已经广泛应用于骨生物学研究,可以预防和治疗骨质疏松症、修复骨缺损、促进骨折愈合并减轻症状[7]。然而,静磁场作为一种穿透性强且能量损耗低的物理治疗方式,能否延缓股骨头坏死的病理进程尚不清楚。本实验采用将大鼠股骨头圆韧带切断、缝线结扎股骨颈远端,模拟股骨头血供受损的股骨头坏死模型,评估静磁场对股骨头坏死骨重建与血管生成的影响,为物理治疗股骨头坏死提供新的见解。
1 材料与方法
1.1 材料
1.1.1 实验材料 45 只约12 周龄的SPF 级雄性Sprague-Dawley(SD)大鼠,体重230~250 g,由中国人民解放军军事医学科学院实验动物中心提供[生产许可证号:SCXK(京)2022-0002,动物批号:NO.111251221100144445]。每笼饲养5 只大鼠,饲养室光照-黑暗周期为12 h,温度控制在25℃下,允许其自由摄取饲料和水。所有实验根据天津医科大学实验动物管理规定进行,并经天津医科大学伦理委员会批准[SYXK(津)2019-0004]。
1.1.2 主要仪器和试剂 数字化双能X 线骨密度仪购自美国Norland 公司。石蜡切片机(RM255)购自德国Leica 公司。光学显微镜BX53 购自日本Olympus 公司。HE、MacNeal′s、TRAP 染料、β-actin 一抗均购自美国Sigma 公司。墨汁购自中国北京索莱宝公司。RUNX2、NFATc1 一抗均购自美国Abcam 公司。
1.2 方法
1.2.1 动物分组及造模 45 只大鼠采用随机数字表法分成为对照组(Sham 组,n=15)、股骨头坏死组(ON 组,n=15)、股骨头坏死静磁场治疗组(ONS 组,n=15)。如前所述进行股骨头坏死造模[8-9]。用2%异氟烷麻醉大鼠,侧卧备皮,以股骨大转子为中心取髋部外侧切口,分离皮下组织及肌肉层,打开髋关节囊并显露股骨头,随后将髋关节脱位,切断股骨头圆韧带,使用3.0 缝线结扎股骨颈远端,使股骨头血供受损,造成股骨头缺血性坏死模型,双侧股骨头同时造模(图1)。随后将髋关节复位,分层缝合肌肉组织、皮下组织和表皮。确保术中股骨头完整分离、缝线结扎牢固,及时消毒清理术后手术器械,避免细菌污染。Sham 组在不破坏股骨头解剖结构的前提下,切开后只分离臀大肌后缝合。术后3 d 内,给予大鼠1%的盐酸丙吗卡因和恩诺沙星(5 mg/kg)药膏局部涂抹(1 次/d),分别缓解手术创伤所致疼痛和预防感染。
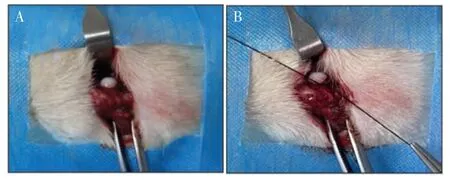
图1 股骨头坏死造模示意图Fig.1 Schematic diagram of femoral head necrosis modeling
1.2.2 静磁场治疗 手术造模后第2 天,ONS 组接受静磁场治疗。在鼠笼底部放置定制的静磁场设备治疗4 周,每天持续24 h(图2)。根据前期实验的结果,选择200 mT 为合适的静磁场强度[10]。放置静磁场后,允许大鼠在笼子中正常活动。Sham 组和ON组仅放置在鼠笼中,没有静磁场干预。
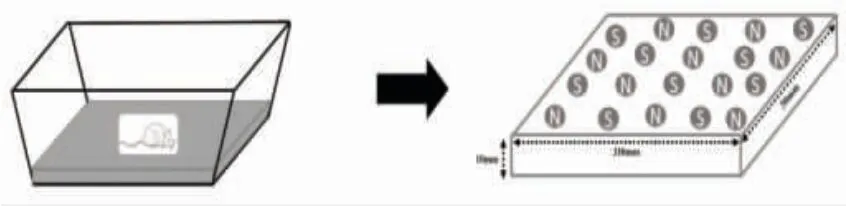
图2 静磁场装置示意图Fig.2 Schematic diagram of static magnetic field device
1.3 骨密度(BMD)检测 在静磁场治疗后,使用2%异氟烷对大鼠进行吸入式麻醉,双能X 线骨密度仪(pDEXA)检测大鼠BMD,定位在大鼠双侧股骨头,指标为BMD 和骨矿含量(BMC)。
1.4 组织学分析
1.4.1 组织处理 30 只大鼠(每组n=10)在造模后第4 周末进行人道主义处死。剥离大鼠后腿,剔除皮肤、软组织及韧带,保留完整股骨头。将股骨头组织置于10%中性福尔马林中固定2 d,14%的EDTA中脱钙5 周。将骨组织标本用石蜡包埋,冠状位切片,厚度为5 μm。
1.4.2 HE、MacNeal′s、TRAP 染色 使用石蜡包埋的大鼠股骨头标本(n=6),组织切片经二甲苯脱蜡、梯度乙醇水化后,进行HE、MacNeal′s、TRAP 染色,脱水透明后树胶封片,显微镜下每张切片随机选取5 个高倍视野,观察组织病理形态学改变。使用Olympus CCD DP73 软件进行骨小梁的面积/总面积、空骨陷凹率等相关数据的测量。
1.4.3 墨汁灌注 首先麻醉动物,将15 只大鼠在实验结束后第4 周末(每组n=5)腹腔注射10%水合氯醛(3 mL/kg)进行麻醉。然后将大鼠四肢固定,用肝素生理盐水灌注心脏(每只大鼠生理盐水用量约为80 mL),直至灌注液可以从右心房造口处流出,保证流出液清亮时停止灌注。抽取墨汁灌注液并进行左心室灌注,保证灌注液能从右心房造口处流出,至大鼠皮肤黏膜全部变黑为止(每只大鼠灌注液用量约为100 mL)。灌注结束后,处死大鼠,将大鼠静置于4℃过夜。保留股骨头组织,脱钙5 周后进行石蜡包埋并切片,切片厚度为25 μm。使用中性树胶封片并在正置显微镜下观察并测量单位面积内的血管面积。
1.5 Western 印迹分析 充分研磨股骨头组织,在RIPA 裂解缓冲液中提取总蛋白。在4℃下离心10 min 去除杂质。采用一抗RUNX2(1∶1 000)、NFATc1(1∶1 000)和β-actin(1∶10 000)在4℃过夜孵育。二抗室温(1∶20 000)孵育90 min 后,经化学发光后用凝胶成像系统检测相关蛋白的表达并通过Image J软件分析各组蛋白条带的灰度值。
1.6 统计学处理 使用IBM SPSS Statistics 26 统计软件进行统计学分析,并采用Graphpad Prism 7 软件进行统计图制作。符合正态分布的计量数据采用表示,多组间比较采用单因素方差分析(oneway ANOVA),组间多重比较行最小显著差法(LSDt检验)。P<0.05 为差异有统计学意义。
2 结果
2.1 静磁场增强股骨头坏死大鼠的BMD 与Sham组相比,ON 组股骨头坏死区域的BMD、BMC 降低(t=22.030、13.088,均P<0.001),而应用静磁场治疗4 周后,与ON 组相比,ONS 组大鼠股骨头坏死区域的BMD、BMC 降低情况得到改善(t=-5.372、-4.584,均P<0.001,图3)。
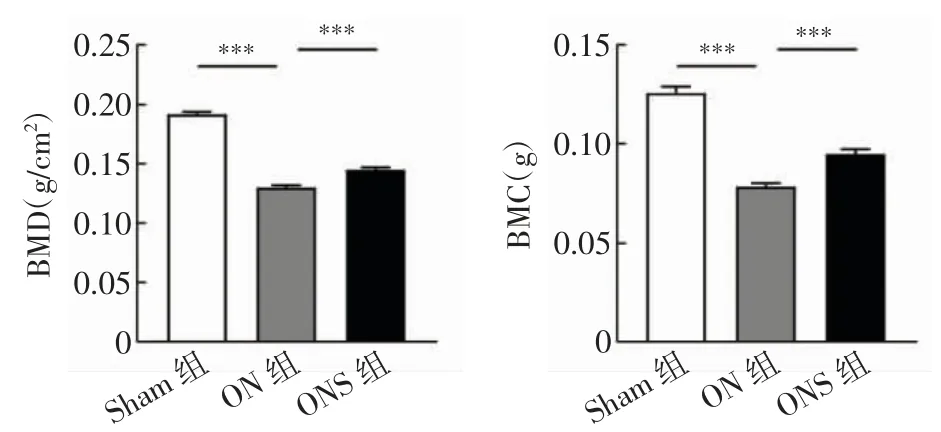
图3 各组大鼠股骨头骨密度的改变Fig.3 Changes in bone density of the femoral head in each group
2.2 静磁场促进股骨头坏死大鼠骨量的增加 在显微镜下,对HE 染色的股骨头石蜡切片照相、分析骨小梁的面积/总面积(%),并观察代表骨坏死形成的空骨陷凹。结果表明,与Sham 组相比,ON 组骨量明显减少(t=1.352,P<0.001);而静磁场治疗后,与ON 组相比,ONS 组骨量显著增加(t=-4.038,P<0.001)。高倍镜视野显示:与Sham 组相比,ON 组视野内可见大量空骨陷凹(t=-6.662,P<0.001);而经过静磁场治疗后,ONS 组比ON 组空骨陷凹数明显减少(t=2.056,P<0.05,图4)。
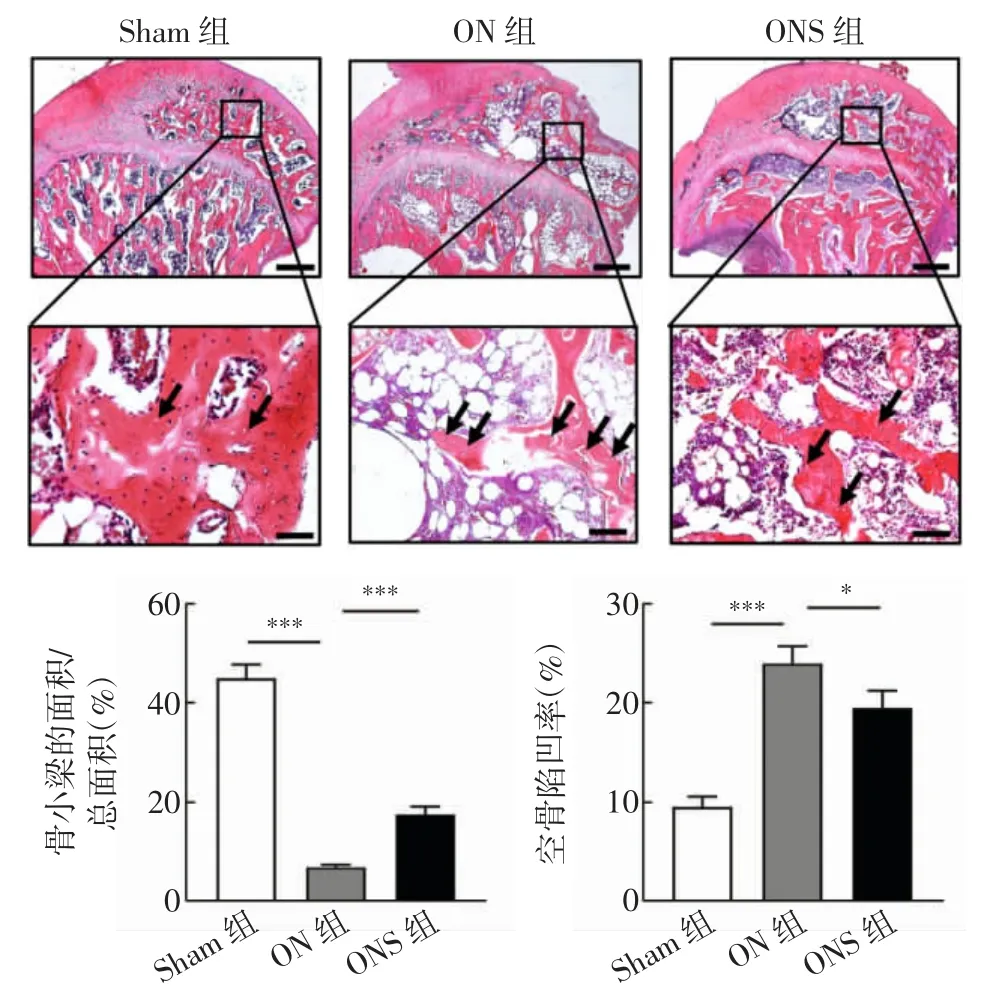
图4 股骨头HE 染色形态学检查(40×,200×)Fig.4 Morphological examination of the femoral head by HE staining(40×,200×)
2.3 静磁场促进股骨头坏死大鼠的骨形成 Mac-Neal′s 染色结果显示,与Sham 组相比,ON 组股骨头的成骨细胞数/骨表面明显减少(t=18.762,P<0.001),但静磁场治疗后,与ON 组相比,ONS 组成骨细胞数/骨表面显著增加(t=-8.227,P<0.001,图5)。与Sham 组相比,ON 组RUNX2 蛋白的表达水平明显降低,而经静磁场治疗后,ONS 组比ON 组RUNX2 蛋白的表达水平明显提高(t=12.080、-5.850,均P<0.05,图6)。
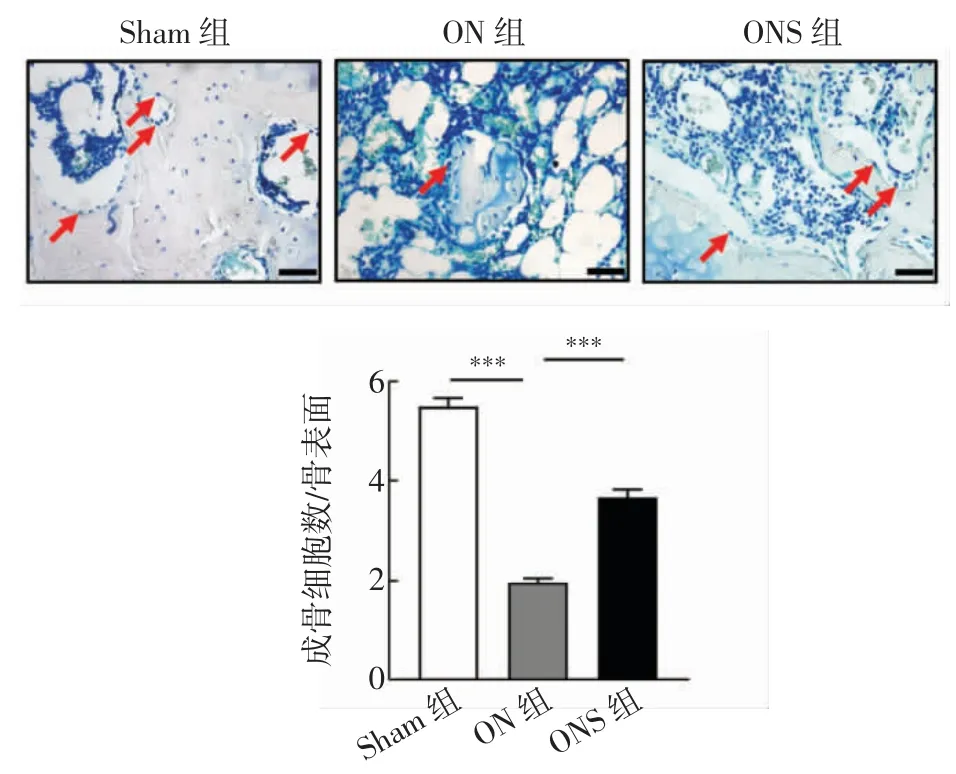
图5 股骨头MacNeal′s 染色(400×)Fig.5 MacNeal′s staining of the femoral head(400×)
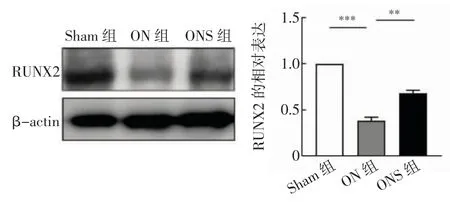
图6 Western 印迹检测各组RUNX2 表达Fig.6 Western blotting was used to detect the expression of RUNX2 in each group
MacNeal′s 染色结果显示,与Sham 组相比,ON组股骨头的成骨细胞数/骨表面明显减少(t=18.762,P<0.001),但静磁场治疗后,与ON 组相比,ONS 组成骨细胞数/骨表面显著增加(t=-8.227,P<0.001,图5)。与Sham 组相比,ON 组RUNX2 蛋白的表达水平明显降低,而经静磁场治疗后,与ON 组相比,ONS组RUNX2 蛋白的表达水平明显提高(t=12.080、-5.850,均P<0.05,图6)。
2.4 静磁场抑制股骨头坏死大鼠的骨吸收 TRAP染色显示,与Sham 组相比,ON 组中破骨细胞数/骨表面明显增加,破骨细胞异常活跃(t=-9.803,P<0.001);而与ON 组相比,ONS 组破骨细胞数/骨表面显著减少(t=4.116,P<0.05),见图7。采用Western印迹结果表明,ON 组股骨的NFATc1 表达量比Sham 组明显增加(t=-6.033,P<0.001);而静磁场治疗后,ONS 组比ON 组NFATc1 表达量显著减少(t=3.618,P<0.05,图8)。
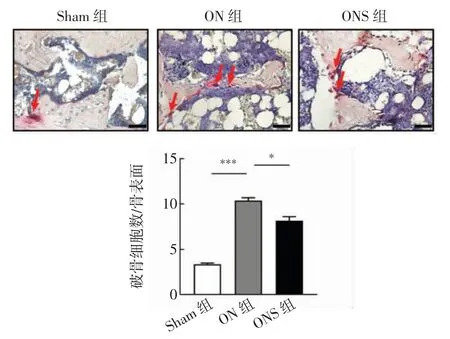
图7 股骨头TRAP 染色(400×)Fig.7 TRAP staining of the femoral head(400×)

图8 Western 印迹检测各组NFATc1 表达Fig.8 Western blotting was used to detect the expression of NFATc1 in each group
2.5 静磁场促进股骨头坏死大鼠的血管生成 墨汁灌注实验显示,与Sham 组相比,ON 组血管面积明显减少(t=7.389,P<0.001),而与ON 组相比,ONS 组血管面积减少得到显著改善(t=-3.613,P<0.01,图9)。
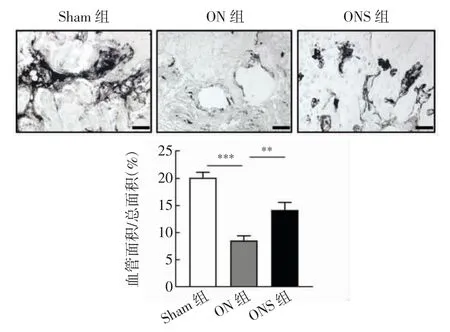
图9 墨汁灌注实验检测静磁场对大鼠血管生成的影响(100×)Fig.9 The effect of static magnetic field on angiogenesis was detected by ink perfusion experiment in rats(100×)
3 讨论
股骨头坏死又称股骨头缺血性坏死,是由于股骨头缺乏血供而导致骨坏死的一种骨科疾病[11]。统计显示股骨颈骨折、髋关节脱位、皮质类固醇类激素治疗和酗酒是导致股骨头坏死发生、发展的常见原因[12]。目前,股骨头坏死的发病率逐年升高,已经造成了严重的社会和经济负担[13]。因此,找到有效治疗股骨头坏死的方法显得格外迫切。
因为股骨头坏死多发于青壮年,而置换的假体使用寿命有限,且青年人活动量大,容易造成假体松动,因此并不适合进行髋关节置换手术,临床上进行早期诊断和治疗可有效保护髋关节,延缓关节置换时间[14]。研究表明,静磁场作为一种无创、安全且简便的治疗方式,可以通过促进成骨细胞增殖和分化,增加BMD、促进骨愈合、维持骨骼健康和治疗骨骼疾病[15-16]。本实验以股骨头坏死大鼠为研究对象,探究静磁场改善股骨头组织骨重建与血管生成的机制,证实静磁场通过增强成骨细胞的骨形成,抑制破骨细胞的骨吸收,增加血管生成,延缓股骨头坏死。本结果与之前报道的静磁场对骨骼、关节的有益作用相一致[17]。股骨头塌陷可能与成骨细胞和破骨细胞活性的变化有关[18]。研究证明,骨坏死区内参与血管生成的内皮祖细胞功能发生障碍,死亡的细胞会释放内源性炎症因子,刺激破骨细胞的活化增加,导致组织进一步的损伤[19]。股骨头坏死也会导致患者骨坏死区内骨髓干细胞和成骨细胞的功能下降[20]。在坏死区,骨修复差,参与骨组织修复的骨细胞增殖能力降低,破骨细胞活性增加,进而导致骨丢失[20]。因此,调节坏死区的成骨和破骨细胞活性可能是延缓股骨头坏死进展的有效方法之一。在本研究中,与ON 组相比,静磁场治疗增加了股骨头组织的骨量。MacNeal′s 染色显示,静磁场治疗增加了股骨头组织骨小梁表面成骨细胞的数量。TRAP染色显示,经过静磁场治疗后,股骨头组织骨小梁表面破骨细胞的数量减少。Western 印迹结果显示,静磁场治疗增加了股骨中RUNX2 的表达,降低了NFATc1 的表达。另外,成功的血管生成可以有效刺激骨再生,而新生血管的减少会导致骨再生下降[21]。笔者之前的研究发现,机械加载作为一种动态力学刺激,通过周期循环的力学刺激和骨应力变化,引起骨髓腔内压改变、骨质内液体流动与分子转运,增加H 血管的表达,促进成骨,抑制破骨,影响骨髓间充质干细胞分化,调节血管生成,进而达到治疗绝经后骨质疏松的目的[22-24]。但机械加载作用于体表,通过间接的方式刺激骨髓腔内压改变、骨质内液体流动与分子转运而发挥治疗作用,且在转化到临床治疗过程中,由于个体差异大,无法达到统一的作用效果,故仍有局限性。而静磁场属于静态力学刺激,可以更直接的影响到深层组织细胞,更快发挥作用。且相关研究表明,静磁场可以通过增强细胞活力,增加血管生成,促进伤口愈合[25]。故在此基础上,本实验扩展了之前的研究范围,探究静磁场对股骨头坏死血管生成的作用机制。在本研究中,墨汁灌注实验显示,静磁场治疗可以增加股骨头组织内血管的生成。这与静磁场治疗可促进血管生成的结果相一致[26]。
综上所述,本研究表明静磁场可以作为股骨头坏死的一种新的治疗方法,创新性地证实了静磁场对促进成骨细胞的骨形成、抑制破骨细胞的骨吸收从而改善骨重建并增加血管生成的治疗效果。但是本研究还有不足之处,如静磁场对股骨头骨坏死区域内血管微环境的调节,延缓骨坏死的具体机制还需要进一步探究。
