放射治疗对宫颈癌DNA甲基转移酶表达的影响*
2024-01-10蔡志平
徐 晗,高 扬,白 静,蔡志平,邵 国
(1.内蒙古科技大学包头医学院基础医学与法医学院,内蒙古 包头 014040;2.内蒙古科技大学包头医学院内蒙古低氧适应转化医学重点实验室;3.包头医学院二附院呼吸科;4.包头市肿瘤医院放射治疗科;5.深圳市龙岗区第三人民医院转化医学中心)
宫颈癌(cervical cancer,CIN)是严重危害女性健康的癌症,也是造成女性癌症死亡的主要原因之一。放射治疗是宫颈癌治疗的重要手段,但放射耐受会影响治疗效果[1]。DNA甲基化是调节基因表达的重要方式之一,放射治疗后特定基因的DNA甲基化变化导致的基因表达变化与放射治疗敏感或耐受关系密切[2]。如宫颈癌放射治疗后生长阻滞和DNA损伤诱导基因45(growth arrest and DNA damage gene 45,GADD45)蛋白变化可能是其放射耐受的原因之一[3]。DNA甲基化是由DNA甲基转移酶(DNA methyltransferase,DNMT)催化调节的,到目前为止共发现了三种有DNA催化活性的DNMT。宫颈癌的放射耐受发生可能和DNA损伤修复等众多基因有关联,放射治疗可能影响了DNMTs的表达从而导致这些基因参与了放射耐受。本研究采用real-time PCR实验技术检测放射治疗前、中、后三个时期宫颈癌组织中DNMT1、DNMT3A和DNMT3B mRNA的表达水平,探讨DNMT1、DNMT3A和DNMT3B在宫颈癌放射治疗耐受过程中的作用,为宫颈癌放射治疗和放射耐受提供表观遗传学依据。
1 材料和方法
1.1标本和试剂 12例宫颈癌样本均来自2018-2019年包头市肿瘤医院,患者均接受相同的放射治疗模式:全盆腔外照射45 Gy/25次(Frequency,f),腔内近距离治疗5~6 Gy/次(f),共治疗5~6次(f),每一个患者的3组样本分别为外照射结合近距离治疗前、治疗中(近距离治疗3次)和治疗结束留取样本;Trizol、逆转录试剂盒(Thermo Scientific RevertAid RT试剂盒),BeyoFastTM Probe qPCR Mix(2×),焦碳酸二乙酯(DEPC),其他试剂均为国产分析纯试剂;Real-time PCR仪(ABI 7900HT Real-Time PCR System)。
1.2引物 根据文献记载和Genebank序列,用Primer premier 5.0软件分别设计DNMT3A、DNMT3B和DNMT1以及内参β-actin的引物,由上海生工公司合成,引物序列(5′-3′)如下:DNMT1 F:AACCTTCACCTAGCCCCAG;R:CTCATCCGATTTGGCTCTTTCA;DNMT3A F:GACAAGAATGCCACCAAAGC;R:CGTCTCCGAACCACATGAC;DNMT3B F:AGGGAAGACTCGATCCTCGTC;R:GTGTGTAGCTTAGCAGACTGG;β-actin F:AGGTGAAGGTCGGAGTCA;R:GGTCATTGATGGCAACAA。
1.3qRT-PCR法 研磨组织加入500 μL Trizol,将组织研磨破碎后补足Trizol至1 000 μL,用注射器吹打15次,使组织和试剂充分混合;室温5 min,加入500 μL氯仿,剧烈震荡15 s,室温放置3 min,4 ℃,10 000 g,离心15 min后取上清;加入500 μL异丙醇,室温10 min,4 ℃,10 000 g,离心10 min后,弃上清;75%无酶乙醇1 000 μL,4 ℃,7 500 g,离心5 min后弃上清,放置室温下晾干乙醇,加入20 μL无酶水溶解RNA,室温下10 min,-80 ℃保存。紫外分光光度计测量RNA纯度和浓度,利用反转录试剂盒(Thermo公司)反转录为cDNA。采用cDNA作为反应的模板,在Real-time PCR仪上进行PCR反应。反应条件:95 ℃预变性10 min,再进行95 ℃,30 s;58 ℃,30 s;72 ℃,30 s,40个循环,最后72 ℃延迟2 min停止反应。

2 结果
2.1宫颈癌放射治疗前、中、后三个时期DNMT1对β-actin mRNA的相对表达量的比较 相对表达量分别是(0.122 9±0.021 7)、(0.569 6±0.021 7)和(0.162 0±0.035 2);放射治疗期间和放射治疗之前宫颈癌组织中DNMT1 mRNA的表达差异有统计学意义(P<0.05),放射治疗期间和放射治疗之后宫颈癌组织中DNMT1 mRNA的表达差异有统计学意义(P<0.05),放射治疗之前和放射治疗之后宫颈癌组织中DNMT1 mRNA的表达差异有统计学意义(P<0.05)。见图1。
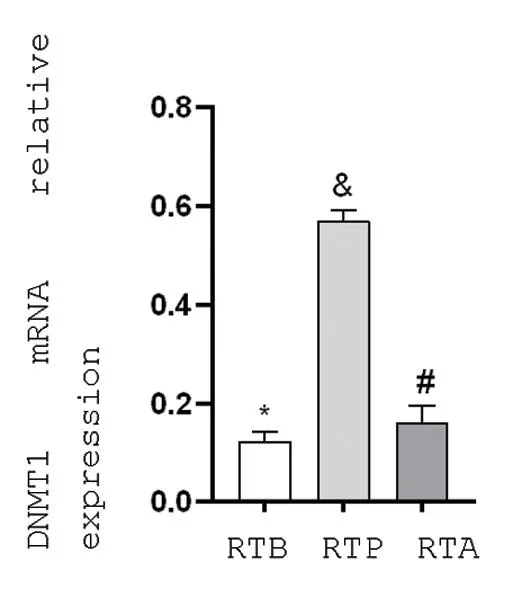
图1 DNMT1 mRNA对β-ACTIN mRNA相对表达量(n=12)
2.2宫颈癌放射治疗前、中、后三个时期DNMT3A对β-actin mRNA的相对表达量比较 相对表达量分别是(0.001 2±0.000 1)、(0.002 1±0.000 1)和(0.001 4±0.000 1),放射治疗期间和放射治疗之前宫颈癌组织中DNMT3A mRNA的表达差异有统计学意义(P<0.05),放射治疗期间和放射治疗之后宫颈癌组织中DNMT3A mRNA的表达差异有统计学意义(P<0.05),放射治疗之前和放射治疗之后宫颈癌组织中DNMT3A mRNA的表达差异无统计学意义(P>0.05)。见图2。
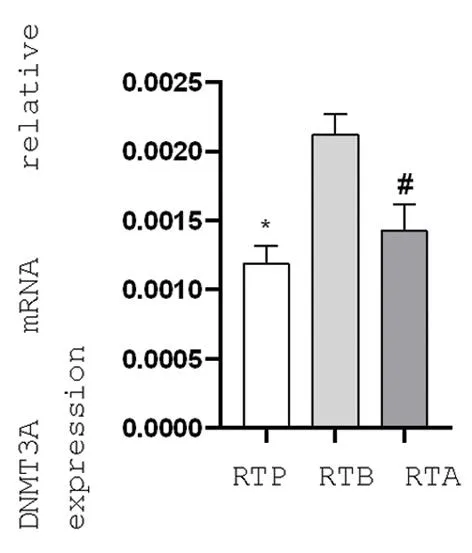
图2 DNMT3A mRNA对β-ACTIN mRNA相对表达量(n=12)
2.3宫颈癌放射治疗前、中、后三个时期DNMT3B对β-actin mRNA的相对表达量比较 相对表达量分别是(0.662 7±0.034 8)、(0.810 4±0.084 5)和(0.239 1±0.047 0),放射治疗期间和放射治疗之前宫颈癌组织中DNMT3B mRNA的表达差异有统计学意义(P<0.05),放射治疗期间和放射治疗之后宫颈癌组织中DNMT3B mRNA的表达差异有统计学意义(P<0.05),放射治疗之前和放射治疗之后宫颈癌组织中DNMT3B mRNA的表达差异有统计学意义(P<0.05)。见图3。
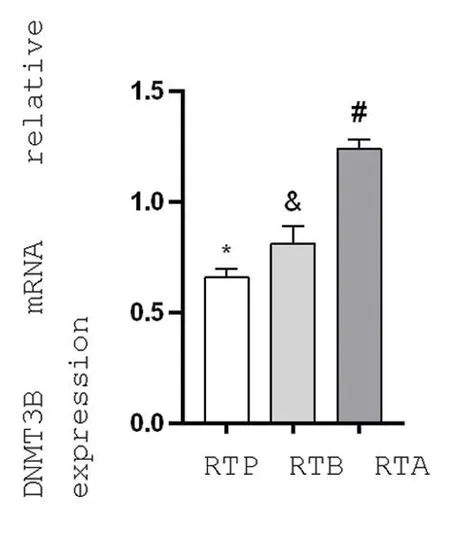
图3 DNMT3B mRNA对β-ACTIN mRNA相对表达量(n=12)
3 讨论
放射治疗被认为是癌症中最常用的治疗方法之一,放射耐受和放射不敏感性是导致治疗效果不理想的原因。放射治疗在宫颈癌晚期具有较好的治疗作用,可以有效地减少术后的复发[4],但是临床观察发现部分患者会产生放射耐受性致使治疗效果不敏感。研究表明,放射治疗敏感性可以通过多种途径进行调节,在多种疾病中可以看出DNA甲基化和放射耐受之间存在紧密联系。Chen等[5]研究发现经过辐射U照射后的DNA双链的断裂可以通过泛素特异性蛋白酶(USP)USP44的调节进行修复,USP44的高甲基化促进了鼻咽癌的放射治疗耐受性,增强USP44的表达可以增强鼻咽癌患者的放射敏感性;在食管癌患者中,CDKN2A以及TP73等基因甲基化的增加与放化疗反应差显著相关,其中RUNT相关转录因子3(RUNX3)在放射耐药性食管癌细胞中被高甲基化和下调,放射治疗前标本中的甲基化水平可以预测食管鳞状细胞癌的放射敏感性[6];而在对于喉癌患者的研究中,Olson等[7]经过DNA甲基化转移酶抑制剂处理取出TOP2A(DNA拓扑异构酶II α)的甲基化,使耐药的喉癌细胞重新获得敏感性,激活了基因的重新表达,说明DNA甲基化的改变有助于改变喉鳞状细胞癌的放射耐受;Liu等[8]的研究表明,较高的p73表达与宫颈癌放射敏感性呈正相关关系,高甲基化的p73使得宫颈癌细胞放射耐受,同时,可以通过调节部分基因启动子区域甲基化状态改变宫颈癌放射治疗敏感性,对于放射敏感性的调节主要通过调节细胞周期[9]和细胞凋亡[10]的变化。说明宫颈癌的放射治疗受放射耐受性影响很大,如若可以增加放射敏感性则可以使患者有较好的治疗和预后效果。
DNA甲基化可以影响基因表达,DNA甲基化升高,基因表达降低。众所周知,DNA甲基转移酶是调节DNA甲基化的关键因素,DNA甲基化起主要作用的甲基转移酶主要有三个:DNMT1、DNMT3A和DNMT3B。DNMT1可识别半甲基化DNA,在UFRH1蛋白的作用下甲基化修饰新生链上的DNA,起维持DNA甲基化作用;DNMT3A和DNMT3B具有DNA甲基转移酶活性,可以在组蛋白修饰的指导下,精准地给DNA添加甲基化修饰。DNA甲基转移酶介导了多种因子在癌症体内的调控,例如在结直肠癌中[11],化疗和放疗通过抑制DNMT1的表达,上调了BNIP3表达,促进结直肠癌细胞的凋亡,而通过DNA甲基化酶抑制剂治疗后,逆转甲基化的发生,从而诱导肿瘤细胞凋亡的耐受性;通过沉默表达DNMT3B使DNA去甲基化恢复并激活p53和p21,致使鼻咽癌的放射耐受性增加[12];宫颈癌的发生发展受多种基因的调控,已知肿瘤抑制因子p16在宫颈癌中过表达[13],p16INK4A是宫颈癌变的肿瘤标志物,对确定接受放疗的患者生存具有重大影响,p16在其DNA甲基化转移酶作用下的特异性改变提高了肺癌和胃癌细胞的耐受性,可能在宫颈癌细胞中也有相似的功能。本研究中发现放射治疗后DNMT1、3A和3B表达均发生了改变,说明DNMTs的改变可以调节宫颈癌放射治疗耐受。同时已有研究结果[14]提示DNMTs表达降低可能参与放射耐受相关基因表达增加,多种基因参与宫颈癌细胞辐射耐受性发展,而在放射耐受相关基因中,DNA损伤修复相关基因的作用最为重要,如PDRG1、GADD45等,其中GADD45蛋白是DNA修复和表观遗传基因调控之间的纽带[3],而GADD45α基因的表达可以调控肿瘤的放射耐受状态,GADD45α表达降低显著促进了放射耐受性的发展,通过调控Gadd45α可以调控宫颈癌细胞的放射耐受性[15],说明DNA损伤修复基因可以通过DNA甲基化的调控参与放射治疗耐受,然而目前并没有针对放射治疗耐受的有效药物治疗,但在已有的研究中发现宫颈癌放射治疗敏感性的调节和肿瘤相关基因有关,例如p73可以通过甲基化的转录沉默,调节DNA甲基化可以改变宫颈癌的放射敏感性[8],SEPT9基因高甲基化在宫颈癌的诊疗中具有高敏感性和特异性,同时通过调节肿瘤相关巨噬细胞极化来增强已经被削弱的癌症细胞的放射耐受[16]。异常的前体启动子甲基化可以使肿瘤细胞产生放射耐受性[17],而不同的放射治疗时间会使细胞在一段时间内产生放射耐受后重新激活了细胞体内的放射敏感因子[18]。本研究实验结果显示经过放射治疗期间DNMTs的表达较放射治疗之前升高,且放射治疗结束后DNMTs的表达虽呈现了下降的趋势,但是仍高于放射治疗之前,猜测原因除了和放射治疗时间有关以外,可能也和本批实验样本均为放射不敏感样本有关,Kuhmann等[18]研究中说明的分次照射累计达到不同放射剂量后出现辐射耐受可以说明此现象。关于这一点,后续实验可以采用同样剂量下的放射治疗后预后良好患者的样本进行进一步的实验研究。
本研究发现放射治疗前、中、后DNMT3A,DNMT3B和DNMT1的表达发生改变,这种变化可能是宫颈癌放射治疗耐受的原因之一。提示在放射治疗宫颈癌过程中,若同时可以使用DNMTs的抑制剂,则可能降低宫颈癌细胞的放射抵抗性,增加放射敏感性[19]。本研究后续将使用动物模型,通过DNMTs抑制剂联合放射治疗,探讨是否可以降低宫颈癌的放射治疗耐受。
