撒坝猪源E. coli高致病性毒力岛通过NLRP3/ASC/Caspase-1途径诱导IPEC-J2细胞焦亡
2024-01-10肖金龙赵维薇
肖金龙,王 浩,万 全,沈 珏,张 博,赵维薇,邓 静,王 喜,赵 汝,肖 鹏*,高 洪*
(1.云南农业大学动物医学院,昆明 650201;2.云南农业大学食品科学技术学院,昆明 650201;3.云南农业大学动物科学技术学院,昆明 650201)
撒坝猪属于农业部地方猪种遗传资源保护品种,在分类上属于乌金猪品系,具有饲料要求低、利用率高、适应性和抗逆性较强等优点[1-2]。1月龄以内的仔猪易被致病性大肠杆菌(Escherichiacoli,E.coli)感染,可致仔猪黄痢、白痢和水肿病甚至死亡,对仔猪的生长发育造成极大的威胁[3-4]。同时,由于致病性E.coli的血清型众多、抗原类型差异大且复杂多变、新发病型不断出现的原因,使得大肠杆菌病总体的发病率呈升高趋势[5-6]。深入研究致病性E.coli对于相关疾病的预防、诊断、治疗及保障养殖业的健康发展具有重要意义。E.coli属于革兰阴性菌,部分特殊类型的E.coli具有毒力基因,如HPI基因[7-8]。HPI首先在耶尔森菌中被发现,大小35~45 kb,可向E.coli水平转移[9]。研究发现耶尔森菌HPI功能缺失可显著降低细菌对小鼠的毒性,禽源E.coliHPI基因缺失会引起部分相关毒力因子表达水平下降、黏附细胞能力减弱、半数致死量(median lethal dose,LD50)上升以及症状减轻等,而含有HPI的E.coli可提高小鼠的死亡率[10-12],提示HPI在E.coli感染、侵袭、致病过程中起重要作用。焦亡是由各种病原微生物感染或其他危险信号引起的、伴随着炎性反应的程序性细胞死亡,可分为Caspase-1介导的经典焦亡通路和Caspase-4/5/11介导的非经典焦亡通路。在经典焦亡通路中,机体受到危险刺激引起炎性小体组装并切割激活Caspase-1,GSDMD自身抑制状态被Caspase-1破坏,同时Caspase-1将Pro-IL-1β及Pro-IL-18切割激活,随后GSDMD-N通过脂质结合位点迁移至质膜,破坏质膜完整性,诱导焦亡的发生,IL-1β和IL-18也随之外释,进一步扩大炎症[13-14]。目前有研究发现,弗氏志贺杆菌、沙门杆菌、耶尔森杆菌等均可诱导细胞发生细胞焦亡[15],而致病性E.coliHPI能否诱导细胞焦亡仍不清楚。本研究以LPS+ATP为阳性对照,将E.coliΔHPI、E.coliHPI感染IPEC-J2细胞,观察细胞形态、质膜孔的形成、焦亡通路相关因子的表达变化及炎性复合体的组装情况,探究撒坝猪源E.coliHPI诱导细胞焦亡的机制,阐明E.coliHPI对细胞焦亡的影响,为撒坝猪源E.coliHPI的致病机制提出新见解。
1 材料方法
1.1 材料
1.1.1 细胞和试验用菌 IPEC-J2购于吉尼欧生物公司(广州)。E.coliHPI由云南农业大学病理实验室分离自云南楚雄腹泻撒坝仔猪粪便,并以20%的甘油保存于-80 ℃冰箱,已验证HPI结构完整性[16]。E.coliΔHPI为实验室前期利用CRISPR/Cas9技术敲除并保存菌株,已验证基因敲除成功[17]。
1.1.2 主要试剂、仪器 RNA提取试剂盒、反转录试剂盒(Vazyme Biotech Co.,Ltd.),4%多聚甲醛、抗淬灭封片剂(Biosharp)、ECL显影液、BCA蛋白定量试剂盒、10~180 ku Western blot蛋白marker、DAPI(Servicebio),NLRP3 Antibody、Caspase-1 Antibody、GSDMD Antibody、Goat anti-rabbit IgG(Abcam Plc)。
紫外可见分光光度计(北京普析仪器公司),超速低温离心机(Beckman Coulter, Inc.),倒置荧光显微镜(Olympus America.),CO2培养箱(Thermo Fisher Scientific Inc.),荧光定量PCR仪(Bio-Rad Laboratories, Inc.)。
1.2 方法
1.2.1 试验分组 细胞接种六孔板培养,每孔加入2 mL细胞培养基;对照组(Control):细胞正常培养,试验组:细胞培养液中接种OD600 nm=0.6~0.8的E.coliHPI或E.coliΔHPI菌液100 μL;阳性对照(LPS+ATP)组:10 μg·mL-1LPS处理5.5 h,再加入5 mmol·mL-1ATP处理0.5 h;各组于处理后不同时间点收集细胞进行以下试验,每组设置3个重复。
1.2.2 IPEC-J2的感染处理和CPE拍照 各组细胞于作用后6 h弃去细胞培养液,洗涤3次,光学显微镜下观察拍照。
1.2.3 IPEC-J2的HE染色 各组细胞爬片用95%乙醇固定、苏木素染液作用10 min、伊红染色液作用2 min、滴加中性树胶封片,观察拍照。
1.2.4 RT-qPCR检测焦亡通路相关因子 各组细胞于处理后0.5、3、6、9、12 h收集样品,参照高旭雯等[18]的方法提取总RNA;gDNA去除及cDNA合成方法按试剂盒说明书进行;RT-qPCR检测GSDMD、NLRP3、Caspase-1、ASC、IL-1β、IL-18的mRNA表达水平,利用2-ΔΔCt法计算各基因的相对表达量。RT-qPCR引物序列及退火温度见表1。

表1 引物信息Table 1 The Primer
1.2.5 激光共聚焦观察NLRP3/Caspase-1炎性复合体的组装 各组细胞处理9 h后4%甲醛固定15 min,0.2% TritonX-100通透3 min,3% BSA封闭1 h,随后加入NLRP3 Antibody(1∶200)及Caspase-1 Antibody(1∶100)混合液于4 ℃冰箱内孵育12 h,再加入羊抗小鼠IgG(1∶200)及Goat anti-rabbit IgG(1∶200)混合液室温遮光孵育1 h,DAPI染色液室温遮光孵育5 min,防淬灭剂封片,镜下观察并采集图像。
1.2.6 Western blot检测焦亡标志蛋白GSDMD-N 各组细胞处理9 h后加入裂解液低温裂解15 min,依照蛋白浓度测定试剂盒说明书测定蛋白浓度,样品进行聚丙烯酰胺凝胶电泳、转膜,随后将PVDF膜放入5%脱脂奶粉封闭2 h,加入一抗于4 ℃冰箱内孵育12 h,加入二抗于室温下孵育1 h、ECL显色液显色;凝胶成像系统中观察并采集图像。
1.2.7 IPEC-J2的碘化丙啶(propidium iodide, PI)染色 各组细胞爬片用95%乙醇固定、加入2 mL PI染液遮光孵育20 min、DAPI孵育5 min、拍照观察计算形成质膜孔的阳性细胞占比。

2 结 果
2.1 IPEC-J2 CPE观察
对照组小肠上皮细胞在正常情况下排列紧密呈梭形(图1a),E.coli感染后由于细菌的大量繁殖及代谢废物的排出,可见E.coliΔHPI组与E.coliHPI组细胞均出现细胞肿胀、轮廓模糊等现象(图1b、c),阳性对照组细胞出现肿胀变形、脱落、破碎等更为严重的病理变化(图1 d)。

a. 正常培养的细胞; b. E. coli ΔHPI感染6 h的细胞; c. E. coli HPI感染6 h的细胞; d. LPS+ATP处理6 h的细胞A. Normal cultured cells; b. Cells infected with E. coli ΔHPI for 6 h; c. Cells infected with E. coli HPI for 6 h; d. Cells treated with LPS+ATP for 6 h 图1 小肠上皮细胞CPE形态观察(标尺=500 μm)Fig.1 CPE morphology observation of IPEC-J2 (Scale bar=500 μm)
2.2 IPEC-J2 HE染色
HE结果显示,正常IPEC-J2细胞呈梭形,轮廓清晰,无脱落现象(图2a)。E.coli感染组和阳性对照组中细胞均表现出不规则形态,细胞间界线模糊不清,逐渐变为椭圆形或圆形,膨胀变形破裂(图2b、c、d)。相较于E.coliΔHPI组,E.coliHPI和阳性对照组病变更严重,细胞发生坏死崩解,并大量脱落,细胞核破裂溶解。
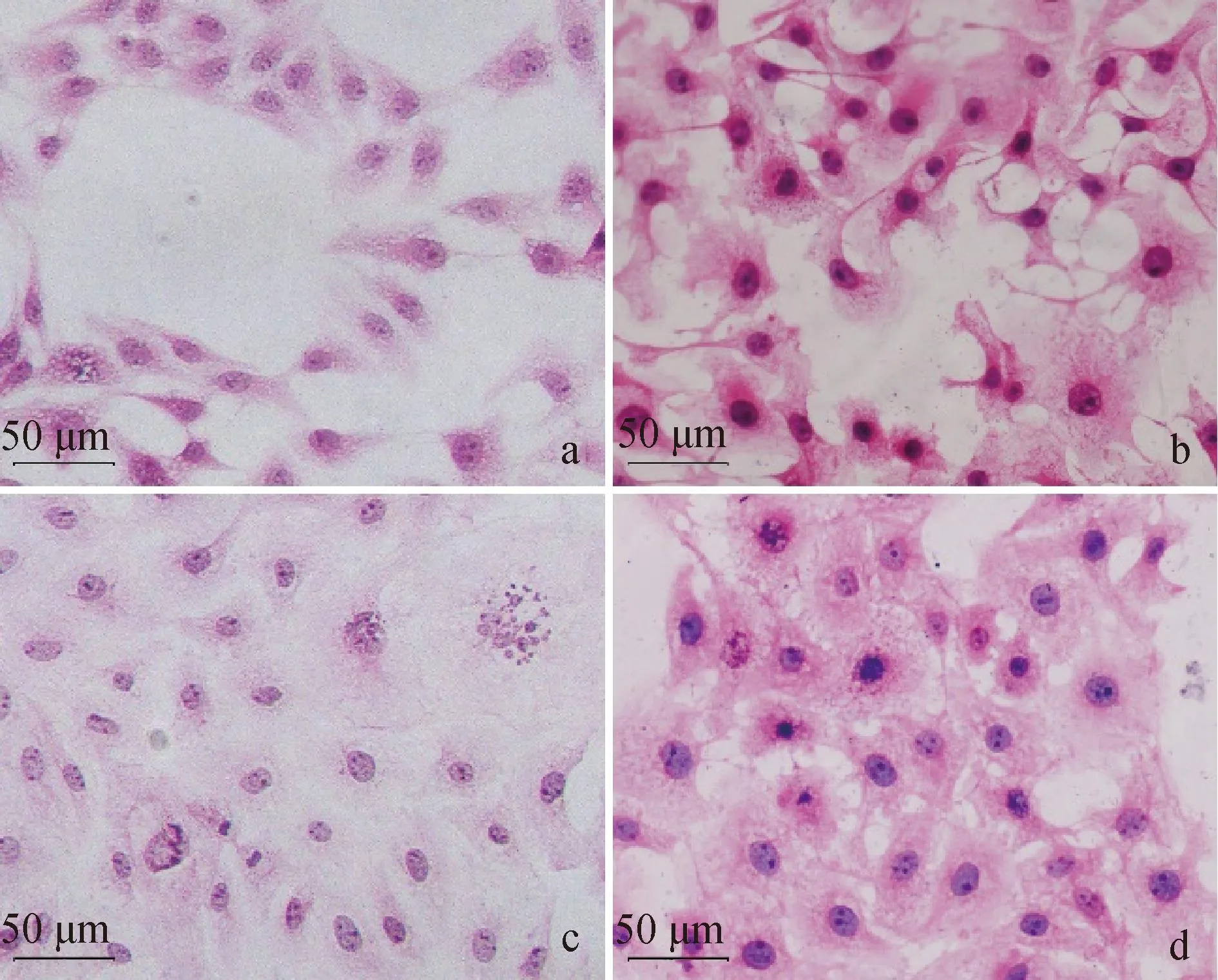
a. 正常培养的细胞; b. E. coli ΔHPI感染6 h的细胞; c. E. coli HPI感染6 h的细胞; d. LPS+ATP处理6 h的细胞A. Normal cultured cells; b. Cells infected with E. coli ΔHPI for 6 h; c. Cells infected with E. coli HPI for 6 h; d. Cells treated with LPS+ATP for 6 h 图2 小肠上皮细胞HE染色结果(标尺=50 μm)Fig.2 HE staining results of IPEC-J2(Scale bar=50 μm)
2.3 IPEC-J2 RT-qPCR检测
以β-actin为内参,2-ΔΔCt法计算各组相应时间点GSDMD、NLRP3、Caspase-1、ASC、IL-1β、IL-18的mRNA水平。结果显示:E.coli感染组细胞内焦亡关键因子及炎性因子mRNA水平均先升高再降低;阳性对照组细胞各因子mRNA水平极显著高于对照组;在3~9 h,E.coliHPI组与E.coliΔHPI组细胞内各因子mRNA表达量呈现显著或极显著差异;试验组细胞中焦亡通路关键因子在6或9 h达高峰(图3)。
2.4 IPEC-J2中炎性复合体的组装
qPCR结果显示,细胞焦亡的执行蛋白GSDMD的mRNA表达量在6 h达到高峰,GSDMD蛋白的表达及活化过程要稍晚于GSDMDmRNA的转录过程,所以后续对GSDMD蛋白的表达活化及膜孔的形成均在作用后9 h进行检测。
图4为各组细胞NLRP3、Caspase-1蛋白表达及共定位情况,NLRP3蛋白用绿色荧光标记,Caspase-1蛋白用红色荧光标记,DAPI用蓝色荧光标记,Merge为3种荧光的合成结果。E.coli感染组和阳性对照组在细胞质中均出现了明显的NLRP3和Caspase-1共定位情况,表明NLRP3/Caspase-1炎性复合体的组装;同时E.coliHPI组的蛋白荧光强度极显著高于E.coliΔHPI组。
2.5 GSDMD-N的表达
以β-actin蛋白为内参蛋白,Western blot检测各组作用9 h时细胞内GSDMD及其活化形式GSDMD-N的蛋白表达量。结果显示:在约31和53 ku处出现条带,符合GSDMD-N和GSDMD的蛋白大小;阳性对照及试验组细胞的GSDMD、GSDMD-N蛋白表达量相对于对照组极显著升高;E.coliHPI组与E.coliΔHPI组相比,GSDMD及GSDMD-N蛋白表达量差异极显著(P<0.01)(图5)。
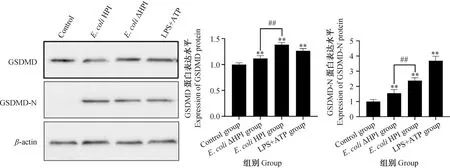
图5 IPEC-J2 GSDMD及其活化形式GSDMD-N蛋白的表达水平及量化结果Fig.5 Expression level and quantitative results of IPEC-J2 GSDMD and its activated form GSDMD-N protein
2.6 IPEC-J2 质膜孔形成情况
图6为细胞处理9 h后的PI染色情况,有膜孔的细胞被PI染料红色荧光标记,细胞核用DAPI蓝色荧光标记,Merge为二种荧光的合成结果。结果显示各组细胞处理9 h后E.coli感染组和阳性对照组细胞死亡率极显著高于对照组,其中E.coliHPI组细胞死亡率极显著高于E.coliΔHPI组,且E.coliHPI组高于阳性对照组。
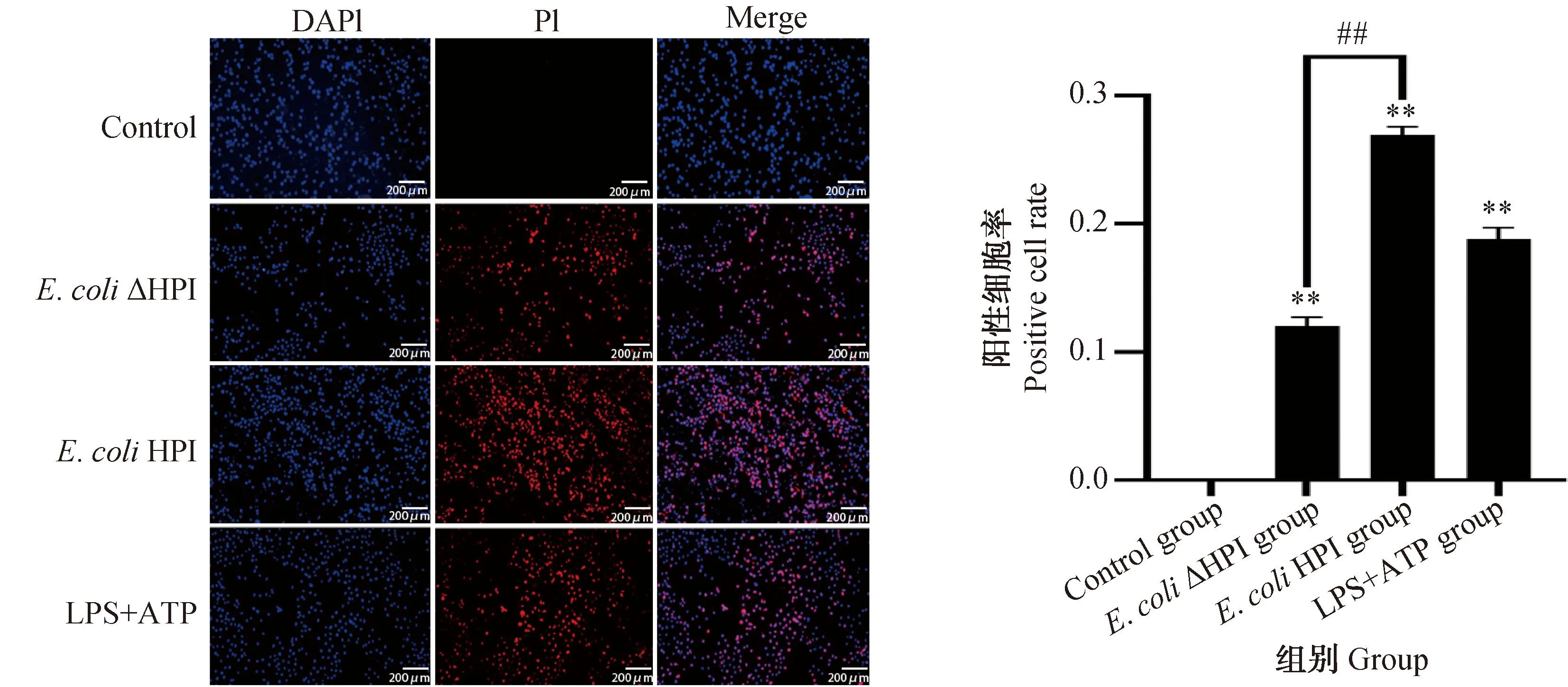
图6 小肠上皮细胞PI染色结果及细胞阳性率Fig.6 PI staining results and positive rate of IPEC-J2
3 讨 论
LPS+ATP被广泛用于细胞焦亡模型的构建[19-20],本研究将LPS+ATP作用于小肠上皮细胞作为阳性对照。结果显示,在E.coliΔHPI组中,可能由于细菌代谢物或其他毒力因子导致细胞也出现了CPE,但相对于E.coliΔHPI组,E.coliHPI组感染造成的细胞损伤更加严重,表明HPI可以促进或导致细胞的损伤。为了确定细胞出现CPE是否伴随焦亡的发生,对焦亡通路关键因子mRNA水平进行检测,发现感染3~9 h时E.coliHPI组焦亡通路关键因子及炎性因子mRNA表达量显著高于E.coliΔHPI组,表明致病性E.coliHPI对于细胞焦亡NLRP3/ASC/Caspase-1信号通路关键因子及炎性因子的表达具有促进作用,这与以往的研究结果相符合[21-22]。
当细菌、真菌等各种病原相关分子和来自宿主的某些危险信号分子刺激机体时,先天性免疫系统即整合胞内信号转导并组装形成蛋白复合物[23]。Caspase-1前体借助“中间桥梁”接头蛋白ASC与相应的模式识别受体(NLRP3等)连接,而后组装成一个高分子量的炎性小体[24-25]。Wang等[26]通过共聚焦显微镜观察到巨噬细胞焦亡模型中NLRP3、ASC、Caspase-1在细胞质中共定位现象,我们利用激光共聚焦同样发现了炎症小体重要组件NLRP3和Caspase-1蛋白的在细胞质中的定位现象,且E.coliHPI组的蛋白荧光强度极显著高于E.coliΔHPI组,表明E.coliHPI能够促进NLRP3和Caspase-1蛋白的表达及NLRP3/Caspase-1炎性复合体在细胞质中的组装,进一步确定了E.coliHPI通过NLRP3/ASC/Caspase-1经典焦亡通路诱导焦亡的发生。
炎性小体形成后将Caspase-1前体水解为成熟的Caspase-1,Caspase-1再将焦亡的刽子手——GSDMD在ASP275位点切割激活。GSDMD由N端形成结构域(PFD)和C端抑制结构域(RD)组成,正常状态下PFD和RD相互作用抑制GSDMD活性,被Caspase-1切割后PFD和RD分离,PFD在质膜中寡聚形成直径1~2 μm的孔隙,允许IL-1β、IL-18、PI、Caspase-1等直径更小的物质通过。此外,Caspase-1还可以诱导IL-1β、IL-18前体的成熟,在机体内招募免疫细胞,增强T细胞和NK细胞功能,进而放大炎症反应,诱导细胞焦亡[27-29]。
GSDMD蛋白本身作为所有炎性Caspase的作用底物,是细胞焦亡真正的执行蛋白[30],通过Western blot对其在细胞内表达情况的检测可以进步确定细胞是否发生了焦亡。与E.coliΔHPI组相比,在E.coliHPI组中GSDMD及GSDMD-N有更高的表达率,这与RT-qPCR结果和细胞表现出特征性的死亡状态一致。焦亡的典型特征为质膜膜孔的产生,使得细胞内外相互连通,PI染液便能够通过膜孔进入细胞着色,最终呈现出染色阳性[31]。试验组及阳性对照组细胞PI染色阳性率明显升高在一定程度上证明焦亡的发生,同时E.coliHPI组较E.coliΔHPI组细胞阳性率显著上升,表明E.coliHPI对于IPEC-J2膜孔的产生有积极影响,诱导了细胞焦亡的发生。在E.coliHPI组中,CPE、焦亡通路关键因子mRNA表达量、NLRP3/Caspase-1炎性复合体组装情况、GSDMD-N蛋白表达量均与LPS+ATP诱导的细胞焦亡模型相似,表明E.coliHPI能够诱导细胞焦亡的发生。
值得注意的是,E.coliHPI组中NLRP3/Caspase-1蛋白荧光强度、GSDMD-N均低于阳性对照组,但E.coliHPI组PI染色阳性率却高于阳性对照组,可能是E.coliHPI通过经典焦亡通路诱导GSDMD蛋白表达的同时也通过其他途径诱导了其他打孔蛋白的表达,如GSDMB、GSDMC、GSDME等[27],这值得人们进一步深入探究。
4 结 论
致病性E.coliHPI对NLRP3/Caspase-1炎性复合体的组装具有促进作用,并通过NLRP3/ASC/Caspase-1途径切割激活GSDMD-N,促进质膜孔的形成,从而诱导猪小肠上皮细胞发生焦亡。
