STM1827在鼠伤寒沙门菌生物被膜形成及环境应激中的调控作用
2024-01-10李莉莉陈凯风周洲平王南威瞿孝云徐成刚张建民
李莉莉,陈凯风,陈 兵,周洲平,王南威,瞿孝云,徐成刚,廖 明,3,张建民*
(1.华南农业大学兽医学院,农业部兽用疫苗创制重点实验室,农业部人兽共患病重点实验室,广东省动物源性人兽共患病重点实验室,人兽共患病防控制剂国家地方联合工程实验室,广州 510642;2.深圳海关动植物检验检疫技术中心,深圳 518045;3.广东省农业科学院,广州 510640)
沙门菌是一种广泛流行的人畜共患病原菌,不仅给养殖业带来严重的经济损失,同时也危害人类的健康[1]。而鼠伤寒沙门菌是沙门菌中最重要的血清型之一[2-4],也是目前我国流行率最广的血清型之一[5],其具有较强的适应性,不仅可以对抗生素及抑菌剂产生耐受性[6],而且可以抵抗宿主体内的压力,实现在宿主体内的生存并增殖[7-8],使其在世界范围内广泛传播。据统计全球每年由鼠伤寒沙门菌感染引起的胃肠炎病例约有9 380万例,其中约有15万人死亡[9],同时在沙门菌导致的食物中毒病例中鼠伤寒占比16.81%[10]。因此,具有重要的公共卫生学意义。故鼠伤寒沙门菌适应性机制的揭示对于其防控至关重要。
研究发现,细菌生物被膜的形成在其适应性中发挥着重要作用[11],而生物被膜形成的关键是广泛存在于细菌中的第二信使分子环二鸟苷酸(c-di-GMP)[12]。c-di-GMP主要是由鸟苷酸环化酶(guanylate cyclase, DCGs)和磷酸二酯酶(phosphodiesterase, PDEs)分别合成与降解,而这两种酶分别由高度保守的GGDEF与EAL结构域组成[13]。目前在鼠伤寒沙门菌中共发现22个GGDEF与EAL结构域相关基因,部分基因已被证明可以参与c-di-GMP代谢。如含有GGDEF结构域的AdrA能够通过调控胞外多糖的合成促进细菌生物被膜的形成[14];含有EAL结构域的STM1697基因,其缺失可以导致鼠伤寒沙门菌对细胞的侵袭与黏附能力增强[15];含有EAL结构域的STM1344可以抑制鼠伤寒沙门菌的运动能力[16];具有PDE活性的YhjH可以促进鼠伤寒沙门菌的运动[17]等,但仍有部分基因功能尚未深入研究。作者通过实验室前期强生物被膜与弱生物被膜菌株转录组分析发现20个与c-di-GMP代谢相关基因发生差异表达,其中STM1827作为含有EAL结构域的假定基因,其在生物被膜与环境适应性方面的具体调控作用尚不清楚。因此进一步了解该基因的功能有助于阐明c-di-GMP在鼠伤寒沙门菌生物被膜形成中的信号调控网络与揭示鼠伤寒沙门菌的适应性机制。
基于此,本研究以STM1827为对象,通过基因缺失株与回补株,揭示STM1827在鼠伤寒沙门菌中对c-di-GMP水平、细菌生物被膜形成、运动性、环境应激之间的调控作用,进一步完善c-di-GMP在生物被膜形成中的调控网络,同时为沙门菌病的防控奠定理论基础。
1 材料与方法
1.1 菌株与质粒
鼠伤寒沙门菌WT269、质粒pKD4、pKD46、pCP20及质粒PBAD均为本实验室保存。
1.2 主要试剂、仪器
硫酸卡那霉素、氨苄青霉素、硫酸庆大霉素均购自鼎国生物技术有限公司;c-di-GMP含量 ELISA KIT试剂盒购自上海恒远生物科技有限公司;LB琼脂、LB肉汤培养基均购自环凯微生物技术有限公司。
1.3 引物的设计与合成
根据鼠伤寒沙门菌全基因组序列,使用Primer 5设计引物,引物STM1827-Red-F/R用来扩增含有STM1827同源片段的卡那霉素抗性片段;引物STM1827-JD-F/R用于鉴定STM1827基因;引物STM1827-HF/HR用于STM1827基因扩增;引物PBAD-F/R用于STM1827回补株的鉴定。具体引物信息见表1,所有的引物均由上海生工生物工程技术服务有限公司合成。

表1 PCR引物名称及序列Table 1 PCR primer name and sequence
1.4 缺失株与回补株的构建
根据Red同源重组方法[18]构建STM1827基因缺失株。利用引物STM1827-Red-F/R扩增质粒pKD4上的卡那霉素基因片段,后将扩增片段进行胶回收。将回收的STM1827基因打靶片段电转化入含有质粒pKD46并已诱导表达的亲本株WT269感受态细胞中,后将其复苏涂布含有卡那霉素平板,培养过夜,挑取单菌落摇菌,经PCR鉴定为阳性的菌液涂布于含有卡那霉素平板于42 ℃消除质粒pKD46,利用引物pKD46-JD-F/R鉴定质粒pKD46消除。通过质粒pCP20去除卡那霉素抗性片段,同样经热激消除质粒pCP20,最后将鉴定正确的STM1827基因缺失株命名为269ΔSTM1827。
利用质粒PBAD构建STM1827克隆载体,继而电转入菌株269ΔSTM1827感受态细胞中,利用引物PBAD-F/R进行PCR鉴定,将鉴定正确的菌株命名为269ΔSTM1827R,即为回补株。
1.5 生长曲线的测定
挑取WT269、269ΔSTM1827、269ΔSTM1827R单菌落至LB肉汤中培养过夜,次日将菌液稀释到的LB肉汤中并调整OD600 nm至0.1,37 ℃,200 r·min-1连续培养20 h,每隔1 h测其OD600 nm,绘制菌株生长曲线。
1.6 c-di-GMP含量的测定
挑取单菌落至LB肉汤中培养过夜,次日将菌液稀释至LB肉汤中培养,将菌液离心弃上清,PBS洗涤3次并将其破碎,破碎的菌体离心2 min,弃其上清并用PBS洗涤菌体一次,随后离心2 min弃上清。将沉淀用2 mL PBS重悬起来,100 ℃水浴5 min,迅速加入冰乙醇,使得乙醇最终浓度为65%,萃取15 s,后离心2 min抽取上清液,即为样品c-di-GMP。将提取好的样品用c-di-GMP ELISA KIT试剂盒进行含量测定,并根据标准曲线确定样品中c-di-GMP含量。
1.7 细菌生物被膜形成的测定
根据参考文献[19]的方法,挑取单菌落至LB肉汤中培养过夜,将菌液稀释到无盐LB肉汤中,取200 μL接种于96孔板,30 ℃,静置培养48 h后弃去悬浮液,PBS洗涤3次,每孔加入200 μL的无水甲醇固定15 min,弃去液体并晾干。随后每孔加入200 μL 1%的结晶紫溶液染色15 min,弃去未结合的染料,并用PBS洗涤3次,晾干后每孔加入200 μL 33%的乙酸溶解结晶紫,测量OD595 nm值。
1.8 多细胞行为表型的测定
根据参考文献[20]试验方法,挑取单菌落至LB肉汤中培养过夜,吸取10 μL菌液接种在含有刚果红(40 mg·L-1)和考马斯亮蓝(20 mg·L-1)的无盐LB平板上,28 ℃,培养5~6 d,观察菌落的形态及与染料结合情况。
1.9 细菌胞外基质成分的检测
根据参考文献[21]试验方法,挑取单菌落至LB肉汤中培养过夜,取10 μL菌液接种于无盐LB琼脂上,28 ℃静置培养18 h,随后用0.9%的氯化钠溶液重悬菌体并最大速度离心10 min,收集上清液,在试管中加入上清液2.5倍体积的99%冰乙醇,最大速度离心20 min并弃去上清液,将所得到的颗粒在65 ℃过夜干燥后,用ddH2O重悬,最后用分光光度计检测样品中蛋白质和DNA的浓度。对于胞外多糖含量的测定,首先制备浓度为0、0.2、0.4、0.6、0.8、1.0 mg·mL-1的葡萄糖溶液,随后与5%的苯酚溶液混合,迅速加入硫酸试剂混匀,室温下静置10 min,置于65 ℃水浴18 min,取出后插于冰上冷却至室温,在OD490 nm处测量吸光值,绘制葡萄糖标准曲线。同时将菌体混悬液离心后收集的上清液10倍稀释后与5%的苯酚溶液混合,迅速加入硫酸试剂混匀,室温下静置10 min,后置于65 ℃水浴18 min,取出并插于冰上至室温。最后在OD490 nm处测量吸光值,同时根据葡萄糖标准曲线确定多糖浓度。
1.10 细菌运动性的测定
根据参考文献[22]试验方法,挑取单菌落至LB肉汤中培养过夜,次日吸取10 μL菌液接种在0.5%的LB琼脂上,置于37 ℃培养6 h,通过测量细菌在平板中的迁移所形成圆圈的直径评估运动能力。
1.11 实时荧光定量PCR检测相关基因转录水平
根据Omega公司生产的细菌RNA提取试剂盒提取菌株的总RNA,利用试剂盒进行逆转录合成cDNA。以16S基因作为内参,通过qRT-PCR检测与细菌生物被膜形成相关基因CsgA、CsgB、BcsA、BcsB,及运动性相关基因FliA、FlhC、FlhD的转录水平(引物序列见表1)。反应体系为cDNA模板1 μL,上下游引物各0.4 μL,2×ChamQ Universal SYBR Green qPCR Master Mix 10 μL,去离子水8.2 μL。反应程序:95 ℃预变性 2 min;PCR 反应阶段:95 ℃ 15 s,58 ℃ 30 s,40个循环。采用比较周期阈值法(2-ΔΔCt法)分析基因表达水平。
1.12 环境应激抵抗力的检测
参考文献[19]试验方法,挑取单菌落至LB肉汤中培养过夜,次日将菌液离心弃去上清液,PBS洗涤3次,最后将沉淀的菌体用LB肉汤重悬起来,随后将其菌液分别加入至含有5 mmol·L-1H2O2、0.25% SDS消毒剂的LB肉汤中,连续培养10 h,每隔1 h测定OD600 nm值,并绘制生长曲线。
1.13 数据分析
数据采用 GraphPad Prism 8.0.1 软件中t检验分析数据,****.P<0.000 1;***.P<0.001;**.P<0.01;*.P<0.05。
2 结 果
2.1 STM1827基因缺失株与回补株的构建
利用Red同源重组方法获得基因缺失株269ΔSTM1827,以STM1827-JD-F/R为引物,PCR鉴定结果显示(图1A),野生株269扩增条带大小为2 383 bp,基因缺失株扩增条带约为679 bp,与预期结果相符,表明成功构建缺失株,将其命名为269ΔSTM1827。

A. 269ΔSTM1827缺失株的鉴定(M. 5 000 bp DNA相对分子质量标准;1. 野生株WT269;2. 缺失株269ΔSTM1827);B. 269ΔSTM1827R回补株的验证(M. 5 000 bp DNA相对分子质量标准;1.质粒PBAD;2. 回补株269ΔSTM1827R)A. Identification of the 269ΔSTM1827 mutant strain (M. 5 000 bp DNA relative molecular weight; 1. Wild strain WT269; 2. Missing strain 269ΔSTM1827);B. Identification of 269ΔSTM1827R compelement strain (M. 5 000 bp DNA relative molecular weight; 1. Plasmid PBAD; 2. Retrogression strain 269ΔSTM1827R)图1 269ΔSTM1827缺失株与269ΔSTM1827R回补株的PCR鉴定Fig.1 Identification of 269ΔSTM1827 mutant strain and 269ΔSTM1827R complement strain by PCR
通过重组质粒PBAD-STM1827构建回补株,用引物PBAD-F/R为引物进行PCR验证,结果显示(图1B),质粒大小为381 bp,回补株出现2 208 bp,证明回补株构建成功,将其命名为269ΔSTM1827R。
2.2 菌株生长曲线的测定
对野生株WT269、缺失株269ΔSTM1827、回补株269ΔSTM1827R培养不同时间点OD600nm进行测定,绘制生长曲线。结果如图2所示,野生株WT269与缺失株269ΔSTM1827的生长速度基本一致,没有明显差异,回补株与野生株的生长速度也没有差异。
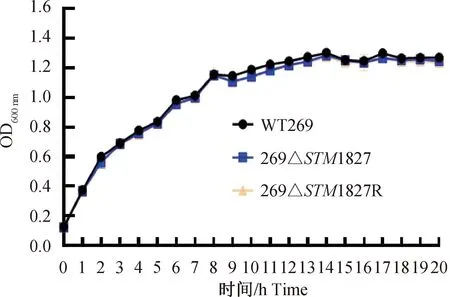
图2 各菌株的生长曲线Fig.2 Growth curve of each strain
2.3 菌株c-di-GMP含量的测定
对野生株WT269、缺失株269ΔSTM1827、回补株269ΔSTM1827R的c-di-GMP含量进行测定。结果如图3所示,269ΔSTM1827中c-di-GMP的含量比野生株WT269中的c-di-GMP含量增加了33.16%,显著升高(P<0.05)。回补株胞内c-di-GMP的含量与野生株相比没有差异(P>0.05)。
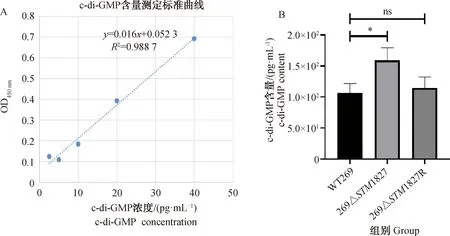
A. c-di-GMP标准曲线;B. c-di-GMP含量。ns. P>0.05, *. P<0.05A. c-di-GMP standard curve; B. c-di-GMP content. ns. P>0.05, *. P<0.05图3 各菌株的c-di-GMP含量Fig.3 C-di-GMP content of each strain
2.4 菌株生物被膜形成能力检测
通过结晶紫染色法测定细菌生物被膜形成能力。结果如图4所示,与野生株WT269相比,缺失株269ΔSTM1827的生物被膜形成能力显著增强,上调2.19倍,回补株269ΔSTM1827R与野生株相比没有差异(P>0.05)。
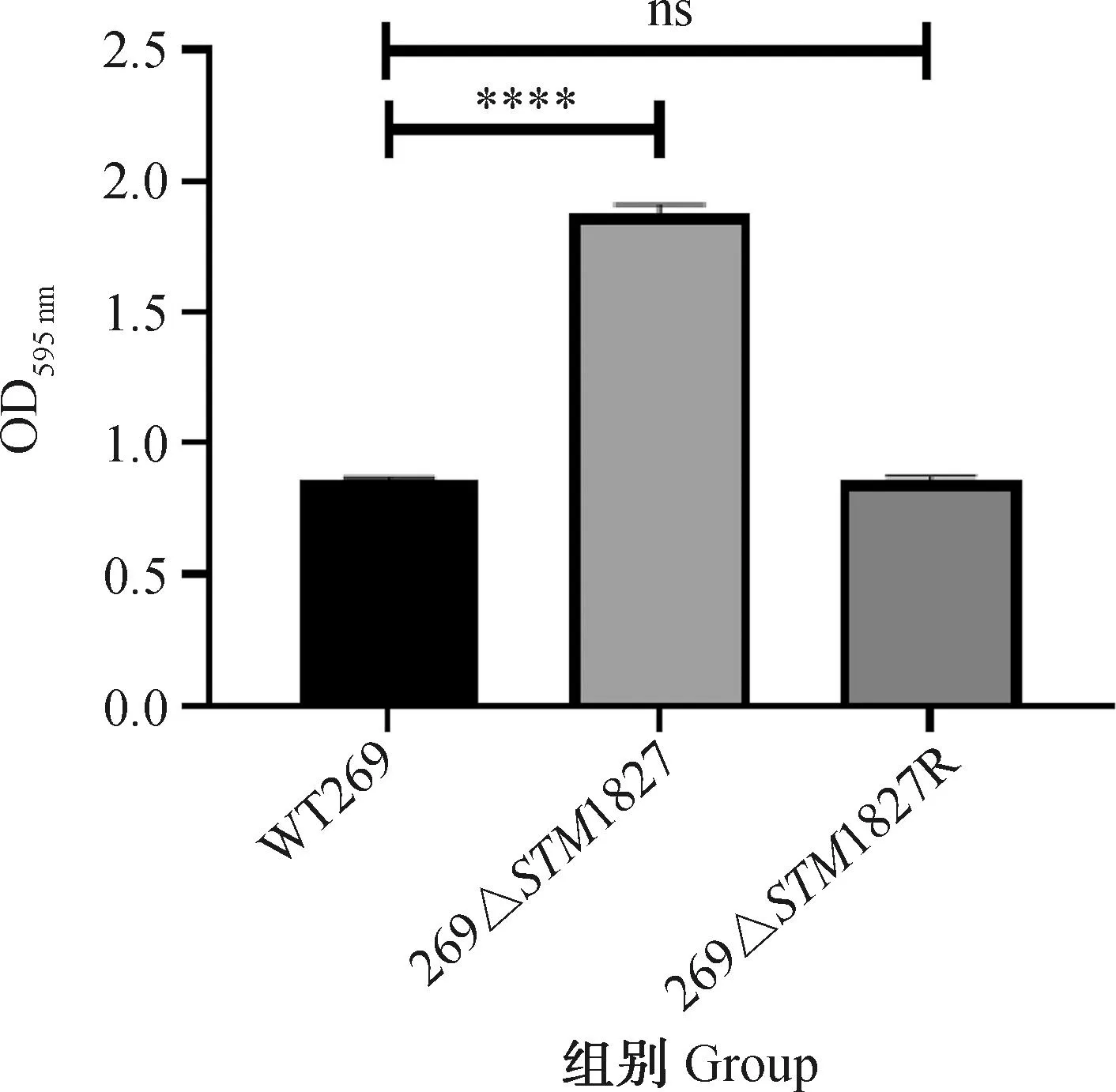
ns. P>0.05,****. P<0.000 1图4 生物被膜形成Fig.4 Biofilm formation
2.5 菌株多细胞行为表型检测
使用考马斯亮蓝与刚果红平板对菌株的多细胞行为表型进行鉴定。结果如图5所示,与野生株WT269相比,269ΔSTM1827菌株在考马斯亮蓝和刚果红平板上的菌落表面更加粗糙,褶皱更加明显,颜色也相较野生株更加深。
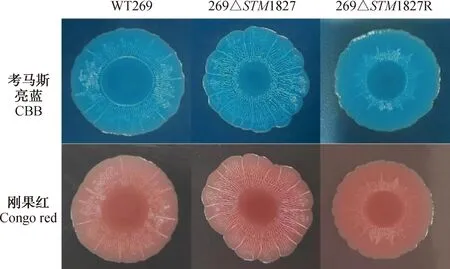
图5 多细胞行为表型Fig.5 Multicellular behavioral phenotypes
2.6 菌株生物被膜相关胞外基质成分的检测
对菌株胞外基质成分进行定量检测,结果如图6所示。缺失株269ΔSTM1827胞外蛋白质与胞外DNA含量与野生株WT269相比没有明显变化(P>0.05),而269ΔSTM1827菌株胞外多糖成分显著增加(P<0.000 1),比亲本株增加了1.3倍。回补株的胞外基质成分含量与野生株相比没有差异(P>0.05)。
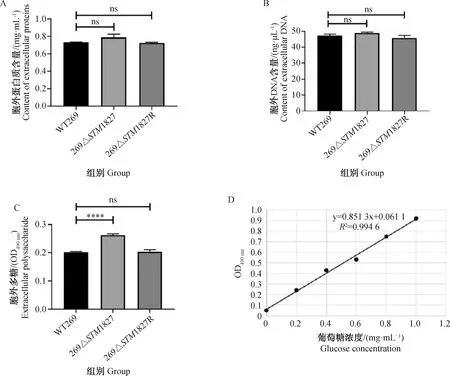
A.胞外蛋白质;B. 胞外DNA;C. 胞外多糖;D. 葡萄糖标准曲线。ns. P>0.05,****. P<0.000 1A. Extracellular proteins; B. Extracellular DNA; C. Extracellular polysaccharide; D. Glucose standard curve. ns. P>0.05,****. P<0.000 1图6 胞外基质成分定量Fig.6 Extracellular matrix component quantification
2.7 菌株运动性检测
观察菌株在0.5%半固体琼脂板上形成的运动圈,结果如图7所示。缺失株269ΔSTM1827在6 h时菌株的运动直径明显小于野生株WT269,下降13%。回补株的细菌运动直径与野生株相比差异不显著(P>0.05)。
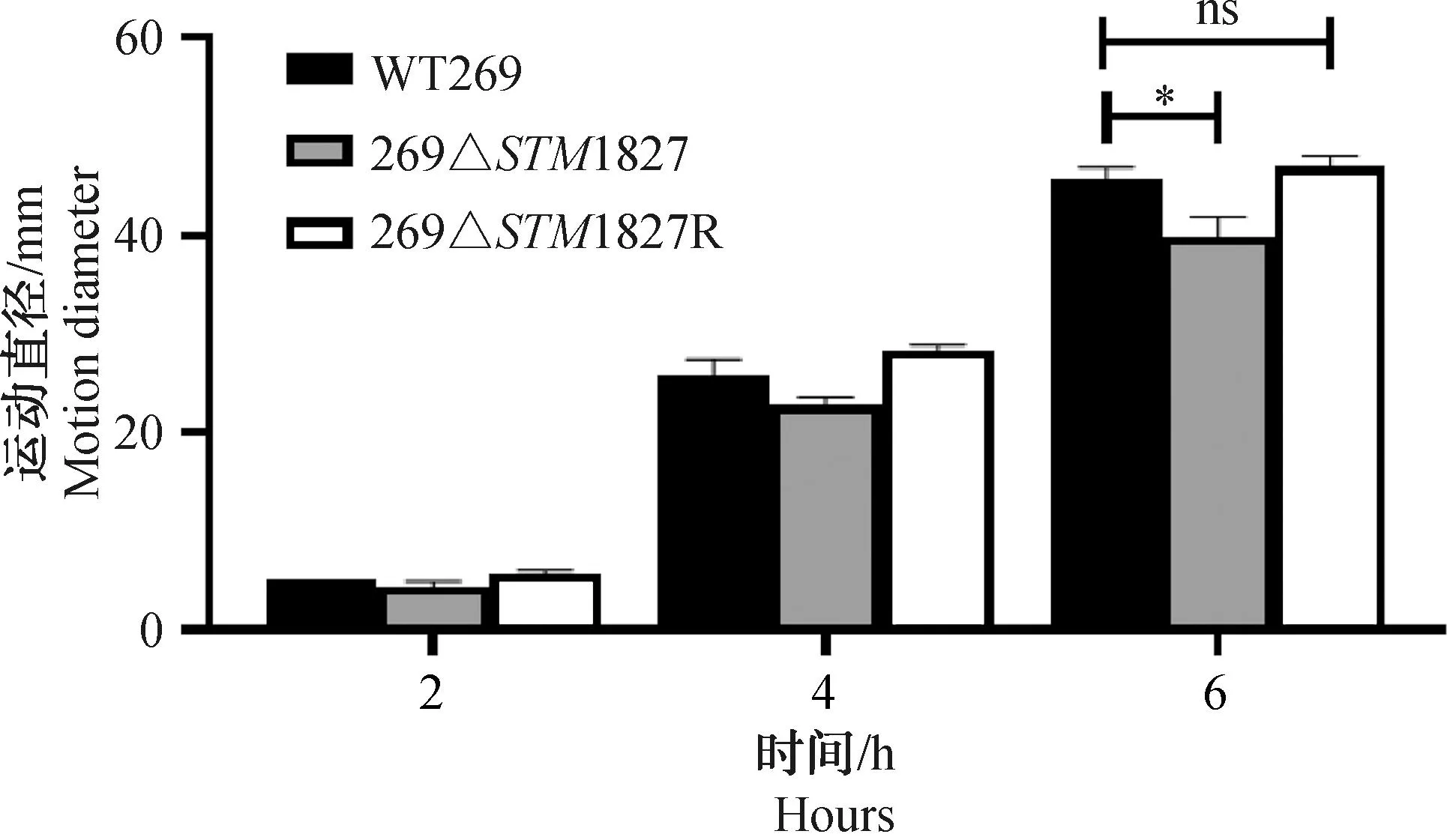
ns. P>0.05, *. P<0.05图7 运动性检测Fig.7 Motility assays
2.8 实时荧光定量PCR检测相关基因转录水平
荧光定量检测结果如图8所示。与野生株WT269相比,缺失株269ΔSTM1827胞外多糖合成基因(BcsA、BcsB)、胞外蛋白质合成基因(CsgA)的表达量都有增加,其中以BcsA和BcsB基因表达最为显著(P<0.000 1),分别上调19倍与11倍,与前面胞外基质定量成分中主要是胞外多糖含量增加的结果一致;同时运动相关基因(FliA、FlhC)的表达量与野生株相比显著下降,分别下降了20%与13%。回补株相关基因转录水平与野生株相比差异不显著(P>0.05)。
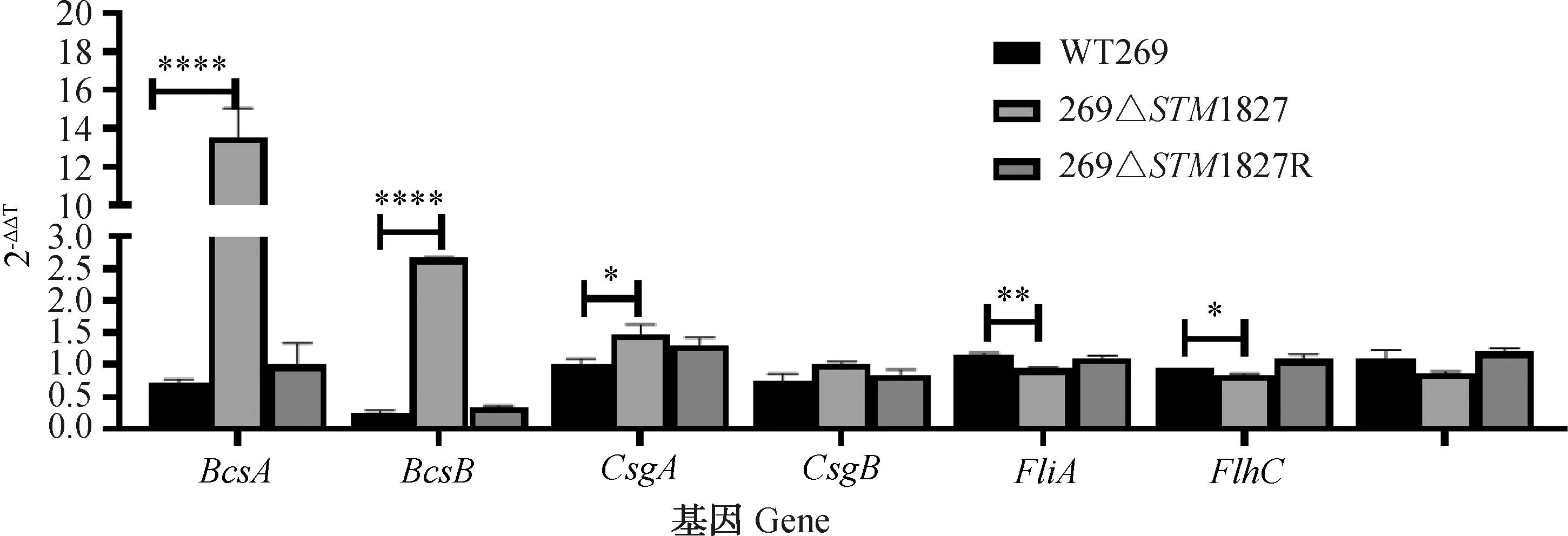
*. P<0.05,**. P<0.01,****. P<0.000 1图8 生物被膜与运动性相关基因转录水平Fig.8 Transcription levels of biofilm and motility related genes
2.9 环境应激抵抗力的检测
对在不同环境应激条件下菌株的抵抗能力进行检测,结果如图9所示。在5 mmol·L-1H2O2的条件下培养,与野生株WT269、回补株269ΔSTM1827R相比,缺失株269ΔSTM1827在5 h后细菌的生长速度显著加快(P<0.01)(图9A);在SDS消毒剂条件下培养,与野生株WT269、回补株269ΔSTM1827R相比,缺失株269ΔSTM1827在2 h后细菌的生长速度下降程度明显较慢(P<0.05)(图9B)。
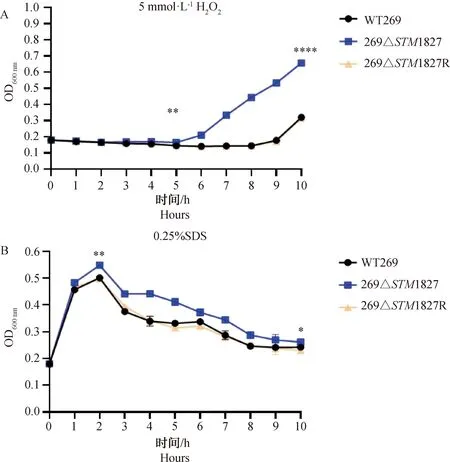
A.氧化应激; B. 消毒剂应激。*. P<0.05,**. P<0.01,****. P<0.000 1A. Oxidative stress;B. Disinfectant stress. *. P<0.05,**. P<0.01,****. P<0.000 1图9 各菌株对环境应激抵抗力的测定Fig.9 Determination of resistance to environmental stress for each strain
3 讨 论
鼠伤寒沙门菌是一种重要的人畜共患病原菌,环境适应性较强,可以通过在不利环境下产生生物被膜,从而产生较强的耐药性及对不利环境的抗性[23-25],还可以通过污染的食物和饮水引起人类和动物患病,造成广泛流行,这给鼠伤寒沙门菌病的防控带来很大的挑战。环二鸟苷酸(c-di-GMP)影响细菌生物被膜形成对细菌的适应性起到十分重要的作用。但是STM1827作为降解c-di-GMP的假定基因,其在鼠伤寒沙门菌生物被膜的形成和适应性方面的研究还比较缺乏,因此,本研究以STM1827为研究对象,通过基因同源重组的方法成功构建了STM1827基因缺失株,为了检测该基因在鼠伤寒沙门菌中的生物学特性,进行了生长曲线鉴定,结果发现缺失了STM1827之后并没有影响菌株的生长速率,说明STM1827对鼠伤寒沙门菌的生长特性不产生影响。
c-di-GMP分别由GGDEF结构域和EDL结构域负责合成和降解,根据实验室前期研究发现有20个基因可能参与了生物被膜的形成,其中STM1827作为EAL假定基因被发现,为了进一步确定STM1827是否对c-di-GMP产生调控作用,本研究进一步检测了c-di-GMP含量,结果发现当STM1827编码基因缺失后,细菌胞内c-di-GMP的含量升高,说明STM1827发挥了磷酸二酯酶的作用,可以降解c-di-GMP,进而调控c-di-GMP在菌株内的含量。
细菌内c-di-GMP是生物被膜形成的一个重要调控因素。一般高浓度的c-di-GMP促进细菌生物被膜的形成,低浓度的c-di-GMP抑制细菌生物被膜的形成[17]。因此本研究进一步检测了STM1827相关菌株的生物被膜形成能力,结果发现当缺失STM1827之后生物形成能力增强,与此结果一致的是,在刚果红和考马斯亮蓝平板上的菌落呈现出更加粗糙的多细胞行为表型,说明产生了更多的胞外多糖等胞外物质。以上结果与降解c-di-GMP基因的相关结果符合[22]。说明在鼠伤寒沙门菌中,STM1827参与c-di-GMP水平的降解过程,且因此抑制细菌生物被膜的形成。
为了进一步揭示STM1827在鼠伤寒沙门菌生物被膜产生中的调控机制,本研究对不同STM1827表达水平菌株生物被膜相关的胞外物质胞外多糖、胞外蛋白质、胞外DNA进行了检测[26-27]。发现,STM1827主要调控生物被膜相关胞外基质中的胞外多糖,当STM1827基因缺失后,菌株的胞外多糖含量增加,这与上述的多细胞行为检测结果相符合。与本研究发现一致的是在生物被膜形成过程中,c-di-GMP作为第二信使,可以调控细菌胞外基质成分的生成进而影响生物被膜的形成[28]。在铜绿假单胞菌中,鸟苷酸环化酶PelD通过正向调控细菌胞外多糖的合成,促进细菌生物被膜的形成[29]。这说明STM1827是通过促进胞外多糖的产生促进生物被膜的形成。且与以上结果相一致的是在基因水平上,当STM1827缺失之后BcsA、BcsB表达量增加,而这两个基因是编码胞外多糖的主要基因[30]。因此以上结果说明在鼠伤寒沙门菌中,STM1827通过抑制基因BcsA、BcsB的表达抑制胞外多糖合成,进而抑制生物被膜形成。
细菌运动性对生物被膜的形成十分重要,在生物被膜形成早期细菌通过运动使细菌找到合适的定植位点,同时增加细菌接触物体表面的机会[31]。之后细菌会由运动状态转变为静止状态并形成生物被膜[16],本研究发现,当STM1827基因缺失后,菌株的运动能力明显呈现抑制状态,这与之前的报道相符合,如发现在铜绿假单胞菌中,高水平的c-di-GMP抑制菌体的运动性[32]。与此同时在基因水平上,与运动直接相关的鞭毛合成基因FliA、FlhC的转录水平在STM1827基因缺失后明显下降。表明STM1827可以通过促进鞭毛基因FliA、FlhC表达促进细菌运动性,从而不利于生物被膜的形成。
生物被膜的形成有利于细菌抵抗外界不利环境的压力,从而增强其生存能力[33-34]。SDS消毒剂常用于环境灭菌,其次氧化应激是哺乳动物细胞用作快速消除细菌病原体的抗菌武器,因此为了揭示STM1827在菌株适应性方面是否存在调控作用,本研究进一步进行了不同STM1827表达水平菌株在消毒剂和过氧化氢下的生长特性研究,发现与野生株相比,当缺失STM1827基因缺失后,菌株在氧胁迫和SDS消毒剂胁迫条件下的生存能力增强。这与单增李斯特菌中生物被膜形成能力增强后,细菌在氧胁迫和酸胁迫条件下的适应性能力增强的报道相符合[35-36]。表明STM1827可以通过抑制生物被膜的形成进而抑制鼠伤寒沙门菌在H2O2和消毒剂环境下的适应性。
4 结 论
本研究以c-di-GMP通路基因STM1827为研究对象,利用Red同源重组技术构建基因缺失株269ΔSTM1827,对其进行在菌株c-di-GMP含量、生物被膜形成能力及适应性方面的研究。结果表明,STM1827基因缺失不影响菌株的生长特性,但可以升高c-di-GMP水平、增强生物被膜形成能力、促进胞外多糖产生、抑制运动性和增强鼠伤寒沙门菌在氧胁迫、SDS消毒剂胁迫下的适应性。综上所述,在鼠伤寒沙门菌中,STM1827作为降解c-di-GMP水平基因,参与c-di-GMP信号分子的代谢途径,并在鼠伤寒沙门菌生物被膜的形成和适应性方面发挥着重要作用。本研究进一步完善了c-di-GMP对鼠伤寒沙门菌生物被膜形成的调控网络,同时为鼠伤寒沙门菌防控新靶标的筛选和新策略的开发奠定理论基础。
