Snail1对牛脂肪细胞增殖分化影响及作用机制的研究
2024-01-10张文涛刘晨阳朱炳霖姚宇航
张文涛,刘晨阳,朱炳霖,柳 丽,田 媛,姚宇航,成 功*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.国家肉牛改良中心,杨凌 712100)
肉牛肌内脂肪含量与牛肉的风味、多汁性和嫩度密切相关[1-2]。肌内脂肪含量是衡量牛肉品质等级的重要指标之一[3]。肌内脂肪的形成与脂肪细胞的增殖和分化密切相关,而脂肪细胞增殖分化的过程本质上是基因表达模式的改变,受到了一系列转录因子的协同调控[4-5]。然而,目前关于肉牛脂肪沉积调控的研究仍处于起步阶段,相关功能基因及其转录调控机制有待进一步挖掘和研究[1,6]。Snail1属于锌指转录因子超家族,它是中胚层形成的关键基因。Snail家族成员编码转录抑制子,通过结合下游基因启动子区E-box(CAGGTG)位点参与基因表达调控[7-8]。前人研究表明,Snail1在上皮-间充质转化、免疫调节和细胞干性维持等方面均具有广泛的生物学功能[9-12]。此后大量研究也表明,Snail1在癌细胞的侵袭、迁移和增殖过程同样发挥了重要作用[13-14]。近年来研究发现,Snail1也参与了脂肪细胞的分化调控[15]。Snail1可通过结合人脂联素(Adiponectin,ADPN)启动子区E-box元件,进而抑制Adiponectin表达[16]。同时,Snail1可通过抑制3T3-L1细胞过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT增强子结合蛋白α(CEBP/α)的表达来抑制脂肪细胞分化,染色质免疫沉淀试验等进一步证实了Snail1通过直接结合PPARγ启动子区E-box元件来抑制PPARγ的转录活性[16]。有研究表明,Wnt-GSK3 β信号通路可通过磷酸化修饰调控Snail1的蛋白水平,进而参与了细胞增殖调控[17-19]。然而,目前关于Snail1在牛脂肪细胞增殖和分化中的作用及其靶基因和信号通路仍未知,有待进一步研究。
1 材料与方法
1.1 主要材料
本试验所用牛前体脂肪细胞通过酶消化法从肾周脂肪组织分离,具体方法参考先前文献[20]。脂肪组织采自西北农林科技大学国家肉牛改良中心秦川肉牛良繁场秦川牛新生牛。
1.2 主要仪器
CO2细胞培养箱(Thermo Fisher);实时荧光定量PCR仪(Biorad);倒置荧光显微镜(Olympus);活细胞工作站(Biotek);化学发光成像系统(Biorad);流式细胞仪(BD);多功能酶标仪(TECAN)。
1.3 主要试剂
胎牛血清(FBS, PAN);细胞周期染色试剂盒(联科生物);Cell Counting Kit-8(同仁生物);Cell-LightTMEdU Apollo567 In Vitro Kit(广州锐博);脂肪细胞分化诱导I液(每100 mL:IBMX 300 μL, 0.5 mmol·L-1; 胰岛素1 mL, 2 μmol·L-1; 地塞米松10 μL, 1 μmol·L-1; 罗格列酮7.8 μL, 1 μmol·L-1);脂肪细胞分化诱导II液(每100 mL:胰岛素1 mL,2 μmol·L-1);PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa);TB Green Premix Ex TaqTMII(Tli RNaseH Plus,TaKaRa);LipofectamineTM3000试剂盒(ThermoFisher)。
1.4 方法
1.4.1 腺病毒包装及转染Snail1过表达腺病毒(Ad-Snail1)及其空载对照(Ad-NC)由百恩维生物科技有限公司(深圳)包装完成。腺病毒滴度为1.02×1011PFU·mL-1。腺病毒侵染试验具体参照先前文献[21]。
1.4.2 流式细胞术 培养牛前体脂肪细胞汇合度达到40%~50%时,利用Snail1过表达腺病毒按照MOI=22 侵染细胞,每组生物重复3次。细胞侵染48 h后,消化并收集细胞,按照细胞周期染色试剂盒说明书(联科生物)进行处理,流式细胞仪(BD FACSAriaTMIII,BD)上机对牛脂肪细胞的细胞周期进行分析。
1.4.3 CCK-8细胞增殖试验 将牛脂肪细胞接种于48孔板,每孔4 000个细胞。分别用Ad-NC、Ad-Snail1处理24、48、72 h后,按照CCK-8说明书(Cell Counting Kit-8,同仁生物)操作,于450 nm处测定吸光度(Infinite M200PRO,TECAN)。
1.4.4 EDU染色 将牛前脂肪细胞接种到12孔板培养,直到汇合度达到40%~50%进行腺病毒侵染,每组生物学重复3次。细胞侵染48 h后,按照EdU染色试剂盒(Cell-LightTMEdU Apollo567 In Vitro Kit,广州锐博)进行染色,检测细胞增殖情况。
1.4.5 牛前脂肪细胞的分化 将牛前脂肪细胞接种于6孔板中,置于37 ℃下,5% CO2培养箱中(Thermo Fisher)培养至融合度达80%时进行Ad-NC、Ad-Snail1腺病毒侵染。侵染48 h后,细胞中加入诱导I液进行诱导分化。诱导I液处理2 d后,更换诱导II液进行分化维持,之后每2 d更换一次诱导II液。
1.4.6 油红O染色 诱导分化第6天的牛脂肪细胞经PBS润洗3次,4%多聚甲醛室温固定30 min。然后用PBS冲洗3次,1%油红O工作液避光孵育30 min。之后用PBS多次冲洗细胞,最后在倒置荧光显微镜下拍照。
1.4.7 甘油三酯测定 诱导分化第6天的牛脂肪细胞加入胰酶消化,然后加入等体积10% FBS培养液终止消化,转移至离心管,1 000 r·min-1离心5 min,弃上清,加入细胞裂解液,混合后静置10 min。将180 μL的上清液转移到新的离心管中,70 ℃加热10 min,然后2 000 r·min-1离心5 min取上清,配制标准品作标准曲线。在96孔板中加入工作液190 μL和10 μL上清样品,避光37 ℃孵育10~15 min,利用酶标仪550 nm波长进行甘油三酯测定。
1.4.8 RNA逆转录及实时定量PCR分析 采用Trizol法提取牛脂肪细胞总RNA,于-80 ℃保存。按照TaKaRa逆转录试剂盒及SYBR®Primix Ex TaqTMⅡ试剂盒(TaKaRa)说明书进行RNA逆转录和实时荧光定量PCR。
1.4.9 蛋白质印迹 用于增殖和分化检测的牛脂肪细胞经预冷的PBS冲洗3次后加入预冷的RIPA和蛋白酶抑制剂,冰上孵育15 min以裂解细胞。裂解的细胞12 000 r·min-1, 4 ℃,离心10 min,分离取上清液,通过BCA法对提取的蛋白进行定量。在提取的蛋白中加入5×蛋白上样缓冲液,然后100 ℃煮沸10 min,-80 ℃保存备用。Western blot试验蛋白上样量为20 μg。用于Western blot分析的抗体概要信息列于表1。
表1 抗体信息Table 1 Antibody information
1.4.10 转录组测序 将牛脂肪细胞接种于6孔板中,用Ad-NC、Ad-Snail1侵染48 h后进行成脂诱导分化。收集分化第6天细胞并送至广州基迪奥生物技术公司进行Illumina HiSeq2000 RNA-seq测序。利用Omicshare生物信息学云平台(https://www.omicshare.com/)对测序数据进行分析,按照|Fold change|≥1.5、FDR<0.05标准进行差异表达基因(DEGs)筛选。利用Omicshare在线工具对差异表达基因进行KEGG通路富集分析。利用String在线工具和Cytoscape软件构建目标基因集的蛋白相互作用(PPI)网络。在线工具MEME软件包中FIMO(https://meme-suite.org/meme/tools/fimo)对牛注释基因起始上游2 000 bp,下游100 bp进行Snail1潜在的E-box结合位点分析,联合转录组测序DEGs筛选Snail1蛋白潜在结合靶基因。
1.4.11 荧光素酶报告分析 pFLAG-Snail1过表达载体和SFRP2启动子区报告载体pSFRP2-luc+均由北京生工合成并克隆。将HEK293A细胞接种于48孔细胞培养板。当细胞融合度达到60%时,按照LipofectamineTM3000试剂盒(ThermoFisher)操作步骤将pFLAG-Snail1(0、0.25、0.5、1.0 μg)+ pSFRP2-luc+或pbasic-luc+质粒进行共转染,每组3个生物学重复,海肾荧光素酶质粒pRL-TK作为内参校正。转染36 h后,通过酶标仪进行双荧光素酶活性检测(Dual-Glo Luciferase Assay System,Promega)。
2 结 果
2.1 Snail1腺病毒侵染及过表达效率检测
将Ad-Snail1腺病毒以最佳感染复数MOI=22侵染牛前体脂肪细胞,检测其过表达效率。通过对照组pEGFP-N1质粒转染组绿色荧光蛋白检测发现,腺病毒显著提高了外源基因转染效率(图1A)。实时荧光定量PCR和Western Blot结果表明,Ad-Snail1腺病毒能显著上调细胞中Snail1基因的表达。与对照组相比,Snail1基因mRNA平均表达量提高了255.76倍(图1B,P<0.01),蛋白表达量较对照组明显提高(图1C)。结果表明,Ad-Snail1腺病毒过表达效果良好,可进行下一步的试验。

A. pEGFP-N1质粒,Ad-NC、Ad-Snail1转染/侵染牛前体脂肪细胞48 h荧光检测(标尺:200 μm);B. qRT-PCR检测Snail1基因mRNA表达水平;C. Western blot检测Snail1蛋白过表达效率。*.P<0.05;**.P<0.01,下同A. Fluorescent detection of pEGFP-N1 plasmid, Ad-NC, and Ad-Snail1 transfection/infection into cattle preadipocytes for 48 hours(bar: 200 μm); B. Detection of Snail1 mRNA level by qRT-PCR; C. Western blot analysis to detect the overexpression efficiency of Snail1 protein. *. P<0.05;**. P<0.01, the same as below图1 Snail1基因过表达效率检测Fig.1 Snail1 gene overexpression efficiency detection
2.2 Snail1抑制牛前脂肪细胞增殖
CCK-8检测结果表明,与对照组(NC)相比,Snail1过表达48、72、96 h后,细胞数量明显减少(P<0.05),说明Snail1抑制了牛前体脂肪细胞的增殖过程(图2A)。EdU染色结果显示,Snail1过表达后减少了EdU阳性细胞数量(P<0.05), 表明DNA复制受到抑制(图2B)。流式细胞术检测结果发现,Snail1过表达显著上调了G0/G1细胞数量(P<0.05),下调G2/M期细胞数量(P<0.05),S期细胞呈现一定下降趋势。上述结果表明,Snail1过表达引起G1/S期阻滞,抑制细胞增殖(图2C)。进一步,通过实时荧光定量PCR和Western Blot对增殖相关标志基因与蛋白检测分析发现,Snail1过表达抑制了细胞周期相关基因(CCNB1,CCND2)的mRNA(P<0.05)和蛋白的表达(图2D)。综上所述,这些结果表明Snail1通过下调细胞周期相关基因的表达,使得细胞G1/S期阻滞,从而抑制前脂肪细胞的增殖。
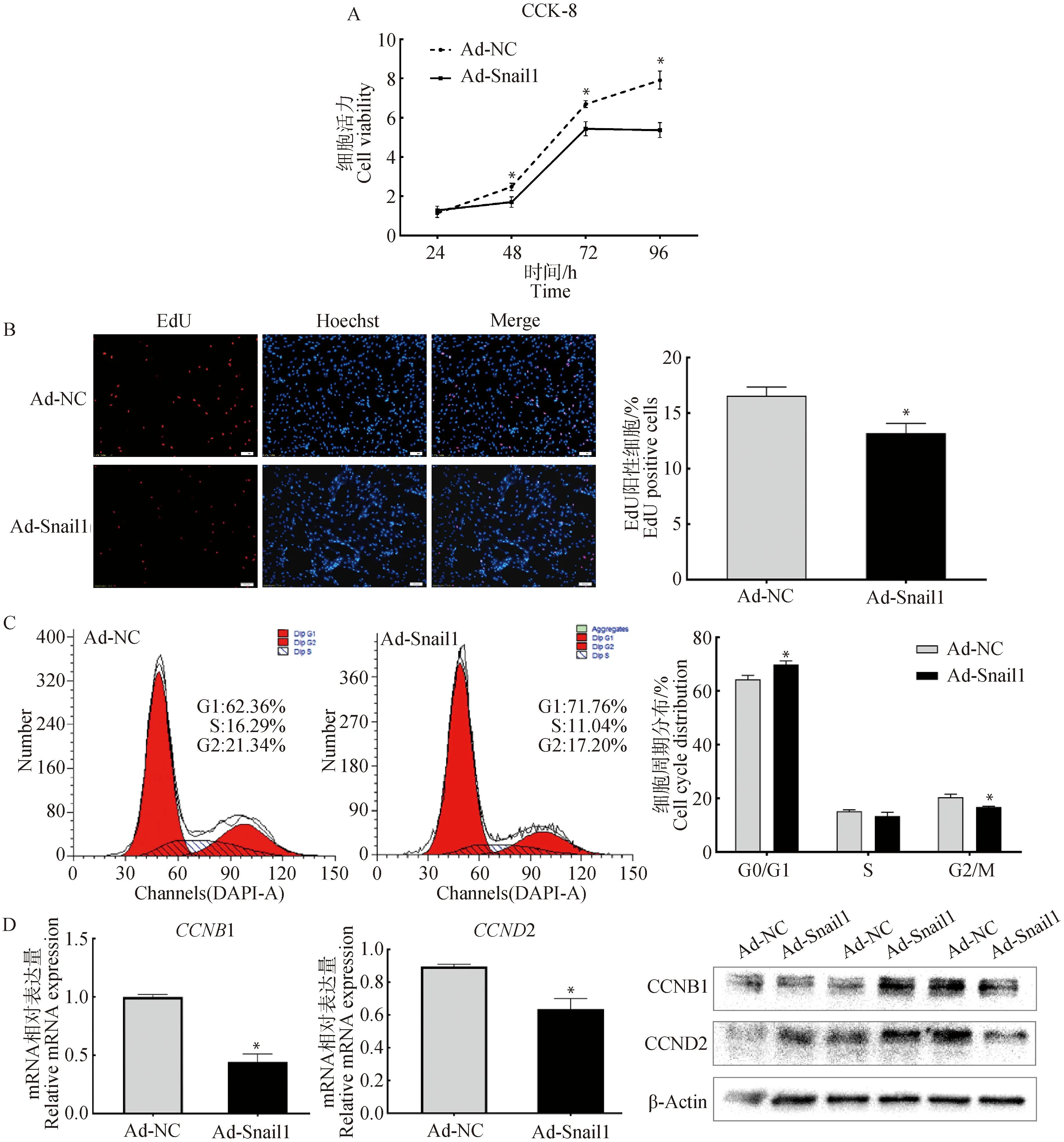
A. CCK-8检测细胞活力;B. EdU染色检测DNA复制活性: 阳性细胞EdU染色(红色),细胞核Hoechst染色(蓝色)(标尺:100 μm);C. 流式细胞术测定牛前体脂肪细胞细胞周期;D. Snail1过表达48 h后细胞周期相关基因表达检测A. Cell viability analysis by CCK-8;B. The activity of DNA replication detection by EdU staining: Positive cells were stained with EdU (Red), nucleus were stained with Hoechst (blue)(bar: 100 μm); C. The percentages of bovine preadipocytes in different cell-cycle phases were determined by flow cytometry;D. Relative expression analysis of cell cycle related genes after 48 hours of Snail1 overexpression treatment图2 Snail1抑制牛前脂肪细胞增殖Fig.2 Snail1 inhibited the proliferation of cattle preadipocytes
2.3 Snail1抑制牛前体脂肪细胞成脂分化及甘油三酯生成
为了探究Snail1对牛前体脂肪细胞成脂分化的影响,对Ad-Snail1侵染并诱导分化第6天的牛脂肪细胞进行油红O染色和甘油三酯测定。结果发现,Snail1过表达抑制了牛脂肪细胞的成脂分化和甘油三酯的生成 (图3A,3B)。qRT-PCR和Western blot分析表明,Snail1过表达后,PPARγmRNA表达量下降 (P= 0.06),但蛋白表达量无明显变化;脂肪酸结合蛋白4 (FABP4) mRNA表达量显著降低(P<0.05),蛋白水平呈现相同下降趋势;脂蛋白脂酶 (LPL) mRNA表达量显著降低;磷酸肌醇3激酶调节亚基3 (PIK3R3) mRNA表达水平极显著升高(P<0.01,图3C)。上述结果表明,Snail1过表达抑制了牛前体脂肪细胞成脂分化。
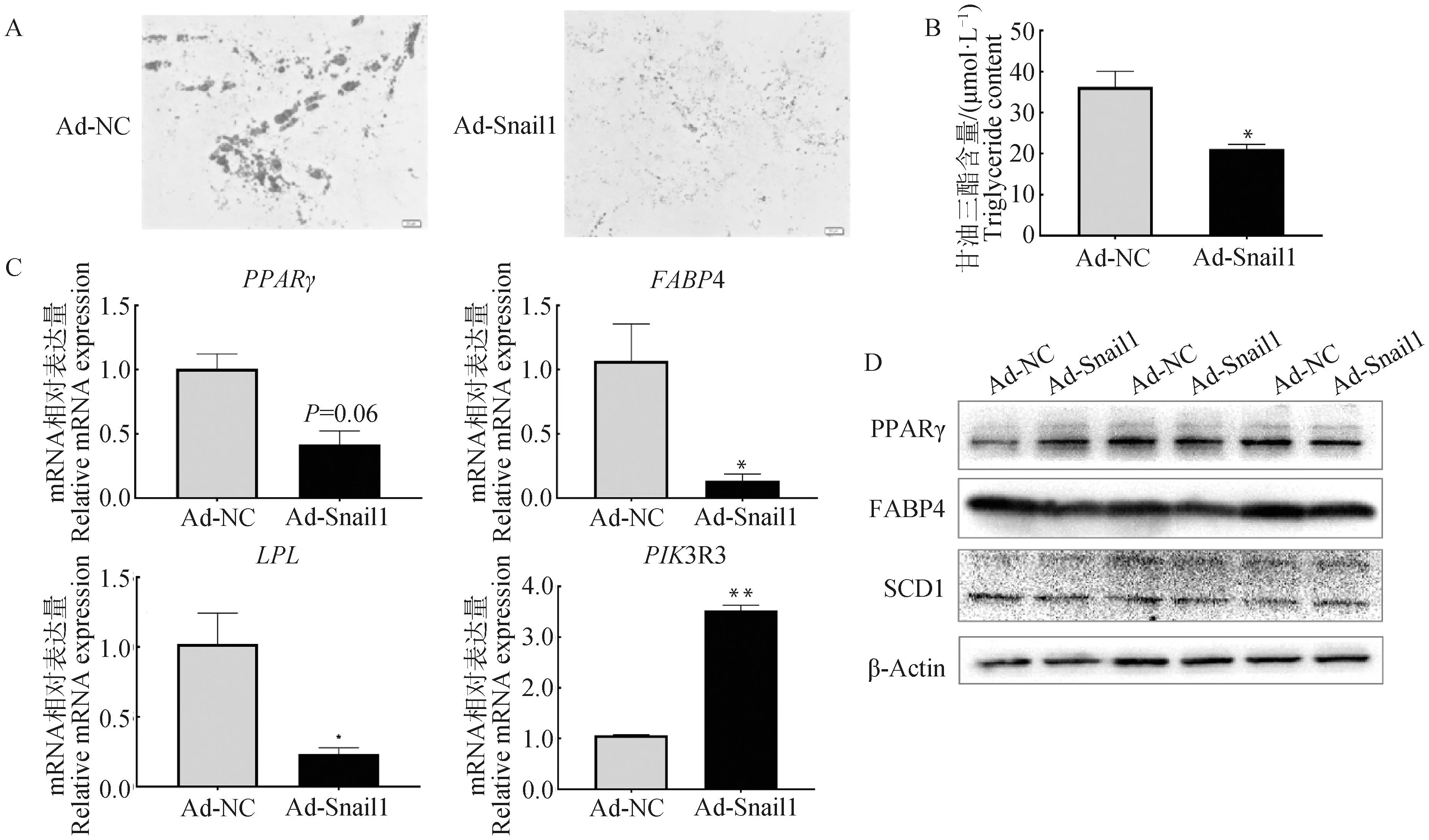
A.油红O染色结果(标尺:50 μm); B.甘油三酯测定结果; C.Snail1基因过表达且诱导分化6 d后,细胞分化相关标记基因mRNA表达水平检测;D.蛋白表达水平检测A. Oil Red O staining results(bar: 50 μm); B. Triglyceride content analysis; C. The relative mRNA expression level detection of cell differentiation-related marker genes after overexpression of Snail1 gene and induced differentiaion for 6 days; D. Protein expression level detection图3 Snail1抑制牛脂肪细胞成脂分化Fig.3 Snail1 inhibited adipogenic differentiation of cattle adipocytes
2.4 RNA-Seq探究Snail1影响成脂分化潜在作用信号通路
利用RNA-Seq对转录因子Snail1影响脂肪细胞分化的潜在作用信号通路进行分析。热图结果显示,Ad-Snail1、Ad-NC组能明显分为两组,表明测序结果良好(图4A)。与对照组相比较,Snail1基因过表达组有791个基因表达显著上调,549个基因表达显著下调 (|Fold change|≥1.5)(图4B,4C)。KEGG富集分析结果表明,差异基因主要富集在PPAR、ECM受体互作、PI3K-AKT、MAPK、尼古丁成瘾及胰岛素分泌等信号通路(图4D)。
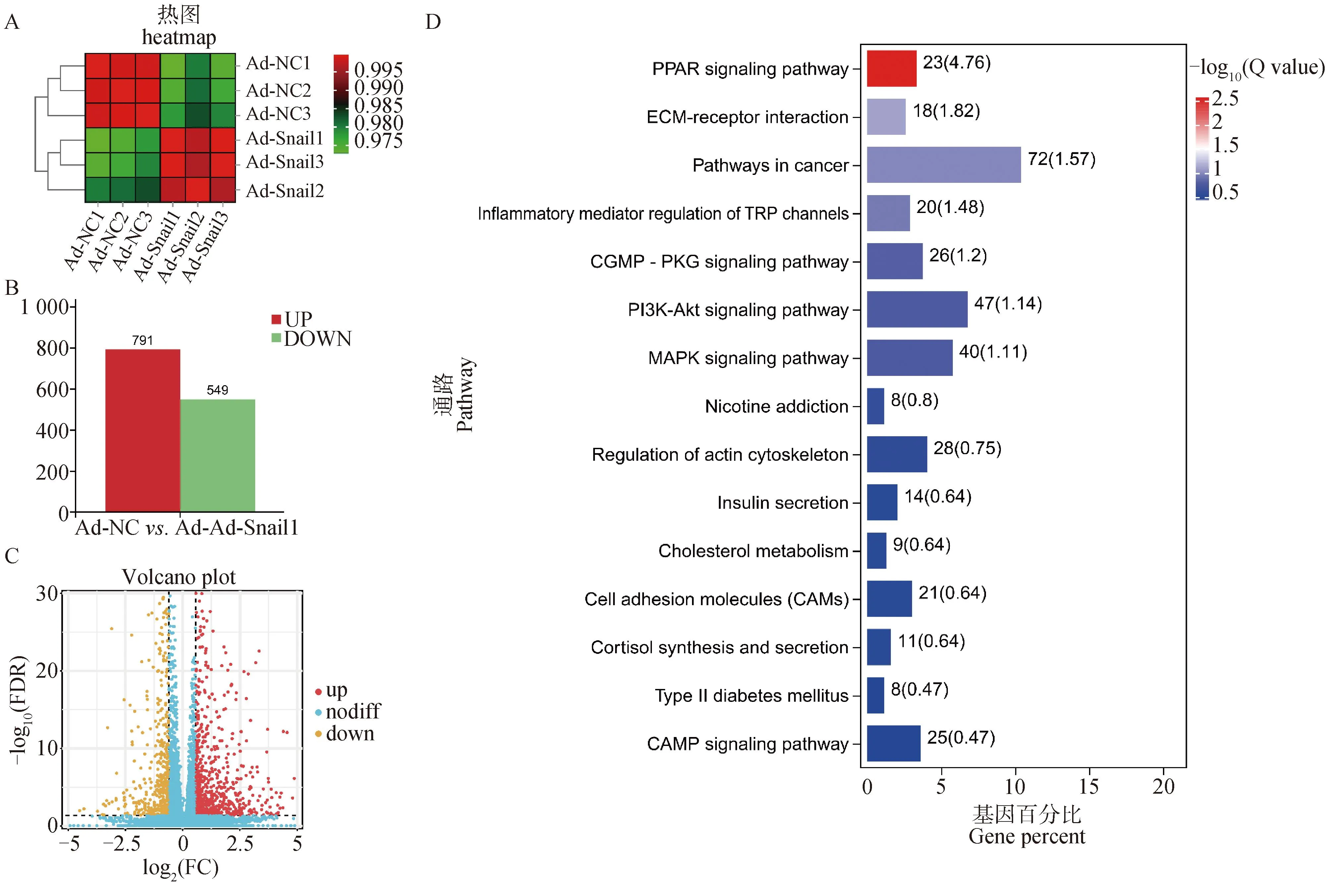
A.聚类分析;B.差异表达基因(DEGs)分析;C.差异表达基因(DEGs)火山图; D. 差异表达基因(DEGs)KEGG通路富集分析A. Cluster analysis; B. Differentially expressed gene (DEGs) analysis; C. Volcanic map of differentially expressed genes (DEGs); D. KEGG pathway enrichment analysis of DEGs图4 RNA-Seq分析Fig.4 RNA-Seq analysis
随机挑选RNA-Seq结果中8个差异基因进行qRT-PCR检测,通过qRT-PCR与RNA-Seq差异倍数相关性分析发现,RNA-Seq/qRT-PCR差异倍数相关系数为0.88(P<0.001),结果表明RNA-Seq测序结果可靠(图5A、5B)。
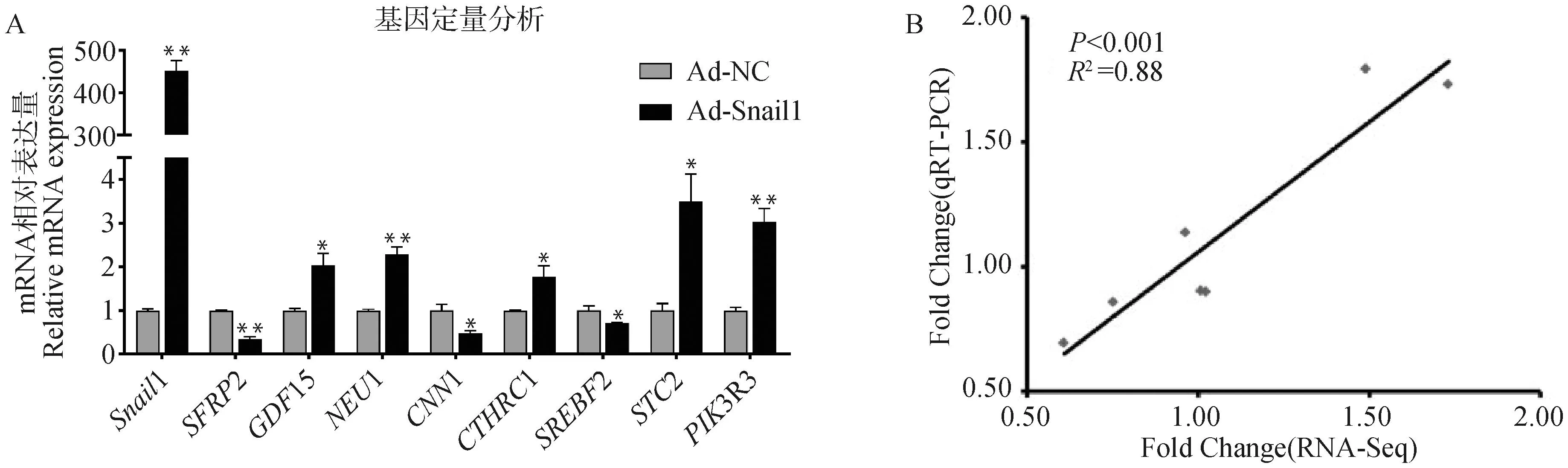
A. qRT-PCR验证;B. RNA-seq/qRT-PCR差异倍数相关性分析A. qRT-PCR verification of RNA-Seq results; B. Correlation analysis of fold changes of RNA-Seq/qRT-PCR图5 RNA-Seq测序数据验证Fig.5 Verification of RNA-Seq data
2.5 Snail1作用靶基因的预测、筛选及验证
为了获得Snail1作用关键的潜在靶基因,利用String在线工具对脂肪细胞分化相关的下调基因(|Fold change|≥2)进行蛋白互作(PPI)网络构建(图6)。进一步利用Cytoscape mCODE 对互作网络功能模块进行聚类分析,发现下调基因富集到了5个子网络集(表2)。

图6 Snail1 过表达后差异基因PPI 网络构建Fig.6 PPI network construction of DEGs after Snail1 overexpression

表2 mCODE筛选子网络Table 2 mCODE filtlers subnetworks
利用MEME包中的FIMO工具搜索牛注释基因启动子区域(上游2 000 bp,下游100 bp),筛选潜在的结合靶基因。通过Pearson相关系数对预测的靶基因和RNA-Seq数据进行分析,结合KEGG富集信号通路筛选发现,Wnt信号通路拮抗基因SFRP2基因可能是Snail1的潜在靶基因(图6,表3)。RNA-Seq 数据表明,Snail1过表达后SFRP2下调3.3倍,且该基因位于PPI互作网络中核心子网络 5的Wnt信号通路中(图6,表2)。此外,SCD、ATGL等脂肪代谢相关基因也可能是Snail1的潜在靶基因(表3)。

表3 Snail1靶基因预测及表达相关性分析Table 3 Prediction of Snail1 target gene and correlation analysis of its expression
进一步通过荧光素酶试验对Snail1潜在靶基因SFRP2进行验证。JASPAR软件分析发现,在SFRP2启动子区域发现了Snail1转录因子的5个潜在结合位点,其中包含FIMO 软件预测的388~397位置结合位点(图7A)。pFLAG-Snail1和pSFRP2-luc+共转染293 T细胞36 h后进行荧光素酶检测(pRL-TK为内参)。结果表明,SFRP2启动子活性随着Snail1表达质粒浓度的升高而被显著抑制,呈现剂量依赖效应(图7B)。阴性对照组pBasic-luc+中荧光素酶含量无明显变化(图7C)。以上结果表明,SFRP2可能是Snail1直接作用的靶基因。
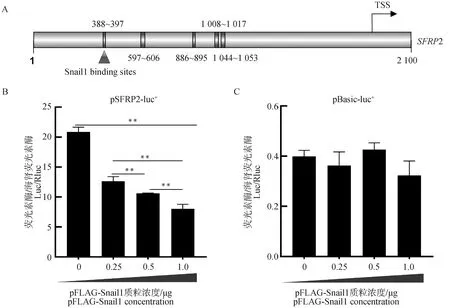
A. SFRP2启动子中Snail1的潜在结合位点示意图;B.荧光素酶检测Snail1过表达对pSFRP2-luc+启动子活性的影响;C.阴性对照pBasic-luc+质粒A.Diagram of potential Snail1 binding sites in SFRP2 promoter;B.Luciferase detection of the effect of Snail1 concentration on the activity of SFRP2 promoter;C.pBasic-luc+ plasmid was used as negative control图7 SFRP2启动子区Snail1潜在结合位点和Snail1-SFRP2靶向关系的验证Fig.7 Verification of potential Snail1 binding sites and Snail1-SFRP2 targeting relationships in SFRP2 promoter region
3 讨 论
肉牛的脂肪沉积过程表现为脂肪细胞的增殖和分化过程,其受到了一系列转录因子的协同作用。近年来研究发现,Snail1在成脂分化过程中发挥重要作用。Snail1通过结合并抑制成脂分化关键基因PPARγ的表达,抑制小鼠3T3-L1细胞的分化。Snail1基因在3T3-F442A细胞中过表达导致其分化为成熟脂肪细胞的能力丧失[22]。此外,Snail1可以通过招募组蛋白去乙酰化酶(histone deacetylase,HDACs)抑制MyoD与其靶基因的结合,进而抑制肌源性分化[23]。上述研究表明,Snail1同时参与细胞脂肪生成和成肌细胞分化的调控,是影响动物脂肪沉积和肌肉发育的重要候选功能基因。然而,在细胞增殖方面Snail1的作用仍存在争议。目前多数研究表明Snail1促进了细胞的增殖,如Snail1可诱导癌症中的EMT过程从而促进肝癌细胞的增殖[24];TRIM55可以通过UPP途径促进Snail1降解,进一步的抑制肿瘤的发展和肺癌细胞的增殖过程[25]。然而,也有研究表明Snail1对于细胞增殖具有抑制作用,如Snail1通过直接结合并抑制成脂基因Fasn表达,进而阻断由胰岛素刺激产生的产脂酶表达来抑制脂肪生成,同时抑制肝脏中的脂肪细胞增殖[26]。本研究发现,Snail1抑制了牛前脂肪细胞的增殖和分化过程。RNA-Seq、靶基因预测及荧光素酶报告试验等证实,Wnt/β-catenin信号通路关键拮抗蛋白基因SRFP2是Snail1的靶基因。Snail1可能通过靶向SRFP2介导的Wnt/β-catenin参与了脂肪细胞分化调控。
细胞增殖受到了细胞周期的调控,主要表现在DNA的复制及其随后的细胞分裂过程,其又可细分为4个不同的阶段(G0/G1期、S期、G2期和M期)[27]。本研究发现,Snail1过表达显著下调了促增殖相关基因如CCNB1、CCND2的mRNA水平和蛋白水平的表达。CCNB1是有丝分裂的主要调节因子,在调控周期蛋白依赖激酶1 (CDK1)中发挥关键作用,主要通过与CDK1形成复合物,磷酸化其底物,促进细胞周期由G2期向有丝分裂期过渡[28]。CCND2是一种D型细胞周期蛋白,与CDK4、CDK6结合参与G1/S检查点调控[29-30]。流式细胞术显示,Snail1基因过表达导致G1/S期阻滞,G2、M期细胞比例降低;EdU染色显示,过表达Snail1可显著降低复制期EdU阳性细胞比例;CCK-8结果也显示,Snail1过表达可降低细胞增殖速率。上述结果表明,Snail1基因抑制了牛前脂肪细胞增殖并导致细胞周期G1/S期阻滞。
前脂肪细胞能够在诱导剂的作用下分化为产生脂滴的成熟脂肪细胞,脂滴是成熟脂肪细胞的一个显著形态特征,其在脂肪细胞分化过程中逐渐积累[31]。本研究发现,Ad-Snail1抑制了脂肪细胞分化及脂滴的生成。通过对RNA-Seq差异基因的KEGG分析显示,差异基因主要富集在PPAR、ECM受体互作、PI3K-AKT、MAPK、尼古丁成瘾及胰岛素分泌等信号通路。PPAR信号通路是脂肪细胞分化的明星通路,该通路的下调会抑制脂肪细胞的分化过程[32];尼古丁成瘾信号通路参与了脂肪的调控,尼古丁饲喂的小鼠体重降低并伴随着脂肪细胞体积减小[33]。也有研究表明,尼古丁促进了上皮细胞向间质细胞的转化,进而促进了肿瘤的形成[34]。本研究RNA-Seq测序也证实,Snail1过表达激活了尼古丁成瘾相关信号通路基因的表达,而Snail1及尼古丁成瘾信号通路基因均在上皮细胞向间质细胞转化及癌症的发生过程中发挥重要作用。
为了进一步探究Snail1参与脂肪细胞分化的潜在分子机制,对FIMO工具预测的靶基因及 RNA-Seq等数据进行分析发现,SFRP2、AQP9、Serpine1、SCD、ATGL等为Snail1潜在靶基因。前人研究证实,Snail1可结合并靶向调节甘油三酯脂肪酶基因ATGL[35]。本研究通过荧光素酶试验表明,Wnt信号通路拮抗蛋白基因SFRP2是Snail1的潜在靶基因,而Wnt信号通路在PPI蛋白互作网络中被显著富集。Wnt/β-catenin属于经典的Wnt信号通路,主要由Wnt家族蛋白、糖原合成激酶3(GSK3)、轴突蛋白(Axin)、β-catenin和TCF/LEF家族转录因子组成。Wnt/β-catenin信号通路的激活抑制了GSK3β的磷酸化,进而抑制了C/EBPα和PPARγ的表达,抑制分化过程[36]。本研究表明,Snail1可通过结合并抑制Wnt信号通路拮抗蛋白基因SFRP2的表达,进而激活Wnt信号通路介导的成脂分化抑制作用。前人研究发现,Snail1可通过与β-catenin蛋白相互作用激活Wnt信号通路,参与调控癌细胞上皮间质转化,而Wnt信号通路的激活抑制了GSK3β活性,进一步提高了Snail1蛋白的稳定性[37]。那么可推测Wnt信号通路可能存在正反馈效应,通过“Snail1/SFRP2-Wnt/β-catenin-GSK3β”环[22],进一步维持Snail1对Wnt信号的激活参与牛脂肪发育的调控,但其分子机制仍有待进一步研究。这些发现为进一步探究Snail1调节脂肪生成的机制提供了新的思路。
4 结 论
前人对于Snail1在牛前体脂肪细胞增殖和分化中的作用尚不明确。本研究通过CCK-8、EdU、流式细胞术及油红O、甘油三酯等试验发现,Snail1抑制了牛脂肪细胞的增殖和分化过程。通过转录组测序、靶基因预测及荧光素酶等试验证实,SFRP2是Snail1的潜在靶向基因,且Snail1可能通过“Snail1/SFRP2-Wnt/β-catenin-GSK3 β”正反馈环参与牛脂肪细胞分化调控。上述研究为进一步探索Snail1在脂肪生成中的机制奠定了基础,同时为通过分子育种提高牛肌内脂肪含量提供了思路。
