猪源葡萄球菌的分离与鉴定
2024-01-10杨江宇焦海宏万金隆
杨江宇 焦海宏 肖 静 万金隆
(1 塔里木大学动物科学与技术学院,新疆阿拉尔 843300;2 兵团南疆动物疫病诊断与防控工程实验室,新疆阿拉尔 843300)
1 前言
葡萄球菌病是由葡萄球菌引起的人和动物多种疾病的总称,如皮肤的化脓性炎症、菌血症、败血症和各种内脏器官的严重感染。猪源葡萄球菌感染仔猪会引起渗出性皮炎,同时也叫“猪油皮病”,是一种仔猪急性接触性传染病。该菌常寄居于皮肤、黏膜上,当动物机体的抵抗力低下或皮肤、黏膜等破损时,病菌便乘虚而入,渗出性皮炎是该病菌引起猪发病的主要症状[1]。一旦仔猪感染葡萄球菌病,不仅会出现皮肤感染,还会影响身体的正常生长发育,严重的导致死亡。
1.1 病原
猪源葡萄球菌是微球菌科葡萄球菌属的一群革兰氏阳性球菌,是一种圆球形、无鞭毛、无荚膜、不能运动、无芽孢的病原菌,该病原菌对培养基要求不高,普通培养基上可正常生长;在含血液琼脂固体培养基上生长成表面光滑、边缘湿润、圆形无溶血环的菌落;肉汤培养基上生长成浑浊菌落;在麦康凯培养基上无法良好生长。该病原菌对环境要求不严格,具有良好的耐受力,在pH 值4.5~9.0 的环境中,均能生长,生长最适温度为37℃左右,加热至80℃30 min 才能杀灭,瞬间杀灭需要加热至100℃,该菌在干燥脓汁内可存活20~80 d[2]。
1.2 流行病学
葡萄球菌在自然环境中分布极为广泛,在空气、土壤、食物、污水、尘埃中都有存在,也是人和动物体表及上呼吸道的常驻菌。仔猪感染猪源葡萄球菌的因素很多,如饲养管理与饲养圈舍的环境、饲养工具、猪群免疫力等[3]。葡萄球菌主要危害5~10日龄的乳猪,其次是断奶仔猪,在急性期的发病率可高达100%,死亡率达70%~100%,一年四季都可能发生,但是发病最多的是在夏季和秋季温暖潮湿的季节,没有明显的地域特征,传播途径主要通过猪与猪之间的接触感染,在母猪的皮肤和耳朵等处隐藏的细菌为主要的传染源[4,5]。因为发病率和致死率极高,所以给我国规模化养猪业造成严重的经济损失[6]。
1.3 临床症状和病理变化
感染葡萄球菌的猪发病初期皮肤红肿,渗出粘稠的液体,形成结痂,有一股恶臭,呈横纹龟裂,用力将痂皮剥掉,露出红色的伤口,里面有粘稠的液体和脓性分泌物的红色创面,随着病程延长,在伤口上会形成一块块黑色纽扣状结痂[7]。病猪眼结膜苍白,眼部水肿,病变结痂揭开后可暴露鲜红色创面,创口皮肤湿润,黏膜浆性脓液,病猪体表淋巴结体积变大,并出现肿胀和出血,肝脏、肾脏、脾脏等组织肿胀,输尿管体积变大,并有细胞碎片,部分病猪肾脏淤血,肾盂内有许多化脓病灶,呈黄豆粒状。病猪胃肠空虚,部分病猪腹腔内有化脓性病灶[8]。
1.4 分离鉴定猪源葡萄球菌的目的和意义
采集阿克苏地区某猪场3 只患病猪的病料,对其进行细菌培养、形态学观察、生化试验以及药敏试验和PCR 测序,分离出猪源葡萄球菌。近年来,渗出性皮炎的危害虽然未达到严重影响生产的程度,但在某些猪场已成为一个严重问题,也已成为猪的一种常见病。该病通常呈散发性,猪一旦感染该病,其药物的治疗效果较差,病死率仍较高,导致养猪业发生严重的经济损失[9]。我国猪渗出性皮炎发病率增多已是客观存在,研究和关注该病的病原、流行病学及发病机理对其防治具有重要意义。
2 试验材料
2.1 试验动物
本试验材料来源于新疆阿克苏地区某猪场,从保育舍挑选典型病例活猪3 头。
2.2 试验仪器与试剂
GSP 9080WBE 型隔水式恒温培养箱由上海博讯实业有限公司生产,CX31 数码生物显微镜由上海尼康仪器有限公司生产,C1000 Touch PCR 仪由Bio-Rad 中国公司生产,DYY12 型电泳仪由北京六一仪器厂生产,Pico17 型高速离心机由赛默飞世尔科技有限公司生产,C1000 TouchTM 型全自动凝胶成像分析仪由Bio-Rad中国公司生产。
胰蛋白胨大豆肉汤(TSB)由Solarbio 生产,LB 琼脂由青岛高科技工业园海博生物技术有限公司生产,革兰氏染色试剂由上海生物工程有限公司生产,DL2000 Marker 由北京天根生化科技有限公司生产,细菌16S rRNA 通用引物(27F,1492R)由上海生物工程技术服务有限公司合成,细菌基因组DNA 提取试剂盒由北京天根生化科技有限公司生产,核酸染液GelvlewI 由上海生物工程技术服务有限公司生产,药敏纸片由杭州微生物试剂有限公司生产。
3 试验方法
3.1 剖检采样
无菌条件下采集病猪的心脏、肝脏、脾脏、肺脏、肾脏等组织,划线接种于培养基上培养。同时,将组织样品-80℃保存备用。
3.2 分离培养
配制TSB 固体培养基、5% LB 绵羊血平板培养基和TSB 液体培养基备用。把采集好的病料放入操作台中,做好无菌防护。把采集的病料用刀切下一块,用高温灼烧冷却后的接种环从切面直接插入病料组织中,抽出后用三线法接种于TSB 培养基和5% LB 绵羊血平板培养基上,在37℃恒温箱中培养10 h,观察第1 代培养菌在培养基上的生长情况。用革兰氏染色镜检,观察细菌的颜色、大小、形态[9],再用接种环挑取固体培养基上的菌落接种于TSB 培养基和5% LB 绵羊血平板培养基上进一步纯化培养,镜检观察第2 代培养菌。取纯化后的菌落接种于TSB 液体培养基上,通过37℃摇床增菌,然后革兰氏染色镜检,即可得到纯化的第3 代培养菌。
3.3 形态学观察
固体培养基上形态学观察,选择干净灭菌的载玻片,往载玻片上滴1 滴蒸馏水备用,用高温灭菌后的接种环在培养基上挑选生长情况良好的菌落蘸取其一半,于蒸馏水中稀释,用火焰固定法固定,然后用革兰氏染色法进行染色,结晶紫1~2 min、碘液1~3 min、酒精30~60 s、复红染液15~30 s,自然风干后用显微镜观察其颜色、形态、大小、结构。液体培养基形态学观察,取出纯化的菌液放入操作台中,选择干净的载玻片备用,用移液枪取10 μL 菌液放入载玻片上,用灭菌的接种环顺时针旋转抹开,用火焰法固定,然后用革兰氏染色法进行染色,风干后显微镜下观察,与固体培养基上的细菌进行对比。
3.4 生化试验
严格按照无菌操作,在无菌操作台上进行。准备好葡萄球菌生化试验所需要的微量生化鉴定管、山梨醇、木糖、葡萄糖蛋白胨水(VP)、尿素、葡萄糖产气、硫化氢等,将分离好的纯种菌液用移液枪取50 μL 分别接种于微量生化管中,用封口膜密封好放于37℃的恒温培养箱培养12 h,即可取出观察。VP 试验的葡萄糖蛋白胨水微量管取出后还需要先加入VP 试剂甲液3 滴,再加VP 试剂乙液1 滴,然后再放回恒温培养箱中培养4 h取出观察结果。
3.5 分子生物学鉴定
3.5.1 DNA 提取
⑴取菌液300 μL 于200 mL 离心管中,加入DNA zol 700 μL,颠倒3 次使其混匀然后静置5 min,放入离心机中12 000 rpm 离心10 min;
⑵取上清液800 μL,加入到新的2 mL 离心管中;⑶再加入500 μL 无水乙醇,颠倒混匀5 次,静置3 min,放入离心机7 500 rpm 离心3 min 弃上清液;
⑷加入800 μL 75%无水乙醇,颠倒混匀,放入离心机12 000 rpm 离心5 min 弃上清液;
⑸重复第(4)步;
⑹开盖静置使无水乙醇挥发;
⑺加入40 μL 8 mM 的NaOH,用移液枪重复稀释混匀即可得到提取的DNA;
⑻过夜保存放入4℃冰箱,长期保存放入-20℃冰箱。
3.5.2 PCR
检测16S rRNA 的扩增所需反应体系及反应条件[10],见表1、表2。

表1 PCR 反应体系

表2 PCR 反应条件
3.5.3 电泳
⑴制作凝胶:称取0.5 g 琼脂糖,倒入50 mL(1×TAE)缓冲液,放入微波炉加热2 min,待其完全溶解再次加热至清澈透明无沉淀;选择大小合适的齿梳插入胶板中卡好,备用;静待琼脂糖溶液冷却1 min 后加入5 μL 核酸染液充分混匀;倒入制胶板中,确认凝胶中无气泡或无异物,等待15~30 min 凝固后拔出梳子[11]。
⑵点样:第一个泳道加入DL2000 marker,其余泳道加PCR 产物,最后一个泳道加空白对照;
⑶把点样好的凝胶板放入DYY12 型电泳仪中30 min;
⑷电泳琼脂糖凝胶板放入C1000 TouchTM 型全自动凝胶成像分析仪进行观察;
⑸把扩增所得基因片段送测序公司进行测序。
3.5.4 测序及序列比对
把测序的基因片段,用数据库NCBI 的序列进行同源性比对。
3.6 药敏试验
采用药敏纸片扩散法进行药敏试验,严格按照无菌操作,在无菌操作台上进行。首先选好该试验所需要的药敏纸片:氧氟沙星、庆大霉素、万古霉素、环丙沙星、头孢唑啉、红霉素、克林霉素、头孢他啶、新霉素、青霉素、四环素、林可霉素[12]。选择3 个BD 培养基,用移液枪取100 μL 分离好的葡萄球菌菌液接种于BD 培养基上,然后用高温灭菌后的涂布棒均匀涂布(必须均匀涂布不然会影响试验结果),涂布均匀后,在培养基上选择4 个适当位置放上药敏纸片(放药敏纸片的时候按压一下以防脱落),放好纸片后,把培养基放入37℃恒温培养箱中培养18~24 h 取出,用游标卡尺测量抑菌圈直径即可。结果判定参照美国实验室标准委员(NCCLS)推荐的规定进行判断,即抑菌圈直径>20 mm 为极敏,在15~20 mm 之间为高敏,在10~14 mm 之间为中敏,<10 mm 为低敏,无抑菌圈为耐药[13,14]。
4 结果
4.1 剖检结果
体表观察有划水现象、呼吸急促、喘气、站立困难、精神萎靡不振、眼结膜苍白、消瘦、口鼻眼有黏液、皮肤各处有创伤结痂、皮肤外表泛红呈红斑、前肢肘关节处有许多透明小水泡,如下图1。

图1 病猪体表观察
肝脏色泽不均一、有淤血,部分肝脏颜色偏黄、部分肝脏颜色呈暗红色、质地实,切开肝脏,血液颜色偏黑红,胆囊肿大、胆汁颜色为蓝绿色,肺脏质地实而硬、颜色不均一、有大面积出血块。肺叶外缘苍白无色。心脏心包膜与心脏分离明显、心脏颜色偏灰白。脾脏上有白色结节、有水泡、颜色偏灰紫。肾脏色泽不均一、有散状出血斑、肾乳头呈灰白色、肾盂有脓性分泌物(尿酸盐沉积)。有些肠段鼓气、空虚、透明、充血,有些肠段内含有暗褐色的比较干硬的圆球状内容物,肠系膜出血严重、血管明显肿大。胃中黏液增多、有黄色液体残渣、出血严重。
4.2 分离培养及染色镜检结果
4.2.1 分离培养结果
将病料组织液接种于TSB 培养基和5%绵羊血平板培养基上培养10 h,发现TSB 培养基表面长有圆形、不透明、表面隆起、光滑、圆珠状菌落,直径1.0~2.0 mm;5%绵羊血平板培养基表面长有圆形、乳白色、针尖状菌落、稍粘、无溶血环。
4.2.2 镜检观察结果
用革兰氏染色法进行染色观察,发现菌体呈蓝紫色,菌株属于革兰氏阳性菌,其形态特征主要为双球或短链状排列或数个球状细菌串联成葡萄状,可将其初步判定为猪源葡萄球菌。
4.3 生化试验结果
生化鉴定结果见表3,7 株生化试验结果一样,均符合猪源葡萄球菌的生化特性。
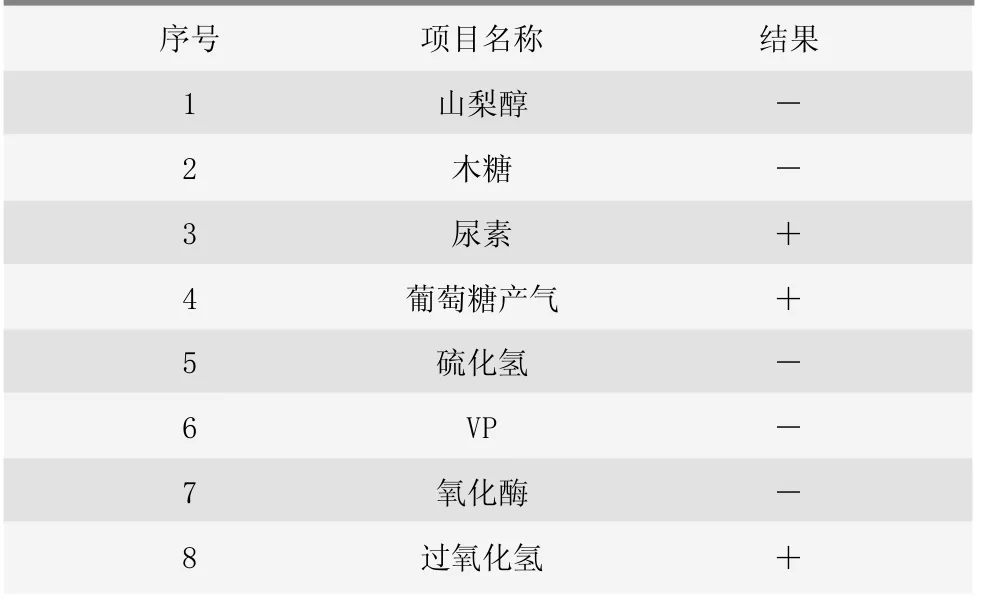
表3 生化试验结果
4.4 PCR 检测结果
用显微镜观察得到的7 个样本葡萄球菌基因组作为模板,一个空白对照,用PCR 法对16S rRNA 基因序列进行扩增,通过电泳30 min,用C1000 TouchTM 型全自动凝胶成像分析仪进行观察,该试验菌株16S rRNA基因PCR 产物的大小约为1 500 bp,与预期片段大小基本符合,而且阳性对照和阴性对照结果成立。
进一步送北京测序公司测序得到7 株细菌基因片段,用数据库NCBI 的序列进行多重比对,得出结果为分离出来的菌株DNA 与葡萄球菌的核苷酸同源性高为99.93%,由此推断本试验获得的菌株为猪源葡萄球菌。
4.5 药敏试验结果
采用药敏纸片扩散法检测分离菌株对不同抗生素药物的敏感性,试验结果如表4所示,分离菌株对抗生素氧氟沙星、环丙沙星、头孢唑啉、万古霉素、新霉素高度敏感;对青霉素、四环素、克林霉素、头孢他啶中度敏感;对庆大霉素、林可霉素、红霉素产生耐药。
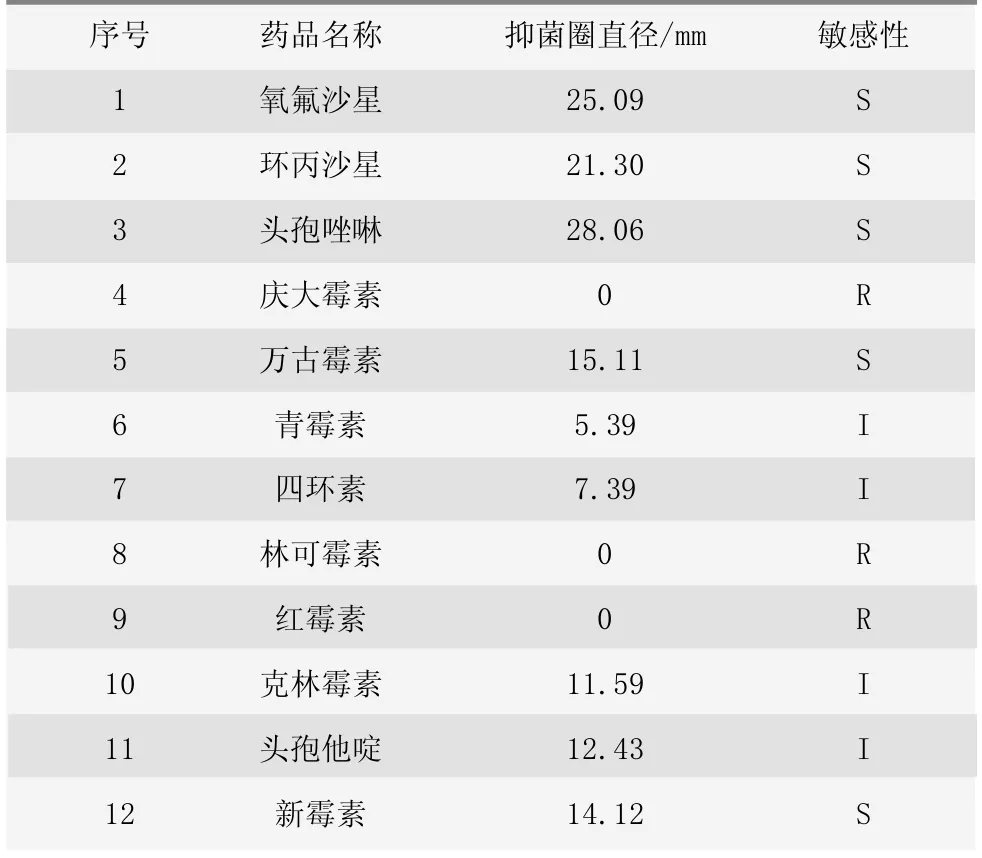
表4 分离菌株耐药性分析
5 讨论
本试验为了分离猪源葡萄球菌,从阿克苏某猪场挑选3 头疑似葡萄球菌感染的患病仔猪。通过解剖观察内脏病变情况,发现病变明显的部位主要有肠、脾脏、肝脏、肺脏和胆囊,实验室细菌分离培养及革兰氏染色,显微镜观察菌落颜色、形态、大小,初步判断分离得到葡萄球菌;然后通过生化试验鉴定和PCR 测序结果得出7 株与猪源葡萄球菌的同源性达99.93%的菌株。药敏试验显示该菌株对庆大霉素、青霉素、四环素、林可霉素、红霉素、克林霉素、头孢他啶均有耐药性,而对头孢唑啉、万古霉素、氧氟沙星、环丙沙星、新霉素表现敏感;头孢唑啉、新霉素与查找资料中标准抗菌谱结果存在差异[15],病菌应该对该2 种抗生素产生低敏和耐药性,但在试验中却对其表现高敏性。此外,其他文献报道葡萄球菌对克林霉素、庆大霉素及四环素敏感性较高,但本试验的菌株对以上3 种抗生素却产生低敏和耐药性[16]。通过了解发现,3 头病猪在猪场治疗时使用的抗生素为庆大霉素和四环素,可能是由于该原因导致病菌发生变异,对药敏试验结果造成一定影响。病猪临床症状的不明显和解剖病变结果的差异也可能是由于病猪在猪场接受治疗所引起。由此可推断该3 头患病仔猪是由葡萄球菌和其他病菌共同感染所致。
6 结论
本试验从3 头病猪料中分离出7 株猪源葡萄球菌,通过细菌分离培养、形态学观察、生化试验、PCR 检测都与猪源葡萄球菌性状一致。最后进行药敏试验,结果显示,该菌对氧氟沙星、环丙沙星、头孢唑啉、新霉素高度敏感,对青霉素、四环素、克林霉素、头孢他啶中度敏感,对庆大霉素、林可霉素、红霉素耐药。
