青藤碱配伍芍药苷协同增效抗胶原诱导性关节炎作用机制研究
2024-01-10戴宗顺彭清华
戴宗顺,张 逢,林 也,黄 红,李 鑫,彭清华*,蔡 雄*
1.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410208;2.宁乡市人民医院中医风湿免疫科,湖南 长沙 410600
类风湿关节炎(rheumatoid arthritis, RA)是一种以关节滑膜慢性病变,进行性关节软骨与骨侵蚀,最终导致关节畸形、功能障碍为临床特征的自身免疫性疾病[1]。流行病学调查显示,我国RA 患病率为0.42%,男女比例约为1∶4[2],与普通人群相比,RA 的心血管死亡风险增加50%[3]。 目前,RA 的临床治疗策略主要是抑制关节炎症反应,阻止病变进展,从而达到缓解病情,提高、维持患者生存质量的目的[4]。目前,治疗RA 的药物主要包括非甾体抗炎药、糖皮质激素、缓解病情抗风湿药(disease-modifying anti-rheumatic drug, DMARD)、靶向小分子药物(如托法替布)、生物制剂(如阿达木单抗)等。 临床一线DMARD 如甲氨蝶呤、来氟米特等,其有效性在临床使用中虽得到了广泛认可,但临床缓解率仍然偏低,且长期服用存在明显胃肠道反应、 肝肾功能损害等不良反应,1/3 以上患者因不能耐受而中断治疗;新型生物制剂费用昂贵,且可能导致恶性肿瘤、结核、严重感染等风险增加[2,5]。 如何在不增加毒副作用的基础上提高RA 治疗收益,是目前亟待解决的问题。
中医药以其多成分、多靶点、多环节整体调节缓解RA 病情,具有独特的优势[6-7]。青风藤与白芍是治疗RA 的常用中药,临床常配伍使用,而青藤碱与芍药苷分别是青风藤与白芍的主要有效成分[8-9]。 本课题组及其他研究皆证实青藤碱或芍药苷对RA 动物模型以及患者具有一定疗效[10-11],但其单独抗RA的药效作用强度均相对较弱,临床主要用于辅助治疗。 为进一步提高其治疗RA 的疗效,课题组前期研究明确了青藤碱配伍芍药苷的最佳配比剂量[12-13]。为此,本研究拟进一步明确青藤碱配伍芍药苷协同治疗RA 的疗效及其作用机制,以期为中医药配伍用药提供实验依据。
1 材料与方法
1.1 实验动物
SPF 级雌性Wistar 大鼠,体质量100~120 g,购自北京维通利华实验动物有限公司,饲养于湖南中医药大学实验动物中心,许可证号:SYXK(湘)2013-0005,动物可自由饮食和活动,温度20~26 ℃,相对湿度40%~70%,12 h 昼夜交替。 本实验经湖南中医药大学动物伦理委员会审查通过,审查号为20140406。实验过程中无动物死亡,所有操作均遵守实验动物伦理福利动物伦理。
1.2 主要试剂
青藤碱、芍药苷(西安小草植物科技公司,批号:20131115、20141020);甲氨蝶呤(上海吉至生化科技有限公司,批号:M1243390A);牛Ⅱ型胶原(bovineⅡ-type collagen, CⅡ)(美国Chondrex 公司,批号:U27038384);非完全弗氏佐剂(incomplete freund's adjuvant, IFA)(美国Sigma-Aldrich 公司,批号:W09038383);EDTA 脱钙液(福州文莱生物科技有限公司,批号:20222XM0727);肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)ELISA 试剂盒(武汉华美公司;批号:00151508、00261899);BCA 测定试剂盒(北京康为世纪公司,批号:GR100310-1);基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)抗体、基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)抗体、基质金属蛋白酶组织抑制剂-1(tissue inhibitor of matrix metalloproteinase-1, TIMP-1)抗体(美国Abcam 公司,批号:GR172655-1、P0013B、60008-1-Ig);RIPA 组织蛋白裂解液(上海碧云天生物技术有限公司,批号:SA00001-1);β-actin 抗体、羊抗小鼠-IG、超敏ECL 发光液(美国Proteintech 公司,批号:SA00001-2、B500022、085982)。
1.3 主要仪器
足肿测定仪(意大利UGO 公司,型号:Basile 37140);高分辨率小动物微型CT(美国PerkinElmer公司,型号:Quantum FX Demo);匀浆机(德国IKA公司,型号:T10 basic);多功能酶标仪(美国Thermo Fisher 公司,型号:Varioskan Flash);化学发光成像系统(美国Bio-Rad 公司,型号:Chemi Doc XRS+);电子天平(日本岛津公司,型号:ATY224)。
1.4 分组、造模、给药及取材
60 只雌性Wistar 大鼠随机分为正常组、模型组、甲氨蝶呤组、青藤碱组、芍药苷组、青藤碱配伍芍药苷组(青芍配伍组),每组10 只。 于大鼠尾根部皮内注射0.20 mL CⅡ/IFA 乳剂(含200 μg CⅡ),致敏后第7 天再次多点注射0.10 mL CⅡ/IFA 乳剂加强免疫[14]。 在造模后,每天观察大鼠关节炎发病症状,每3 天记录四肢关节炎指数评分、测量双后足肿胀容积,基于关节炎指数评分表对造模大鼠进行评分,并剔除未发病鼠,记录每只大鼠4 个足爪,评分最高分为16 分。 评分≥4 分,足肿胀容积>1.6 mL,提示造模成功[15]。 用药剂量参考课题组前期研究结果[16]。 自胶原诱导性关节炎(collagen induced arthritis, CIA)造模当天起,各组动物以1 mL/100 g 进行灌胃给药,正常组和模型组灌胃等体积蒸馏水,青藤碱组予青藤碱50 mg/kg 灌胃,芍药苷组予芍药苷120 mg/kg 灌胃,青芍配伍组予青藤碱50 mg/kg+芍药苷120 mg/kg 灌胃,每天1 次,连续30 d。 甲氨蝶呤组大鼠在CIA 造模后第1、3、7、14、21、28 天给予甲氨蝶呤1 mg/kg 灌胃。 末次给药后,次日用2%戊巴比妥纳麻醉大鼠,腹主动脉取血进行相关检测,从踝关节以上截取大鼠双后足,一部分用于放射学与组织病理学检查,另外一部分用于蛋白检测。
1.5 药效作用评价
造模后,每天观察大鼠关节炎发病症状,每3 天进行双后足肿胀容积测量、四肢关节炎指数评分及体质量称量。
1.6 放射学与组织病理学检查
治疗结束后,采用小动物CT 扫描大鼠后足,评价关节骨侵蚀程度;2%戊巴比妥纳麻醉后处死大鼠,切除后足,4%多聚甲醛固定,EDTA 脱钙,石蜡包埋、切片;HE 染色后,于光学显微镜下观察其病理学变化。采用组织病理学滑膜评分标准进行评估:关节腔间隙正常,无炎症细胞浸润,无滑膜组织增殖,无骨组织破坏为0 分;关节腔间隙轻度改变,炎症细胞少量浸润,滑膜组织轻度增殖,骨组织轻度破坏为1 分;关节腔间隙狭窄,炎症细胞浸润,滑膜组织中度增殖,骨组织中等程度破坏为2 分;关节腔间隙明显狭窄,炎症细胞大量浸润,滑膜组织大量增殖、血管翳形成,骨组织严重破坏为3 分[5,15]。
1.7 炎症细胞因子TNF-α、IL-1β 检测
腹主动脉采血,4 ℃、3 500 r/min 离心5 min(离心半径10 cm)。 取血清,按照ELISA 试剂盒说明书,检测各组大鼠血清TNF-α、IL-1β 含量。
1.8 MMP-2、MMP-9 和TIMP-1 检测
取双后足,剔除多余肌肉、筋膜,置于匀浆机内,加入液氮,破碎。 取100 mg 骨组织,加组织裂解液,冰上提取蛋白,BCA 法测定蛋白浓度。 采用20 μL的上样体系,校齐各孔的蛋白含量,进行电泳、转膜,5%脱脂奶粉封闭,MMP-2、MMP-9 和TIMP-1 抗体按照1∶1 000 稀释后孵育,4 ℃过夜,洗膜,室温孵育二抗(1∶2 000),TBST 洗膜后,超敏ECL 发光液显色,在核酸蛋白表达成像系统中进行显影成像。
1.9 统计学分析
采用SPSS 22.0 软件进行统计学分析。 计量资料用“±s”表示,多组间均数比较采用单因素方差分析,据方差齐性检验,方差齐与不齐分别采用LSD法和Games-Howell 法。 P<0.05 表示差异有统计学意义。
2 结果
2.1 青藤碱配伍芍药苷对CIA 大鼠关节炎症状的影响
在第12、15、18、21、24、27、30 天,与正常组比较,模型组足肿胀容积、关节炎指数评分增加(P<0.01),体质量降低(P<0.01);与模型组对比,甲氨蝶呤组、青藤碱组、芍药苷组和青芍配伍组大鼠足肿胀容积及关节炎指数评分均降低(P<0.01),体质量增加(P<0.01);与甲氨蝶呤组比较,青藤碱组、芍药苷组大鼠足肿胀容积、关节炎指数评分增加(P<0.01),体质量降低(P<0.01);与青藤碱组比较,青芍配伍组大鼠足肿胀容积及关节炎指数评分均降低(P<0.01),体质量增加(P<0.01);与芍药苷组比较,青芍配伍组大鼠足肿胀容积及关节指数评分均降低(P<0.01),体质量增加(P<0.01)。 详见图1。

图1 各种大鼠足肿胀容积、关节炎指数评分、体质量比较(n=10)
2.2 青藤碱配伍芍药苷对CIA 大鼠关节骨侵蚀的影响
正常组大鼠趾跖关节对位关系良好,关节间隙清晰,未见关节面狭窄或增宽,关节面光滑平整,关节周围软组织未见肿胀。与正常组比较,模型组大鼠关节呈弥漫性肿胀,边缘骨质侵蚀,关节间隙狭窄甚至消失,骨质疏松,有明显的骨侵蚀,明显畸形;甲氨蝶呤组大鼠关节可见趾跖关节间隙模糊,关节腔间隙狭窄程度较轻,骨侵蚀较轻,无明显关节畸形改变;青藤碱组大鼠部分关节肿胀,趾跖关节间隙明显变窄,骨侵蚀明显,可见关节畸形;芍药苷组大鼠关节间隙变窄,骨侵蚀明显,可见关节变形;青芍配伍组关节间隙狭窄程度及骨侵蚀较轻,关节结构较完整。
与正常组比较,其余各组关节骨侵蚀评分明显升高(P<0.01);与模型组比较,甲氨蝶呤组、芍药苷组、青芍配伍组大鼠关节骨侵蚀评分明显降低(P<0.05,P<0.01);与甲氨蝶呤组比较,青藤碱组、芍药苷组关节骨侵蚀评分明显升高(P<0.01);与青藤碱组比较,青芍配伍组大鼠关节骨侵蚀评分明显降低(P<0.01);与芍药苷组比较,青芍配伍组大鼠关节骨侵蚀评分明显降低(P<0.01)。 详见图2、表1。
表1 各组大鼠关节骨侵蚀评分比较(±s,n=10)

表1 各组大鼠关节骨侵蚀评分比较(±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与甲氨蝶呤组比较,▲▲P<0.01;与青藤碱组比较,●●P<0.01;与芍药苷组比较,○○P<0.01。
组别正常组模型组甲氨蝶呤组青藤碱组芍药苷组青芍配伍组骨侵蚀评分/分0±0 4.1±0.68**1.8±0.35**##3.6±0.75**▲▲3.4±0.63**#▲▲2.2±0.62**##●●○○

图2 各组大鼠关节骨破坏比较
2.3 青藤碱配伍芍药苷对CIA 大鼠组织病理改变的影响
正常组关节结构完整,细胞排列整齐,无炎症细胞浸润,关节软骨形态完整,软骨下骨结构清晰。 模型组大鼠踝关节组织可见大量炎症细胞浸润,滑膜组织显著增生,血管翳生成并伴有严重的骨破坏。青藤碱组和芍药苷组滑膜中等程度增生,炎症细胞浸润,关节软骨细胞肿胀。 甲氨蝶呤组和青芍配伍组大鼠关节滑膜细胞轻度增生,可见少量炎症细胞浸润于组织中。 详见图3。
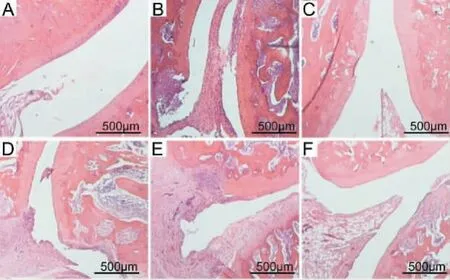
图3 各组大鼠踝关节组织病理改变(HE,×100)
与正常组比较,其余各组关节组织病理评分明显升高(P<0.01);与模型组比较,甲氨蝶呤组、青藤碱组、芍药苷组、青芍配伍组大鼠关节组织病理评分明显降低(P<0.05,P<0.01);与甲氨蝶呤组比较,青藤碱组、芍药苷组关节组织病理评分明显升高(P<0.01);与青藤碱组比较,青芍配伍组大鼠关节组织病理评分明显降低(P<0.05);与芍药苷组比较,青芍配伍组大鼠关节组织病理评分降低(P<0.05)。 详见表2。
表2 各组踝关节组织病理评分比较(±s,n=10)
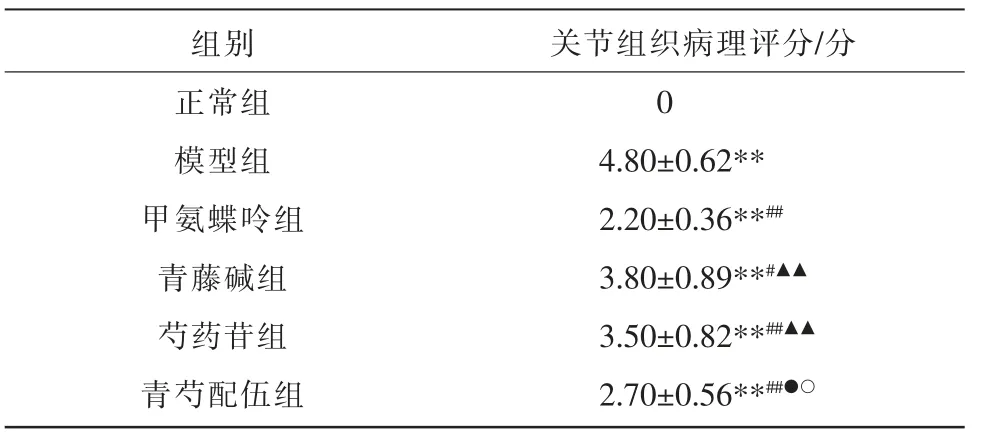
表2 各组踝关节组织病理评分比较(±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与甲氨蝶呤组比较,▲▲P<0.01;与青藤碱组比较,●P<0.05;与芍药苷组比较,○P<0.05。
组别正常组模型组甲氨蝶呤组青藤碱组芍药苷组青芍配伍组关节组织病理评分/分0 4.80±0.62**2.20±0.36**##3.80±0.89**#▲▲3.50±0.82**##▲▲2.70±0.56**##●○
2.4 青藤碱配伍芍药苷对CIA 大鼠血清TNF-α、IL-1β 表达的影响
与正常组比较,其余各组大鼠血清TNF-α、IL-1β明显增高(P<0.05,P<0.01);与模型组比较,甲氨蝶呤组、青藤碱组、芍药苷组、青芍配伍组大鼠血清TNF-α、IL-1β 水平明显下降(P<0.05,P<0.01);与甲氨蝶呤组比较,青藤碱组、芍药苷组TNF-α、IL-1β水平明显增高(P<0.01);与青藤碱组比较,青芍配伍组大鼠血清TNF-α、IL-1β 水平下降(P<0.05,P<0.01);与芍药苷组比较,青芍配伍组大鼠血清TNF-α、IL-1β水平下降(P<0.05,P<0.01)。 详见表3。
表3 各组大鼠血清TNF-α、IL-1β 表达水平比较(±s,n=10)
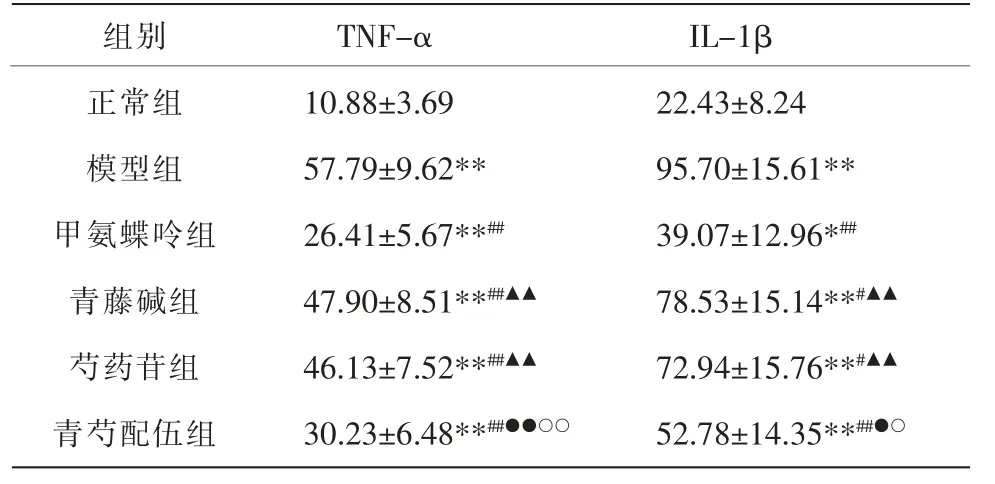
表3 各组大鼠血清TNF-α、IL-1β 表达水平比较(±s,n=10)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与甲氨蝶呤组比较,▲▲P<0.01;与青藤碱组比较,●P<0.05,●●P<0.01;与芍药苷组比较,○P<0.05,○○P<0.01。
组别正常组模型组甲氨蝶呤组青藤碱组芍药苷组青芍配伍组TNF-α 10.88±3.69 57.79±9.62**26.41±5.67**##47.90±8.51**##▲▲46.13±7.52**##▲▲30.23±6.48**##●●○○IL-1β 22.43±8.24 95.70±15.61**39.07±12.96*##78.53±15.14**#▲▲72.94±15.76**#▲▲52.78±14.35**##●○
2.5 青藤碱配伍芍药苷对CIA 大鼠MMP-2、MMP-9和TIMP-1 表达的影响
与正常组比较,其余各组大鼠骨组织MMP-2、MMP-9、TIMP-1 表达明显增高(P<0.05,P<0.01)。与模型组比较,甲氨蝶呤组、青藤碱组大鼠骨组织MMP-2、MMP-9、TIMP-1 表达明显下降(P<0.05,P<0.01);芍药苷组大鼠骨组织MMP-2、MMP-9 表达明显下降(P<0.01);青芍配伍组大鼠骨组织MMP-2、MMP-9 表达明显下降(P<0.01),TIMP-1 表达显著增高(P<0.01)。与甲氨蝶呤组比较,青藤碱组、芍药苷组骨组织MMP-2、MMP-9 表达明显增高(P<0.01)。与青藤碱组比较,青芍配伍组大鼠骨组织MMP-2、MMP-9 表达明显降低(P<0.01),TIMP-1 表达显著增高(P<0.01)。 与芍药苷组比较,青芍配伍组大鼠骨组织MMP-2、MMP-9 明显降低(P<0.01),TIMP-1 表达显著增高(P<0.01)。 详见图4、表4。
表4 各组大鼠MMP-2、MMP-9 和TIMP-1 表达水平比较(±s,n=10)

表4 各组大鼠MMP-2、MMP-9 和TIMP-1 表达水平比较(±s,n=10)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与甲氨蝶呤组比较,▲▲P<0.01;与青藤碱组比较,●●P<0.01;与芍药苷组比较,○○P<0.01。
组别正常组模型组甲氨蝶呤组青藤碱组芍药苷组青芍配伍组MMP-2 0.59±0.16 5.59±0.80**1.59±0.49*##4.31±0.85**##▲▲4.11±0.64**##▲▲1.89±0.65**##●●○○MMP-9 1.02±0.04 6.30±0.77**1.83±0.48*##5.04±0.75**##▲▲4.82±0.59**##▲▲1.84±0.50**##●●○○TIMP-1 0.99±0.11 2.78±0.44**2.02±0.33**##2.17±0.47**#2.59±0.49**4.07±0.44**##●●○○

图4 各组大鼠MMP-2、MMP-9 和TIMP-1 电泳图
3 讨论
青风藤为防己科植物青藤Sinomenium acutum(Thunb.) Rehd.et Wils.的干燥藤茎。青风藤味苦、辛,性平,归肝、脾经,具祛风湿、行气血、利关节、止痹痛之功。 青藤碱是从青风藤中分离提取出来的一种生物碱单体,药理药效研究表明,青藤碱具有抗炎、镇痛、抑制免疫等多种生物活性,并已制备成正清风痛宁缓释片及正清风痛宁注射液等成药,临床上用来治疗RA 风寒湿痹证[17]。青藤碱在RA 治疗药物分类中,归属于植物类治疗药物,但因其生物利用度低,具有强烈的组胺释放作用,部分患者容易出现瘙痒、出汗、潮红、肿痛加重现象,从而限制了其在RA 中的广泛应用。 白芍为毛茛科植物芍药Paeonia lactiflora Pall.的干燥根,味苦、酸,性凉,归肝、脾经,可养血柔肝、通痹止痛、敛阴止汗。 芍药苷作为白芍的主要药效成分,具有抗炎、镇痛、免疫调节作用,亦已制备成白芍总苷胶囊用于RA 的治疗,在RA 治疗药物中分类为植物类药物[18]。 但青藤碱及芍药苷抗RA 作用强度均相对较弱,临床主要用于辅助治疗[19-20]。 故本研究进一步明确,青藤碱配伍芍药苷协同抗RA 的药效及其作用机制。RA 关节中异常活化的滑膜是免疫系统中影响骨稳态的重要部位,滑膜炎是关节表现的病理基础,也是导致继发性骨质破坏的原因。 而其中的具体机制涉及免疫细胞、炎症因子等一系列信号传导通路的级联反应,导致关节结构的破坏[21]。 TNF-α、IL-1β 被称为前炎症细胞因子,是关节炎症发生的重要炎症因子。 TNF-α由单核巨噬细胞系大量合成,诱导机体炎症级联瀑布效应,产生细胞因子风暴,导致局部血管渗透性增加,炎症细胞浸润,引起非特异性炎症反应,在炎症自身免疫性疾病中发挥关键作用[22]。 TNF-α 抑制剂通过抑制或中和机体内的TNF-α 细胞因子,减轻炎症反应和调节免疫功能,已进入临床使用的TNF-α 抑制剂包括英夫利昔单抗、依那西普、阿达木单抗、戈里木单抗等[23]。 IL-1β 由激活的巨噬细胞产生,可促使中性粒细胞在CIA 大鼠关节腔中定向聚集,使其过度激活导致关节损伤;另外还可以诱导滑膜细胞分泌RANKL,通过RANKL-RANK 信号通路介导破骨细胞生成造成骨破坏[24]。 美国食品药品监督管理局于2001 年批准IL-1 受体拮抗剂阿那白滞素用于RA,此后,又开发了特异性结合IL-1β 的人源化单克隆抗体卡纳单抗[25]。 TNF-α 与IL-1β 协同诱导滑膜细胞异常增殖并分泌大量促炎因子,是介导RA关节滑膜炎症反应及骨破坏的关键炎症细胞因子[26],可导致组织炎症浸润,关节表现为红、肿、热、痛及功能障碍,阻断TNF-α、IL-1β 是临床治疗RA 有效的靶点。 同时,大量增殖的炎症细胞诱导滑膜细胞和软骨细胞产生MMP-3、MMP-2 等降解细胞外基质的蛋白酶,造成关节软骨侵蚀与骨破坏[27]。
本研究结果显示,CIA 大鼠关节大量炎症细胞浸润,并伴有严重的骨破坏,与相关报道结果相一致[28]。青藤碱与芍药苷配伍联用能显著抑制大鼠足肿胀容积、降低关节炎指数评分,而青藤碱或芍药苷单用未见明显药效作用,青芍配伍用药协同保护关节组织病理改变作用显著优于青藤碱或芍药苷单用。 进一步研究发现,与青藤碱或芍药苷单用比较,青芍配伍能显著降低TNF-α、IL-1β 含量。 结果提示,青藤碱与芍药苷配伍用药可协同抑制TNF-α、IL-1β 细胞因子的表达,发挥抗CIA 药效作用。
MMP-2 与MMP-9 由巨噬细胞、成纤维滑膜细胞及各种结缔组织细胞产生,是降解骨细胞外基质的重要内肽酶,主要通过降解Ⅰ型、Ⅳ型、Ⅴ型和Ⅸ型胶原以及黏合素介导关节骨与软骨侵蚀[29]。而TIMP-1 是MMPs 的天然抑制剂[30]。 本研究发现,青藤碱与芍药苷配伍能显著降低MMP-2、MMP-9表达,上调TIMP-1 表达,且效果优于青藤碱或芍药苷单用。 结果表明青藤碱与芍药苷配伍用药可能通过抑制MMP-2、MMP-9 表达,上调TIMP-1 表达,发挥协同抗CIA 药效作用。
综上所述,青藤碱配伍芍药苷发挥协同抗CIA药效作用,其机制可能与减少血清中关键的促炎细胞因子TNF-α、IL-1β 含量,抑制骨组织MMP-2、MMP-9 表达,促进TIMP-1 表达有关,通过抑制炎症细胞浸润、滑膜增生,减少软骨侵蚀和骨破坏,从而发挥疗效。中药配伍后通过多通路、多环节作用于机体而抑制炎症反应和骨破坏,发挥治疗作用,其更深一步的机制尚有待研究阐明。
