基于Exo III 信号放大的荧光适配体传感器检测Kunitz 型大豆胰蛋白酶抑制因子
2024-01-09李心珠谷春梅于寒松董鹏超鲍云翔
李心珠,谷春梅*,于寒松,董鹏超,鲍云翔
(1.吉林农业大学食品科学与工程学院,吉林长春 130118)(2.国家大豆产业技术体系加工研究室,吉林长春 130118)
大豆含有丰富的蛋白质和各种必需氨基酸,是主要的工业原材料及经济作物。同时富含多种抗营养因子,其中大豆胰蛋白酶抑制因子(Soybean Trypisin Inhibitor,STI)是一种很重要的抗营养因子,包括Kunitz 胰蛋白酶抑制因子(Kunitz Trypsin Ihhibitor,KTI )和 Bowman-Birk 胰蛋白酶抑制因子(Bowman-Birk Inhibitor,BBI)[1]。一方面,其与胰蛋白酶、糜蛋白酶相互作用,形成一种不易降解的稳定复合体,导致蛋白质的消化吸收与利用减弱。另外,因为人体蛋白酶降低,造成体内含硫氨基酸降低,引起胰腺肿大、免疫功能下降等,危害人类及动物健康,制约各行业大豆利用率[2],因此对其检测势在必行。目前对于KTI 的检测有脲酶检测、酶化学检测法,酶联免疫吸附试验是目前最广泛的一种免疫检测法,用于大豆抗营养成分测定[3,4],通过酶高效催化作用,使抗体的特异性结果放大。由于抗体合成成本高以及本身易受到外界环境的干扰,因此,有必要建立高效的KTI 检测技术。
作为一种新型信号分子,核酸适配体具有高亲和力、易于合成修饰、成本低、靶标范围大等优点[5-8],使其在蛋白质作用研究[9-11]、环境监控[12-14]、食品安全检测[15-17]等众多领域受到了广泛重视[18]。核酸适配体作为寡核苷酸片段与靶分子结合,通过构建适配体生物传感器将结合信号转化为易于检测的信号[19],分为荧光适配体传感器[20-22]、比色适配体传感器[23,24]、电化学适配体传感器[25,26]等。目前纳米材料被用于多种方面[27],由于其灵敏、操作简单等被作为辅助元件[28]。CNPs 为其中一种,具有价格低廉、生物相容性好、无毒害等优点[29]。由于CNPs 具有纳米尺度和碳物质特性,对平面型染料分子的作用强,利用π-π堆积作用,可以使单链DNA 在其表面产生强烈的吸附,吸附在CNPs 表面上的荧光团通过电子或能量转移被有效淬灭,因此CNPs 作为荧光淬灭剂,将为生物分子荧光识别技术的发展奠定基础[30]。
近年来,核酸信号放大技术广泛用于不同物质的分析检测,其中ExoIII能不断催化降解双链DNA,并特异性催化其从3’末端水解[31],其信号放大不需要特定的识别序列,适用于生物传感平台的构建,已被用于核酸[32,33]、金属离子[34]、有机物[35]等的检测。本研究构建一种ExoIII信号放大技术与CNPs 结合的方法,实验原理如图1 所示,由KTI 适配体、cDNA、SP、ExoIII和CNPs 5 个部分组成。不存在KTI 时,APT 与cDNA 产生互补双链,SP 为单链结构,加入CNPs 后,SP 被CNPs 吸附淬灭;当KTI 存在时,KTI与APT 结合,cDNA 和SP 互补成双链,无法被CNPs吸附,SP 依然呈现荧光态,同时ExoIII在3’末端对其进行降解,并通过ExoIII的周期性切割释放出大量荧光团,使荧光强度得到明显提高,基于此可对KTI进行灵敏检测。
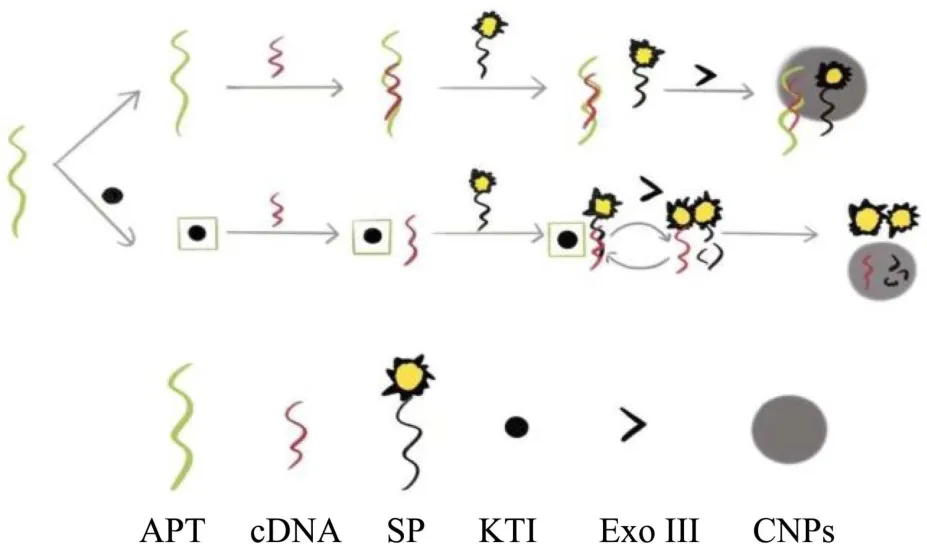
图1 荧光适配体生物传感器检测原理图Fig.1 Fluorescence aptamer biosensor detection schematic
1 材料与方法
1.1 材料与试剂
KTI、BBI、SBA标准品,均购于美国Sigma-Aldrich公司;碳纳米颗粒,购于北京德科岛金;核酸外切酶III,购于苏州近岸蛋白质科技股份有限公司;豆浆;DNA 序列,均由上海生工生物工程技术服务有限公司合成。据文献报道,在3’-端的双链DNA 必须至少有4 个不匹配的碱基,以阻止ExoIII的水解[36]。因此将4 个胸腺嘧啶T 添加到APT 与cDNA 的3’-端,以阻止ExoIII的DNA 水解,表1 是用于实验的所有序列。

表1 DNA 序列Table 1 DNA sequences
1.2 仪器与设备
MB-102 恒温金属振荡浴,杭州博日科技有限公司;YHZ-112B 恒温振荡培养摇床,苏州市国飞仪器有限公司;infinitieM200型多功能酶标仪,Nano Quant;TGL-16 型高速台式离心机,上海安亭仪器厂。
1.3 试验方法
1.3.1 荧光适配体生物传感器检测KTI
首先,将APT、cDNA、SP 的浓度分别配置为0.2、0.2、1 μmol/L,取50 μL APT 与50 μL 的KTI 溶液进行混合,其中KTI 的质量浓度为200 ng/mL,室温反应1 h;然后分别取50 μL cDNA 和50 μL SP 加入到上述混合物中,在室温下反应30 min;最后,添加含40 U ExoIII的缓冲液100 μL,对SP进行消化,在37 ℃条件下反应2 h;当酶解结束以后,将体系加热到75 ℃进行5 min 后停止反应;然后,在反应混合物中添加200 μL 的CNPs 溶液,最后的体积是500 μL,并在37 ℃黑暗的条件下培养该混合物30 min[37]。荧光发射光谱测试条件为:激发波长为490 nm,发射波长范围为500~640 nm,入射狭缝以及出射狭缝宽度为5 nm。依照523 nm 处的峰值强度对KTI 的浓度做定量分析。
1.3.2 CNPs 质量浓度的优化
CNPs 在本研究中用作检测平台,它的质量浓度是影响检测结果的主要因素。如果系统中CNPs 质量浓度太低,无法有效地消除未被水解的信号探针SP的荧光,从而使背景荧光强度太高影响检测限;在质量高浓度下淬灭过大会使测定结果不精确,所以必须优化CNPs 的质量浓度。CNPs 的添加质量浓度为20、40、60、80、100 μg/mL,采用与上述1.3.1 荧光适配体生物传感器检测KTI 相同的方法进行测定。
1.3.3 可行性试验
核酸外切酶III作为一种切割酶,具有高效的酶催化活性,对靶标循环有促进作用[38]。为了增加检测的灵敏度,使用ExoIII对荧光信号进行辅助放大,为了验证该方法是否可行需对其进行试验分析,试验共分为a、b、c、d 四组,试剂组合如下表2 所示,其中没有添加的试剂被ddH2O 取代,KTI 的质量浓度是200 ng/mL,最终体积为500 μL,反应过程同1.3.1。

表2 试剂及组合Table 2 Reagent and combination
1.3.4 特异性研究
为了检验该方法对KTI 的特异性,分别加入质量浓度为200 ng/mL 的KTI、BBI、SBA 标准溶液,其余操作与1.3.1 相同。通过比较不同种类的KTI 类似物存在时,体系的相对荧光强度大小来判断本方法的选择性。
1.3.5 豆浆样品中KTI 加标回收测定
取豆浆样品作为检测对象,验证体系在实际样品中的实用性,具体方法如下:用ddH2O 将豆浆配置为φ=1%的缓冲体系,加入不同量的KTI 溶液,KTI 的质量浓度为50、100、500 ng/mL,获得了一系列浓度的加标KTI 标准溶液。将APT、cDNA、SP 的浓度分别配置为0.2、0.2、1 μmol/L,取50 μL APT 与50 μL 加标KTI 溶液进行混合,室温反应1 h;分别取50 μL cDNA 和50 μL SP 加入到上述混合物中,在室温下反应30 min;然后,添加含40 U ExoIII的缓冲液100 μL,消化SP,在37 ℃条件下反应2 h;当酶解结束以后,将体系加热到75 ℃进行5 min 后停止反应;最后,在反应混合物中添加200 μL 的CNPs 溶液,反应总体积为500 μL,并在37 ℃黑暗的条件下培养该混合物30 min,测试条件同1.3.1。
1.3.6 数据分析
试验中的分析数值均采用三次平行试验进行处理,以“平均值±标准差”表示;采用Origin 2021 和GraphPad Prism 8 软件绘图;采用Excel 2010 进行数据处理。
2 结果与讨论
2.1 CNPs 质量浓度优化结果
CNPs 是传感器的检测平台,其质量浓度对检测结果有重要影响[39],因此需要对其质量浓度进行优化。图2 为体系中加入不同浓度的CNPs,KTI 是否存在的条件下荧光强度值的变化,其中红色柱状为添加KTI 溶液时的荧光强度,黄色柱状为未添加KTI 时的荧光强度。从图2 中可以看到,CNPs 质量浓度越来越高,系统的荧光强度逐渐降低,CNPs 质量浓度为40 μg/mL 时,荧光强度显著高于其他更高质量浓度(P<0.05),当CNPs 质量浓度达到60 μg/mL 后,质量浓度增大对荧光强度的变化影响不显著,逐渐趋于平稳。是因为随着CNPs 质量浓度的增加,荧光信号被大量淬灭。
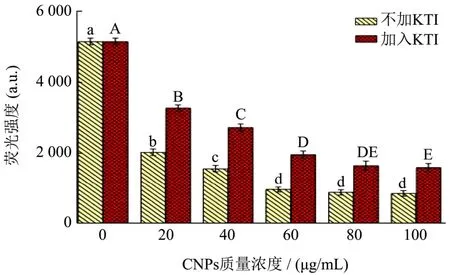
图2 CNPs 在不同质量浓度下的荧光强度对照图Fig.2 Comparison of fluorescence intensity of CNPs at different mass concentrations
如图3 所示为体系的相对荧光强度,呈现先升高后下降趋势,当CNPs 质量浓度为60 μg/mL 时,相对荧光强度值最高,为1.0 左右,与其他数据之间具有显著差异(P<0.05),之后的相对荧光强度没有显著差异(P>0.05),因此选择60 μg/mL 作为最终的优化结果。与冯婷婷等[40]基于CNPs 传感器检测腺苷脱氨酶实验结果相比,CNPs 优化质量浓度相似。
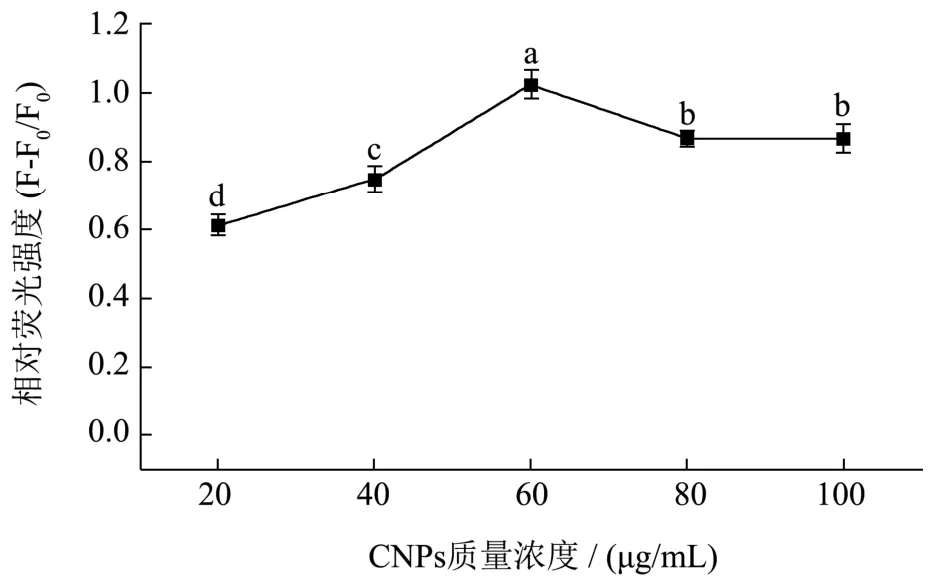
图3 CNPs 在不同质量浓度下的相对荧光强度Fig.3 The relative fluorescence intensity of CNPs at different mass concentrations
2.2 方法可行性分析
为了考察实验方法的有效性,该实验采用了检测体系中是否出现ExoIII时对荧光强度的影响来检验实验方法的准确性,如图4 所示。在体系中不具有ExoIII时,加入KTI 与不加入KTI 的荧光强度对比有较小范围的不同(图4 中的b、c),但KTI 的引入使适配体与KTI 结合,cDNA 与信号探针SP 互补,由此产生了双链DNA,不能完全被CNPs 吸附,从而增加了溶液的荧光强度;当体系中加入ExoIII时,体系与CNPs 进行酶促切割,从而使检测信号放大,荧光强度显著增加(图4 中的a、d),但是体系的背景荧光没有太大变化,此时的荧光信号是背景信号的3 倍左右。相对于没有ExoIII的情况下,添加之后荧光信号增加约80%(图4 中的b、d)。实验结果显示,利用ExoIII循环放大技术可以提高荧光信号的强度,与赵阳阳[41]实验关于适配体生物传感器检测赭曲霉毒素A的可行性分析中的结果基本相同,说明此方法可行。
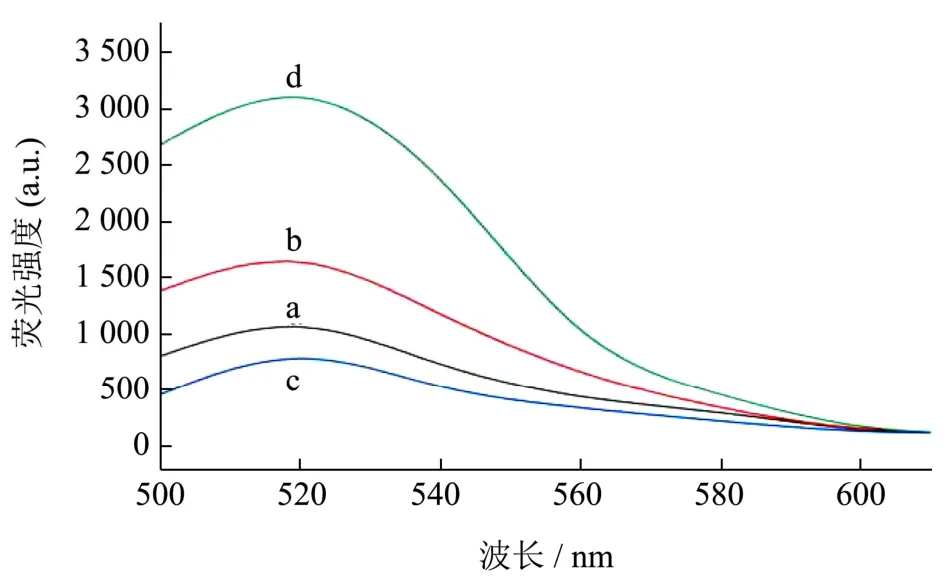
图4 不同体系的荧光光谱图Fig.4 Fluorescence spectra of different systems
2.3 标准曲线的绘制
方法可行性和CNPs 质量浓度优化试验条件确定后,将不同质量浓度的KTI(100~600 ng/mL)加入到检测体系,以研究适配体生物传感器对于KTI 检测的灵敏度。如图5 所示,实验结果表明,随着KTI 浓度的增加荧光强度逐渐增加,在此范围内呈线性相关,线性相关系数R2=0.999 1,检测限(LOD)设定为三倍空白溶液的荧光信号的标准偏差,因此得出适配体生物传感器检测限(LOD)为12.59 ng/mL。对照现有KTI 检测技术,如表3 所示,本方法对于KTI 的检测优于文献报道[42],具有更低的检测限,灵敏度较高。

表3 本方法与现有检测技术对比Table 3 This method is compared with existing detection techniques
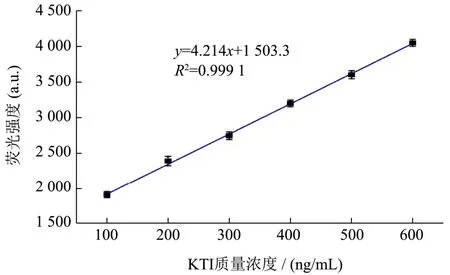
图5 传感器在不同KTI 质量浓度下的标准曲线Fig.5 The standard curve of the sensor at different KTI mass concentrations
2.4 特异性研究
选择以下两种KTI 类似物BBI、SBA 进行特异性试验,通过对KTI 适配体生物传感器的特异检测,是测定其可靠性的一个重要参数。主要在于检测其能特异性结合KTI 外,是否还与其他KTI 结构相似的物质结合。如图6 所示,实验结果表明,与其他两种类似物BBI、SBA 相比,KTI 体系中相对荧光强度最高,为0.9 左右,与其他两组数据之间存在显著性差异(P<0.05),两种类似物的相对荧光强度较小,核酸适配体不能识别,两者数据间没有显著性差异(P>0.05)。结果表明,KTI 适配体能够进行KTI 的特异性识别,因此验证了该适配体生物传感器对KTI具有良好的选择性和特异性。

图6 KTI 的特异性试验Fig.6 Specificity test of KTI
2.5 豆浆样品中KTI 回收率试验结果
基于这种适配体生物传感器具有良好的检测能力和良好的选择性,在实际样本中评价其检测方法的可行性。用ddH2O 将豆浆配置为1%的缓冲体系,加入不同量的KTI 溶液用于分析测定,KTI 的质量浓度分别为50、100、500 ng/mL,采用加标回收法对三种不同KTI 质量浓度的回收率进行测定,如表4 所示。回收率介于97.42%~102.85%范围内,数据之间没有显著性差异(P>0.05),相对标准偏差(RSD)在0.61%~2.36%之间,检测准确度良好。结果表明ExoIII辅助放大信号检测法对于实际样品中的KTI表现出良好的检测性能,能有效用于实际样品的检测。

表4 适配体生物传感器用于豆浆样品中KTI 的测定Table 4 Aptamer biosensor for the determination of KTI in soybean milk samples
3 结论
开发了一种以核酸适配体作为识别单元,核酸外切酶III作为信号放大元件以及碳纳米颗粒作为信号开关的荧光型适配体生物传感器,利用ExoIII不断降解-杂交循环,结合CNPs 的荧光淬灭效果对检测信号进行放大,可以有效提高KTI 检测的灵敏度。KTI 的荧光强度与KTI 浓度之间存在着一定的线性关系,线性相关系数R2=0.999 1,检测限(LOD)为12.59 ng/mL,所设计的核酸适配体生物传感器显示出良好的选择性。以豆浆作为样品,采用加标回收法测得回收率为97.42%~102.85%,相对标准偏差(RSD)在0.61%~2.36%之间。相对于常规的测定方法,该方法具有操作简便、灵敏度高、专一性良好等优点,可以作为一种新的测定方法用于实际样品中KTI 的检测。
