平板显色法同时计数生乳中的大肠菌群和菌落总数
2024-01-09董鑫芸谢一嘉刘媛媛王清瑶肖性龙
董鑫芸,谢一嘉,刘媛媛,王清瑶,肖性龙
(华南理工大学食品科学与工程学院,广东广州 510640)
生乳是未经生产加工的原料奶,目前生乳执行的是GB 19301-2010《食品安全国家标准 生乳》,其中要求菌落总数≤2×106CFU/g(mL)[1],标准中对菌落总数限量较宽泛,且未对大肠菌群限制。但生乳中含有丰富的营养物质[2],极容易受到动物体及挤奶环境微生物的污染[3],而不合格的生乳是不允许进入生产环节的。菌落总数和大肠菌群作为食品卫生的指示性指标[4],因此对于大肠菌群与菌落总数的检测则显得尤为重要。
大肠菌群(Coliform)是指在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽胞杆菌[5]。目前依照GB 4789.3-2016《食品安全国家标准食品微生物学检验大肠菌群计数》[6]的最可能数法(Most Probable Number,MPN)和GB 4789.2-2022《食品安全国家标准食品微生物学检验菌落总数测定》[7]的平板计数法对食品中的大肠菌群和菌落总数进行定量检测,需要分别进行测定,一方面操作繁琐、效率低,同时也增加了人力物力的消耗。而其他方法,如生物传感器法[8]、分子生物学法[9]、免疫学法[10]等,基于它们具有快速与高灵敏度的优点,已被广泛用于细菌检测,然而,这些方法需要使用精密的实验仪器、复杂的样品处理与分析程序,且检测成本高。此外,由于生乳基质成分的复杂性,在其中检测细菌数量,难以达到理想效果,在多场景检测应用上存在较大限制。现研究的复合显色培养基致力于实现大肠杆菌和大肠菌群的同时计数[11,12],对于大肠菌群和菌落总数同时计数的培养基研究较少。因此,本论文意在开发一种同时检测大肠菌群和菌落总数的复合显色培养基,以较低的成本实现检测的高效性、简单可操作性,从而对生乳的卫生情况进行监控。
传统的大肠菌群监测是基于lacZ 基因编码的β-半乳糖苷酶(β-Galactosidase,β-Gal)通过“酶-底物反应法”进行大肠菌群的检测[13,14],本研究基于该原理选用结构与乳糖类似的邻硝基酚-β-D-半乳糖苷(2-Nitrophenyl-β-D-Galactopyranoside,ONPG)作为β-Gal 的显色底物,ONPG 无需渗透酶存在可迅速进入细菌细胞内,被β-Gal 水解后释放出黄色的邻位硝基苯酚(Orthonitrphenyl,ONP)[15],使得平板上的大肠菌群菌落呈现出区分于一般菌株的颜色,以此同时进行大肠菌群和菌落总数的计数。本研究在传统大肠菌群和菌落总数的平板计数方法基础上,开发了一款基于ONPG的同时计数大肠菌群与菌落总数的复合显色培养基方法,提高了大肠菌群与菌落总数的检测效率,为同时测定大肠菌群和菌落总数提供一种有效的检测方案。
1 材料与方法
1.1 菌种、试剂与仪器
1.1.1 菌种
本章所用菌株共13 株,具体包括大肠菌群菌株:大肠杆菌(Escherichiacoli)ATCC 25922、大肠杆菌(Escherichiacoli)O157:H7、肺炎克雷伯菌(K.pneumoniae)CICC 10781、弗氏柠檬酸杆菌(Citrobacterfreundii)CMCC 48007、阴沟肠杆菌(Enterobactercloacae)CICC 21539、阪崎肠杆菌(Enterobactersakazakii)ATCC 29544、产气肠杆菌(Enterobacteraerogenes)CICC 10293;非大肠菌群菌株:金黄色葡萄球菌(Staphylococcusaureus)ATCC 29213、金黄色葡萄球菌(Staphylococcusaureus)ATCC 6538、沙门氏菌(Salmonellatyphimurium)ATCC 14028、单增李斯特菌(Listeriamonocytogenes)ATCC 19117、蜡样芽孢杆菌(Bacilluscereus)CMCC 70331、副溶血性弧菌(Vibrioparahaemolyticus)ATCC 17802。均为华南理工大学食品质量与安全检测中心保存菌株,均保存于φ=50%的甘油中,冻存在-80 ℃冰箱中。其中,大肠杆菌(Escherichiacoli)ATCC 25922、大肠杆菌(Escherichiacoli)O157:H7 作为该平板培养基的质控菌株。
1.1.2 试剂
乳糖(Lactose,Lac)、葡萄糖(Glucose,Glu)、胰蛋白胨(Casein Tryptone,CT)、酵母膏粉(Yeast Extract Fermentation,YEF)、琼脂(Agar)、氯化钠(NaCl)、磷酸氢二钾(K2HPO4)、磷酸二氢钾(KH2PO4),均购自天津市大茂化学试剂厂;异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-Thiogalactoside,IPTG)、ONPG,均购自上海瑞永生物科技有限公司;平板计数琼脂培养基(PCA)、胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)和结晶紫中性红胆盐琼脂培养基(VEBR),均购自广东环凯生物技术有限公司。
1.1.3 仪器
FA-2104 分析天平,上海舜宇恒平科学仪器有限公司;SPX-2508-Z 生化培养箱,上海博讯实业有限公司医疗设备厂;HZQ-F100 恒温振荡培养箱,上海一恒科学仪器有限公司;SW-CJ-1FD 超净工作台,苏州智净净化设备有限公司;XW-80A 微型漩涡混合仪,上海泸西分析仪器厂有限公司;YXQ-LS-100Ⅱ立式压力蒸汽灭菌器,郑州南北仪器设备有限公司;5424 小型高速离心机,上海成贯仪器有限公司;Synergy Neo2多功能酶标仪,北京德利卡生物技术有限公司;UV-1801紫外/可见光分光光度计,北京瑞利仪器有限公司。
1.2 试验方法
1.2.1 菌种的活化及培养
用接种环蘸取少量-80 ℃甘油保藏的菌液后在平板上划线,37 ℃培养24 h,挑取单菌落转接至液体培养基中,于37 ℃摇床180 r/min 培养12 h 至对数生长期,通过上述操作完成对13 株菌株的活化。将培养至对数生长期的菌液经离心并重悬至生理盐水中,进行梯度稀释,获得终浓度为101~109CFU/mL 的菌悬液。将浓度为108CFU/mL 的大肠菌群菌株混合制备大肠菌群悬液,记为“Mix1”,另将浓度为108CFU/mL 的13 株菌液混合,记为“Mix2”,置于4 ℃冰箱保存,用于后续实验。
1.2.2 基础培养基的配方选择
参考GB 4789.3-2016 和GB 4789.2-2016 中培养基以及常规培养基的配方,如表1 所示,选定胰蛋白胨、酵母膏粉、NaCl、K2HPO4和KH2PO4作为本实验培养基的基础成分,其中胰蛋白胨提供氮源,酵母膏粉提供B 族维生素等生长因子,NaCl 维持渗透压平衡。由于大肠菌群会利用乳糖发酵产酸,因此需要缓冲体系来维持增菌过程中体系的酸碱平衡。最终,确定基础培养基配方:CT 10.0 g/L、YEF 3.0 g/L、NaCl 5.0 g/L、K2HPO42.75 g、KH2PO41.75 g/L、ONPG 0.1 g/L,最终pH 值为6.8。培养基配制完成后经121 ℃高压蒸汽灭菌后待用,ONPG 使用0.22 μm 微孔滤膜后加入。

表1 培养基配方成分比较Table 1 Comparison of formula components of each culture medium
1.2.3 诱导β-半乳糖苷酶表达的条件优化
ONPG 是一种结构与乳糖类似的化合物[16],无需渗透酶的存在可迅速转移至细菌细胞内[17],经β-Gal水解生成半乳糖和黄色化合物ONP[18]。颜色的深浅与β-Gal 的活力成正比,即当培养基中的大肠菌群所合成的β-Gal 含量越多,大肠菌群菌体就可以更快速地生长为明显的黄色菌体。因此,为了更优地对大肠菌群菌落进行计数,本培养基中需要加入合适的大肠菌群β-Gal 诱导剂,促进大肠菌群乳糖操纵子的启动与表达。IPTG、Lac 是lacZ 的诱导剂,且低浓度的Glu有益于lacZ 的转录,因此下面将分别对上述三种物质的影响进行探究。
1.2.3.1 ONP 最佳波长和浓度的确定
向基础培养基中分别加入一定量的ONPG母液和预先配置好的菌液浓度均为1.0×108CFU/mL 大肠菌群菌液。将各组样品置于摇床(37 ℃,180 r/min)中培养12 h。为测定该显色体系对不同波长的吸收大小,利用紫外分光光度计对该黄色产物溶液进行全波长(300~700 nm)扫描。
1.2.3.2 IPTG 对β-半乳糖苷酶诱导效果的测定
为探究IPTG 对大肠菌群β-Gal 的诱导表达效果,设计IPTG 浓度的单因素实验。向基础培养基中加入不同量的IPTG,再加入配置好的Mix1,使各组培养基中IPTG 质量浓度分别为0、0.01、0.03、0.05、0.07、0.09 g/L。将各组样品置于摇床(37 ℃,180 r/min)中培养12 h。然后,用紫外分光光度计测定410 nm 处的光密度。实验每组设置3 个平行。
1.2.3.3 Lac 对β-半乳糖苷酶诱导效果的测定结果
Lac 是β-Gal 的天然底物和间接诱导剂[19],可以诱导大肠菌群β-Gal 的表达。为探究Lac 对大肠菌群β-Gal 的诱导表达效果,设计Lac 质量浓度的单因素实验。向基础培养基中加入不同量的Lac,再加入配置好的Mix1,使各组培养基中Lac 的终质量浓度分别为0、0.5、1.0、1.5、2.0、2.5、3.0 g/L。将各组样品置于摇床(37 ℃,180 r/min)中培养12 h。然后,用紫外分光光度计测定410 nm 处的光密度。实验每组设置3 个平行。
1.2.3.4 Glu 对β-半乳糖苷酶诱导效果的测定结果
较低质量浓度的Glu 可以促进大肠菌群β-Gal 的表达[20],为探究Glu 对大肠菌群β-Gal 的诱导表达效果,设计Glu 质量浓度的单因素实验。向基础培养基中加入不同量的Glu,再加入配置好的Mix1,使各组培养基中Glu 的终质量浓度分别为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 g/L。将各组样品置于摇床(37 ℃,180 r/min)中培养12 h。然后,用紫外分光光度计测定410 nm 处的光密度。实验每组设置3 个平行。
1.2.4 菌落生长的单因素条件优化
1.2.4.1 CT 质量浓度的优化
为寻求本培养基中合适的CT 质量浓度,设计CT质量浓度的单因素实验。向基础培养基中加入不同量的CT,再加入Mix2,使各组培养基中CT 终质量浓度分别为0、2.5、5.0、7.5、10.0、12.5、15.0、17.5、20.0 g/L。将各组样品置于37 ℃摇床(180 r/min)中培养12 h。然后,用紫外分光光度计测定600 nm 处菌悬液的光密度,以此判定该培养基的增菌效果。实验每组设置3 个平行。
1.2.4.2 YEF 质量浓度的优化
为寻求本培养基中合适的YEF 质量浓度,设计YEF 浓度的单因素实验。向优化后的CT 基础培养基中加入不同量的YEF,再加入Mix2,使各组培养基中YEF 终质量浓度分别为0、1.0、1.5、2.0、2.5、3.0、3.5 g/L。置于37 ℃摇床(180 r/min)中培养12 h,然后用紫外分光光度计测定600 nm 处菌悬液的光密度,以此判定该培养基的增菌效果。实验每组设置3 个平行。
1.2.4.3 NaCl 质量浓度的优化
为寻求本培养基中合适的NaCl 质量浓度,设计NaCl 的单因素实验。根据优化后的CT、YEF 质量浓度,向各组培养基加入Mix2,使各组培养基中NaCl终质量浓度分别为0、3.0、4.0、5.0、6.0、7.0 g/L,将各组中培养基分别置于37 ℃、摇床(180 r/min)中培养12 h。然后,用紫外分光光度计测定600 nm 处菌悬液的光密度,以此判定该培养基的增菌效果。实验每组设置3 个平行。
1.2.4.4 缓冲体系pH 值的优化
为寻求本培养基中合适的pH 值,设计pH 值的单因素实验。用0.1 mol/L NaOH 溶液调整各组培养基的pH 值,再加入配置好的Mix2,使各组中pH 值分别为7.0、8.0、9.0、10.0。将各组样品置于37 ℃摇床(180 r/min)中培养12 h。然后,在600 nm 和410 nm下用紫外分光光度计测定细菌的光密度。实验每组设置3 个平行。
1.2.5 显色培养基的特异性验证
选取13 种生乳中常见致病菌进行复合显色平板培养基的特异性验证。将活化至对数期的13 株菌株分别接种至显色培养基中,37 ℃培养24 h、48 h,观察菌落生长情况及出现黄色产物情况,进一步验证该复合显色培养基的选择性与特异性。
1.2.6 显色培养基在生乳中的实际应用
将Mix1和Mix2菌液离心重悬至同等体积的经灭菌处理的生乳中制备加标样品,充分振匀,梯度稀释至终浓度未102、104、106、108CFU/mL,分别接种至显色培养基、PCA 培养基和VEBR 培养基中,其中,以PCA 培养结果记为菌落总数,以VEBR 培养基培养计数结果记为大肠菌群数,通过平板计数法,将本实验培养基与国标方法中计数培养基进行比较,以此验证本研究研制培养基计数结果的准确性。实验每组设置3 个平行。
1.2.7 数据分析
运用SPSSAU 软件,对数据进行一致性分析。
2 结果与讨论
2.1 β-半乳糖苷酶的诱导条件优化结果
2.1.1 大肠菌群显色底物的最佳吸收波长
黄色化合物ONP 的全波长吸收情况如图1,结果显示该黄色化合物在波长为410 nm 处有最大吸收值。显色程度越深则表明β-Gal 的活力越高,且在该培养条件下对大肠菌群β-Gal 的诱导表达效果越佳。因此,选择OD410作为ONP 的最佳吸收波长,来判断大肠菌群β-Gal 的诱导表达效果。
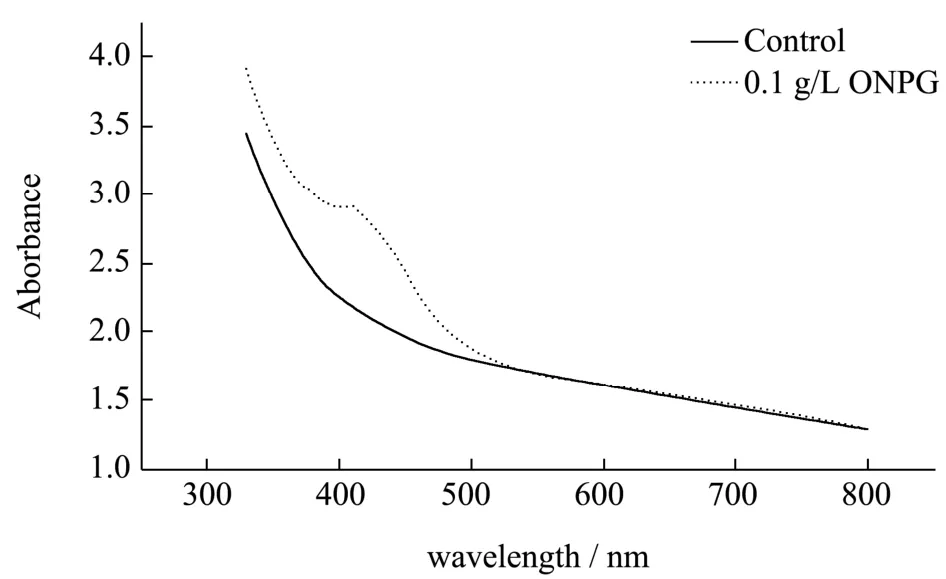
图1 黄色体系的吸收光谱Fig.1 The absorption spectrum of the yellow system
2.1.2 IPTG 对β-半乳糖苷酶诱导效果的测定结果
IPTG 是一种异丙乳糖模拟物[21],是活性极强的活性诱导物质[22],因其半乳糖苷键中的氧被硫取代失去了水解活性,能够不被细菌代谢而十分稳定,在缺乏渗透酶基因(lacY)的情况下也能被有效抄送至细胞内[23],因而能够高效诱导乳糖操纵子的转录过程。如图2 所示,当基础培养基中添加浓度为0.05 g/L 的IPTG,其对于β-半乳糖苷酶的诱导表达效果最佳。
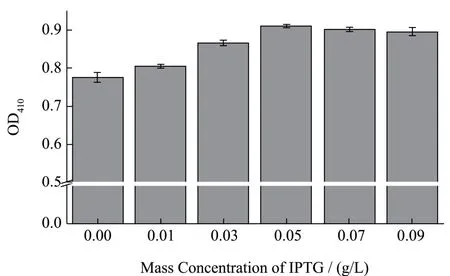
图2 IPTG 对大肠菌群诱导β-Gal 表达的效果Fig.2 Effect of IPTG on induced expression of coliform β-Gal
2.1.3 Lac对β-半乳糖苷酶诱导效果的测定结果
乳糖经β-Gal 作用,异构化为异丙乳糖[24],异丙乳糖与阻遏蛋白结合[25]致其失活,停止抑制结构基因(lacZ)的表达,阻遏蛋白的转录抑制作用得到解除,因此可以通过增加诱导剂的浓度来促进乳糖操纵子的表达[26]。如图3 所示,当Lac 的添加终浓度为2.0 g/L,OD410达到最大值,则说明此时该浓度的乳糖最有利于乳糖操纵子的表达。

图3 Lac 对大肠菌群诱导β-Gal 表达的效果Fig.3 Effect of Lac on induced expression of coliform β-Gal
2.1.4 Glu对β-半乳糖苷酶诱导效果的测定结果
Glu 可通过两条路径调节β-Gal 转录,一是通过诱导剂排除[25],外源Glu 会降低乳糖渗透酶运输Lac的效率;二是分解代谢抑制[27],在缺乏Glu 的情况下,腺苷酸环化酶(AC)活跃,产生的环磷酸腺苷(cAMP)与分解代谢激活蛋白(CAP)结合,CAP 被激活后与启动子上游结合(这是稳定的RNA 聚合酶结合所必须的)[28],增加DNA 聚合酶和启动子的亲和力,增强转录,在缺乏Glu 的情况下,腺苷酸环化酶/cAMP/CAP 轴被激活。如图4 所示,随着Glu 添加浓度的增加,OD410均呈现不同程度的下降,因此确定培养基在不添加葡萄糖的情况下,对β-半乳糖苷酶的诱导表达效果较佳,实验结果符合分解代谢抑制的原理,与Szeberenyi[28]研究结果一致。
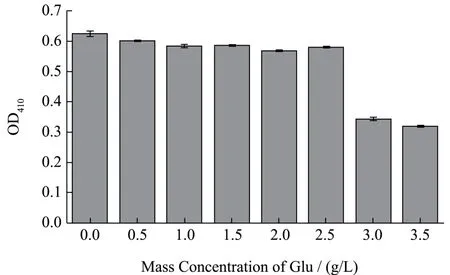
图4 Glu 对大肠菌群诱导β-Gal 表达的效果Fig.4 Effect of Glu on induced expression of coliform β-Gal
2.2 菌落生长的单因素条件优化结果
2.2.1 CT 质量浓度的优化结果
胰蛋白胨不仅能够为细菌生长提供所需氮源[29],同时还能够调节培养体系的pH 值[30],能够对于大肠菌群产酸导致体系pH 值降低起到一定缓冲作用,使得培养体系中除大肠菌群外的菌株能够正常增殖。另一方面,胰蛋白胨较蛋白胨颜色浅,对实验结果干扰较小。如图5 所示,随CT 浓度的增加,细菌的生长情况逐渐向好,当CT 的添加量≥12.5 g/L,CT 添加浓度增加,细菌的光密度基本保持不变。因此,将12.5 g/L 确定为培养基CT 的最佳添加浓度。

图5 CT 质量浓度对细菌生长的影响Fig.5 The effect of CT on bacterial growth
2.2.2 YEF 质量浓度的优化结果
酵母浸粉含有促生长因子[31],因此有利于细菌的生长。如图6 所示,随YEF 浓度的增加,细菌的生长情况逐渐向好,当YEF 的添加量≥2.5 g/L,YEF 添加浓度增加,细菌的光密度基本保持不变,基于酵母浸粉黄色,添加过量会影响菌落的观察,因此,将2.5 g/L确定为培养基YEF 的最佳添加浓度。
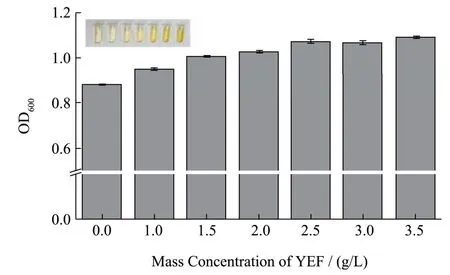
图6 YEF 质量浓度对细菌生长的影响Fig.6 The effect of YEF on bacterial growth
2.2.3 NaCl 质量浓度的优化结果
NaCl 为细菌生命活动提供无机盐,对维持细菌细胞内外渗透压平衡具有重要作用[32]。NaCl 浓度较低时,不足以提供给细菌生命活动足量的无机盐,同时细菌细胞吸水膨胀;浓度过高时,细菌细胞处于失水状态。合适的NaCl 浓度对细菌的生长繁殖具有重要意义。如图7 所示,当NaCl 浓度为5.0 g/L 时,细菌表现出较为良好的生长情况。
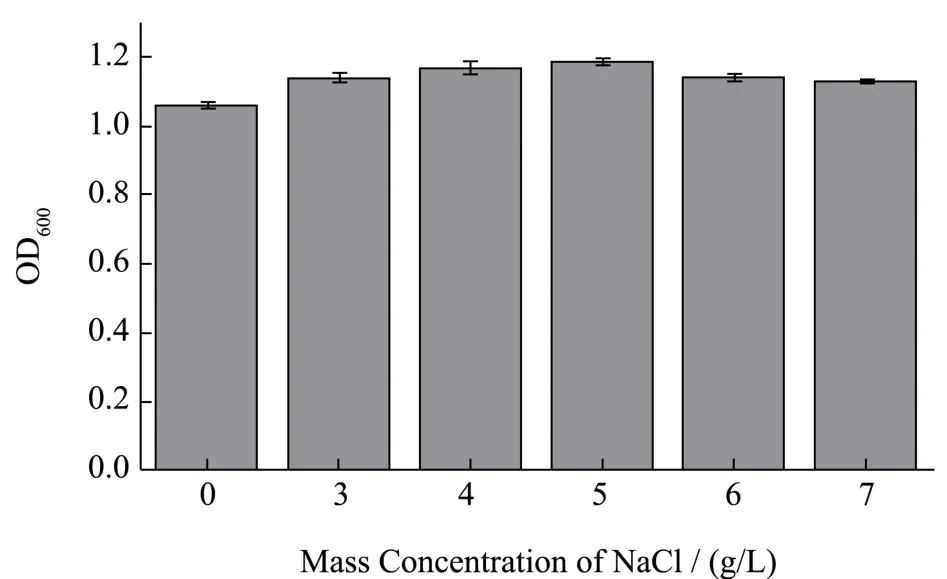
图7 NaCl 质量浓度对细菌生长的影响Fig.7 The effect of NaCl on bacterial growth
2.2.4 缓冲体系pH 值的优化结果
中性及碱性条件下,ONP 显黄色,但大肠菌群发酵产酸,因此选择合适的缓冲体系对显色结果尤为重要。初始pH 值会影响ONP 的显色效果,但同时也会影响细菌的生长情况。如图8 所示,当缓冲体系的pH值为8.0 时,410 nm 处吸光度值达到最大值,但pH值8.0 不利于细菌的生长,因此最终仍选择(7.0±0.2)作为培养基缓冲体系的pH 值。

图8 缓冲体系pH 值对显色结果的影响Fig.8 The effect of buffer system pH on coloration
2.3 显色培养基特异性验证结果
如表2 所示,利用复合显色培养基对13 株细菌进行培养观察发现,仅7 株大肠菌群菌株的显色培养基形成黄色至橙色的菌落(图9b、9c),其它6 株种牛奶中常见的致病菌在该培养基上均能够正常生长,但其菌落均为乳白色(图9a)。因此,该复合显色培养基对于大肠菌群具有特异性。
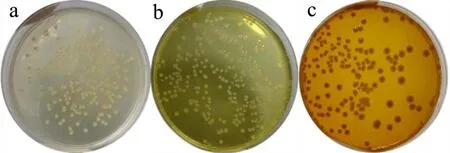
图9 不同细菌的培养和显色情况Fig.9 Culture and chromogenic results of different bacteria
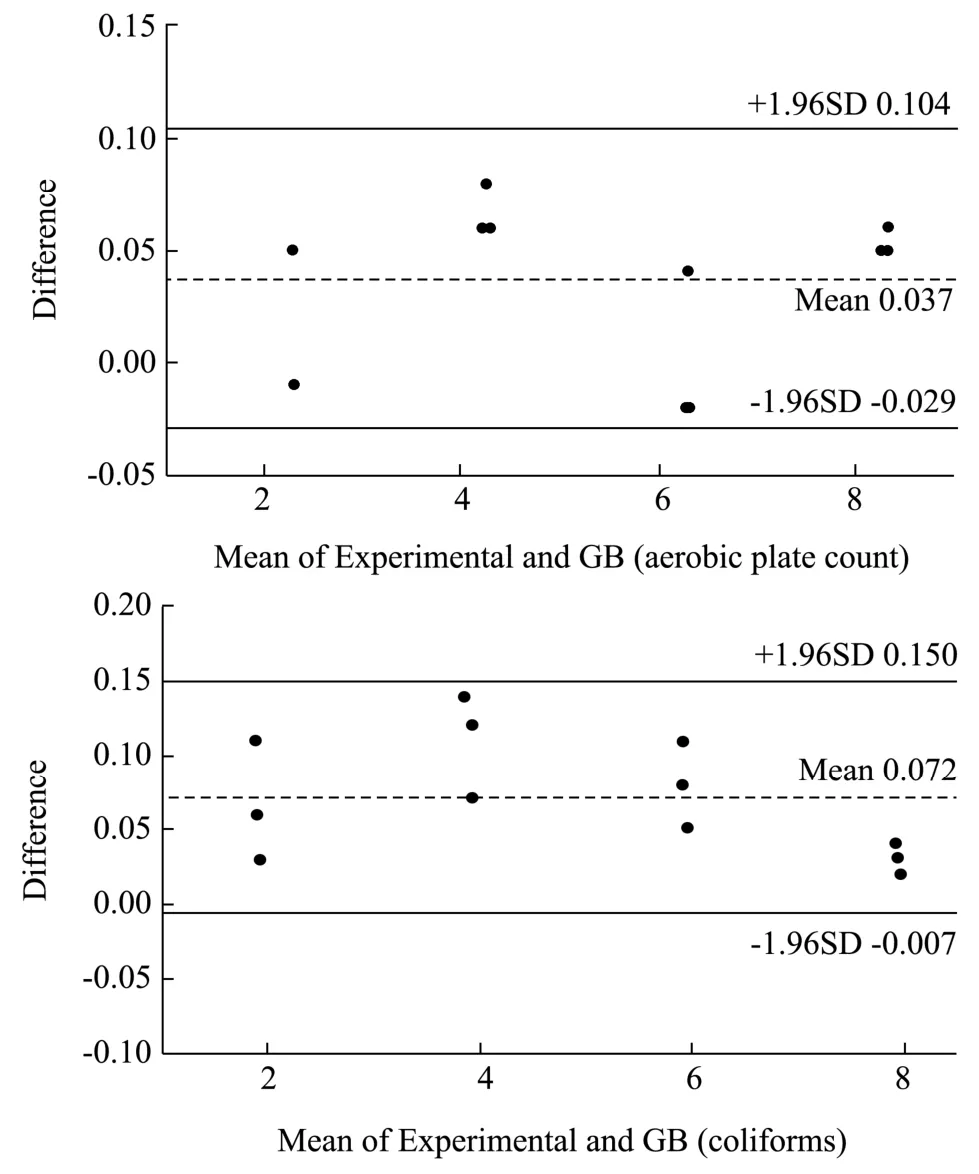
图10 实验方法和国标方法的Bland-Altman 图Fig.10 Bland-Altman plot of experimental method and national GB method

表2 显色培养基对于牛奶中常见治病菌的特异性验证Table 2 Specificity verification of chromogenic medium for common bacteria in milk

表3 本方法与国标方法的比较Table 3 Comparison between this method and national standard method
2.4 显色培养基在生乳中的实际应用结果
将Mix1和Mix2与生乳进行混合模拟自然污染生乳,将梯度稀释至合适浓度的加标样品分别与实验培养基和国标培养基混合培养,如图 10 所示,Bland-Altman 图中所有散点均分布在基本均落在95%一致性区间(即1.96 个标准差范围内),说明两种方法的一致性情况良好,即该复合显色培养基的计数结果和国标方法之间没有显著差异,可以相互替换。在相对准确的基础上,该复合显色培养基同时能够进行大肠菌群计数,具有较强的操作性和实际的应用价值,这将有助于更为高效的评估生乳的卫生情况。
3 结论
大肠菌群具有lacZ 基因,该基因表达生成β-Gal,研究结果表明培养基中添加ONPG可使大肠菌群菌落呈现黄色至橙色,而非大肠菌群菌株,如金黄色葡萄球菌、沙门氏菌等,培养后均能正常生长且菌落则呈现乳白色,无明显黄色物质产生,因此确定该复合显色培养基具备同时进行大肠菌群和菌落总数计数的可操作性条件。经优化,确定该复合显色培养基的最佳配方为CT 12.5 g/L、YEF 2.5 g/L、K2HPO42.75 g/L、KH2PO41.75 g/L、NaCl 5.0 g/L、Agar 15.0 g/L、ONPG 0.10 g/L,pH 值为7.0,在此基础上,添加0.05 g/L IPTG或2.0 g/L Lac 均能够促进β-Gal 的表达,使得黄色产物ONP 能够得快速富集,从而缩短达到可观测结果的培养时间,这对于提高检测效率具有重要意义,相反若培养基中添加Glu,Glu 则会通过诱导剂排除(乳糖运输)和分解代谢抑制两条途径抑制β-Gal 的表达,从而导致大肠菌群菌落的显色效果不佳,因此本研究将不考虑使用一般作为细菌培养基中首选碳源的Glu作为该复合显色培养基的碳源。优化后的培养基能达到与国标计数方法较为一致的准确性,因此能够应用于生乳中卫生指示性指标(大肠菌群和菌落总数)的计数,具备实际应用价值。
基于酶学的方法简便快速、准确,复合显色培养基可以通过肉眼直接观察菌落颜色,同时进行大肠菌群和菌落总数的计数和鉴定,提高了检测效率,降低了检测成本。但本研究未对诱导lacZ 基因表达的单因素进行混合验证,后续实验可进行完善,同时由于ONPG 具有较强的膜透过性,因此存在释放产物ONP外泄至细胞外,延长菌落颜色识别的时间,因此未来可讨论表面活性剂对于此的影响。
