不同方法提取广佛手膳食纤维性质的比较分析
2024-01-09华建新卓思雨田嘉瑜郭彦希周爱梅
华建新,卓思雨,田嘉瑜,郭彦希,周爱梅
(华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642)
佛手(CitrusmedicaL.var.sarcodactylisSwingle)为芸香科柑橘属常绿小乔木佛手的干燥成熟果实,其作为一种药食同源的传统中药,已有悠久的临床用药历史[1]。佛手富含精油、黄酮、多糖和膳食纤维等多种活性成分,具有抗肿瘤、抗菌、降血脂、降血糖、提高免疫和抗氧化等多种生物活性[2-5],近年来受到广泛关注。佛手因产地不同可分为“广佛手”、“川佛手”、“金佛手”和“建佛手”,其中,广佛手作为广东省重点发展保护的道地药材品种,已被列入《广东省岭南中药材保护条例》,有一定的经济价值,具有广阔的开发利用前景。
膳食纤维(Dietary Fiber,DF)是无法被胃肠道消化酶所消化的碳水化合物及其类似物的总称[6],按照溶解度可分为可溶性膳食纤维(Soluble Dietary Fiber,SDF)和不可溶性膳食纤维(Insoluble Dietary Fiber,IDF)。SDF 可溶于热水,主要成分有果胶、部分半纤维素等,也包括部分微生物多糖;IDF 不溶于热水,主要成分为纤维素、半纤维素和木质素等。与IDF 相比,SDF 在许多方面具有更强的生理功能,如排除有害金属离子、降低胆固醇、预防高血压、心脏病、胆结石和糖尿病等,而且有利于人体的消化吸收[7-9]。然而天然来源的膳食纤维中SDF 含量较少,需要采用化学法、酶法、发酵法、物理法等对天然原料改性,提高其SDF 的含量和品质。目前,提高水溶性膳食纤维的方法主要有高温蒸煮法、超微粉碎法、酶解破壁法、螺杆挤压法、超高压处理法等[10-14]。高温蒸煮法是在一定的高温高压下对膳食纤维进行改性,使其中的不溶性膳食纤维分子链断裂,增加可溶性膳食纤维的含量;超微粉碎法能利用机械动力的方法克服膳食纤维内部凝聚力,并使其破碎,从而改变膳食纤维的物理化学性质;酶解破壁法借助淀粉酶、糖化酶、纤维素酶和木聚糖酶等降解纤维素、木质素,从而得到相对纯化且得率较高的可溶性膳食纤维;超高压技术在100~1 000 MPa、室温或较低温度条件下,用水或者油作为介质传递压力给膳食纤维,使其结构发生改变,提高可溶性膳食纤维的含量,并引起性质和功能改变。
据测定,广佛手干片中含有45%左右的粗纤维,可作为膳食纤维的优质生产原料,但目前国内外对佛手尤其是对广佛手膳食纤维的研究仍处于起步阶段。因此,本研究以膳食纤维的得率、结构特性、理化性质为指标,评价不同提取方法如高温蒸煮、超微粉碎、复合酶法单独作用和复合作用对佛手膳食纤维性质的影响,以期为广佛手精深加工提供一定的实践指导意义。
1 材料与方法
1.1 材料与试剂
广佛手干片,由广东展翠食品股份有限公司提供;纤维素酶(比活力50 U/mg)、木聚糖酶(比活力6 000 U/mg),由上海源叶生物科技有限公司提供;其他试剂均为市售分析纯。
1.2 仪器与设备
AL104 万分之一电子天平、DELTA320 pH 计,梅特勒-托利多仪器(上海)有限公司;DHG-970 电热鼓风干燥箱,海齐心科学仪器有限公司;DF-101S 数显电热恒温水浴锅,巩义予华仪器有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;TGL-16G 高速台式离心机,上海安亭仪器厂;Vertex 70 傅里叶变换红外光谱,德国Bruker 公司;Ulitma IV X 射线多晶粉末仪,日本Rigaku 公司;EVO MA 15 扫描式电子显微镜,德国Zeiss 公司;LS-50HG 立式压力蒸汽灭菌锅,江阴滨江医疗设备有限公司;XDW-6B 超低温超微粉碎机,济南达威机械设备有限公司。
1.3 试验方法
1.3.1 广佛手膳食纤维提取
1.3.1.1 热水提取法(H)
参考戴建波[15]的方法,下同,称取一定量过60目筛的广佛手粉,按料液比1:20(g/mL)加水混匀,在60 ℃水浴180 min,提取完毕后冷却至室温,抽滤取滤渣,60 ℃热风干燥后得佛手IDF,称重;滤液于55~60 ℃旋转蒸发至原体积的1/3~1/4后,加入四倍体积的95%(V/V)乙醇,室温沉淀过夜,取沉淀以95%(V/V)乙醇洗涤,干燥得佛手SDF,称重;两者质量之和为佛手总膳食纤维(Total Dietary Fiber,TDF)质量。按以下公式计算得率:
式中:
Y——得率,%;
M1——膳食纤维质量,g;
M2——广佛手粉质量,g。
1.3.1.2 高温蒸煮辅助热水提取法(HTH)
称取一定量过60目筛的广佛手粉,按料液比1:20(g/mL)加水混匀,于高压蒸汽灭菌锅中120 ℃蒸煮40 min,取出后冷却至60 ℃,在60 ℃水浴180 min,提取完毕后各种DF收集方法同1.3.1.1。
1.3.1.3 超微粉碎辅助热水提取法(UMH)
称取一定量过60目筛的广佛手粉进行超微粉碎处理,按料液比1:20(g/mL)加水混匀,在60 ℃水浴180 min,提取完毕后各种DF收集方法同1.3.1.1。
1.3.1.4 纤维素酶和木聚糖酶复合酶解法(E)
称取一定量过60 目筛的广佛手粉,按料液比1:20(g/mL)加水混匀,调整pH 值为4.5,加入酶活力配比为1:1 的复合酶(纤维素酶+木聚糖酶=200 U/g+200 U/g,下同),50 ℃水浴60 min,酶解完毕后在100 ℃保持5 min 灭酶,冷却至室温,抽滤取滤渣,蒸馏水洗涤至中性,60 ℃热风干燥后得佛手IDF,称重;滤液按1.3.1.1 的方法处理,干燥得佛手SDF,称重;两者质量之和为佛手TDF 质量。
1.3.1.5 高温蒸煮辅助复合酶解提取法(HTE)
称取一定量过60目筛的广佛手粉,按料液比1:20(g/mL)加水混匀,于高压蒸汽灭菌锅中120 ℃蒸煮40 min,取出后调整pH值为4.5,加入复合酶进行酶解,具体酶解方法和各种DF收集方法同1.3.1.4。
1.3.1.6 超微粉碎辅助复合酶解法(UME)
称取一定量过60目筛的广佛手粉进行超微粉碎处理,按料液比1:20(g/mL)加水混匀,调整pH值为4.5,加入复合酶进行酶解,具体酶解方法和各种DF收集方法同1.3.1.4。
1.3.1.7 理化成分的测定
将H-TDF、HTH-TDF、UMH-TDF、E-TDF、HTE-TDF、UME-TDF六种样品进行理化成分含量对比。
水分含量测定参照GB 5009.3-2016中的直接干燥法;灰分含量测定参照GB 5009.4-2016中的第一法;蛋白质含量测定参照GB 5009.5-2016中凯氏定氮法;膳食纤维含量测定参照GB 5009.88-2014中的酶重量法。
1.3.2 广佛手膳食纤维结构性质鉴定
1.3.2.1 傅里叶变换红外光谱法(FT-IR)分析
准确称取1.5 mg 的广佛手膳食纤维样品于玛瑙研钵,再加入100 mg 干燥好的溴化钾粉末,充分研磨至无法看到晶状物为止,经压片机压成透明薄片后,使用FT-IR 在400~4 000 cm-1范围进行扫描测定。
1.3.2.2 X-射线衍射(XRD)分析
将干燥好的广佛手膳食纤维样品充分粉碎,过100目筛后进行XRD分析。操作条件:采用铜靶,管压40 kV,电流40 mA,步长0.04°,扫描速度17.7 s/步,扫描范围2θ=5°~60°。
1.3.2.3 扫描电镜(SEM)观察
将广佛手膳食纤维样品以导电胶固定在铜桩上形成薄层,用洗耳球将多余的膳食纤维粉末除去,采用离子溅射的方法喷金,通过扫描电子显微镜在2.0 kV的条件下对样品进行1 000 倍放大观察、拍照。
1.3.2.4 分子量测定
葡聚糖标准曲线的制作:采用岛津高效液相色谱仪配备示差折光检测器,凝胶色谱柱TSKgel G5000 PWxl 与TSKgel G 3000 PWxl 串联,流动相为纯水,流速为0.6 mL/min,检测时间为35 min,柱温为35 ℃,上样体积为20 µL,检测系列浓度葡聚糖标准品的色谱图,得到葡聚糖分子量对数lg M 与洗脱体积的曲线,并对曲线进行线性拟合,得到公式y=0.025x2-1.296x+19.408
分子量测定:将广佛手可溶性膳食纤维样品用流动相配制成10 mg/mL 的溶液,溶解后过0.45 µm 滤膜进样,记录色谱图。根据葡聚糖分子量标准洗脱曲线计算样品相对分子量。
1.3.3 广佛手膳食纤维理化性质分析
1.3.3.1 持水力的测定
参考Ma 等[16]的方法,称取适量广佛手膳食纤维粉末(m1),置于已知质量的50 mL 离心管(m2)中,加入40 mL蒸馏水,混匀后室温下静置1 h,4 000 r/min离心20 min,去除上清液后称重记录离心管和样品的总质量(m3),按以下公式计算持水力。
式中:
W——持水力,g/g;
m1——广佛手膳食纤维质量,g;
m2——离心管质量,g;
m3——去除上清液后离心管和广佛手膳食纤维的总质量,g。
1.3.3.2 膨胀力的测定
参考Ding 等[17]的方法,称取适量广佛手膳食纤维粉末(M),置于10 mL 具塞刻度试管中,记录样品原始体积(V2),加入10 mL 蒸馏水,混匀后室温下静置18 h,记录样品吸水膨胀后的体积(V1),按以下公式计算膨胀力。
式中:
E——膨胀力,g/g;
M——广佛手膳食纤维质量,g;
V1——样品原始体积,mL;
V2——样品吸水膨胀后体积,mL。
1.3.3.3 持油力的测定
参考Ma 等[16]的方法,称取适量广佛手膳食纤维粉末(M2),置于已知质量(M3)的50 mL 离心管中,加入花生油10 mL,室温静置l h,4 000 r/min 离心20 min,除去上层油脂和管壁上的残渣,称质量(M1),按以下公式计算持油力。
式中:
O——持油力,g/g;
M1——除去上层油脂和管壁上的残渣的总质量,g;
M2——广佛手膳食纤维质量,g;
M3——离心管质量,g。
1.3.3.4 阳离子交换能力
参考Ma 等[18]的方法,称取0.25 g 左右广佛手膳食纤维粉末,记录质量为Mc,置于100 mL 烧杯中,加入50 mLm=5% NaCl 溶液,搅拌均匀使样品充分分散在溶液中,以0.01 mol/L NaOH 滴定样品溶液至中性,记录pH 值为7 时消耗NaOH 溶液的体积为Vc。以不加样品的m=5% NaCl 为空白溶液进行滴定,记录NaOH 溶液消耗体积为V0,按以下公式计算阳离子交换能力。
式中:
C——阳离子交换能力,mol/g;
Mc——广佛手膳食纤维质量,g;
V0——空白溶液滴定消耗NaOH 溶液的体积,mL;
Vc——样品溶液滴定消耗NaOH 溶液的体积,mL。
1.3.3.5 亚硝酸盐吸附能力
NO2-标准曲线的绘制:参照GB 5009.33-2016 的方法,建立溶液中NO2-含量的标曲,得到NO2-含量(X,μg)与吸光值(Y)之间的线性回归方程为:Y=0.032 9X,R2=0.999 2。
样品吸附能力的测定:将NaNO2标准溶液分为两份,分别调节pH 值为7.0 和2.0,以模拟小肠和胃环境。向150 mL 锥形瓶中,加入50 mL 200 μg/L 的NaNO2标液,然后加入0.25 g 广佛手膳食纤维样品,记录质量为MN,于37 ℃下电磁搅拌反应,反应120 min后各取0.5 mL 样液,测定NO2-的含量,记录为X1,同时做空白实验对照,测定NO2-的含量,记录为X2,按以下公式计算亚硝酸盐吸附能力。
式中:
N——NO2-吸附量,mg/g;
MN——广佛手膳食纤维质量,g;
X1——样品溶液NO2-的含量,μg;
X2——空白溶液NO2-的含量,μg
f——稀释倍数。
1.4 数据分析
使用Origin 2018对数据进行作图;使用SPSS 22.0软件对数据进行统计学处理,采用单因素方差分析进行组间差异显著性分析,P<0.05,差异显著;结果以±s表示。
2 结果与分析
2.1 不同提取方法对广佛手膳食纤维理化成分和得率的影响
由表1 可知,在六种TDF 之间,HTE-TDF 的水分含量9.58 g/100 g 和灰分含量5.88 g/100 g 最高,UMH-TDF 的蛋白质含量7.62 g/100 g 最高,H-TDF的TDF 含量82.49 g/100 g 最高,TDF 含量大小依次为H-TDF、E-TDF、HTE-TDF、UME-TDF、HTH-TDF、UMH-TDF,其中HTH-TDF 和UMH-TDF 的TDF 含量无显著差异(P>0.05),可以看出经过高温蒸煮、超微粉碎、复合酶解处理后,TDF 含量均呈现不同程度的降低,其中复合酶解处理后降低程度最小,单独高温蒸煮和超微粉碎处理后下降较明显,但辅助复合酶解处理后TDF 含量有所提高。这可能是由于在高温蒸煮、超微粉碎处理过程中,广佛手粉的纤维被有效破坏,除膳食纤维外的其他物质溶出,导致HTH-TDF和UMH-TDF 的TDF 含量降低,但经过纤维素酶和木聚糖酶酶解后,大分子物质进一步转化为小分子物质使HTE-TDF 和UME-TDF 的TDF 含量升高[19]。

表1 广佛手粉末和不同提取方法制备的广佛手总膳食纤维理化成分对比Table 1 Comparison of physical and chemical components of total dietary fiber of bergamot powder and bergamot prepared by different extraction methods
由图1 可知,与H 法相比,HTH 法的TDF 得率无显著差异(P>0.05),其余处理均显著提高(P<0.05),其中得率最高的是E 法,为59.15%,比H 法提高了25.26%;在IDF 得率方面,HTH 法和HTE 法显著降低(P<0.05),UME 法无显著差异(P>0.05),而UMH 和E 法则显著提高(P<0.05),其中得率最高的是UMH 法,为48.45%,比H 法提高了24.29%;在SDF 得率方面,UMH 法无显著差异(P>0.05),其余处理均显著提高(P<0.05),其中得率最高的是HTE 法,为23.68%,比H 法提高了187.38%。
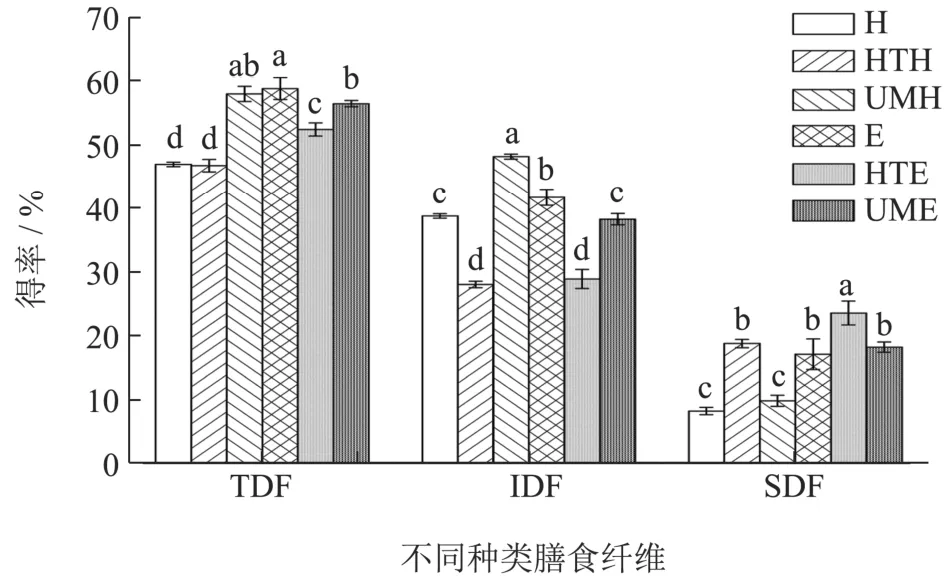
图1 不同提取方法对广佛手膳食纤维得率的影响Fig.1 Effects of different extraction methods on the yield of dietary fiber in bergamot
与H 法相比,HTH 法的TDF 得率几乎无变化,IDF 得率降低,SDF 得率升高,说明一定的高温高压打断了IDF 的分子链,从而提高SDF 的含量[20];UMH法的TDF 得率升高,IDF 得率升高,但SDF 得率几乎无变化,说明超微粉碎产生的剪切应力破坏了广佛手物料内部的凝聚力[21],从而提高其TDF 和IDF 得率,但超微粉碎产生的剪切应力可能未打断广佛手膳食纤维内部的分子链,导致其SDF 得率变化不大;E法的广佛手TDF、IDF、SDF 得率均呈现上升的趋势,说明纤维素酶和木聚糖酶的复合酶解有效降解了广佛手膳食纤维的部分链结构[22],从而使膳食纤维得率整体升高;HTE 法的广佛手TDF 和SDF 得率升高,IDF得率降低,且TDF 和SDF 得率均显著高于HTH 法(P<0.05),而IDF 得率与后者无显著差异(P>0.05),说明一定的高温高压处理可能使广佛手膳食纤维的酶解位点增多,从而使酶解作用更充分,导致IDF 更多转化为SDF[8];UME 法的广佛手TDF 和SDF 得率升高,IDF 得率无显著变化,其中TDF 得率略低于UMH法(P>0.05),SDF 和IDF 得率则分别高于和低于后者(P<0.05),说明经过超微粉碎处理后可使酶解作用更充分,提高SDF 得率。
2.2 不同提取方法对广佛手膳食纤维结构特性的影响
2.2.1 广佛手膳食纤维的FT-IR 分析
FT-IR 可检测分子结构中的化学键和基团,分析膳食纤维的结构。图2a 和图2b 为六种不同提取方法制备的广佛手IDF 和SDF 的FT-IR 图谱。整体上看,六种IDF 和SDF 的出峰位置类似,其中HTE-IDF 的各吸收峰强度均高于其他IDF,而H-SDF 的各吸收峰强度均高于其他SDF,UME-SDF 次之。
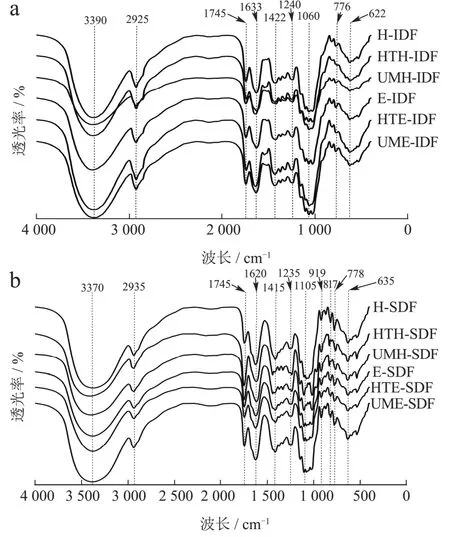
图2 不同提取方法对广佛手膳食纤维主要官能团的影响Fig.2 Effects of different extraction methods on main functional groups of dietary fiber in bergamot
六种不同提取方法制备的IDF 和SDF 均存在3 370~3 390 cm-1附近出现的宽展圆滑吸收峰、1 620~1 633 cm-1附近出现的强锋以及1 415~1 422 cm-1附近出现的弱锋,具有-OH、C=O 和C-H 伸缩振动的特征,表明经过不同提取方法制备的IDF和SDF仍具备多糖的官能团[23]。在3 370~3 390 cm-1的宽吸收峰是羟基的O-H 拉伸特征峰[24],HTE-IDF 和H-SDF 在此处的峰强度最高,而经过复合酶解处理提取的广佛手膳食纤维在此处的吸收峰强度也较高,如 E-IDF、HTE-IDF、UME-IDF 和E-SDF、HTE-SDF、UME-SDF等,可能是由于高温蒸煮、超微粉碎产生的机械应力和酶解导致广佛手膳食纤维分子间更多的氢键暴露出来[19]。2 925~2 935 cm-1附近的吸收峰为CH3、CH2、CH 等的C-H 伸缩振动,与膳食纤维中疏水基团的含量有关[25]。1 620~1 633cm-1和1 415~1 422 cm-1处的吸收峰分别归因于不对称和对称的C=O 拉伸,这是由半乳糖醛酸的存在所引起[15],HTE-IDF 和H-SDF 在此处的吸收峰强度最高,表明其可能有更多糖醛酸的存在。1 060~1 105 cm-1的吸收峰归因于环振动与C-OH侧基的伸缩振动和C-O-C 糖苷键的振动重叠[25],表明六种SDF 均存在吡喃糖形式的多糖结构,该结构也是果胶的多聚半乳糖醛酸结构,HTE-IDF 和H-SDF 在此处的吸收峰强度均高于其他方法。在919 cm-1附近有一个明显吸收峰,这是由于吡喃环的非对称环伸缩振动引起[26];接近776~817 cm-1处的吸收峰证明存在α-D-吡喃葡萄糖结构;622~635 cm-1附近的吸收峰则为硫酸多糖中硫酸盐的残留峰[15]。六种提取方法获得的广佛手IDF 和SDF 的傅里叶红外光谱出峰位置类似,其中HTE-IDF 的各吸收峰强度均高于其他IDF,说明高温蒸煮辅助复合酶解处理能使广佛手IDF 的主要官能团暴露出来,进一步发挥其作用;H-SDF 的各吸收峰强度均高于其他SDF,说明不同提取方法均会不同程度影响广佛手SDF 的主要官能团,其中UME-SDF 的峰强度受影响较小。
2.2.2 广佛手膳食纤维的XRD 分析
膳食纤维主要由有序结晶区和非晶区组成,它们分别占70%和30%,XRD 分析可评估结晶度的变化,分析膳食纤维分子的聚集状态。从图3a 和图3b可以看出,六种不同提取方法制备的广佛手IDF 和SDF 的峰形相似,均在衍射角 16.66°~17.62°、20.72°~20.78°和36.24°~36.48°附近出现衍射峰,具有典型纤维素Ⅰ型结构所对应的晶面,且结晶与非结晶区共存[27]。相比于H-IDF,其他提取方法所得IDF 在20.78°、36.48°、39.36°、55.26°、63.88°处的峰强度均有降低,可能是经过高温蒸煮、超微粉碎和酶解处理后,部分广佛手IDF 向SDF 转化及破坏部分可维持聚合物网络结构的氢键所致[28];在SDF方面,HTE-SDF 的整体衍射强度相对较高,可能原因是高温蒸煮辅助复合酶解处理破坏了部分纤维素链,去除半纤维素等非晶态组分,使SDF 纤维素分子间的氢键更多暴露出来[8]。
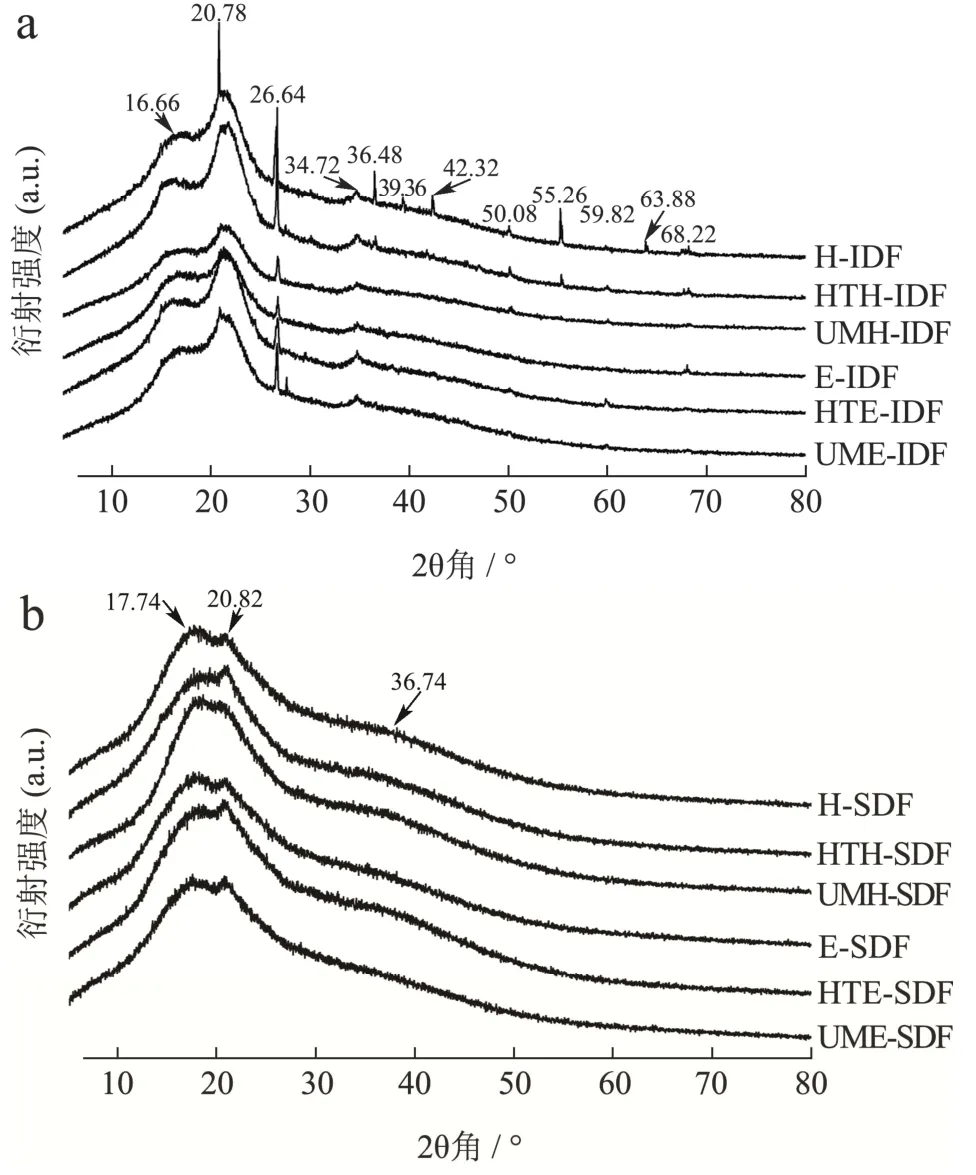
图3 不同提取方法对广佛手膳食纤维晶型的影响Fig.3 Effects of different extraction methods on crystal form of dietary fiber in bergamot
2.2.3 广佛手膳食纤维的SEM 分析
如图4 所示,不同提取方法对广佛手IDF 结构的影响较较小。在相同的观察倍数下(1 000×),六种不同提取方法制备的IDF 均呈现颗粒状结构,且表面分布褶皱,存在大量微小孔洞,但颗粒大小存在差异。由图5 则可以看出,不同提取方法对广佛手SDF 的结构影响较大。在相同的观察倍数下(1 000×),H-SDF 呈现出不规则的片状结构,结构紧密,且比表面积较大;HTH-SDF 呈现层叠的不规则片状结构,结构较为疏松,可能是因为高温蒸煮处理破坏了纤维分子链的初始结构[29];UMH-SDF 呈现连续光滑的不规则片状结构,结构较紧密,可能是因为膳食纤维的结构完整性受到破坏,其表面粗糙度降低[30];E-SDF 呈现层叠的不规则片状结构,相较于H-SDF 结构更疏松,可能是经酶水解后,SDF 中纤维素链的部分糖苷键被降解,表现出更粗糙的表面结构[31];HTE-SDF 呈现层叠的不规则片状结构,结构较为紧密,且层叠层数较多,可能是在高温蒸煮处理的条件下复合酶解进一步促进了纤维的断裂,导致层隙的形成[29];UME-SDF 呈现弯曲不规则的微小片状结构,结构疏松,可能是超微粉碎处理后SDF 的结构松动,使酶更容易作用在结合位点,从而使比表面积更大。

图4 不同提取方法对广佛手不溶性膳食纤维表面结构的影响Fig.4 Effects of different extraction methods on surface structure of insoluble dietary fiber in bergamot

图5 不同提取方法对广佛手可溶性膳食纤维表面结构的影响Fig.5 Effects of different extraction methods on surface structure of soluble dietary fiber in bergamot
2.2.4 广佛手可溶性膳食纤维的分子量分析
分子量会影响膳食纤维的水化特性、阳离子交换能力、质地和应用特性。分析不同提取方法所得广佛手可溶性膳食纤维分子量间的差异,结果如图6。六种提取方式所得到的可溶性膳食纤维分子量谱图较为相似,但占比和分子量大小有所差异,其中H-SDF 主要含有3 个组分172 520 ku(10.89%)、372 ku(11.04%)、1.38 ku(68.96%);HTH-SDF 主要含2 个组分14 962 ku(59.72%)、1.46 ku(35.31%)。UMH-SDF 主要含2个组分83 705 ku(20.32%)、1.35 ku(71.06%);E-SDF主要含2 个组分71 360 ku(23.12%)、1.44 ku(63.14%);HTE-SDF 主要含2 个组分54 285 ku(37.08%)、1.42 ku(58.02%)。UME-SDF 主要含2 个组分55 949 ku(31.24%)、1.38 ku(61.62%),可知除H-SDF 外,其他五种SDF 的分子量主要存在Mw>10 000 ku、2 ku>Mw>1 ku 两个组分,且经过不同提取方法处理后,H-SDF 中分子量最大组分(Mw>100 000 ku)和中间组分(1 000 ku>Mw>100 ku)在其他SDF 中没有出现,小分子组分(2 ku>Mw>1 ku)均有出现,可能是提取过程中采用高温蒸煮、超微粉碎、复合酶解等处理后使SDF 大分子量组分降解为更小分子量的组分,同时也使一定分子量的组分(100 000 ku>Mw>10 000 ku)出现[32]。经过复合酶解处理后,E-SDF 的大分子组分分子量下降,但占比升高,可能是因为酶解提取影响了SDF 的化学结构,导致其水解成较小分子组分[33],经过单独高温蒸煮、超微粉碎处理后的HTH-SDF 和UMH-SDF 呈现类似的变化趋势。对高温蒸煮和超微粉碎处理进一步辅助复合酶解后,HTE-SDF 的大分子组分分子量升高,但占比降低,原因可能是高温蒸煮辅助复合酶解使SDF 释放部分大分子量组分,Yang 等[29]的研究也报道了类似的结果,UME-SDF 的大分子组分分子量继续降低,但占比增加,可能是超微粉碎辅助复合酶解对SDF 的结构破坏较大,导致其分子量进一步降低。
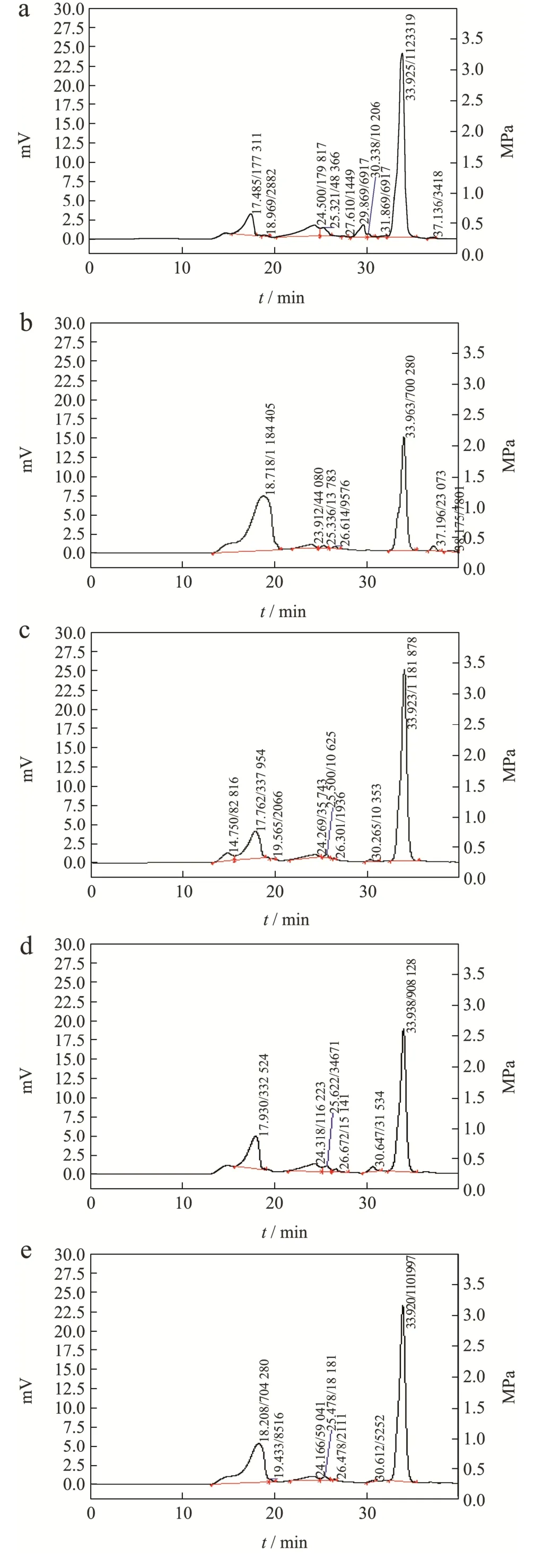
图6 不同提取方法对广佛手可溶性膳食纤维分子量的影响Fig.6 Effects of different extraction methods on molecular weight of soluble dietary fiber in bergamot
2.3 不同提取方法对广佛手膳食纤维理化性质的影响
2.3.1 广佛手膳食纤维的持水力、持油力和膨胀力
膳食纤维与水相互作用的能力是其通过物理吸附作用发挥生理功能的重要基础;膳食纤维持油力的提高有利于其作为添加剂在脂肪、乳液含量较高的食品中应用,且可同时承担一定的稳定剂功能;而膳食纤维与过量的水作用后其质量和体积的变化情况,可较好地反映膳食纤维的容积以及水合能力[34]。
由表2 可以看出,在持水力方面,与H-IDF 相比,HTH-IDF、UMH-IDF 和E-IDF 的持水力无显著变化,而HTE-IDF和UME-IDF的持水力显著提高(P<0.05),其中HTE-IDF 的持水力最高(8.37 g/g);在持油力方面,与H-IDF 相比,HTH-IDF 和E-IDF 的持油力显著降低(P<0.05),UME-IDF 无显著变化(P>0.05),UMH-IDF 和HTE-IDF 显著提高(P<0.05),其中HTE-IDF 的持油力最高(2.11 g/g),这可能是因为高温蒸煮处理和酶解处理单独作用时均会使广佛手IDF的结构变得相对松散,但两者复合处理(高温蒸煮辅助复合酶解处理)时可能使广佛手IDF 存在多孔洞结构[34];在膨胀力方面,与H-IDF 相比,其余五个处理所得IDF 的膨胀力均显著提高(P<0.05),其中E-IDF的膨胀力最高(9.89 mL/g),可能是因为复合酶解暴露了广佛手IDF 表面的极性和非极性基团[30]。
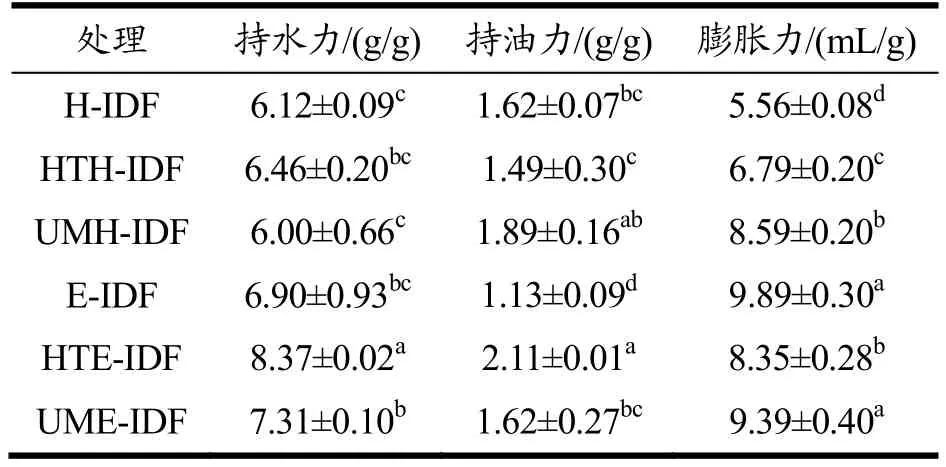
表2 不同提取方法对广佛手不溶性膳食纤维持水力、持油力和膨胀力的影响Table 2 Effects of different extraction methods on water holding capacity,oil holding capacity and swelling capacity of bergamot insoluble dietary fiber
由表3 可以看出,在持水力方面,与H-SDF 相比,HTH-SDF、UMH-SDF、HTE-SDF 的持水力均显著降低(P<0.05),E-SDF 和UME-SDF 略有提高但无显著性差异(P>0.05),其中E-SDF 的持水力最高(9.69 g/g),可能原因是高温蒸煮、超微粉碎、高温蒸煮辅助复合酶解处理会使广佛手SDF 的结构变松散,且对膳食纤维分子链中的糖苷键破坏较大,使更多亲水基团暴露,而复合酶解和超微粉碎辅助复合酶解处理对广佛手SDF 的空间结构影响较小[29,34];在持油力和膨胀力方面,与H-SDF 相比,HTH-SDF 和HTE-SDF 均显著降低,而UMH-SDF、E-SDF 和UME-SDF 均显著提高(P<0.05),HTH-SDF 和HTE-SDF 持油力的变化规律与持水力的相同,但UMH-SDF 的持油力呈现相反的规律,原因可能是超微粉碎、复合酶解和超微粉碎辅助复合酶解处理后广佛手SDF 有助于油脂的吸附[17],UMH-SDF、E-SDF和UME-SDF 的膨胀力较高的原因可能是经过超微粉碎、复合酶解和超微粉碎辅助复合酶解处理后广佛手的SDF 暴露了更多氢键[35],其中UME-SDF 的持油力最高(13.76 g/g),而E-SDF的膨胀力最高(7.42 mL/g)。
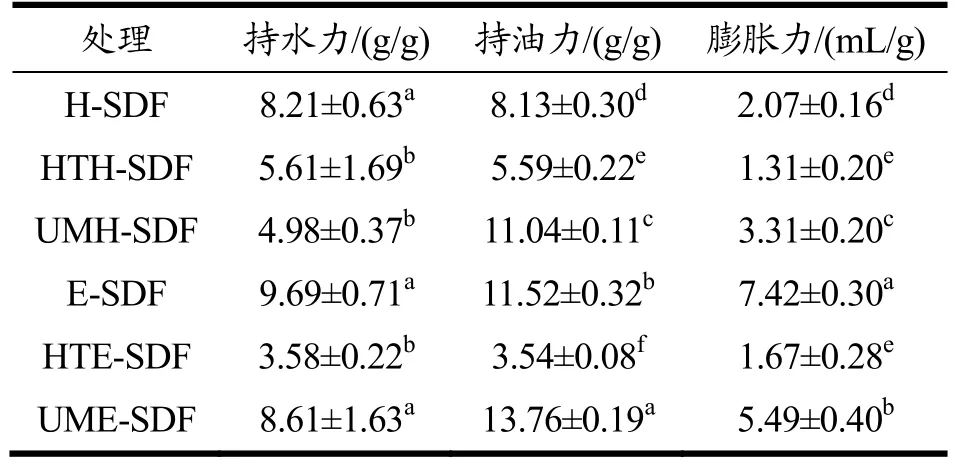
表3 不同提取方法对广佛手可溶性膳食纤维持水力、持油力和膨胀力的影响Table 3 Effects of different extraction methods on water holding capacity,oil holding capacity and swelling capacity of bergamot soluble dietary fiber
2.3.2 广佛手膳食纤维的阳离子交换能力
膳食纤维分子的侧链基团中含有部分羧基和氨基,具有一定的弱酸性阳离子交换能力,这使其具有维持人体肠道pH 值稳定、控制离子浓度平衡及调节渗透压的生理功能[36]。
由图7a 可知,与H-IDF 相比,HTH-IDF 的阳离子交换能力显著降低,UMH-IDF、HTE-IDF 和UME-IDF 则显著提升(P<0.05),而E-IDF 无显著差异(P>0.05),其中HTE-IDF 的阳离子交换能力最高(0.24 mol/g)。由图7b可知,与H-SDF相比,HTH-SDF的阳离子交换能力显著降低(P<0.05),而UMH-SDF、E-SDF、HTE-SDF 和UME-SDF 无显著变化(P>0.05),其中E-SDF 的阳离子交换能力最高(0.31 mol/g)。这可能是因为高温蒸煮或超微粉碎辅助复合酶解处理会破坏膳食纤维分子链的共价键,暴露出更多的羧基和羟基,使其更有利于阳离子交换[18],但单独高温蒸煮处理会降低广佛手膳食纤维的阳离子交换能力,IDF 和SDF 均呈现相似的规律。

图7 不同提取方法对广佛手膳食纤维阳离子交换能力的影响Fig.7 Effects of different extraction methods on cation exchange capacity of dietary fiber in bergamot
2.3.3 广佛手膳食纤维的亚硝酸盐吸附能力
膳食纤维具有较疏松的结构,且存在一些具有较强亚硝酸盐结合力的基团包括羧基、羧甲基和酚酸等,可作为良好的亚硝酸盐吸附剂[37]。
由图8a 可知,pH 值为2 时,与H-IDF 相比,HTH-IDF、E-IDF 的亚硝酸盐吸附能力显著降低(P<0.05),而UMH-IDF、HTE-IDF 和UME-IDF 无显著差异(P>0.05),其中UMH-IDF 的亚硝酸盐吸附能力最高(12.87 mg/g),说明超微粉碎、高温蒸煮辅助复合酶解、超微粉碎辅助复合酶解对广佛手IDF中能吸附亚硝酸盐的基团影响较小[38];pH 值为7 时,与H-IDF 相比,HTH-IDF 的亚硝酸盐吸附能力(7.28 mg/g)显著升高(P<0.05),其他处理则无显著差异(P>0.05),说明高温蒸煮处理可使广佛手IDF结构变得疏松。由图8b 可知,pH 值为2 时,与H-SDF相比,其余五个处理获得的广佛手SDF 的亚硝酸盐吸附能力均显著降低(P<0.05),其中HTE-SDF(3.36 mg/g)和UME-SDF(3.39 mg/g)的下降幅度相对较小,可能是高温蒸煮、超微粉碎和酶解处理均破环了与吸附亚硝酸盐能力有关的基团,且酸性条件下,亚硝酸盐离子在广佛手SDF 上的吸附可能属于化学吸附而不是物理吸附[39];相反,pH 值为7 时,与H-SDF 相比,其余五个处理得到的广佛手SDF 的亚硝酸盐吸附能力均显著升高(P<0.05),其中UME-SDF最高(1.54 mg/g),E-SDF(1.40 mg/g)和HTE-SDF(1.17 mg/g)次之,说明高温蒸煮、超微粉碎和酶解处理均能使广佛手SDF 的结构更适合吸附亚硝酸盐离子。上述结果还说明,广佛手膳食纤维在模拟胃环境(pH 值2)条件下的亚硝酸盐吸附能力优于小肠环境(pH 值7),原因可能是pH 值较低时,H+与亚硝酸盐离子反应生成HNO2,并进一步生成能与广佛手膳食纤维中酚酸基团快速反应的氮氧化合物[37]。

图8 不同提取方法对广佛手不溶性膳食纤维亚硝酸盐吸附能力的影响Fig.8 Effects of different extraction methods on nitrite adsorption capacity of insoluble dietary fiber in bergamot
3 结论
不同提取方法对广佛手膳食纤维的理化成分、得率、结构和理化性质会产生不同的影响。在理化成分方面,在六种TDF 之间,HTE-TDF 的水分含量9.58 g/100 g 和灰分含量5.88 g/100 g 最高,UMH-TDF的蛋白质含量7.62 g/100 g 最高,H-TDF 的TDF 含量82.49 g/100 g 最高;在得率方面,E-TDF 的得率最高,为59.15%;UMH-IDF 的得率最高,为48.45%;HTE-SDF 的得率最高,为23.68%。
在结构特性方面,六种提取方法获得的广佛手IDF 和SDF 的傅里叶红外光谱出峰位置类似,其中HTE-IDF 和H-SDF 的各吸收峰强度相对较高;六种不同提取方法制备的广佛手IDF 和SDF 的X-射线衍射峰峰形也相似,其中H-IDF 和HTE-SDF 的整体衍射峰强度相对较高;六种不同提取方法制备的广佛手IDF 的表面结构类似,但六种广佛手SDF 的表面结构则存在一定差异;在六种SDF 之间,采用高温蒸煮、超微粉碎、复合酶解等处理后所得SDF 的大分子量组分降解为更小分子量的组分。
在理化性质方面,HTE-IDF 的持水力、持油力、阳离子交换能力最高,E-IDF 的膨胀力最高,pH 值2时UMH-IDF 的亚硝酸盐吸附能力最高,而pH 值7时HTH-IDF 的亚硝酸盐吸附能力最高;另一方面,E-SDF 的持水力、膨胀力最高,UME-SDF 的持油力最高,E-SDF 的阳离子交换能力最高,pH 值2 时H-SDF 的亚硝酸盐吸附能力最高,而pH 值7 时UME-SDF 的亚硝酸盐吸附能力最高。
综上所述,高温蒸煮辅助复合酶解法对广佛手膳食纤维总体性质影响较好,且SDF得率最高,从得率、性质保持、工艺条件等方面来看,高温蒸煮辅助复合酶解法在广佛手膳食纤维提取上具有广阔的应用前景。
