牛蒡根蛋白-降压肽纳米颗粒的制备及稳定性表征
2024-01-09李在群柴智冯进马恺扬李莹
李在群,柴智,冯进,马恺扬,李莹*
(1.江苏大学食品与生物工程学院,江苏镇江 212000)(2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
牛蒡俗称东洋参,属菊科草本植物,是一种具有较高食用价值和药用价值的中药。牛蒡根具有抗菌、抗氧化、降血糖等药理活性[1],新鲜牛蒡根由70%水、2.8%蛋白质、25%碳水化合物及0.6%灰分组成,其中蛋白质为牛蒡根重要组成成分[2]。然而,牛蒡作为食品原料的研究已经非常广泛,但其研究重点多为牛蒡多糖与膳食纤维[3],而不是牛蒡蛋白。随着消费者对食品安全的担忧和动物源蛋白价格的上涨,人们对天然植物源蛋白的兴趣不断增加[4]。据报道,根茎中膳食蛋白质被认为是一种具有较高生物价值的蛋白质[5]。例如,Tran 等[6]报道的山参蛋白介导的纳米颗粒表现出良好的抗炎效果。牛蒡根干片中蛋白质含量为12.3%,蛋白质在加工过程中作为副产品被丢弃,造成蛋白质资源的浪费。而牛蒡根中氨基酸含量比较丰富,其中药效氨基酸占氨基酸总量的77.65%,鲜味氨基酸为36.34%,同时也是一种成本较低的天然植物蛋白来源[7]。
从泥鳅中提取的降压肽具有较强的血管紧张素转化酶(Angiotensin Converting Enzyme,ACE)抑制活性[8],然而,生物活性肽易被胃肠道中的酶降解,需要通过载体保护其能递送到有效作用靶位点[9]。这可以通过纳米载体包埋来实现,以保护其结构和功能完整性,并提高其对胃肠道蛋白酶和肽酶的稳定性。因此,包封已成为促进生物活性肽作为功能性食品增强人类健康的相关重要技术,它保护生物活性肽免受物理化学影响,并增强其在体外和体内的功效[10]。
纳米颗粒作为载体具有多种优势,纳米技术已成为制药科学领域的重要组成部分。在纳米颗粒中,蛋白质基纳米颗粒是最重要的。研究表明,蛋白质基纳米颗粒与其他类型的纳米颗粒相比具有无毒和可生物降解等优势[11]。Yang 等[12]测试了乳清蛋白水解物在麦芽糖糊精和β-环糊精胶囊中的包封效果。另一方面,Alvarado 等[13]使用海藻酸盐阿拉伯胶包封抗高血压肽。这些研究中最重要的结果是证实了包埋可以提高活性物质的稳定性。尽管如此,关于活性分子包封优点的证据是不够的,需要更多的研究来证明,以便提供有关活性分子包埋技术的相关数据。
本研究通过自组装制备负载泥鳅降压肽的牛蒡根蛋白纳米颗粒,探讨不同因素对AHLL 的包埋效果及其稳定性情况,同时对牛蒡根蛋白纳米颗粒的粒径、微观形态和结构进行表征,不仅提高牛蒡根蛋白的利用率,而且为泥鳅源降压肽的口服利用提供了基础。
1 材料与方法
1.1 试剂与仪器
牛蒡粉,实验室前期制备;血管紧张素转化酶抑制肽,上海强耀公司;Tris-HCl 缓冲液,上海源叶生物有限公司;透析袋(8 000~14 000 u),上海源叶生物有限公司;BCA 蛋白定量试剂盒,上海碧云天生物技术有限公司;PAGE 预制胶,上海碧云天生物技术有限公司;其余试剂均为国产分析纯。
BX-2F 磁力搅拌器,常州普天仪器制造有限公司;TGL-50 WS 型大容量高速离心机,巩义市宏华仪器设备工贸有限公司;LB 941 TriStar 微孔板多功能分析仪,德国Berthold Technologies 公司;1260 Infinity 高效液相色谱仪,美国Agilent 公司;Alpha-1900Plus 紫外分光光度计,上海普元仪器有限公司;F-7000 荧光分光光度计,日本Hitachi 公司;500 型精密电子天平,意大利BEL 公司;DK-8D 电子恒温水浴槽,上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 牛蒡蛋白提取
采用Tris-HCl 缓冲液浸提法提取牛蒡根蛋白[14],取4 g 牛蒡粉按照1:10 料液比加入pH 值8 和pH 值9的NaOH 溶液与不同浓度Tris-HCl 缓冲液(pH 值7.4)40 mL,充分摇匀混合后4 ℃冰箱浸提过夜(约10 h),充分浸提后7 000 r/min 离心10 min 取上清液,向上清液中加入硫酸铵至饱和度为85%(m/V),4 ℃冰箱过夜后6 000 r/min 离心10 min,除去上清液得到蛋白质浸膏,加入少量Tris-HCl 缓冲液使蛋白质溶解,使用超纯水透析(截留量为8 000~14 000 u)3 d,冻干后得到牛蒡根蛋白粉末。
1.2.2 蛋白含量测定
将得到的0.5 mg 牛蒡粗蛋白加入1 mL 超纯水中复溶,充分混匀后6 000 r/min,离心10 min,取上清液。采用BCA 法对提取的牛蒡粗蛋白进行测定[15],按照试剂A 与试剂B 50:1 的比列配制工作液,将0.5 mg/mL 的标准品按1、2、4、8、12、16、20 μL 加到96 孔板中,并用PBS 补足至20 μL,分别加入200 μL BCA 工作液混匀,37 ℃静置30 min,波长562 nm 酶标仪测定不同浓度标准品的吸光度,以蛋白质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,回归方程为:y=0.904x+0.091 3(R2=0.999 3)。牛蒡粗蛋白中的蛋白质含量根据以上方程及蛋白测定的浓度求得。
1.2.3 Native-PAGE 分析
将制备的蛋白上清液置于离心管中,加入上样缓冲液2 mL,混匀,10 000 r/min 离心3 min 取上清,上样量为20 μL,配制12%(V/V)分离胶,5%(V/V)浓缩胶,以恒流模式进行凝胶电泳。利用0.25%(m/m)考马斯亮蓝(R-25)染液对凝胶染色1 h,使用脱色液(乙酸:乙醇:水=50:75:875)4 ℃冰箱脱色6 h。
1.2.4 BANPs 制备
用HBSS 配制0.01 mol/L 平衡盐溶液,将20 mg AHLL 溶于1 mL HBSS 中制成20 mg/mL 的AHLL 母液,将15 mg 牛蒡根蛋白溶于10 mL 纯水中磁力搅拌30 min,使蛋白充分溶解,将溶液pH 值调节至5,向溶液中缓慢滴加20 mg/mL AHLL 母液使其最终质量浓度为200 μg/mL,随后置于4 ℃层析柜磁力搅拌2 h使其充分结合。通过超高压微射流(12 000 PSI)后,用纯水进行透析,透析期间每4 h 更换一次透析液,透析3 d 后将溶液取出避光保存。
1.2.5 BRP质量浓度对包封率及载药量的影响
控制AHLL 质量浓度为400 μg/mL,其他因素条件不变,利用一系列质量浓度梯度的AHLL 溶液制备BANPs 溶液。探讨不同质量浓度的AHLL 对纳米颗粒溶液的包埋效果。包埋率与载药量由下式计算:
式中:
E——包埋率,%;
L——载药量,%;
A0——投入AHLL 的质量浓度,μg/mL;
A1——游离AHLL 的质量浓度,μg/mL;
A2——投入BRP 的质量浓度,μg/mL。
1.2.6 AHLL 质量浓度对包封率及载药量的影响
控制BRP 为8 mg/mL,其他因素条件不变,利用一系列浓度梯度的AHLL 溶液制备BANPs 复合纳米颗粒溶液。探讨不同浓度的AHLL 对复合纳米颗粒溶液的包埋效果。
1.2.7 BANPs 结构测定
1.2.7.1 扫描电子显微镜(SEM)实验
吸取10 µL按上述1.2.4的方法制备的复合纳米颗粒载体溶液滴加在洁净的盖玻片上室温下烘干液滴后,再将盖玻片粘结在具有导电装置的样品台上,在真空环境下做喷金处理操作,在扫描电镜下观测样品形态特征。
1.2.7.2 粒径及Zeta 电位测定
使用动态光散射测定纳米颗粒的粒径分布和电位。将上述按1.2.4 制备的BRP、BANPs 溶液放入纳米粒度仪的检测槽中,设置温度为(25±1)℃、光散射角度90°,功率30 W。在此条件下测定复合纳米颗粒的粒径和Zeta 电位数值。
1.2.7.3 傅里叶变换红外光谱
采用傅立叶变换红外光谱光谱仪评估了BRP 与AHLL 之间的相互作用。将BANPs 冻干粉末用杵手工研磨成粉末。将研磨好的粉末在4×108Pa 的压力下压制成薄片。以空气为背景,在500~4 000 cm-1和4 cm-1分辨率范围内分析红外吸收扫描。
1.2.7.4 荧光光谱分析
使用荧光分光度计对BRP 与BANPs 进行内源荧光测定。将上述制备的复合纳米颗粒溶液加入微量比色皿中,荧光激发波长280 nm,荧光发射波长285~500 nm,激发缝宽3 nm,发射狭缝宽度10 nm,扫描速度为300 nm/min,于此条件下对样品进行检测。
1.2.7.5 紫外-可见光分析
使用紫外分光度计对BRP、BANPs 及AHLL 进行紫外-可见光光谱扫描,将上述制备的复合纳米颗粒溶液加入石英比色皿中,紫外光谱扫描起始波长190 nm,终止波长600 nm 对样品进行紫外检测。
1.2.7.6 不同解离溶剂对纳米颗粒的影响
利用尿素、NaCl 和SDS 对BANPs 原液进行稀释,得到尿素稀释液(6 mol/L)、NaCl 稀释液(0.5 mol/L)和SDS 稀释液(0.5%)样品。对每个样品的浊度、粒径和Zeta 电位进行测定。
1.2.8 BANPs 稳定性测定
1.2.8.1 温度对纳米颗粒稳定性的影响
将制备好的将制备好的AHLL、BRP、BANPs 溶液分别置于不同温度(60、70、80、90、100 ℃)的水浴锅中保温1 h 后取样,对照为AHLL 溶液标品,取样后过0.45 µm滤膜,用高效液相法测定多肽AHLL的保留量,并利用动态光散射对其粒径和电位进行测定。AHLL 的降解率由下式计算:
式中:
R——降解率,%;
A0——初始AHLL 的质量浓度,μg/mL;
A1——处理后AHLL 的质量浓度,μg/mL。
1.2.8.2 pH 值对纳米颗粒稳定性的影响
调节AHLL、BRP、BANPs 复合纳米颗粒溶液pH值(4.0、5.0、6.0、7.0、8.0),磁力搅拌60 min 后,用高效液相法测定多肽AHLL 的保留量,并利用动态光散射对其粒径和电位进行测定。
1.2.9 数据处理
所有实验数据至少重复3 次,数据结果以平均值和标准差表示。采用SASS 9.4 统计软件对数据进行统计分析,P<0.05 表示有统计学差异。
2 结果与讨论
2.1 浸提溶剂对BRP提取率及蛋白含量的影响
碱溶酸沉法是蛋白质提取的传统方法。本研究采用NaOH 溶液(pH 值8.0、9.0)和0.05、0.1、0.2 mol/L Tris-HCl 缓冲液作为浸提溶剂分别对BRP 进行提取,并考察了BRP 的提取率及蛋白含量。由图1 可知,浸提溶剂的种类和浓度对BRP 的提取率和蛋白含量具有显著的影响。传统碱液提取时,BRP 提取率较低,且长时间的碱液浸提也易造成蛋白质的变性和有害物质生成,对蛋白质的后续利用产生不良影响。Tris-HCl 缓冲液显著提升了 BRP 的提取率(P<0.05),且提取率和蛋白含量随着缓冲液体系浓度的增加而表现出增大的趋势。0.2 mol/L Tris-HCl缓冲液作为浸提溶剂时,BRP 的得率和蛋白含量最高,分别为6.62%和68.62%。
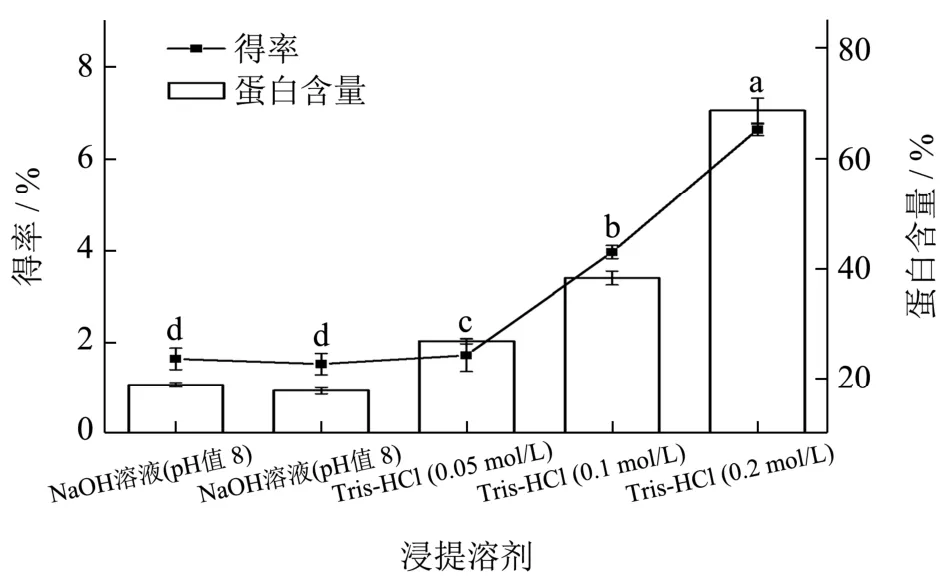
图1 不同浸提溶剂对牛蒡根蛋白提取率及蛋白含量的影响Fig.1 Effects of different extraction solvents on the extraction yield and protein content of burdock root protein
2.2 BRP 的Native-PAGE 分析
通过非变性聚丙烯酰胺凝胶电泳分析了BRP 的均一性,这是一种在非变性条件下分离蛋白复合物的高分辨率方法[16]。结果如图2 所示,天然的BRP 仅在75~100 ku 之间有一条明显的条带,表明大部分BRP 都集中在这个分子量范围内,提取得到的BRP 较为均一。此外,本研究采用的溶剂提取法对BRP 的影响较小,没有破坏牛蒡中固有蛋白组成,也没有杂蛋白干扰。
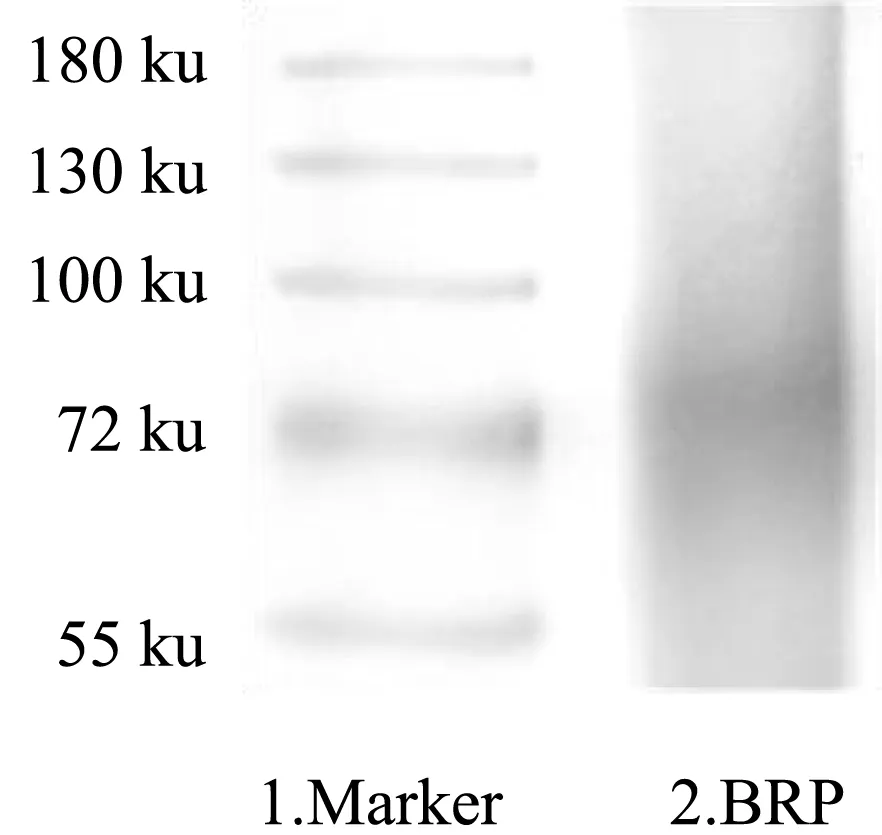
图2 BRP 的Native-PAGE 电泳图谱Fig.2 Native-PAGE electrophoretic pattern of BRP
2.3 BRP、AHLL 质量浓度对BANPs 包封率和载药量的影响
活性肽的包封效率是影响其稳定性和功能发挥的重要因素之一[17]。为此,本研究测定了BRP 和AHLL的质量浓度变化对降压肽包封效率及载药量的影响。固定降压肽AHLL 的添加量为200 μg/mL,保持其它条件不变的情况下制备BANPs,探讨载体蛋白BRP浓度对AHLL 包封率的影响。由图3a 可见,随着BRP浓度的增加,纳米颗粒中AHLL 包封率快速且显著地上升,当BRP 为8 mg/mL 时,AHLL 的包封率最高,达到71.43%,随后继续增大BRP 质量浓度,包封率变化不大,甚至表现出一定的下降趋势。BANPs 的载药量也具有类似的变化:载药量起初随着BRP 质量浓度的增大而上升,接着快速下降并基本保持稳定。这说明,BANPs 的包封率和载药量与载体蛋白BRP 质量浓度之间并不呈现简单的线性正相关关系。当BRP质量浓度较低时,溶液中的载体数量较少,没有足够多的蛋白分子包裹AHLL 导致对AHLL 的包封不充分,因此包封率较低。增加载体BRP 的质量浓度将导致体系中形成更多稳定的纳米颗粒,AHLL 的包封率和载药量随之升高,并逐渐达到饱和。此时继续增大BRP 质量浓度,体系中过剩的载体分子并不有助于包封率的进一步提升,过高的BRP 质量浓度下载体蛋白反而会发生聚集,影响包埋效果,造成AHLL包封率和载药量呈现出下降的趋势。Yuan 等[18]采用不同比例的玉米醇溶蛋白包埋叶黄素,其包埋率与载药量同样呈现先升高后降低的趋势。
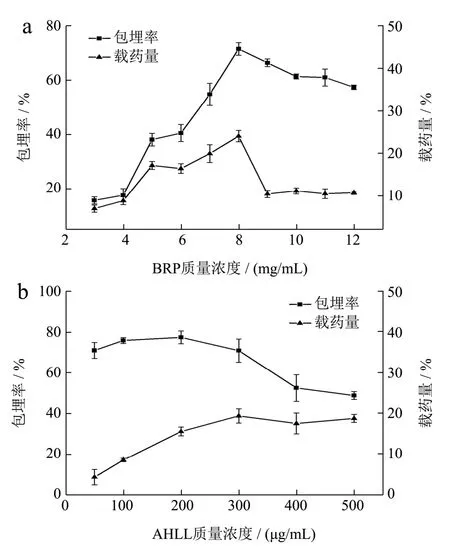
图3 BRP、AHLL 浓度对复合纳米颗粒包封率和载药量的影响Fig.3 Effect of BRP and AHLL concentrations on the encapsulation efficiency and drug loading of composite nanoparticles
类似地,固定载体蛋白BRP 为8 mg/mL,保持其它条件不变的情况下,考察AHLL 添加量对BANPs包封率和载药量的影响(图3b)。随着AHLL 添加量的增加,纳米颗粒的包封率首先略有增大并基本保持稳定,当AHLL 质量浓度为200 μg/mL 时,包封率最高,达到77.28%,此后包封率呈现出下降趋势。纳米颗粒的载药量随着AHLL 质量浓度的增加不断提高,之后保持平稳。这表明,当载体数量过剩时,增加AHLL 质量浓度可以提高纳米颗粒的载药量。当BRP与AHLL 充分结合形成稳定的纳米颗粒后,由于蛋白载体逐渐饱和,过多的AHLL 分子也不会被包埋,反而会造成体系包封率的下降。
2.4 BANPs 的结构表征
2.4.1 粒径与电位分析
zeta 电位决定了悬浮在液体中的纳米颗粒的团聚状况,一般可反映粒子之间由于静电排斥所产生的稳定性。zeta 电位值越大,表明纳米颗粒表面同种电荷产生的静电斥力越大,体系稳定性也相对越好[19]。图4展示了不同pH 值条件下(pH 值2.0~7.0)BRP 和BANPs 的粒径和电位值变化。pH 值2.0 时,BRP 带正电荷;pH 值3.0 左右,BRP 大量凝集形成沉淀,聚集体粒径较大,且电位值趋于零,推测此时达到BRP的等电点。pH 值4.0~7.0 时BRP 带较多负电荷,当pH 值6 时BANPs 电位值为-21.33 mV,由于负电荷的增加,粒子间的排斥力使BRP 粒径较小,集中在138.53~185.47 nm,BRP 体系整体较为稳定,殷婷等[20]报道的负载白藜芦醇的大麦醇溶蛋白纳米颗粒Zeta电位均在20 mV 左右,Zeta 电位(正或负)越高,体系越稳定,即溶解或分散可以抵抗聚集。当BRP 与AHLL 结合形成纳米颗粒后,由于AHLL 的引入使得BANPs 的粒径略高于BRP,为166.80~280.30 nm,粒径分布均匀,且在pH 值4.0~7.0 的范围内,pH 值的改变对BANPs 粒径影响较小。加入AHLL 后,BANPs的电位值略有下降,推测BRP 与AHLL 间存在一定的静电相互作用[21]。

图4 不同pH 值条件下BRP、BANPs 的粒径及电位变化Fig.4 Particle size and potential changes of BRP and BANPs under different pH conditions
2.4.2 荧光与紫外-可见光谱分析
BRP 及BANPs 的荧光发射光谱如图5a 所示。色氨酸和酪氨酸是蛋白质的主要内源荧光基团[22]。激发波长为285 nm 时,BRP 的最大荧光发射峰出现在416 nm 处。加入AHLL 后,BANPs 的荧光强度显著下降,并随着AHLL 浓度增加,荧光强度逐渐降低,发生了荧光淬灭现象。推测在BANPs 的形成过程中,AHLL的引入可能导致BRP疏水核中色氨酸残基原本的疏水微环境发生变化,疏水性降低,极性增强,BRP的固有荧光被淬灭导致体系荧光强度下降,表明疏水相互作用参与了AHLL 与BRP 纳米颗粒的形成,BRP的空间结构变得更加伸展。Wang 等[23]也报道了在制备鳕鱼蛋白纳米颗粒时,随着姜黄素浓度的增加其荧光强度出现有规律的降低,表明疏水相互作用在分子间起重要作用。同时,AHLL 与BRP 结合过程中的静电相互作用可能也影响了BRP 的分子结构。

图5 BRP、BANPs 荧光图谱和紫外-可见光谱图Fig.5 Fluorescence and UV spectra of BRP and BANPs
检测了BRP、BANPs 的紫外-可见光谱。如图5b所示,BRP 的最大吸收峰出现在276 nm 处,是蛋白质中芳香族氨基酸的特征吸收峰[24]。添加AHLL 后,形成的纳米颗粒的吸收峰强度增加,最大吸收波长从276 nm 增加到293 nm,出现红移,表明BRP 与AHLL的结合影响了蛋白质的构象,生成了新的复合物,导致蛋白质的吸收光谱发生变化。吸光度的增加和吸收波长的红移,可能是AHLL 与BRP 间的相互作用使得蛋白质中芳香族氨基酸色氨酸等残基的位置发生变化,产生了新的共轭体系,这与荧光光谱的结果是一致的。
2.4.3 傅里叶变换红外光谱(FT-IR)分析
为了确定BRP 与AHLL 相互作用前后二级结构的变化,本研究对BRP 和BANPs 的红外光谱进行了扫描(图6)。BRP 和BANPs 在3 283 cm-1处存在一个宽频带,而3 100~3 500 cm-1范围的特征吸收峰是由O-H 键的强拉伸振动产生的[25],因此BRP 和BANPs均存在O-H 键的拉伸振动。

图6 BRP、BANPs 红外光谱图Fig.6 FT-IR spectra of BRP and BANPs
蛋白质的主要特征吸收带包括酰胺I 带(1 600~1 700 cm-1)和酰胺II 带(1 500~1 600 cm-1)[26],分别由C=O 的伸缩振动和C-N 的伸缩振动以及N-H 的面内弯曲振动产生,酰胺I 带和酰胺II 带均与蛋白质的二级结构密切相关,是由α-螺旋、β-折叠、转角和无规卷曲叠加共同作用所产生的吸收带[27]。如图6 所示,BRP 的FT-IR 光谱在1 630 cm-1处显示出一个典型的酰胺I 带吸收峰,在引入AHLL 形成BANPs 后,此特征吸收峰产生明显移动,且在1 530 cm-1处观察到出现了一个新的峰,这表明复合纳米颗粒形成时,BRP 和AHLL 的组装力中存在静电相互作用[28]。Fan等[29]报道的大豆分离蛋白与岩藻多糖纳米颗粒由于静电相互作用在酰胺I 带和酰胺II 带均出现移动。这也验证了电位测定的结果。
2.4.4 BANPs 分子间相互作用分析
纳米颗粒之间存在不同类型的作用力,可以通过分析浊度、粒径、电位等参数的相对变化来评估不同解离溶剂条件下纳米颗粒间作用力的变化规律[30]。图7为BANPs 在NaCl、SDS 和尿素3 种不同解离溶剂条件下(24 h)的物化参数变化结果。加入NaCl 后,BANPs 溶液的浊度值、粒径显著增大,电位显著降低并趋于零,表明静电相互作用是BANPs 分子间的主要作用力,同样的,许雪儿等[31]研究的玉米醇溶蛋白纳米颗粒在NaCl 的干扰下发生了电荷屏蔽作用,颗粒絮凝,粒径电位增大;类似地,SDS 的加入也导致了BANPs 溶液的浊度值、粒径增大,电位值降低,即疏水相互作用在BANPs 的形成和稳定过程中也发挥了重要作用。以浊度值的变化(ΔT)为例,3 种条件下ΔT依次为NaCl>SDS>尿素(静电相互作用>疏水相互作用>氢键),此外,粒径和电位的变化趋势也支持上述结果。因此,实验表明,BANPs 的形成和维持主要受静电相互作用和疏水相互作用的影响这与荧光和FT-IR 的结果一致。

图7 不同解离溶剂对BANPs 溶液浊度、粒径及电位的影响Fig.7 Effect of different dissociation solvents on turbidity,particle size and potential of BANPs solution
2.5 BANPs 的微观形貌观察
通过扫描电镜观察到BRP 和BANPs 的微观结构特征,纳米颗粒的结构影响到复合体系的稳定,结果如图8 所示。BRP 呈现外形较光滑且规则的球状颗粒,分布均匀,其粒径主要集中在150~200 nm 之间,这与动态光散射测定的粒径结果是一致的。BANPs 经冷冻干燥后颗粒表面发生皱缩,呈不规则形态,但分布较均匀。相关研究表明,纳米颗粒的形态参数对其生物学反应及相互作用有一定的影响[32]。
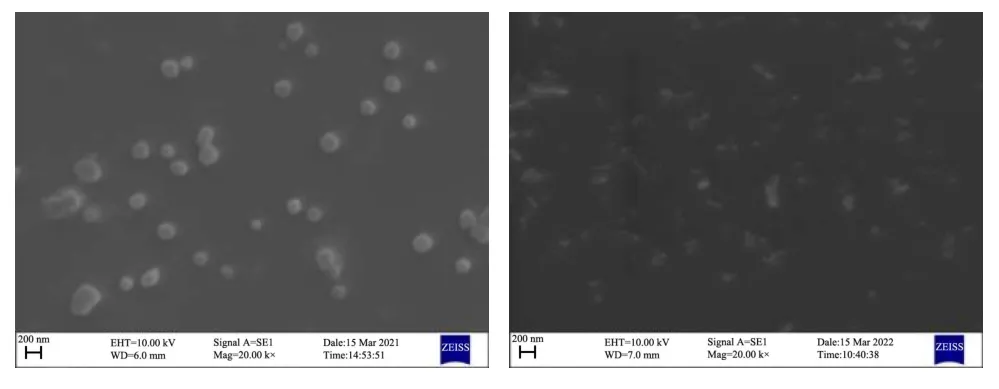
图8 BRP(左)、BANPs(右)的微观形貌观察Fig.8 Microscopic morphology observation of BRP and BANPs
2.6 BANPs 的稳定性分析
2.6.1 BANPs 的热稳定性
AHLL 等天然活性物质在食品加工过程中或极端的条件下(如高温等)通常是不稳定的[33]。因此,在60、70、80、90、100 ℃下处理60 min,考察了游离AHLL 和BANPs 中AHLL 的稳定性。如图9a 所示,游离AHLL 的降解速率较快,温度升高到70 ℃时,AHLL降解率急剧上升到57.39%;当温度达到100 ℃,60 min 后AHLL 仅剩不到25%,75.61%的AHLL 发生了降解,而此时BANPs 中包埋AHLL 的降解率为46.90%,其稳定性提高了28.71 个百分点。Zhang 等[34]测定铁蛋白包埋ACE 抑制肽的稳定性,当温度为80 ℃时,活性肽降解率为51.34%,相同温度下,本研究中AHLL 的降解率仅为36.08%,显著低于Zhang等[34]报道的降解率。在整个温度测试范围内,BRP 包埋处理后的纳米颗粒中AHLL的降解率均显著低于游离AHLL,这表明基于BRP 的纳米载体明显增强了AHLL 的热稳定性。如图10a 所示,随着温度的升高,BANPs 的粒径逐渐降低并保持稳定,而电位的变化较小。这主要是BRP 由于自组装通过静电等相互作用结合形成了致密的纳米颗粒结构和更有效的疏水囊,致密的纳米颗粒结构可以通过隔绝温度与其它水溶性促氧化剂(包括自由基、氧和金属离子)等作用来保护AHLL 免受降解,稳定性提高。
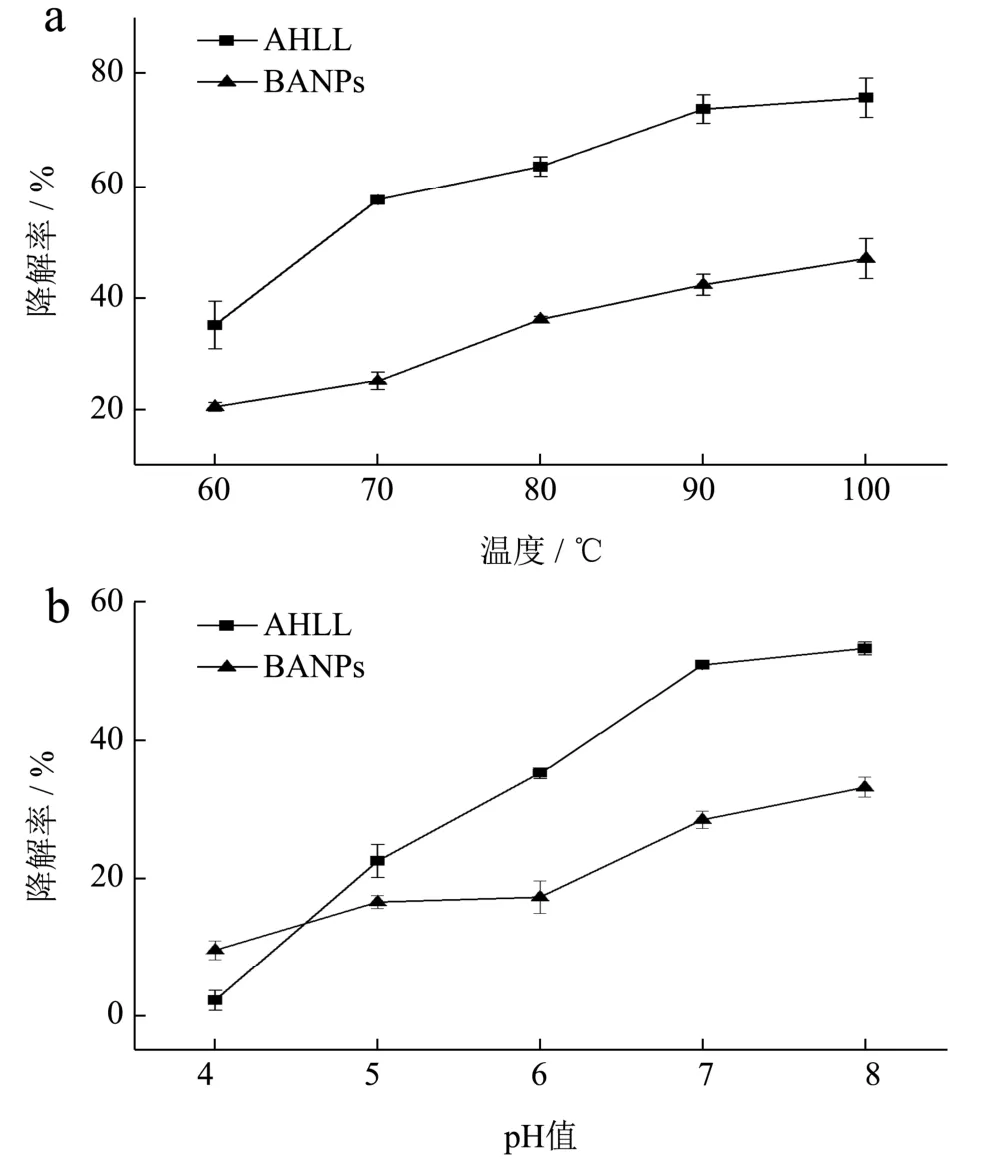
图9 不同温度、pH 值对AHLL 降解率的影响Fig.9 Effect of different temperature and pH on the degradation rate of AHLL

图10 不同温度、pH 值对BANPs 粒径及电位的影响Fig.10 Effects of different temperatures and pH on the particle size and zeta potential of BANPs
2.6.2 BANPs 的pH 稳定性
负载降压肽的牛蒡蛋白纳米颗粒在不同pH 值下的稳定性对其在食品中的应用有很大的影响。以降解率作为不同pH 值下稳定性的评价指标,结果如图9b所示,随着pH 值的逐渐增大,游离AHLL 的降解率急剧增加,pH值7.0~8.0时,AHLL降解率均超过50%;而BANPs 中AHLL 降解率的增加速率较为平稳,在pH 值5.0~8.0 的范围内,BANPs 中包埋的AHLL 的降解率均显著低于游离AHLL。结合图10b 的结果,推测这可能是因为该pH 值范围内时BRP 分子携带较多的负电荷,可通过静电相互作用等与AHLL 较紧密地结合,从而保证了较宽pH 值范围内的纳米颗粒中活性肽的稳定性。
3 结论
本研究表明,利用0.2 mol/L Tris-HCl 缓冲液提取牛蒡根蛋白,并利用BRP 构建了负载AHLL 的复合纳米颗粒递送体系,发现提取的牛蒡根蛋白成分固定无杂蛋白质干扰,与AHLL 通过静电相互作用和疏水相互作用形成稳定的复合纳米颗粒。在BRP 为8 mg/mL,AHLL 为200 μg/mL 时,载体蛋白BRP 对AHLL 的包封率高达77.28%,载药量提高到23.97%,BANPs 颗粒分布比较均匀且粒径较小。随着温度升高和pH 值增大,BANPs 中AHLL 降解率均显著低于游离AHLL,粒径电位变化较小并趋于稳定,稳定性显著提高。因此,本文报道的牛蒡根蛋白可用于小分子生物活性肽的包封与保护,有望用于活性肽的靶向递送与可控释放,为未来我们利用蛋白纳米载体封装小分子疏水活性肽提供理论基础。
