茶多酚对植物乳杆菌的益生作用及其在发酵香肠中的应用
2024-01-09江福林卢云浩何强
江福林,卢云浩,何强*
(1.四川大学轻工科学与工程学院,四川成都 610065)(2.成都大学食品与生物工程学院,四川成都 610106)
发酵香肠是中国著名的传统肉制品,主要是以猪痩肉、猪肥膘、盐和香料等为原料,经过微生物发酵而成的肉制品,因独特的风味、质地和丰富的营养而受到消费者的广泛青睐[1]。早期的发酵香肠是基于原料中天然存在的微生物发酵而成的,难以保证最终产品的质量和风味。如今,为确保最终发酵产品的质量,人工控制发酵以及应用商业发酵剂已经是相当普遍的做法[2]。乳酸菌作为发酵香肠生产中的最重要的发酵剂之一,可以产酸降低产品pH 值,抑制致病菌和腐败菌的生长,同时使纤维蛋白凝固从而提高最终产品的硬度和内聚性。此外,一些乳酸菌具有脂解和蛋白水解活性,有助于香肠风味和感官品质的形成[1,3]。
茶多酚具有良好的抗氧化和抗菌作用,已经被广泛应用于发酵食品中,如发酵香肠、火腿等[4]。此外,一些研究已经证明茶多酚对于某些益生菌(如乳酸菌)的生长表现出促进作用。Tabasco 等[5]的研究表明,质量浓度为0.25~1.0 mg/mL 的多酚(包括儿茶素、表儿茶素和黄烷-3-醇)可以有效刺激乳酸菌的生长。Zhang等[6]研究发现,乌龙茶多酚有助于增强乳酸菌的代谢能力,产生更多的乳酸。另一方面,当茶多酚的浓度过高时,对乳酸菌也可能表现出广谱的抗菌效果。因此,研究茶多酚益生作用的边界浓度,对于指导茶多酚在发酵食品实际生产中的应用具有重要意义。
本实验研究了不同浓度茶多酚对植物杆菌生长的影响,探究了茶多酚益生作用的边界浓度,并在发酵香肠的生产过程中进一步证明了这种益生作用。通过测定乳酸菌数、pH 值、水分活度(Water Activity,aw)、色泽、质构、脂质氧化和挥发性盐基氮含量,探讨了益生作用浓度下的茶多酚对发酵香肠理化品质的影响,以期为茶多酚在香肠和类似发酵食品中的应用提供理论依据。
1 材料和方法
1.1 材料与试剂
猪肉和香肠辅料,购于成都沃尔玛超市;植物乳杆菌(Lactobacillusplantarum6253),购于中国工业微生物菌种保藏管理中心;茶多酚(纯度:98%),购于上海源叶生物科技有限公司;三氯乙酸、氯仿、硫代巴比妥酸、乙二胺四乙酸、硼酸、甲基红、亚甲基蓝、碳酸钾、盐酸均为分析纯,购于成都市科龙化工试剂厂;MRS 培养基、MRS 琼脂培养基、乳酸杆菌选择培养琼脂,购于青岛海博生物有限公司。
1.2 主要仪器与设备
ZWY-2102C 恒温培养箱,上海智城分析仪器制造有限公司;HWS-150B 恒温恒湿箱,杭州绿博仪器有限公司;FiveEasy plus pH 计,德国梅特勒托利多公司;S2-A808绞肉机,济南九阳股份有限公司;Labmaster-aw STANDARD 水分活度仪,瑞士Novasina 公司;CM-5色度色差仪,日本柯尼卡美能达公司;TA.XT.plus 质构仪,英国SMS 公司;Biotek 微孔板检测仪,美国伯腾仪器有限公司。
1.3 方法
1.3.1 菌种活化
将植物乳杆菌接种于MRS 培养基中,在37 ℃下培养24 h,反复活化3 次。实验前用无菌磷酸盐缓冲液(0.01 mol/L PBS,pH 值6.8)将菌液进行适度稀释,得0.5×108CFU/mL 的菌悬液。
1.3.2 茶多酚益生效果的测定
称取不同质量的茶多酚溶解于50 mL MRS 培养基中,得到质量浓度分别为0、0.5、1.0、2.0、4.0、6.0 mg/mL 的培养基。将1 mL 菌悬液接种于该培养基中,于37 ℃、120 r/min 条件下培养24 h。培养结束后,测定培养基的pH 值。菌液进行适度稀释后,将稀释菌液均匀涂布于MRS 琼脂培养基上,37 ℃下培养48 h 后,进行计数。实验重复三次。
1.3.3 生长曲线的测定
准确称取0.10、0.20 g 茶多酚溶解于50 mL MRS培养基中,得到质量浓度分别为0、2.0、4.0 mg/mL的培养基。将1 mL 植物乳杆菌菌悬液接种于该培养基中,在37 ℃、120 r/min 条件下培养。分别于0、5、15、20、25、30 h 取样,测定pH 值和活菌数。
1.3.4 发酵香肠制备
参照文献[7]的方法,将800 g 猪瘦肉和200 g 猪肥膘绞碎,与25 g 氯化钠、50 g 葡萄糖、0.09 g 亚硝酸钠、0.1 g 抗坏血酸钠、3 g 味精、10 g 白酒和3 g 混合香料混合,搅拌均匀后灌入天然猪肠衣。实验分组如下:CN 组(自然发酵组);LP 组(植物乳杆菌接种量:107CFU/g);LPTP 组(植物乳杆菌接种量:107CFU/g,0.2%(m/m)茶多酚添加量)。所有批次的香肠在恒温恒湿箱中风干1 d(25 ℃、30%~50%相对湿度),然后在25 ℃、75%~85%相对湿度下发酵9 d。在不同发酵时间(0、1、3、6、9 d)对每个处理组的香肠进行取样,以测量乳酸菌数、质构、脂质氧化等情况。
1.3.5 发酵香肠中乳酸菌数的测定
参照国标GB 4789.35-2016《食品安全国家标准食品微生物学检验乳酸菌检验》[8]进行乳酸菌计数。
1.3.6 发酵香肠aw和pH 值的测定
aw值:参照赵改名等[9]的方法测定;pH 值:使用pH 计测定[10]。
1.3.7 发酵香肠色泽和质构的测定
色差值:参照周垚卿等[11]的方法测定;质构:参照何琪等[12]的方法测定。
1.3.8 发酵香肠TBARS 值和TVB-N 值的测定
TBARS 值:将5 g 香肠样品与25 mL 7.5%(m/V)的三氯乙酸溶液[含0.1%(m/V)乙二胺四乙酸]以6 000 r/min 混合匀浆60 s,然后过滤两次。吸取3 mL滤液与3 mL 硫代巴比妥酸溶液(0.02 mol/L)混合均匀后,于沸水中加热20 min。空白组与等量三氯乙酸溶液混合。冷却至室温后,加入3 mL 氯仿,混合均匀后以4 000 r/min 离心10 min。测量上层清液在532 nm 和600 nm 的吸光度,TBARS 值以每千克样品中丙二醛的毫克数(mg/kg)表示[13]。
TVB-N 值:参照国标GB 5009.228-2016《食品中挥发性盐基氮的测定》测定[14]
1.3.9 数据处理
实验结果均以平均值±标准差表示。使用SPSS 26.0 进行方差分析、显著性分析,P<0.05 时为差异显著;使用Origin 2021 进行相关性分析、绘图。所有实验重复三次,每个试验设置三个平行样品。
2 结果与分析
2.1 茶多酚对植物乳杆菌生长的影响
不同质量浓度茶多酚对植物乳杆菌生长的影响如图1 所示。由图1 可知,随着茶多酚质量浓度增加,植物乳杆菌活菌数先增加后减少,且在2 mg/mL 时达到最大。与空白组相比,当茶多酚质量浓度为2 mg/mL时,活菌数增长了21.39%,能够明显促进植物乳杆菌生长(P<0.05)。当茶多酚质量浓度为6 mg/mL 时,活菌数则减少了11.63%,显著抑制植物乳杆菌的生长(P<0.05)。以上结果表明在一定浓度范围内,低浓度茶多酚能够促进植物乳杆菌的生长,高浓度茶多酚则抑制其生长[15]。研究表明,部分乳酸菌能够合成没食子酸酯酶和脱羧酶,代谢相关酚类物质以刺激生长[5]。另一方面,茶多酚对乳酸菌的细胞膜和细胞器具有保护作用,能够防止膜脂质过氧化和保护膜流动性[16]。
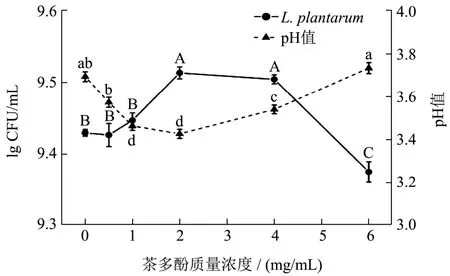
图1 茶多酚对植物乳杆菌生长和培养基pH 的影响Fig.1 Effects of tea polyphenols on the growth of Lactobacillus plantarum and pH of medium
随着茶多酚质量浓度的增大,培养基的pH 值先增加后降低。如图1 所示,茶多酚质量浓度为2 mg/mL时,培养基的pH 值为3.42,显著低于空白组,这是由于低浓度茶多酚能够促进植物乳杆菌生长导致产酸增加,从而降低pH 值。Zhang 等[6]也发现茶多酚有利于乳酸菌产生各种有机酸。
为了进一步说明培养过程中植物乳杆菌活菌数的变化趋势,研究了茶多酚质量浓度为0、2、4 mg/mL时菌株的生长曲线。如图2 所示,茶多酚增强了菌株的生长速度和产酸速度,且稳定期的活菌数高于空白对照组(P<0.05)。因此,以上结果说明茶多酚对植物乳杆菌生长的影响具有浓度依赖性,即适宜质量浓度的茶多酚促进乳酸菌的生长,高质量浓度则体现抑菌作用。
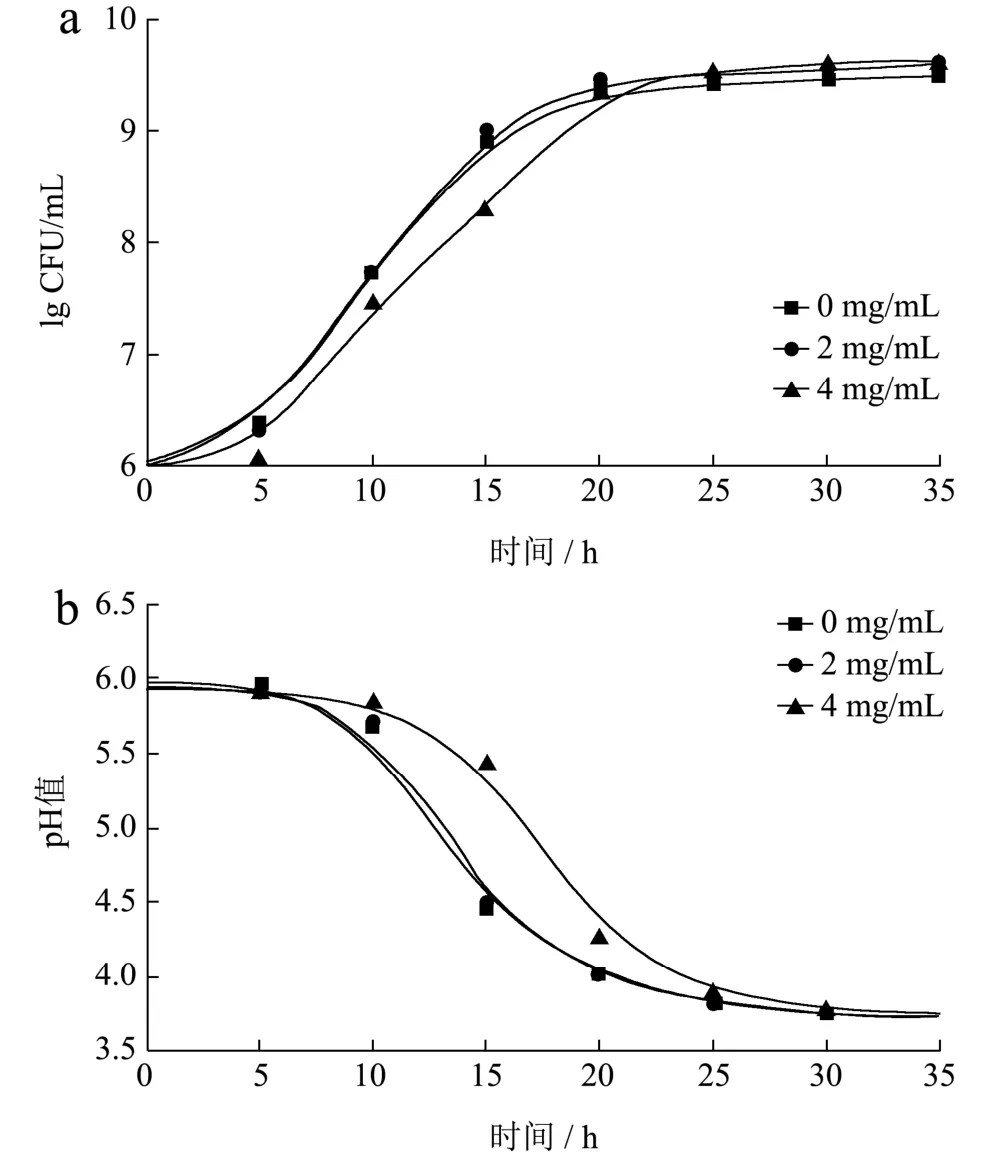
图2 植物乳杆菌生长曲线(a)和培养基pH 值(b)的变化Fig.2 Changes of growth curve of Lactobacillus plantarum (a)and pH of medium (b)
2.2 发酵香肠乳酸菌数的变化
在香肠发酵过程中进一步研究了茶多酚对乳酸菌的益生作用,以探究茶多酚在实际食品生产过程中对产品的质量和安全的影响。发酵香肠的乳酸菌数如图3 所示,接种107CFU/g 植物乳杆菌后,香肠在9 d的发酵过程中保持高水平的乳酸菌数量。自然发酵组的乳酸菌数显著增加,从2.81 lg CFU/mL 增长到3.62 lg CFU/mL,但始终显著低于其他两组(P<0.05)。发酵结束后,LPTP 组的乳酸菌数显著高于LP 组,这与Xiang 等[17]的研究一致,添加桑葚多酚的香肠在贮藏期间显示出最高的乳酸菌数量,这可能是由于多酚可以防止食品基质中的乳酸菌受到氧化损伤和毒性[15]。这些发现与上述培养基体系的结果一致,表明在发酵香肠的生产过程中,茶多酚仍能对乳酸菌发挥益生作用。
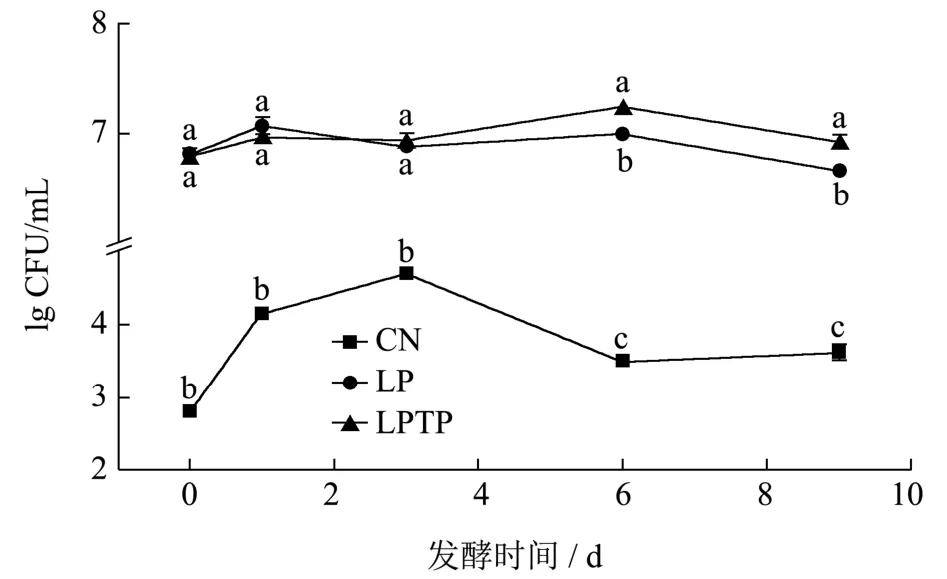
图3 茶多酚对发酵香肠乳酸菌数的影响Fig.3 Effect of tea polyphenols on the number of lactic acid bacteria in fermented sausage
2.3 发酵香肠aw和pH 值的变化
水分活度对食品贮藏稳定性有重要影响,较低的水分活度有利于发酵香肠的货架寿命。由图4a 可知,由于水分流失,aw在发酵期间不断降低,从0.77 下降至0.65,但各组之间不存在显著性差异(P>0.05)。发酵香肠的pH 值如图4b 所示,在整个发酵过程中,CN 组的pH 值稳定在6.05 左右,而LP 组和LPTP 组的pH 值不断下降,最低分别为5.30 和5.42,这是由于乳酸菌在适宜条件下生长繁殖,不断分解糖类产酸,导致pH 值的降低[9]。发酵6 d 后,LPTP 组的pH 值显著低于LP 组(P<0.05),说明茶多酚可以降低发酵香肠的pH 值,这与Zhang 等[10]的发现类似,含有玫瑰多酚的香肠具有较低的pH 值。较低的pH 值能抑制发酵香肠中有害微生物的生长,有利于产品安全[18]。发酵9 d 后,LPTP 组的pH 值有所上升,可能是由于微生物或酶的作用,分解蛋白质产生游离氨基酸和胺等碱性物质,限制了pH 值降低[19]。结果表明,添加茶多酚能够促进乳酸菌发酵产酸,降低产品pH 值,提高发酵香肠的安全性。
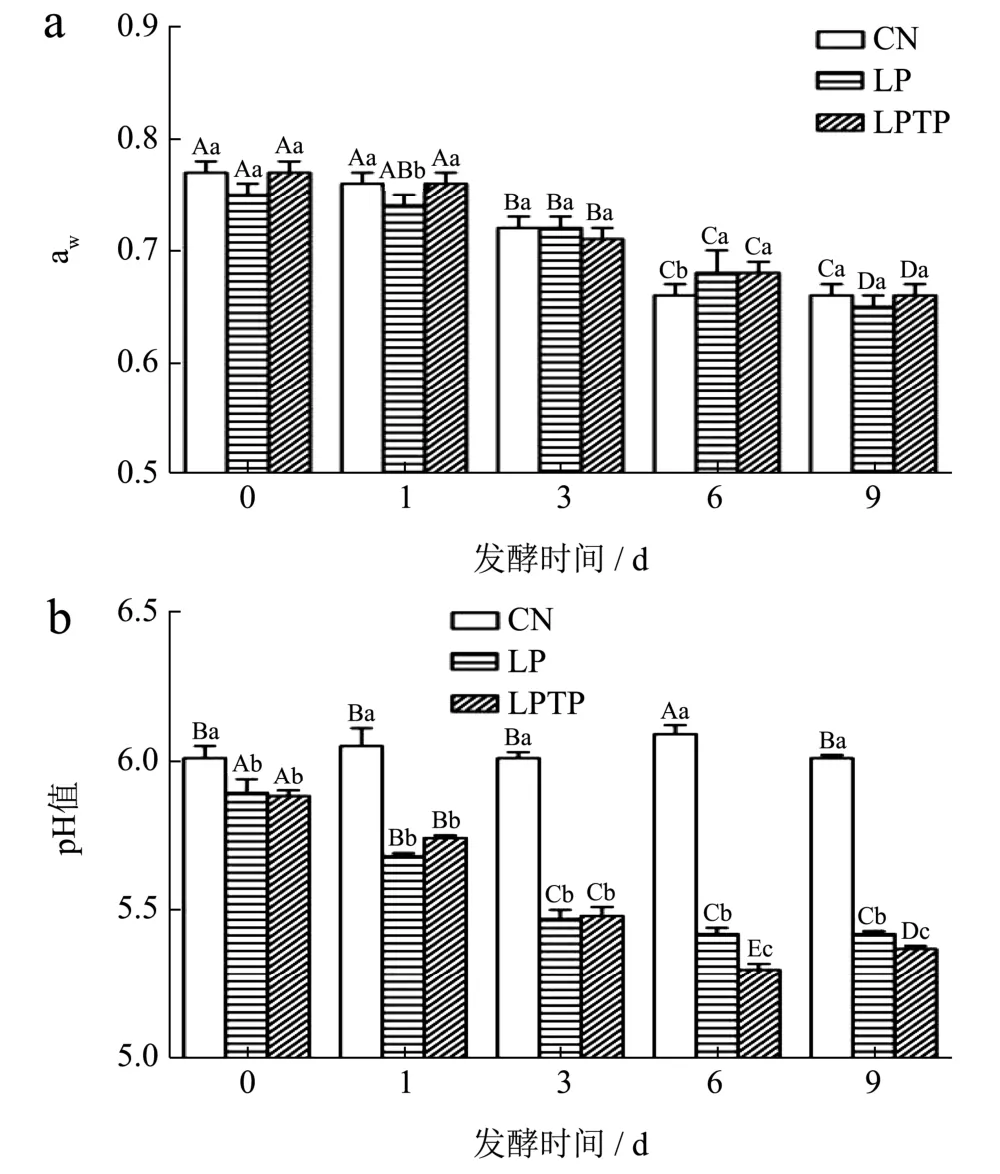
图4 茶多酚对发酵香肠水分活度(a)和pH(b)的影响Fig.4 Effects of tea polyphenols on water activity (a) and pH (b)of fermented sausage
2.4 发酵香肠色泽和质构的变化
发酵过程中香肠的色泽和质构特性变化如表1 所示。由表1 可知,发酵过程中各组香肠的a*值不断增加,而L*、b*值不断降低。发酵结束后,LPTP 组的L*值和a*值分别为60.61 和3.70,均显著高于其他两组(P<0.05),Nowak 等[20]也发现樱桃多酚赋予发酵香肠更高的L*值和a*值,这是因为多酚能抑制肉中肌红蛋白氧化形成棕色的高铁肌红蛋白,从而起到护色的作用[21]。同样地,LPTP 组的b*值也显著高于其他两组,这可能是由茶多酚自身颜色属性导致的。

表1 茶多酚对发酵香肠色泽和质构特性的影响Table 1 Effects of tea polyphenols on color and texture characteristics of fermented sausage
由表1 可知,三组香肠的硬度、弹性、粘附性、内聚性和咀嚼性在发酵过程中均不断增加。发酵结束后,各组的弹性、内聚性和咀嚼性不存在显著性差异(P>0.05)。在硬度方面,各组大小顺序为:LP>LPTP>CN。LP 组的硬度显著高于CN 组,这是因为低pH促使溶解的纤维蛋白聚集,形成有序的蛋白质网络,从而导致硬度增加[22]。然而LPTP 组的硬度显著低于LP 组,这可能是因为多酚可以通过与蛋白质相互作用改变香肠的质地[23]。
2.5 发酵香肠TBARS 值和TVB-N 值的变化
脂质在食品中起着关键作用,脂质过度氧化会产生不良风味物质,降低产品质量和消费者接受程度。TBARS 值用于评估脂质次级氧化产生的醛类物质的数量,能够反映脂质氧化的程度[24]。由图5a 可知,各组香肠的TBARS 值随着发酵时间的增长而显著升高(P<0.05),发酵结束时CN 组、LP 组和LPTP 组分别为0.71、0.61 和0.49 mg/kg。在发酵过程中,自然发酵组的TBARS 值显著高于其他两组(P<0.05),说明乳酸菌能够延缓脂肪氧化[25]。在香肠发酵过程中,乳酸菌可以利用过氧化氢酶或超氧化物歧化酶分解过氧化物,从而降低脂质氧化程度[9]。此外,在发酵过程中,LPTP 组的TBARS 值始终保持最低水平,说明茶多酚能够增强发酵香肠的抗氧化性,这可能是因为茶多酚能够清除自由基和螯合金属离子,阻断脂质氧化反应链,从而有效抑制脂质氧化进程,减少氧化产物生成[11]。
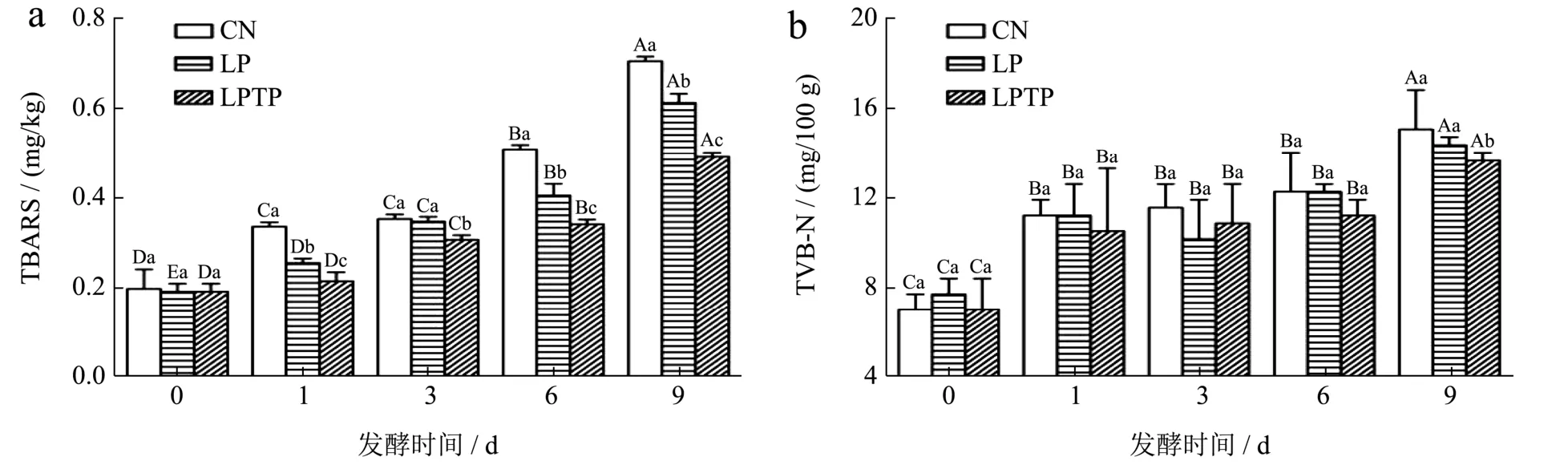
图5 茶多酚对发酵香肠脂质氧化(a)和挥发性盐基氮含量(b)的影响Fig.5 Effects of tea polyphenols on lipid oxidation (a) and the content of volatile base nitrogen (b) of fermented sausage
总挥发性盐基氮被认为是蛋白质和胺类降解的生物标志物,是评价肉类产品新鲜度和保质期的关键指标[26]。TVB-N 值越高,表明肉制品腐败程度越高。由图5b 可知,随着发酵时间延长,各组的TVB-N 值均不断增加。在发酵期间,各组TVB-N 值的顺序为:CN>LP>LPTP,但各组的TVB-N 值差异不显著(P>0.05)。发酵结束后,LPTP 组的TVB-N 值显著低于其他两组,这可能是由于多酚抑制香肠中腐败微生物的生长繁殖,从而延缓了腐败。
2.6 相关性分析
对发酵香肠的各项指标做了相关性分析,结果如图6 所示。发酵香肠的乳酸菌数与L*、a*、硬度呈显著正相关,而与pH 值、TBARS 值呈显著负相关(P<0.05),说明乳酸菌数显著影响香肠的色泽和脂质氧化程度。香肠pH 值与硬度呈显著负相关、而与TBARS 值呈显著正相关(P<0.05),表明pH 越低,氧化程度越轻,但硬度会有所提高。香肠色泽指标(L*、a*、b*)与TBARS 值呈显著负相关,表明脂质氧化程度对香肠色泽具有重要影响,较低的氧化能赋予产品更好的颜色属性。香肠弹性与内聚性、咀嚼性呈显著正相关(P<0.05)。因此,茶多酚能够促进香肠中乳酸菌的生长,进而对香肠色泽、pH、脂质氧化和质构等属性产生影响。
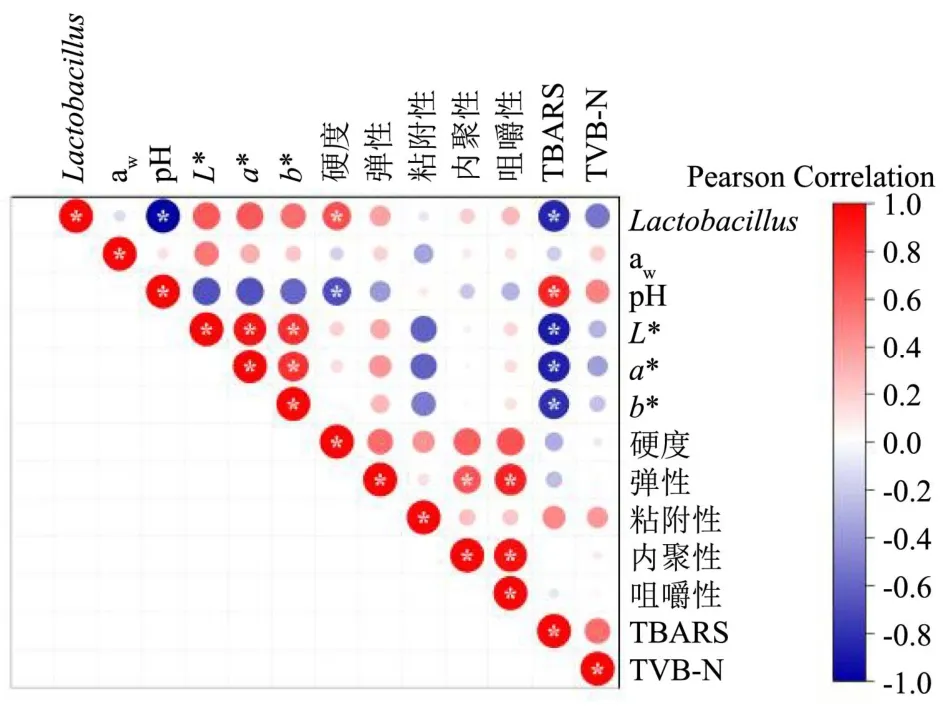
图6 发酵香肠各项指标相关性分析Fig.6 Correlation analysis of various indicators of fermented sausage
3 结论
本文探讨了不同浓度茶多酚对植物乳杆菌的影响及其对发酵香肠理化品质的影响。结果表明,在适宜的浓度下,茶多酚体现出对植物乳杆菌的益生作用,浓度过高则体现抑制作用。在生产发酵香肠的过程中,茶多酚仍能显著促进植物乳杆菌的生长。此外,茶多酚有效降低了香肠发酵过程中的TBARS 值和TVB-N值,从而延缓脂肪氧化和腐败,并在一定程度上提升了产品的色泽和质量。相关性分析表明,发酵香肠的色泽、pH、质构和脂质氧化等理化品质与乳酸菌数存在一定的关联。这些结果对茶多酚在发酵肉制品中的应用具有重要意义,后续可以进一步探索茶多酚促进植物乳杆菌生长的详细机制以及发酵香肠的风味和代谢物分析,为茶多酚在发酵食品中的应用奠定理论基础。
