清酒乳杆菌对发酵风干肠品质的影响
2024-01-09郑云郑爽周天硕鲍伟韩齐李艳青
郑云,郑爽,周天硕,鲍伟,韩齐,2*,李艳青,2*
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)(2.黑龙江省中加合作食品研究发展中心,黑龙江大庆 163319)
发酵香肠是指在自然或人工控制条件下,将绞碎的肉和动物脂肪及辅料等混合后灌进肠衣,经微生物发酵而成的具有较好稳定性、贮藏性和特殊发酵风味的肉制品[1,2]。自由基是引起蛋白质和脂肪氧化的重要因素。自由基在人体中积累过多会引起细胞损伤,在食品中会影响产品质地和货架期[3]。微生物在发酵香肠生产过程中发挥着至关重要的作用。因此,筛选出具备较强抗氧化能力的菌株对于改善发酵肉制品的品质具有重要意义[4-6]。乳酸菌作为发酵肉制品中的主要优势菌,在发酵过程中可促进发酵肉制品色泽和风味的形成、改善肉制品品质特性、提高产品的安全性和稳定性[7-9]。杜宝等[10]研究接种植物乳杆菌和戊糖片球菌至发酵羊肉香肠中,可以有效降低香肠的脂质氧化。潘晓倩等[11]以植物乳杆菌10M-7 为发酵剂应用于发酵风干肠中,促进了肉制品风味的形成。付源[12]从延吉泡菜、自制农家酸菜、四川泡菜中筛选并鉴定出一株戊糖片球菌,将其作为发酵剂应用于发酵香肠中,提高了发酵香肠的品质特性和贮藏性。
发酵过程中微生物群落是动态演变的,各个发酵阶段的菌群种类和数量对品质的贡献也不同,部分微生物在发酵过程中呈现的作用或多或少地对发酵肉制品的质量和理化性质有一定的影响[13]。目前国外将乳酸菌应用于发酵肉制品中的工艺及技术已趋于成熟化,Chen 等[14]发现弯曲乳杆菌、发酵乳杆菌和戊糖乳杆菌能够赋予发酵香肠特殊的风味。国内关于发酵菌株的研究多集中于植物乳杆菌、戊糖片球菌[15],而对于L.sakei作为发酵菌株的研究较少。因此本试验选用从自然发酵风干肠中分离获得的具有抗氧化能力的L.sakei生产发酵风干肠,以自然发酵组为对照,对2组发酵风干肠成熟过程中的品质指标进行测定,分析研究乳酸菌在发酵肉制品体系中的抗氧化效果,结合产品品质和感官评价,为发酵风干肠品质保障和安全控制提供一定理论基础。
1 材料与方法
1.1 材料与试剂
猪后腿肉和肥膘、猪小肠衣、食盐、味素、混合调料、麯酒(玉泉大麯)等,购于当地北京华联超市;葡萄糖(食品级),辽宁泉瑞试剂有限公司。
清酒乳杆菌(L.sakei),保存于中加合作发展中心微生物实验室。
1.2 仪器与设备
HWS-250 型恒温恒湿培养箱、DK-S24 型电热恒温水浴锅,上海森信实验仪器有限公司;5810R 冷冻离心机,德国Eppendorf 公司;SPECORD 210 PLUS紫外分光光度计,德国耶拿分析仪器股份公司;SevenMulti pH 计,美国Mettler Toledo 公司;CM-5色差仪,日本Konica Minolta 公司;NMI20-15 核磁共振食品成像分析仪,苏州纽迈分析仪器股份有限公司;TA-XT PLUS 质构仪,英国SMS 公司。
1.3 试验方法
1.3.1 发酵风干肠的制备
(1)工艺流程
猪后腿肉→切小块(1×1×1 cm3)→混合辅料→拌馅→静置1 h→接种L.sakei→拌馅→静置1 h→灌肠→风干[相对湿度为30%~50%,温度为(25±2)℃,12 h]→发酵[培养湿度为75%~80%,培养温度为(25±2)℃,9 d]
(2)操作要点
瘦肉:肥肉=9:1,配料(质量分数):曲酒1%(按肉总质量计)、味素0.3%、亚硝酸盐0.01%(按肉总质量计)、盐2.5%、混合调味料0.3%、水3%、葡萄糖5%。
乳酸菌组为添加L.sakei生产的风干肠,在腌制好的肉中添加发酵菌株,使其终浓度约为107CFU/g肉馅,搅拌均匀,对照组为没有人为添加发酵剂的天然发酵风干肠。分别在发酵过程中的第0、3、6、9天取样并测定相关指标。
1.3.2 微生物数量的测定
取样品于无菌生理盐水中拍打均质后连续10 倍梯度稀释,选取4~5 个适当稀释度进行涂布,采用营养琼脂培养基和MRS(De Man,Rogosa,Sharpe)琼脂培养基在37 ℃下培养48 h,进行菌落总数与乳酸菌菌数的测定,所有操作均在无菌环境下进行。
1.3.3 产品理化性质的测定
(1)pH 值的测定
参照GB 5009.239-2016 的食品酸度的测定[16]。去除肠衣和脂肪,称取5.0 g 风干肠肉样,加入10 倍体积去离子水,均质,取滤液进行pH 测定。
参考GB 5009.3-2016的食品中的水分进行测定[17],采用直接干燥法测定。称取5 g 绞碎样品置于已烘干至恒质量的称量瓶中,105 ℃烘干至样品恒质量。
(3)水分分布的测定
参照Gao等[18]的方法,去除风干肠的肠衣和肥肉,称取3 g 1×1×1 cm3风干肠肉样,裹一层水胶布,置于核磁试管底部。采用低场核磁共振成像仪进行测定。
(4)色差的测定
去除风干肠肠衣和肥肉,将绞碎样品均匀铺满玻璃皿中,采用色差仪测定风干肠的色差变化(红度值a*、黄度值b*和亮度值L*)。
(5)嫩度的测定
参照Hope 等[19]的方法,利用质构仪的HDP/BS探头,参数设定为:测试速率5 mm/s,触发力5 g,载重物30 kg 进行测定。
“你竟然在我背后捣鬼?”何冰咬牙切齿,看上去恨不得生吞了他,“你竟然接受那狐狸精的委托,让我跟老公分手?”
1.3.4 过氧化物值(Peroxide Value,POV)的测定
按照Chen 等[20]的方法测定样品的过氧化物值,采用还原铁粉做标准曲线。取2 g 肉样,加15 mL 氯仿:甲醇(2:1)混合物,高速均质(11 000g,30 s),加入3 mL 质量分数0.5%氯化钠溶液,4 ℃下离心(1 000 r/min,5 min),取5 mL 下层溶液,加入5 mL氯仿:甲醇(2:1)混合物,漩涡混匀5 s,再加入25 μL Fe2+溶液、硫氰酸铵溶液,漩涡混匀5 s,静止10 min,上清液于500 nm 处测定吸光值。样品测定结果表示为毫克当量每千克(meq/kg)。
1.3.5 硫代巴比妥酸值(Thiobarbituric Acid Value,TBARS)的测定
参考Kong 等[21]的方法,硫代巴比妥酸(TBARS)值的测定:称取0.4 g 肉样,加入3 mLφ=1% TBA 溶液,17 mLφ=2.5% TCA-HCl 溶液,均质,加入0.05 mL 0.01%的抗氧化剂,沸水浴30 min,迅速冷却。取5 mL上清液,加入5 mL 氯仿,漩涡震荡混匀,3 000 r/min离心5 min,取上清液测定吸光度值532 nm。计算公式如下:
式中:
B——硫代巴比妥酸值,mg/kg;
A1——样品吸光值;
M——样品质量,g;
9.48 ——由TBA 反应产物的稀释因子和摩尔消光系数(152 000 L·mol-1·cm-1)推导出的一个常数。
1.3.6 脂肪酸测定参考刘梦等[22]稍作修改。脂肪酸的提取:称取0.5 g绞碎均匀的样品,加入6 mL 混合液(10 mol/L KOH、甲醇),55 ℃水浴1.5 h,期间震荡使其充分混匀;待其冷却到室温时后加入12 mol/L的硫酸溶液0.58 mL,55 ℃水浴1.5 h,取出后冷却至室温,加入3 mL 正己烷,漩涡震荡5 s,离心(1 500 r/min,5 min),取上清液经0.45 μm 的滤膜至进样瓶中,-20 ℃保存备用。脂肪酸的测定:色谱柱(100 m×250 μm,0.2 μm)。参数设定:初始温度120 ℃,持续5 min;150 ℃,升温速率为1.5 ℃/min,28 min;220 ℃,升温速率1.5 ℃/min,10 min。
1.3.7 感官评价
风干肠蒸煮20 min 后,切成约为0.5×0.5×0.5 cm3的小块,随机邀请10 位食品学院本专业相关人员组成评定小组,采用双盲法对发酵风干肠进行综合评价(1~7 分)[11]。

表1 感官评价标准Table 1 Sensory evaluation criteria
1.4 数据分析
采用SPSS Statistics 25 统计软件对数据进行分析,用Duncan 多重比较,P<0.05,差异显著。使用SigmaPlot 14.0 绘图软件作图。每个处理重复3 次,结果以平均值±标准差表示。
2 结果与分析
2.1 风干肠发酵过程中微生物数量的变化
由图1a 可知,发酵过程中风干肠的菌落总数和乳酸菌数均呈先上升后下降的趋势,且L.sakei组菌落总数显著高于对照组(P<0.05)。发酵前期(0~3 d),对照组和L.sakei组菌落总数均显著上升至7.46、8.16(P<0.05),可能是由于此时水分含量高,碳水化合物丰富,为微生物生长提供了良好的生长环境。L.sakei中乳酸菌的加入使其菌落总数显著高于对照组(P<0.05)。发酵后期(3~9 d),对照组和L.sakei组菌落总数下降至6.76、7.33 log CFU/g,可能是随着发酵过程的进行营养物质缺乏、代谢产物积累、水分流失等抑制了微生物的活性,导致菌落总数在发酵后期均出现不同程度的降低。由图1b 可知,发酵前期(0~3 d),乳酸菌作为优势菌生长和繁殖,这对抑制风干肠内不良微生物的生长繁殖具有重要意义。发酵后期(3~9 d),对照组和L.sakei组乳酸菌数分别从6.2、8.16 log CFU/g 下降至5.16、6.4 log CFU/g,这是由于发酵环境水分和营养物质降低阻碍了乳酸菌的正常生长繁殖。刘思婷等[23]研究表明,低盐风干肠中接种植物乳杆菌后,乳酸菌数在发酵期间均呈先上升后下降趋势。

图1 风干肠发酵过程中菌落总数(a)和乳酸菌数(b)的变化Fig.1 The changes of total number of bacterial colonies (a) and lactic acid bacteria (b) of dry sausages during fermentation
2.2 风干肠发酵过程中理化性质的变化
2.2.1 pH 值的变化
由图2 可知,随着发酵过程的进行pH 值呈现显著下降趋势,且对照组pH 值显著高于L.sakei组(P<0.05),由此可知L.sakei的添加可以促进pH 值的降低,加快酸化过程,有助于缩短发酵周期[24]。pH值的下降能够有效抑制发酵风干肠中致病微生物和腐败微生物的生长,有利于提高产品安全性。发酵9 d,L.sakei组pH 值(4.41)显著低于对照组(4.76)(P<0.05),可能是由于L.sakei组乳酸菌数量较多产生了大量乳酸等酸性物质导致的。Lee 等[25]研究表明,乳酸菌产生乳酸,促进酸性环境的生成,从而改善了肉制品的风味,提高了产品的质地。

图2 风干肠发酵过程中pH 值的变化Fig.2 The changes of pH value of dry sausages during fermentation
2.2.2 水分含量的变化
由图3 可知,随着发酵过程的进行,风干肠中水分含量呈下降趋势。发酵0 d,两个处理组水分含量均在55%左右;发酵9 d,对照组水分含量较高为37.15%,L.sakei组水分含量较低为32.15%。这可能是随着发酵的进行,乳酸菌产生乳酸,环境pH 值降低,导致风干肠内部蛋白质变性,进而影响网络空间结构,从而加速水分流失[26]。风干肠中持有较低的水分能够有效抑制病原微生物的生长繁殖,有利于发酵风干肠的生产和保藏。陈援援等[27]研究表明,随着风干过程的进行,接种乳酸菌的风干肠水分含量逐渐降低。

图3 风干肠发酵过程中水分含量的变化Fig.3 The changes of moisture content of dry sausages during fermentation
2.2.3 水分分布的变化
发酵风干肠中的水分分布见图4 所示。风干肠发酵过程中,T2横向弛豫时间曲线主要出现3 个水分分布的状态,分别为:结合水T21(弛豫时间0~10 ms)、不易流动水T22(弛豫时间10~100 ms)和自由水T23(弛豫时间100~1 000 ms)。发酵初期(0 d),风干肠中水分分布主要以不易流动水T22为主,且各处理组差异不显著(P>0.05),结合水T21和自由水T23所占比例较少。风干肠发酵成熟过程中,由于蛋白质结构的变化,不易流动水整体向左迁移,且不易流动水T22的峰面积显著降低(P<0.05),其中接种L.sakei组T22向左迁移程度更加明显,这可能是由于酸性条件下,肌肉蛋白质遭到破坏,水分散失。Bertram 等[28]研究也证明发酵肉制品的水分散失与肌肉蛋白质结构变化有关。

图4 风干肠发酵过程中横向弛豫时间T2的变化Fig.4 The changes of transverse relaxation time T2 of dry sausages during fermentation
2.2.4 颜色的变化
乳酸菌对风干肠发酵过程中颜色变化见表2。由表2 可知,风干肠在发酵过程中L*值和b*值呈整体下降的趋势,发酵9 d,L.sakei组L*值和b*值分别为40.62、11.34,显著低于对照组43.33、12.54(P<0.05)。随着发酵过程的进行,水分逐渐散失,a*值呈先上升后下降的趋势,这可能是风干肠内部水分散失,色素沉积导致a*值升高。而a*值逐渐下降可能是由于肌红蛋白分子的表面被水分子包围,其周围氧分子数量少,去氧肌红蛋白的比例升高所导致的[29]。发酵9 d,L.sakei组a*值(17.02)显著低于对照组(18.27)(P<0.05)。因此,L.sakei作为发酵菌株对色泽的形成未起到促进作用。可能是由于乳酸菌的添加在快速降低酸度值的同时抑制了还原性细菌(如葡萄球菌等)生长,影响了发酵肉制品色泽的形成[30]。Visessanguan等[31]研究表明,接种乳酸菌可使发酵香肠的发色效果更好,与本研究结果不一致,这可能与发酵菌株和发酵环境差异有关。

表2 风干肠发酵过程中颜色的变化Table 2 The changes of color determination of dry sausage during fermentation
2.2.5 嫩度的变化
由图5 可知,在发酵过程中风干肠的嫩度值呈显著下降趋势,发酵0 d 各组风干肠嫩度值在25 000 g左右,差异不显著(P>0.05),随着发酵时间的延长嫩度差异显著(P<0.05)。发酵9 d,L.sakei组嫩度值显著低于对照组(P<0.05),说明L.sakei的添加显著降低了产品的嫩度,这可能是由于风干肠在发酵过程中发生脱水收缩现象,且酸性条件促进蛋白结构发生了改变,导致风干肠嫩度值降低。Ge 等[32]研究表明,干腌火腿发酵过程中溶胶蛋白转变成凝胶蛋白,同时乳酸菌产生的外源性蛋白酶,对肌动蛋白质等其他蛋白质结构有一定影响,最终改变了产品的质构。

图5 风干肠发酵过程中嫩度的变化Fig.5 The change of tenderness of dry sausage during fermentation
2.3 风干肠发酵过程中脂肪的氧化
过氧化值(POV)是衡量肉类及肉制品脂质初级氧化程度的重要指标,与氧化程度呈正相关。如图6a所示,发酵初期风干肠的POV 值处于0.15 mmol/kg左右,差异不显著(P>0.05),发酵3 d 时POV 值急剧上升达到最大值,对照组POV 值为0.42 mmol/kg,L.sakei组POV 值(0.35 mmol/kg)显著低于对照组(0.42 mmol/kg)(P<0.05)。发酵后期(6~9 d),两个处理组的POV 值均呈显著下降的趋势(P<0.05),这是由于随着氧化的发生初级氧化产物逐渐转变为次级氧化产物,且L.sakei组显著低于对照组(P<0.05),说明L.sakei的添加能够有效阻碍风干肠发酵过程中过氧化物的生成。硫代巴比妥酸值是评价肉及肉制品在加工及贮藏过程中次级氧化产物含量的重要指标。脂肪氧化也是影响产品风味物质生成的重要指标,过高会使食品产生哈败味[33],脂肪氧化程度与TBARS值呈线性正相关,国标规定了发酵香肠中的TBARS值需低于1.0 mg/kg。由图6b 可知,在整个发酵过程中,TBARS 值呈上升趋势,其中L.sakei组TBARS值曲线上升较为平缓,发酵过程中L.sakei组TBARS值显著低于对照组(P<0.05),且均符合国家标准,说明L.sakei的添加可显著抑制发酵风干肠的脂肪氧化。
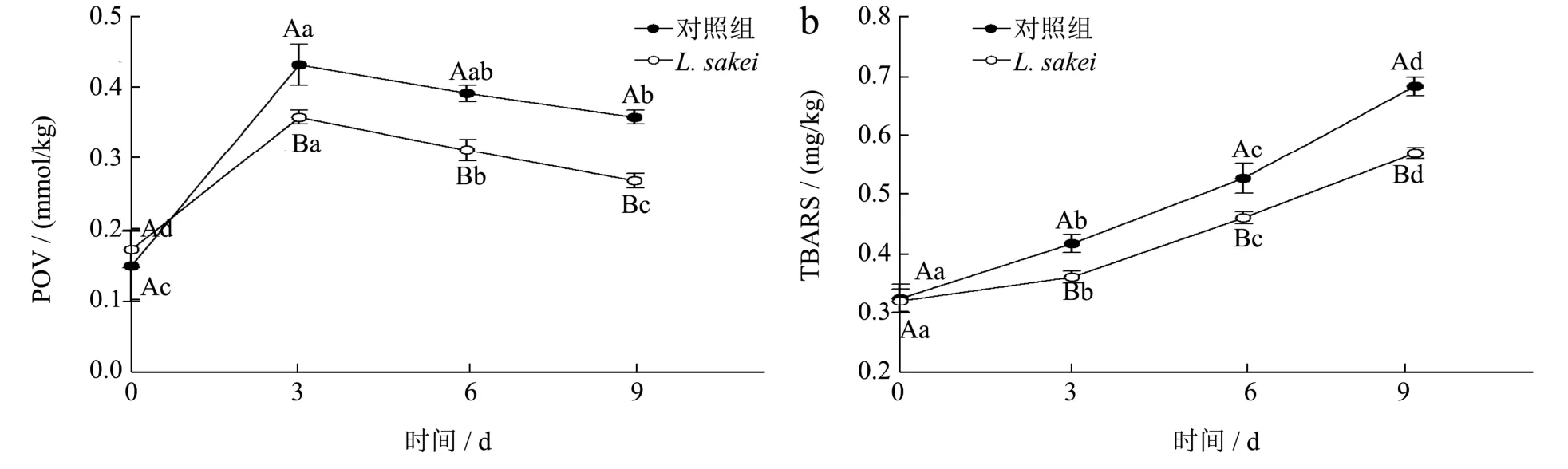
图6 风干肠发酵过程中POV 值(a)和TBARS(b)值的变化Fig.6 The changes of POV (a) and TBARS (b) values of dry sausage during fermentation
2.4 风干肠发酵过程中脂肪酸含量的变化
由表3 可知,发酵终点,风干肠样品中检测出26种挥发性酯类物质,它们主要来源于醇类和酸类的酯化反应,可以赋予发酵风干肠独特的香气。在风干肠发酵过程中,酯类物质的含量和种类均有不同程度的改变,与对照组(0 d)相比,其他两个处理组中的十三烷酸甲酯、神经酸甲酯、γ-亚麻酸甲酯含量均显著升高(P<0.05),这可能与发酵过程中无论是人为添加乳酸菌还是自然发酵,微生物的活动有助于这三种脂肪酸更好的形成。与对照组相比,L.sakei组中的肉豆蔻烯酸甲酯、芥酸甲酯含量显著升高(P<0.05),这可能与L.sakei进行碳水化合物代谢提供更多的酸类物质作为底物参与酯类合成有关,还可能与发酵过程中接种微生物差异有关[34]。对照组(0 d)中棕榈酸甲酯、棕榈油酸甲酯、顺-10-十七烷酸甲酯、硬脂酸甲酯、亚油酸甲酯、花生一烯酸甲酯、花生二烯酸、二十碳三烯酸甲酯含量高于对照组(9 d),这可能是发酵过程种某些物质阻碍了部分脂肪降解。综上,这一结果表明接种L.sakei有利于风干肠中酯类物质的形成,对照组(0 d 和9 d)总酯含量为99.89 g 和100.02 g,接种组(9 d)总酯含量为99.71 g,这可能是乳酸菌产生大量乳酸,导致酸性环境,加快蛋白质降解,微生物群落不断演变,进而影响脂肪氧化,最终影响风干肠中挥发性风味物质的生成[11]。

表3 风干肠中最终单脂肪酸含量Table 3 Content of final mono-fatty acid in dry sausages
2.5 风干肠发酵过程中感官评价的变化
如图7 所示,与对照组相比,L.sakei组具有风干肠特有的浓郁气味。总体可接受性均较高,各项评分都较高。颜色、滋味和总体可接受度都显著高于对照组(P<0.05)。由此可见,接种L.sakei的风干肠在保证原有感官特性的基础上,更易于风味的形成,提升产品可接受度,这主要是由于乳酸菌通过对蛋白质和脂质分解代谢所产生的游离氨基酸、醛酮酯类等风味化合物,有利于改善产品的风味[35]。

图7 感官评价Fig.7 Sensory evaluation
3 结论
本试验研究了L.sakei对发酵风干肠理化性质和安全品质的影响,研究发现L.sakei组微生物数量显著高于对照组(P<0.05),说明L.sakei可以有效抑制风干肠内不良微生物的生长繁殖,且L.sakei的添加能快速降低风干肠发酵期间的pH、水分含量和嫩度,有助于提高风干肠的品质,但L.sakei的添加对于发酵风干肠色泽的形成可能存在负面影响。通过对发酵风干肠POV、TBARS 脂肪氧化指标测定,L.sakei对风干肠脂肪氧化有较好的抑制效果,且L.sakei的添加能有效提高风干肠产品中酯类物质的种类和含量。综上,接种L.sakei有利于提高发酵风干肠的安全性,且感官总体可接受度较好,对发酵风干肠的品质和风味有积极的影响,这对风干肠的实际生产有重要意义。
