基于体外发酵研究膳食纤维复合体对老年人肠道菌群的调节作用
2024-01-09宋瑶谭凯燕黄傲马金克李锐定郑文轩时凤翠于晓涵李全阳
宋瑶,谭凯燕,黄傲,马金克,李锐定,郑文轩,时凤翠,于晓涵,李全阳*
(1.广西大学轻工与食品学院,广西南宁 530004)(2.广西壮族自治区产品质量检验研究院,广西南宁 530200)(3.广西民族大学相思湖学院管理学院,广西南宁 530225)
随着我国社会经济的发展与人口老龄化进程加速,如何活得更加健康长寿得到了人们越来越多的关注与研究。近十年,本团队对广西著名长寿地区老人开展了多次膳食方面调查,并对其饮食、代谢物特征和肠道菌群等进行研究分析,构建了广西长寿饮食模式。该模式以膳食纤维多糖为主,具有高膳食纤维、高维生素A、低能量、低脂肪、低蛋白质、低胆固醇的特点[1,2]。在广西长寿饮食模式中,提供膳食纤维的食物可分为水果、蔬菜与主食三类,根据团队前期调查研究,代表性的水果为脐橙和香蕉,代表性的蔬菜为南瓜苗、空心菜、茶树菇、苦荬菜和红薯叶[3],代表性主食为玉米、红薯、芋头和火麻[4]。膳食纤维与肠道菌群密切相关,并能影响肠道菌群组成比例及数量,进而对人体健康产生影响[5-9]。目前,对膳食纤维的研究多集中在单一膳食纤维方面,如低聚果糖[10]、低聚半乳糖[11]、山楂膳食纤维[12]等。但是对于多种膳食纤维复合的研究相对较少,在一项高脂小鼠的研究中发现复合不溶性膳食纤维对脂类代谢与合成相关的菌属产生了显著的影响[13],Wang 等[14]研究发现,复合多糖膳食纤维增加了年轻大鼠乳杆菌属和双歧杆菌属的相对丰度,降低了球菌属的相对丰度,对维持肠道微生态健康起到了积极作用。本团队前期对衰老小鼠的研究发现广西长寿饮食模式介导的膳食纤维复合体具有提高机体抗氧化水平、降低炎症水平和延缓衰老的作用[15]。除此之外,暂未发现在体外条件下研究膳食纤维复合体对人体肠道菌群及其代谢物的研究。
研究膳食纤维对肠道菌群作用效果的方法目前有三种,分别是体外发酵实验、动物实验和志愿者实验。相比于动物实验成本高与志愿者实验的依从性不一的问题,体外发酵方法具有高可控性且成本低,能够更好的设置初始标准条件、确定发酵时间,也容易调控变量,精准化研究干预效果。利用体外发酵模型可以研究饮食对肠道微生物群的影响,深入了解肠道微生物群介导的发酵过程[16],基于体外发酵方法的膳食研究可用于预测任何膳食物质对健康的有益影响,或抗生素和外源性药物的不良影响[17]。
本研究在团队前期工作基础上,拟从体外发酵角度出发,探究膳食纤维干预下老年人体志愿者粪便典型菌群及粪便菌群代谢物的变化,进一步分析潜在代谢通路及对人体有益的影响,评估广西长寿饮食模式指导下的膳食纤维复合体对老年人体肠道菌群的改善作用,以期为丰富发展膳食纤维通过改善老年人体肠道菌群,促进身体健康的理论提供参考依据。
1 材料与方法
1.1 材料与试剂
香蕉、脐橙、红薯叶、南瓜苗、苦荬菜、空心菜、茶树菇、珍珠黄玉米、芋头、红薯、火麻,广西巴马瑶族自治县坡月村农贸市场;化学试剂,市售分析纯;氘代重水(纯度≥99.9%),青岛麦可瑞生物技术有限公司。
1.2 仪器与设备
UP-FG-1 台式冷冻干燥机(多歧管压盖型),上海优普实业有限公司;RE-2000A 型旋转蒸发器,上海亚荣生化仪器厂;T&J-Mini pod 500 mL×4 型肠道微生态恒化器模拟系统,迪必尔生物工程(上海)有限公司;905GP 型超低温冰箱,赛默飞世尔科技有限公司;Light Cycler 96 实时荧光定量PCR 仪,罗氏医学仪器公司;JBruker Avance 500 MHz 核磁共振光谱仪,德国Bruker 光谱仪器公司。
1.3 试验方法
1.3.1 膳食纤维样品的制备与分组
依照团队前期的提取方法制备膳食纤维。将香蕉、脐橙、红薯叶、南瓜苗、苦荬菜、空心菜、茶树菇、珍珠黄玉米、芋头、红薯、火麻11 种食材在65 ℃干燥后粉粹,过60 目筛备用。依据表1 提取条件,称取过筛后的果蔬原料适量,以对应的固液比加入蒸馏水,混匀后于对应温度下进行热水浴提取对应的时间,提取结束后,冷却至室温,于10 000 r/min 离心15 min,沉淀物真空冷冻干燥得不溶性膳食纤维;上清液65 ℃真空浓缩至原体积1/3,转至烧杯中,加入4 倍体积无水乙醇,4 ℃静置醇沉8 h,8 000 r/min 离心后收集沉淀冷冻干燥得可溶性膳食纤维[18]。依据表2 提取条件,称取过筛后的珍珠黄玉米、芋头和红薯适量,加入蒸馏水浸泡后过200 目筛,得到滤液和滤渣1,滤液进行离心,得到上清液1 和滤渣2,滤渣1 在对应酶添加量和液固比条件下用淀粉酶水解,然后100 ℃水浴灭酶10 min,然后调节pH 值至对应条件,离心,得到上清液2 和沉淀物,沉淀物真空冷冻干燥得到不溶性膳食纤维;上清液1 和上清液2 进行合并,65 ℃真空浓缩至原体积1/3,转至烧杯中,加入4 倍体积无水乙醇,4 ℃静置醇沉8 h,8 000 r/min 离心后收集沉淀冷冻干燥得可溶性膳食纤维。称取过筛后的火麻适量,在蛋白酶添加量为3 000 U/g,液固比10:1 mL/g条件下用蛋白酶水解,然后100 ℃水浴灭酶10 min,然后调节pH 值至9.0,进行离心,得到上清液和沉淀物,沉淀物进行洗涤干燥得到不溶性膳食纤维,上清液65 ℃真空浓缩至原体积1/3,转至烧杯中,加入4倍体积无水乙醇,4 ℃静置醇沉8 h,8 000 r/min 离心后收集沉淀冷冻干燥得可溶性膳食纤维[4]。

表1 果蔬膳食纤维的提取条件Table 1 Extraction conditions of dietary fiber from fruits and vegetables

表2 主食膳食纤维的提取条件Table 2 Extraction conditions of dietary fiber from staple foods
将提取的膳食纤维按照空心菜:南瓜苗:脐橙:苦荬菜:茶树菇:红薯叶:火麻:芋头:香蕉:红薯:玉米=1.00:1.22:2.26:2.36:3.03:3.63:4.82:5.66:7.75:7.69:29.86的质量比混合,膳食纤维共混物与蒸馏水按1:9 的质量比在100 r/min 下搅拌60 min,将样品冷冻干燥得DFC。添加质量体积分数为0.5%、1%、2%、4% DFC的女性实验组分别用DFCF1、DFCF2、DFCF3、DFCF4表示,男性实验组分别用DFCM1、DFCM2、DFCM3、DFCM4 表示,没有添加DFC 的女性和男性对照组用DFCFC、DFCMC 表示。
1.3.2 志愿者肠道菌群样品的准备
从广西南宁市招募10 名65~75 岁志愿者,其中男女性别各半。采用如下条件筛选志愿者:身体健康状况良好,不抽烟、不饮酒、无糖尿病、肾病、肝病和其他肠道类疾病,并且半年内没有服用过抗生素,3周内没有服用益生菌、益生元或泻药。样本采集工作前,对筛选后的志愿者耐心培训指导,于早上收集新鲜的人体粪便样品,收集好后立即放入预先备好的含冰袋的保温盒中,尽快转移至实验室进行无菌分装,冷却后转入-80 ℃冰箱保藏。
开始实验前,以相同比例取5 位女性志愿者粪便样品25 g(每人5 g),于灭菌后的225 mL PBS 溶液中,制成250 g 混合液并震荡混匀。室温8 000 r/min离心1 min 以去除大粪便颗粒,得到的菌悬液用于后续接种。男性组处理方法同女性组。
1.3.3 体外模拟发酵
发酵培养基参考王闪闪[19]的方法制备。取5 个发酵罐并作标记,分别加入配制好的发酵培养基450 mL和0.125 g 厌氧指示剂刃天青,前四组分别加入质量体积百分比(g/mL)为0.5%、1%、2%、4%的DFC,不加DFC 组作为对照组。将发酵系统各部件组装包扎后放入高压灭菌锅中121 ℃灭菌20 min。
将灭菌的发酵罐放入37 ℃恒温水浴锅中,设置磁力搅拌器转速为150 r/min,连接pH 电极和进气管,通入氮气维持厌氧的环境。待恒温水浴锅的温度稳定时向发酵罐中注射入50 mL 的新鲜悬菌液并调节pH值为6.2,保持样品体外发酵48 h。每组做3 个平行试验,并在48 h 定点收集样品于样品管中,收集后立即储存在-80 ℃超低温冰箱中用于后续分析。
1.3.4 发酵液样品中DNA 的提取与检测
发酵液中DNA的提取按照肠道微生物DNA试剂盒提取。提取完成后使用酶标仪检测DNA 浓度及纯度。用无菌超纯水洗涤3 次微孔板,吸取2 μL 洗脱缓冲液对微孔板进行调零,调零后用无菌纸吸干洗脱缓冲液,将加入2 μL DNA 样品加入样品孔进行上机检测,做3 组平行实验。结果OD260/OD280值应在1.80~2.0之间为宜。检验合格的DNA 样品用作RT-qPCR 反应的模板。
1.3.5 发酵液所提DNA qPCR 反应
本实验采用肠道总菌群、大肠杆菌属、拟杆菌属、双歧杆菌属和乳酸杆菌属共5 种肠道菌群引物,引物序列如表3。

表3 5 种肠道菌群的引物序列Table 3 Primer sequences for 5 intestinal microbiota
按照表4 所示用量用模板、引物、RNase-Free H2O和2×SYBR Green qPCR Mix 试剂配置qPCR 反应体系。配好后短暂离心,按照表5 设置qPCR 反应程序设置LightCycler96 实时荧光定量PCR 仪,上机检测。

表4 发酵液提取物中DNA 的qPCR 反应体系Table 4 qPCR reaction system of DNA in fermentation liquid extracts

表5 发酵液提取物中DNA 的qPCR 反应程序Table 5 qPCR procedure for DNA in fermentation liquid extracts
本实验采用的方法是相对定量法,计算公式如下:
式中:
Rx——相对表达量;
A1——待测目的基因的Ct值;
A2——待测内参基因的Ct均值;
A3——对照目的基因的Ct均值;
A4——对照内参基因的Ct均值;
Ct——扩增产物荧光信号达到设定的荧光阈值时所对应的扩增循环数(次)。
1.3.6 发酵产物核磁共振检测样本的制备
取出存储于-80 ℃冰箱中的发酵液样品,在25 ℃室温下解冻30 min,擦干离心管表面的水,涡旋30 s,准确吸取1 mL 的样品于新的2 mL 无菌离心管中,加入500 µL 含tmsp 重水的磷酸盐缓冲溶液(含重水比例10%,K2HPO4/NaH2PO4,pH 值7.4,质量分数0.9%NaCl 的100 mmol/L 磷酸盐),涡旋15 s,用液氮反复冷冻-解冻三次。将混合物均质60 s,然后在4 ℃、8 000 r/min 下离心6 min。吸取上清液于2 mL 无菌离心管中,剩余沉淀物加入500 µL 含tmsp 重水的磷酸盐缓冲溶液,涡旋15 s,用液氮反复冷冻-解冻三次。将混合物均质60 s,然后在4 ℃、8 000 r/min 下离心6 min,合并2 次的上清液在4 ℃,12 000 r/min 条件下离心10 min,用移液枪准确吸取550 μL 的上清液加入到5 mm NMR 管中进行上机检测。
1.3.7 发酵产物样品的1H NMR 的测定方法
将NMR 管中的发酵产物样品在298 K、1H 共振频率为500.13 MHz的核磁共振光谱仪进行NMR图谱检测。使用标准Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列[RD-90°-(t-180°-t)n-ACQ]采集一维光谱,同时采用预饱和法抑制水峰。采集参数为:扫描次数NS=64,采样点数TD=65 536,谱宽SWH=10 000 Hz,驰豫延迟RD=2 s。
1.3.8 发酵产物样品1H NMR 检测图谱的处理与分析
使用MestReNova 14.1 软件(Mestrelab Research S.L)对1H 核磁共振波谱进行相位和基线校正,以tmsp的化学位移0 ppm 进行定标,对化学位移区间δ0.00~9.00 ppm 的区域以δ0.001 ppm 进行分段积分,去除水共振区δ4.64~5.10 ppm 消处水信号的影响,将积分值导出为Excel 表格进行数据处理。
使用SIMCA-P 14.1(Umetrics,Sweden)软件进行多元统计分析。采用主成分分析(Principal Components Analysis,PCA)判定组间发酵液样品总体分布情况,使用正交偏最小二乘判别分析(Orthogonal Partial Least-Squares Discrimination Analysis,OPLS-DA)确定变量投影重要度(Variable Importance for Projection,VIP),采用VIP>1、P<0.05 且结合火山图(FC>2)的条件筛选出差异代谢物,再用生物信息学方法进一步揭示具有统计意义的差异代谢物的靶向代谢通路。
1.3.9 数据分析
采用SPSS 25.0 软件进行试验数据统计分析,利用Origin 2021 和Excel 软件统计分析数据并作图。对于发酵液代谢物的差异变化,正态分布的数据采用配对样本t检验,非正态分布的数据采用配对的Wilcoxon 非参数检验,显著性水平为P<0.05。
2 结果与讨论
2.1 不同DFC 组合对代表性人体肠道菌群中主要菌属的影响
利用qPCR 测定不同DFC 组合发酵液48 h 肠道菌群菌属的相对表达量,探究不同添加比例的DFC 干预下菌属的变化。主要肠道菌群(大肠杆菌属、双歧杆菌属、拟杆菌属和乳酸杆菌属)的相对表达变化量如图1 所示。
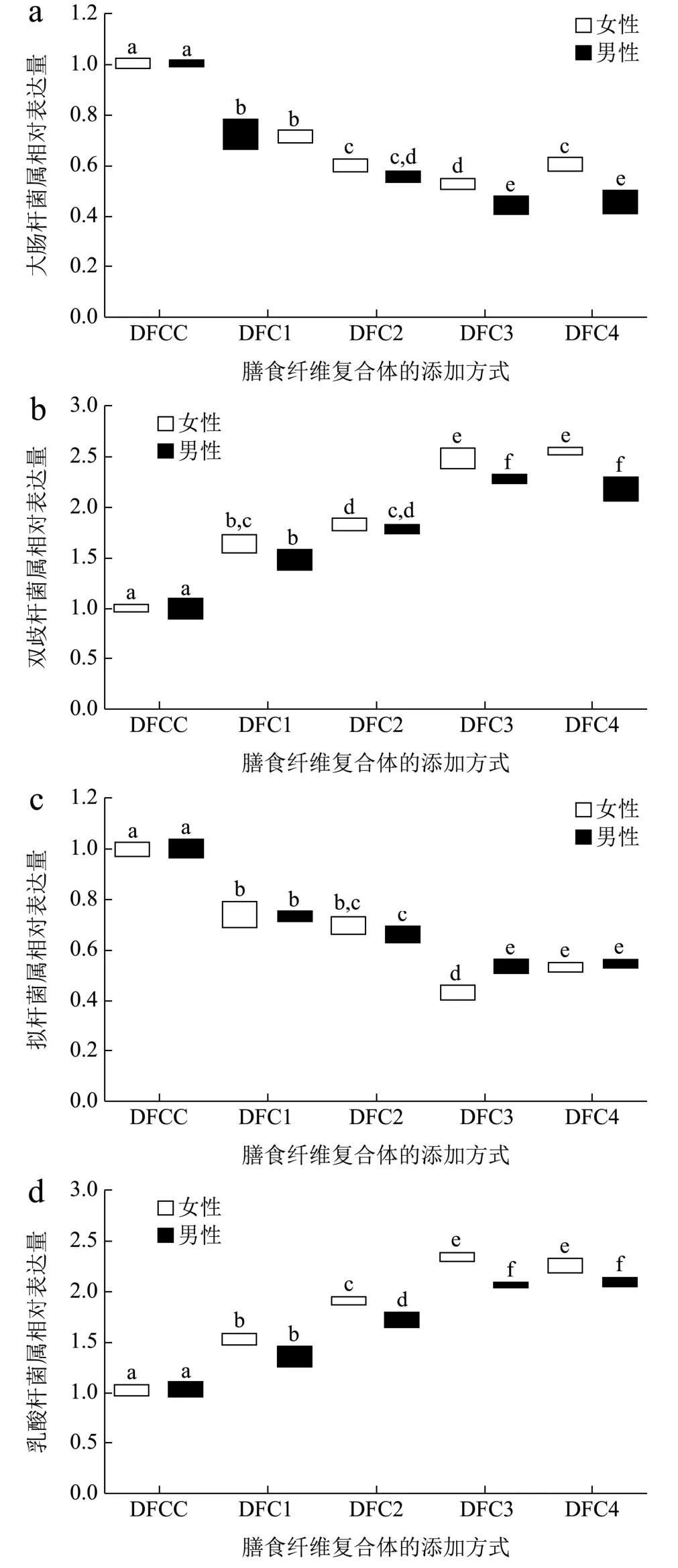
图1 不同DFC 干预后代表性肠道菌群相对表达量Fig.1 The relative expression of representative intestinal microbiota after different DFC intervention
由图1 可知,女性组在不同添加比例的DFC 干预下,发酵液样品中大肠杆菌属和拟杆菌属的含量相对于对照组均表现为下降,双歧杆菌属和乳酸杆菌属的含量相对于对照组均表现为上升。大肠杆菌属相对表达量水平上,DFCF1 组为DFCFC 组的74.27%,显著降低了25.73%(P<0.05),DFCF2 组为DFCFC 组的60.89%,极显著降低了39.11%(P<0.01),DFCF3组为DFCFC 组的52.76%,极显著降低了47.24%(P<0.01),DFCF4 组为DFCFC 组的60.60%,极显著降低了39.40%(P<0.01)。拟杆菌属相对表达量水平上,DFCF1 组为DFCFC 组的74.89%,显著降低了25.11%(P<0.05),DFCF2 组为DFCFC 组的68.83%,极显著降低了31.17%(P<0.01),DFCF3 组为DFCFC组的43.40%,极显著降低了56.60%(P<0.01),DFCF4组为DFCFC 组的52.88%,极显著降低了47.12%(P<0.01)。大肠杆菌属与拟杆菌属均在DFCF3 干预组中下降幅度最大。双歧杆菌属相对表达量水平上,DFCF1 组为DFCFC 组的163.37%,极显著升高了63.37%(P<0.01),DFCF2 组为DFCFC 组的182.00%,极显著升高了82.00%(P<0.01),DFCF3 组为DFCFC组的249.79%,极显著升高了149.79%(P<0.01),DFCF4 组为DFCFC 组的254.34%,极显著升高了154.34%(P<0.01)。乳酸杆菌属相对表达量水平上,DFCF1 组为DFCFC 组的151.64%,极显著升高了51.64%(P<0.01),DFCF2 组为DFCFC 组的189.25%,极显著升高了89.25%(P<0.01),DFCF3 组为DFCFC组的232.99%,极显著升高了132.99%(P<0.01),DFCF4 组为DFCFC 组的225.09%,极显著升高了125.09%(P<0.01)。其中双歧杆菌属在DFCF4 干预组中上升幅度最大,但与DFCW3 干预组相差不大,乳酸杆菌属在DFCF3 干预组中上升幅度最大。
男性组在不同添加比例DFC 干预下,发酵液样品中大肠杆菌属和拟杆菌属的含量相对于对照组均表现为下降,双歧杆菌属和乳酸杆菌属的含量相对于对照组均表现为上升。大肠杆菌属相对表达量水平上,DFCM1 组为DFCMC 组的71.08%,极显著降低了28.92%(P<0.01),DFCM2组为DFCMC组的55.01%,极显著降低了44.99%(P<0.01),DFCM3 组为DFCMC组的44.02%,极显著降低了55.98%(P<0.01),DFCM4 组为DFCMC 组的45.42%,极显著降低了54.58%(P<0.01)。拟杆菌属相对表达量水平上,DFCM1 组为DFCMC 组的73.22%,极显著降低了26.78%(P<0.01),DFCM2组为DFCMC组的65.72%,极显著降低了34.28%(P<0.01),DFCM3 组为DFCMC组的53.14%,极显著降低了46.86%(P<0.01),DFCM4 组为DFCMC 组的54.10%,极显著降低了45.90%(P<0.01)。大肠杆菌属与拟杆菌属均在DFCM3 干预组中下降幅度最大。双歧杆菌属相对表达量水平上,DFCM1 组为DFCMC 组的148.35%,显著升高了48.35%(P<0.05),DFCM2 组为DFCMC组的177.80%,极显著升高了77.80%(P<0.01),DFCM3 组为DFCMC 组的228.71%,极显著升高了128.71%(P<0.01),DFCM4 组为DFCMC 组的221.68%,极显著升高了121.68%(P<0.01)。乳酸杆菌属相对表达量水平上,DFCM1 组为DFCMC 组的141.77%,显著升高了41.77%(P<0.05),DFCM2组为DFCMC 组的172.20%,显著升高了72.20%(P<0.01),DFCM3 组为DFCMC 组的206.11%,极显著升高了106.11%(P<0.01),DFCM4 组为DFCMC组的209.98%,极显著升高了109.98%(P<0.01)。其中双歧杆菌属在DFCM3 干预组中上升幅度最大,乳酸杆菌属在DFCM4 干预组中上升幅度最大,与DFCM3 干预组相差不大。
通过对比发现膳食纤维复合体对大肠杆菌属的抑制作用男性组较强,对拟杆菌属的抑制作用女性组较强,对双歧杆菌属和乳酸杆菌属的增值能力女性组较大,DFC 添加量为2%时的效果最优。王津等[25]研究显示最优膳食纤维比例为2%的茶膳食纤维可对肠道菌群有益生调节作用。本研究结果与上述学者的研究结果相似,说明体外发酵时膳食纤维的添加量不是越多越好。
本团队前期研究发现广西长寿饮食模式指导下的膳食纤维组合对年轻小鼠具有良好抗衰老效果[3]。本研究发现在体外发酵条件下,广西长寿饮食模式指导下的膳食纤维复合体干预后,老年志愿者粪便发酵液中双歧杆菌属与乳酸杆菌属相对含量增加显著,大肠杆菌属与拟杆菌属相对含量显著减少。体外发酵培养下,粪便中的菌群能够利用膳食纤维进行发酵,产生短链脂肪酸,这会抑制大肠杆菌属和拟杆菌属等繁殖,也会促使双歧杆菌属和乳酸杆菌属等有益菌进行繁殖[26]。赵文婧等[27]发现谷子(小米)中的可溶性膳食纤维对大肠杆菌有显著的抑制作用,且均呈现浓度依赖性。张峰等[28]发现高膳食纤维饮食可以降低拟杆菌的数量。Daniel 等[29]对比大量研究发现膳食纤维干预,特别是果聚糖和低聚半乳糖,可提高双歧杆菌属和乳酸杆菌属的粪便丰度。本研究与赵文婧与张峰的研究相比对大肠杆菌和拟杆菌属的相对表达量进行了测定,通过更加直观的数据表明了DFC 对大肠杆菌和拟杆菌属的抑制作用;本研究与Daniel 的研究相比发现,体外条件下广西长寿饮食模式介导的DFC 干预后双歧杆菌和乳酸杆菌属的相对表达量更高。表明广西长寿饮食模式介导下的膳食纤维复合体可以较好的调节肠道微生物组成,从而改善人体健康状态。
2.2 发酵液样品1H-NMR 图谱标定
对发酵液样品谱图进行1H-NMR 图谱定标及积分,典型图谱见图2,根据每种代谢物的化学位移和信号多样性,结合先前报道文献[30-32]和人类代谢组数据库(HMDB;http://www.hmdb.ca/)鉴定并量化了41 种代谢物。
2.3 发酵48 h DFC3 干预组与对照组肠道菌群代谢物的多元统计分析
DFC3 干预组与对照组肠道菌群代谢物的多元统计分析结果见图3。

图3 DFC3 干预组与对照组肠道菌群代谢物的多元统计分析Fig.3 Multivariate statistical analysis of intestinal microbiota metabolites in DFC3 intervention group and control group
如图3 所示,DFC3 干预组与对照组样品肠道菌群代谢物的分布可以分开,其中DFCF3 组PCA 模型的累计解释率R2X=0.855,得到2 个主成分,DFCM3 组PCA 模型累计解释率R2X=0.765,得到2个主成分,此处的PCA 模型是可以参考的。PCA 模型得分图表明,体外发酵后DFC3 组和对照组之间存在良好的分离,表明该模型可以较好地区分发酵后的代谢产物。
2.4 DFC3 组差异代谢物的筛选
根据肠道菌群的结果可知,DFC3 组是最优的,以DFC3 组为主分析代谢物的变化。由图4a 及图4c的火山图(FC>2)和图4b 及图4d 的OPLS-DA 评分图中的VIP 值(VIP>1),筛选出明显不同的代谢物,并将其选为潜在的代谢标志物,再与对照组相比,辨识广西长寿饮食模式指导下的膳食纤维复合体对于粪便菌群代谢物产生的生化影响作用(表6 与表7)。
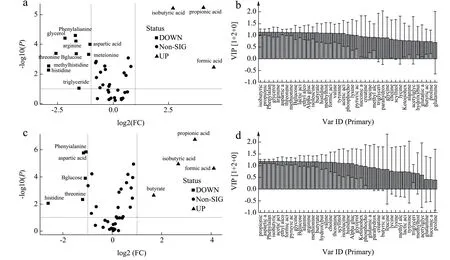
图4 DFC3 组的火山图与VIP 值图Fig.4 Volcano map and VIP value map of DFC3 group

表6 DFCF3 组与对照组相对比的差异代谢物Table 6 The differential metabolites of DFCF3 group compared with control group
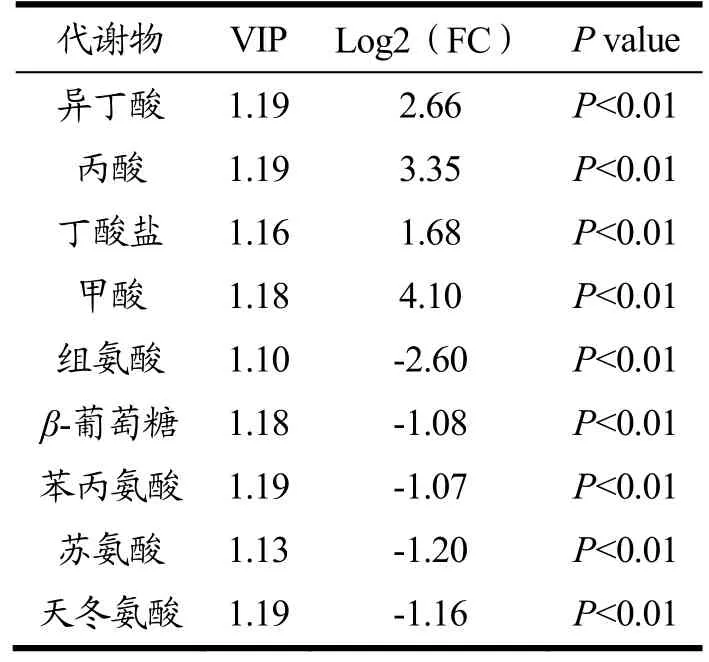
表7 DFCM3 组与对照组相对比的差异代谢物Table 7 The differential metabolites of DFCM3 group compared with control group
由表6 可知,与女性对照组相比,DFCF3 组共有12 种代谢物发生了显著变化,其中,异丁酸、丙酸、甲酸相对丰度显著增加(P<0.01),蛋氨酸、组氨酸、β-葡萄糖、苯丙氨酸、苏氨酸、丙三醇、天冬氨酸、精氨酸、甲基组氨酸的相对丰度显著减少(P<0.01)。由表7 可知,与男性对照组相比,DFCM3 组共有9种代谢物发生了显著变化,其中异丁酸、丙酸、丁酸盐、甲酸相对丰度显著增加(P<0.01),组氨酸、β-葡萄糖、苯丙氨酸、苏氨酸和天冬氨酸相对丰度显著减少(P<0.01)。对比DFCF3 组与DFCM3 组的差异代谢物变化发现,共有的差异代谢物有异丁酸、丙酸、甲酸、组氨酸、β-葡萄糖、苯丙氨酸、苏氨酸和天冬氨酸,且变化趋势相同。其中,DFCF3 组中异丁酸、丙酸、甲酸的FC 值均高于男性DFCM3 组,DFCF3组中组氨酸、β-葡萄糖、苯丙氨酸、苏氨酸的FC 值均低于DFCM3 组,DFCF3 组天冬氨酸的FC 值高于DFCM3 组。
DFC 干预下,志愿者粪便中的肠道菌群发酵膳食纤维产生短链脂肪酸。短链脂肪酸在维持肠道健康和促进动物和人类粘膜免疫反应方面发挥着重要作用[33],还防止胃肠道中病原体的附着和过度生长[34]。Sara 等[35]的研究表明,富含高纤维的饮食模式可有效增加肠道菌群产生的短链脂肪酸。黄妙如等[36]的研究发现金柚幼果膳食纤维具有提高结肠内容物质酵解反应发生速度的作用,产生大量短链脂肪酸。上述结果与本研究的结果相似。在膳食纤维复合体干预后,志愿者粪便发酵液中短链脂肪酸水平显著升高,主要原因可能是膳食纤维有效促进可降解纤维的细菌增值代谢。因此,广西长寿饮食模式指导下的膳食纤维复合体干预老年志愿者粪便后,短链脂肪酸的升高可能会促进粘膜免疫反应,增强人体肠道健康。
根据表6 与表7 可知,DFC3 组相对于对照组葡萄糖相对丰度显著下降。Jee 等[37]研究发现当葡萄糖浓度处于低水平时对机体健康呈现有益作用,Townsend等[38]研究发现高浓度葡萄糖会阻碍有益菌在肠道定植。本研究中膳食纤维复合体干预后的实验组β-葡萄糖相对含量下降,并结合有益菌相对含量增加,表明广西长寿饮食模式指导下的膳食纤维复合体对肠道有益菌的定制起到了一定的促进作用,可能增强机体健康状态。
2.5 DFC3 组与对照组相比差异代谢物的代谢途径分析
为衡量得出的差异代谢物是否反映了其代谢途径的协同变化,使用MetaboAnalyst 5.0 分别将女性组12种差异代谢物和男性组9 种差异代谢物进行代谢物组富集分析和途径分析。选择Home sapiens 路径数据库和Fisher 检验对代谢标志物进行路径富集分析,选择Hypergeometric Test 和Relative-betweeness Centrality对所影响的通路进行拓扑分析,被显著改变的代谢标志物会被映射到与其相关的代谢路径上,并用来解释代谢结果。根据影响阈值大于0.1 和P<0.05 这两个条件筛选潜在的目的代谢通路,结果如图5,女性组与男性组均有2 种潜在的代谢途径,分别为:(1)组氨酸代谢,(2)苯丙氨酸、酪氨酸和色氨酸生物合成。
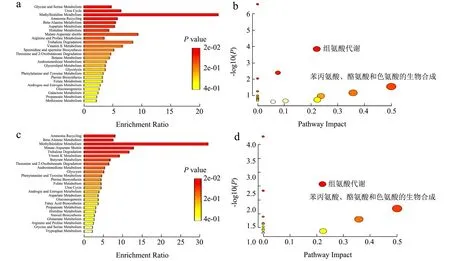
图5 DFC3 组与对照组相比差异代谢物路径富集分析和拓扑分析Fig.5 Pathway enrichment analysis and topological analysis of different metabolites in DFC3 group compared with control group
DFC3 组相对于对照组组氨酸、苯丙氨酸、苏氨酸和天冬氨酸相对丰度显著下降。越来越多的证据表明,像氨基酸和短链脂肪酸的细菌代谢产物是宿主生理学的关键调节因素[39],肠道氨基酸可以有效预测机体健康状况,在诊断疾病方面具有良好潜力[40]。氨基酸作为微生物产生SCFAs 的前体,对于合成在信号通路和代谢中发挥关键调节功能的各种生物活性化合物至关重要[41]。Neis 等[42]研究表明苏氨酸、赖氨酸和谷氨酸可用于丁酸盐的合成。色氨酸是化学上最复杂的氨基酸,几乎可以在其结构中的每个原子上进行生化转化,使其成为多种转化的最佳基质[43],肠道微生物利用色氨酸酶将色氨酸代谢为吲哚,然后吲哚进入宿主门静脉循环,在肝脏中转化为硫酸吲哚酚,接着由肾脏排出,高浓度时具有肾毒性[44]。肠道微生物群对组氨酸、苯丙氨酸和酪氨酸的微生物代谢导致许多与疾病相关的化合物[45],组氨酸经肠道菌群可代谢为丙酸咪唑,在T2DM 患者中发现丙酸咪唑升高,并通过激活p38γ-p62-mTORC1 通路106 损害胰岛素信号传导[46]。高苯丙氨酸可能引起苯丙酮尿症及神经系统的损害等,其中神经系统损害尤为明显,可引起精神障碍、智力缺陷、运动减退等[47]。本研究中膳食纤维复合体干预后的实验组苏氨酸、苯丙氨酸及组氨酸相对含量下降,表明广西长寿饮食模式指导下的抗衰老膳食纤维复合体能够促进短链脂肪酸的产生,可能减少患病风险,增强机体健康状态。
3 结论
本研究探究了体外发酵条件下老年志愿者粪便典型肠道菌群及肠道菌群代谢物的变化。结果表明:与不加膳食纤维的对照组相对,广西长寿饮食模式指导下的抗衰老膳食纤维复合体对老年志愿者肠道典型菌群起到了明显的正向化调控作用,增加了有益菌双歧杆菌属和乳酸杆菌属的丰度,减少了有害菌大肠杆菌属和拟杆菌属的丰度。女性组共筛选出12 种差异代谢物,分别为异丁酸、丙酸、甲酸、蛋氨酸、组氨酸、β-葡萄糖、苯丙氨酸、苏氨酸、丙三醇、天冬氨酸、精氨酸和1-甲基组氨酸,涉及组氨酸代谢,苯丙氨酸、酪氨酸和色氨酸生物合成这两条代谢途径;男性组共筛选出9 种差异代谢物分别为异丁酸、丙酸、丁酸盐、甲酸、组氨酸、β-葡萄糖、苯丙氨酸、苏氨酸和天冬氨酸,涉及组氨酸代谢,苯丙氨酸、酪氨酸和色氨酸生物合成这两条代谢途径。对丰富发展膳食纤维通过改善老年人体肠道菌群促进身体健康的理论提供了一定的参考。
