左外叶肝切除肝移植联合二期全肝切除术(RAPID)治疗肝脏恶性肿瘤
2024-01-09郑启昌
孙 平, 付 广, 郑启昌△
1华中科技大学同济医学院附属协和医院肝胆外科,武汉 430022 2南华大学附属第一医院胃肠外科,衡阳 421001
原发性肝癌是发病率全球第六的恶性肿瘤,且由于恶性程度仅次于胰腺癌,死亡率位居全球第四。慢性病毒性肝炎是肝硬化和原发性肝癌最常见病因,由于我国人群乙肝病毒携带率高,全球大部分原发性肝癌存在于我国[1]。肝脏亦是腹盆腔恶性肿瘤最常见的转移部位,其中又以结直肠癌肝转移最为多见,约50%结直肠癌患者会发生肝转移,而结直肠癌发病率又高于肝癌[2],因此,原发性和继发性肝癌成为危害人民群众生命健康的重要杀手。众所周知,根治性切除是治愈肝癌、获得长期生存的主要手段,虽然近十年分子靶向治疗和免疫治疗取得很大进步,但对总生存的延长有限。因此,探索新的术式以让更多的患者有机会获得根治性切除,仍然是重要的研究方向,譬如近年逐渐开展的联合肝脏离断和门静脉结扎二步肝切除术(ALPPS)[3-4]以及对转移性肝癌行肝移植的探索[5]。
ALPPS出现之前,如果遇到肝右叶肿瘤巨大而残肝体积不够的情况,通常在术前行拟切除侧门静脉栓塞以增加保留侧肝血流,使保留侧肝体积增加,但通常需要数月且效果有限[6]。ALPPS可认为是在此原理上的改进:第一次手术沿拟切除界面离断肝实质并结扎门静脉右支,术后左肝体积可快速增加;二期手术待残余肝体积足够后(通常在一期手术1~2周内),切除右肝[3]。此术式为不可切除的肝肿瘤提供了根治的机会。肝移植是另一种选择,但由于无法有效解决术后肿瘤复发的难题,生存期有限,再加上供肝极其稀缺,全世界均从严把握肝癌肝移植适应证。然而,探索从未停止。挪威奥斯陆的团队对21例经过高度选择的不可切除的结直肠癌肝转移(ur-CRLM)患者行肝移植治疗,5年生存率达到56%,对入选标准进行优化后,进一步提高到83%,而传统化疗组只有9%[7-8],但两组中位无进展生存期相当(约8~10个月),可见良好的远期生存亦得益于辅助治疗的进步。但无论如何,该研究为寻求拓宽肝癌肝移植适应证注入了新的动力,目前已有多项注册的相关临床研究[9]。为了弥合肝癌肝移植疗效和供肝短缺之间的矛盾,融合了ALPPS和肝移植优势的新术式左外叶肝切除肝移植联合二期全肝切除术(resection and partial liver segment 2/3 transplantation with delayed total hepatectomy,RAPID)诞生[10]。
1 RAPID手术诞生的理论背景
奥斯陆的Line团队在对ur-CRLM行肝移植并取得极佳效果后,开始着手解决供肝短缺的矛盾。他们首先想到通过劈裂式肝移植将一个供肝供给2个受者来增加肝源,但由于一个供肝无法同时满足两个成人,通常的做法是将右侧(Ⅰ+Ⅳ~Ⅷ段)供给成人,左侧(Ⅱ~Ⅲ段)供给儿童[11]。由于儿童肝移植的需求较少,且活体供肝较为普遍,对死亡供肝的需求较小,造成了部分左外叶供肝的浪费。那么成人有没有办法用到这些被浪费的左外叶供肝呢?
不得不承认,小体积供肝会带来许多难以克服的挑战。首先,小体积肝脏无法满足机体的代谢需要,为了克服该障碍,手术必须分2期,一期移植左外叶肝脏同时保留受者残余肝脏,以补偿移植物的不足;二期待移植物增生到体积足够后切除残余肝脏。这即需要移植物体积能在短时间内快速增加,也对外科技术和围手术期管理提出了更高要求。其次,需要克服小肝综合征的风险[12]。小肝综合征是由于门脉高灌注和高压力(PVP>20 mmHg)从而破坏肝脏微循环,引起动脉收缩,肝功能障碍甚至肝衰竭,导致移植失败[13]。PVP既不能太高,也不能太低,太低导致供肝增生乏力,亦可能引起所谓的“盗血”现象。最后,由于供肝门静脉血流增加,肝动脉血流代偿减少,从而引起动脉性缺血甚至动脉血栓。因此,在结扎门静脉右支向左分流后,不仅要控制PVP上限,亦要保证肝动脉有足够的血流量。辅助性肝移植亦是很早就提出并应用于临床的概念[14],华中科技大学同济医学院附属同济医院陈孝平院士团队亦探索了小体积辅助肝移植在终末期乙肝肝硬化中的应用,术中保留右肝,仅替换左肝,术后移植肝明显增生,右肝明显萎缩,受者均存活良好[15]。这些理论和技术的积累,加上ALPPS和肝移植的广泛开展,均为RAPID的开展提供了条件,将两种术式的理念合二为一,既可以克服ALPPS手术保留侧肝脏不能有不可切除肿瘤的禁忌,又可以克服左外叶供肝的不足,拓宽了供体来源。
2 RAPID手术适应证
基本同奥斯陆团队选择ur-CRLM患者行肝移植的适应证类似:体能状况评分(ECOG-PS)0~1分;病理确诊的结直肠腺癌;无原位复发及肝外腹腔转移;肝转移不可切除(可切除性由肝胆外科、肿瘤内科、移植科和影像科组成的多学科团队评估,每周重复1次);可有至多3个肺部转移灶(均<15 mm);接受了至少8周的化疗;实验室检查同时满足:血红蛋白>10 g/dL,中性粒细胞>1.0×109/L(治疗后),血小板>10×109/L,胆红素<2倍正常上限,ALT/AST<5倍正常上限,肌酐<1.25倍正常上限,白蛋白正常[10]。该团队亦通过后续的回顾性研究,分析了ur-CRLM患者行肝移植术后预后不佳的高危因素,提出了一些改良的入选标准,以提高手术疗效,可为RAPID手术适应证提供参考[16],该手术的适应证亦可参考国际肝胆胰协会关于ur-CRLM患者行肝移植的最新的指南共识[17]。除了ur-CRLM患者,亦有学者探索将RAPID手术用于肝硬化肝癌患者[18-19]。
3 RAPID手术步骤
自2014年6月第1例RAPID手术开展以来,已有多种RAPID术式应用于临床:按供肝来源可分为死亡供肝RAPID手术[10]和活体供肝RAPID手术[20-21];按移植物安放位置可分为原位移植和异位移植,后者一期手术将移植物移植于脾窝而不处理受者肝脏,二期手术再行全肝切除(RAVAS)[22-23]。但有专家认为异位肝移植可能血管并发症发生率较高,如流出道梗阻导致Budd-Chiari综合征[24],但整体而言,异位肝移植可以取得满意的效果,且给不适合原位肝移植的患者提供了选择[25-26]。其它改进亦包括一期手术同时行原发灶切除+淋巴结清扫+肝切除+肝移植[20],也包括一期切除范围从Ⅰ~Ⅲ段扩大到Ⅰ~Ⅳ段,以利用肝中静脉扩大肝静脉吻合口径,避免术后狭窄。手术过程以最早实施的原位死亡供肝RAPID手术(图1)为例介绍如下。
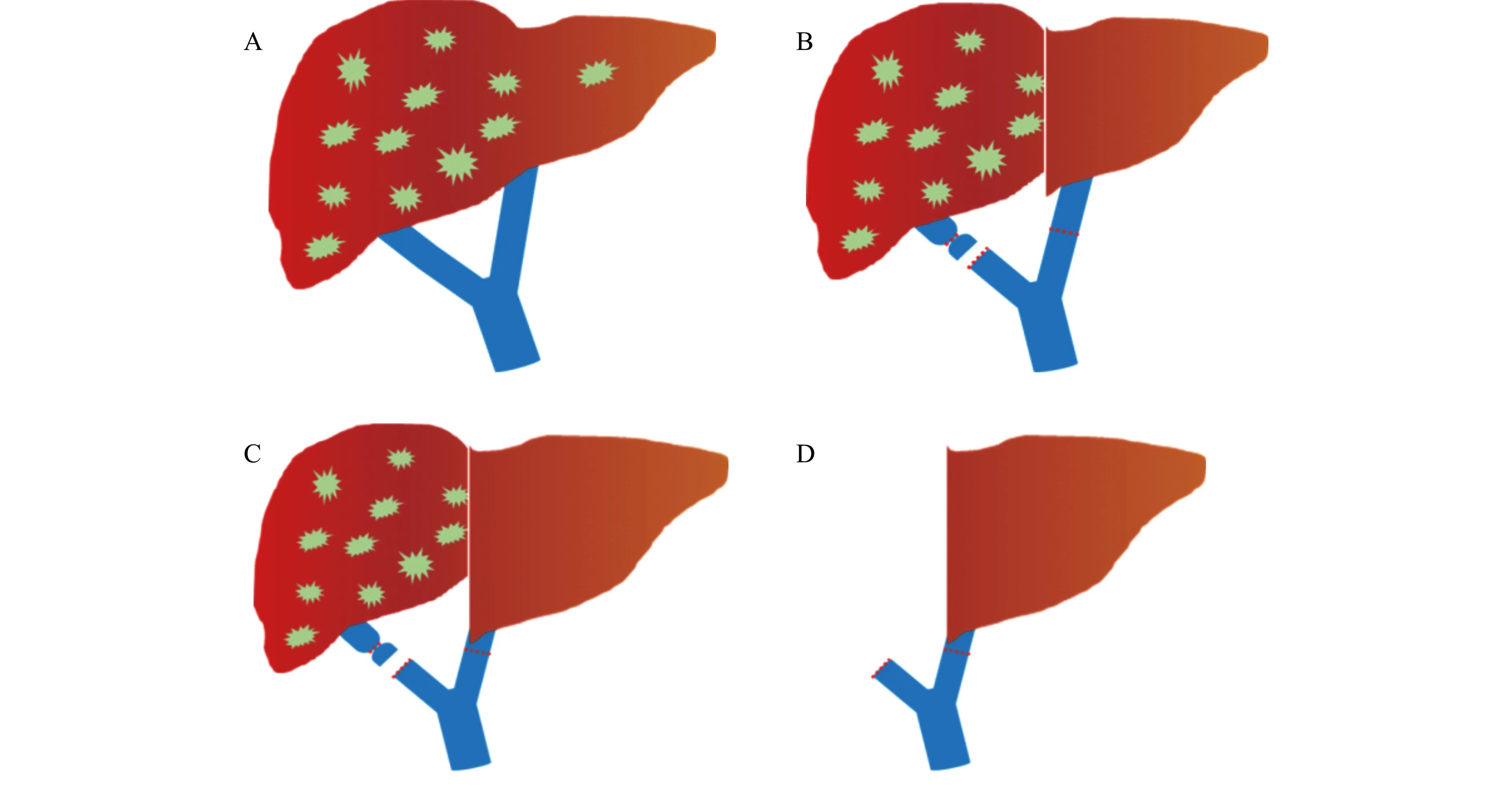
A:手术前状态;B:一期左外叶肝切除肝移植后状态;C:二期手术前状态,左肝增生,右肝萎缩;D:二期手术后状态
3.1 一期手术
包括左肝切除+左外叶肝移植+门静脉右支结扎,腹腔探查排除肝外复发和转移,原位复发,腹膜转移和淋巴结转移;游离肝动脉及门静脉左右支;遵循无瘤原则切除左肝(包含左外叶及尾状叶,即Ⅰ~Ⅲ段);左外叶供肝植入:背驼式技术吻合肝静脉;依次吻合门静脉和肝动脉;吻合完成15 min后,先监测基础门静脉及肝动脉血流量以及门静脉压力,后夹闭门静脉右支重复监测以上指标,结扎门静脉右支,如果PVP >20 mmHg,行限制门静脉压力的操作(限流或分流)[27];胆管吻合;为减少肝脏断面间的粘连,降低二期手术难度,断面可使用涂有人凝血因子纤维蛋白原和凝血酶的胶原海绵或其它有效措施。
3.2 手术间歇期
停用化疗药以免影响移植肝增生;合理选用免疫抑制剂;密切监测肝功能;每周行肝脏CT监测移植肝体积,待移植物/体重比(GBWR)>0.8或移植物达到标准肝体积的35%~40%,可行二期手术。
3.3 二期手术
残余肝切除,类似经典ALPPS手术[3-4]。
4 RAPID手术结局
从已发表的文献报道来看,截至2019年12月,全世界已有11例ur-CRLM患者行RAPID手术,其中3例纳入了死亡供肝RAPID手术的临床研究(NCT02215889)[28]:此3例中1例术后40天死于肝动脉血栓形成和胆道感染;另2例约术后2月肝静脉狭窄植入静脉支架,但均存活至今,1例已经无病生存5.5年;另一例已存活2年,但术后12月发现肺转移,术后18月发现骨转移。有8例接受了活体供肝RAPID手术(5例德国,2例意大利,1例比利时,但其中2例使用了左半肝供肝而不是左外叶供肝),所有供者均未出现并发症。第1例德国患者,术后21 d怀疑排斥反应调整了免疫抑制剂;术后34天出现胆瘘胆汁性腹膜炎,予手术引流后3周痊愈;术后41天出现特发性血小板减少性紫癜,1周后自愈;术后5月出现肺转移骨转移,术后24月死于放射性同位素治疗并发症。另一例德国患者术后4月死于肺栓塞,未发现肿瘤复发。最后3例德国患者随访6~18个月,均存活且无复发。德国以外的3例患者结局尚无报道[21]。新近的一篇文献报道了1例活体供肝RAPID术式用于肝硬化肝癌的患者,左外叶移植后22 d,移植物受者重量比从0.35增长至0.6,然后进行了二期肝切除,术后恢复顺利,截至投稿患者已经无复发生存1年[18]。
5 RAPID技术要点
由于最初的病例均是一期切除肝脏Ⅰ~Ⅲ段[10],然后肝左静脉对端吻合,有2例患者术后2月出现肝静脉狭窄需要植入静脉支架,考虑由于术后短期内移植肝快速增生导致肝静脉扭曲所致。支架植入虽然解除了狭窄,但如何避免才是根本,可能的解决方案包括:供肝肝左静脉同扩大的受者下腔静脉吻合;同时切除Ⅳ段(Ⅰ~Ⅳ段),利用上受者肝中静脉,供肝肝左静脉同整形后的受者肝左肝中静脉吻合[20]。其它技术细节亦包括:切除左肝时高位离断左侧肝管并缝扎断端,可避免对右侧肝管和肝总管的损伤;为方便二期手术,供肝门静脉同受者门静脉主干行端侧吻合,供肝肝动脉同受者肝总动脉行端侧吻合;亦有术者先行离断门静脉右支,行门静脉对端吻合,后根据门静脉压力决定是否行限制门静脉压力的操作,而控制好小体积移植物的门静脉流量和压力被认为是该手术成功的关键,但目前纳入的均是无肝硬化的患者,尚无病例用到限制门静脉压力的额外操作;首选肝管空肠Roux-en-Y吻合方便二期手术操作。
6 可能的争议
有学者质疑活体供肝RAPID手术,认为为何不行传统的活体肝移植,即可一次完成手术,还能降低分期手术期间肿瘤播散转移的风险。而活体供肝RAPID手术的倡导者认为,因为选取的都是ur-CRLM患者,虽然总生存不错,但复发风险极高,仍被认为是姑息手术。而传统的活体肝移植需行供者半肝切取,虽然在全世界范围内,死亡的受者仅为个位数,但并发症发生率不低。为了治疗并不早期的肿瘤,而将供者置于危险的境地,不符合伦理,保证供者的安全才是最高目标,左外叶供肝刚好可将供者风险降到最低[29]。相较死亡供体,活体供肝还有一个优势:由于死亡供者在时间上的不可预测性,而CRLM患者需要定期化疗,只有较小的化疗间隙期适合手术,窗口极小,时间上难以调和,而活体供者可以克服该障碍,选择最佳手术时机。
另一个争论是移植后免疫抑制剂的使用以及肝脏再生可能加速肿瘤生长和转移,尤其是在两次手术的间隙。但奥斯陆的团队在对ur-CRLM行肝移植的前期研究发现,即使是移植后复发的患者,自复发开始,5年生存率仍然达到53%,而行姑息化疗的患者5年生存率为0,由此说明,免疫抑制剂的使用并未明显促进肿瘤进展[8],现在也有具有抗血管生成等肿瘤抑制作用的免疫抑制剂可供选用如mTor抑制剂(西罗莫司和衣维莫司)[30]。亦有手术团队考虑在两次手术间使用抗EGFR单克隆抗体抑制肿瘤进展[22]。
7 展望
对于经过选择的ur-CRLM患者行肝移植是一个切实可行的选择[16]。且最新的回顾性研究发现,其生存率优于先行门静脉栓塞,然后二期行肝切除的患者[31]。死亡供者RAPID手术受限于供肝不足,难以广泛开展,而传统的活体供肝肝移植无法较好地平衡供者风险和受者获益,活体供肝RAPID手术则可结合两者优点,弥补相互不足,在同时可常规开展ALPPS和活体肝移植尤其是儿童活体肝移植的中心,可行探索性尝试,进行临床研究(需进行多学科讨论并获得伦理委员会通过)。但现阶段,囿于手术的复杂性和高风险,必须从严把握适应证,努力做到风险最小化,获益最大化。并对患者进行长期随访,明确该术式的中长期疗效,并为技术的改进和适应证的选择提供依据。未来还可能探索该术式在原发性肝癌和其它种类的恶性肿瘤肝转移患者中的应用价值。
