紫菀酮对LPS诱导的气道细胞炎症反应及自噬的影响*
2024-01-09李桢,艾奎
李 桢, 艾 奎
武汉市第三医院光谷院区儿科,武汉 430074
气道炎症是慢肺阻和哮喘的主要特征之一。在慢阻肺发展和炎症细胞释放炎症介质和破坏性酶的过程中发挥重要作用[1]。自噬是维持细胞稳态和功能的重要过程,对气道炎症的发生具有重要作用。自噬是一个与自噬体形成相关的动态过程,LC3作为自噬标志物,当自噬形成时,胞浆型LC3(即LC3-Ⅰ)会酶解一小段多肽,转变为(自噬体)膜型(即LC3-Ⅱ)[2]。在OVA诱导的哮喘模型小鼠气道组织中发生了自噬[3-5],而在哮喘气道炎症中,气道上皮细胞通过激活NF-κB与活化蛋白-1(AP-1)发生自噬。因此,抑制自噬对哮喘的气道炎症和黏液细胞增生均有治疗作用。
mTOR(雷帕霉素靶蛋白)在调节细胞生长和代谢以响应生长因子和营养物质方面起主导作用,mTOR信号通路与癌症、肥胖、2-型糖尿病的进展以及衰老过程有关[6]。由于mTOR的敏感性不同,其主要在两个复合体中发挥作用,mTOR复合体1和mTOR复合体2,而mTOR复合体1被认为是自噬的主要调节因子[6-7]。
紫菀酮是紫菀的主有效活性成分,主要在其根及根茎中积累[8],能够抑制细胞中炎症因子的产生,从而减轻肺部炎症。但是,紫菀酮能否抑制气道炎症细胞中的自噬发生需要进一步研究,因此,本实验拟在LPS诱导的气道上皮炎症模型的基础上,探讨紫菀酮对气道炎症细胞自噬及机制的作用,为紫菀酮抗哮喘气道炎症的具体分子机制提供实验基础。
1 材料与方法
1.1 材料
Beas-2B细胞来源武汉大学细胞库。紫菀酮(B21703,20 mg)购自源叶生物,BEGM Bullet Kit购自Lonza(CC3170),CCK-8试剂盒购自BestBio(BB-4202),IL-6(HM10205)和TNF-α(HM10001)试剂盒购自Bioswamp,吖啶橙荧光染色检测试剂盒购自金克隆(CC2270),Trizol购自Ambion(15596026),SYBR FAST qPCR Master Mix购自KAPA Biosystems(KM4101),Oligo(dT)18 Primer(3806)、PrimeScriptⅡRtase(2690A)和Recombinant Rnase Inhibitor(2313A)购自TaKaRa,10 mmol/L dNTP Mix购自Solarbio(PC2200)。蛋白质Marker购自Helix(P12103),BCA蛋白浓度测定试剂盒购自Solarbio(PC0020),NF-κB(PAB33379)、p-NF-κB(ab76302)、AP-1(PAB37390)、Beclin 1(PAB35215)、LC3-Ⅱ(PAB34117)、LC3-Ⅰ(PAB34124)、mTOR(PAB30674)、S6K1(PAB33261)、GAPDH(PAB36269)和Goat anti-Rabbit IgG(SAB43714)抗体购自bioswamp,p-mTOR(ab109268)抗体购自Abcam,p-S6K1(9234T)抗体购自CST。
1.2 细胞培养及模型构建
将Beas-2B细胞置于37℃水浴中,待其完全融化,将细胞悬液吸至离心管中,加入4 mL完全培养液,400×g,离心3 min,弃上清,细胞重新悬浮于1 mL培养液中,转移至培养瓶中,加入4 mL完全培养液,置于37℃,5% CO2的培养箱内培养。取对数期生长的上皮细胞用1 μg/mL的LPS干预24 h,构建炎症模型[9]。
1.3 CCK-8检测
利用不同浓度的紫菀酮(0、1、10、25、50、75、100 μmol)干预Beas-2B细胞24 h和48 h后,用CCK-8检测细胞增殖。调整细胞悬液浓度,分于96孔板,3×103个细胞/孔,每孔100 μL,置37℃、5% CO2培养箱中培养过夜。然后按照分组加入不同浓度的紫菀酮干扰细胞,继续培养24 h,48 h,加入10 μL CCK-8溶液,继续培养4 h,在酶联免疫检测仪450 nm处测量各孔的吸光度值。
1.4 ELISA检测
在建模前,利用不同浓度的紫菀酮(0、1、10、25、50、75、100 μmol)干预Beas-2B细胞,再经LPS诱导24 h和48 h后,采用ELISA检测各组细胞中IL-6和TNF-α的水平。首先,将标准品进行稀释,将6只小试管依次编好号码,严格按照说明步骤进行,将每管稀释至相应浓度。然后进行加样,在酶标包被板上设标准品孔、空白孔、样本孔,标准孔依次加入不同浓度的标准品50 μL;样本孔中先加样品40 μL,然后再加生物素标记的抗体10 μL,除空白孔外,每孔加入酶标试剂50 μL,用封板膜封板后置37℃培养箱中温育30 min,洗涤后加入显色液进行显色,最终加入终止液在450 nm波长依序测量各孔的吸光度(A)值。
1.5 吖啶橙荧光染色
将实验分为3组:对照组、LPS组、LPS+紫菀酮(25 μmol)组。首先取AO Stain Buffer和AO Stain,按照19∶1的比例混合,配制工作液,然后取1 mL工作液覆盖细胞,室温避光染色15 min,然后弃去染色液,用PBS洗涤,在荧光显微镜下观察(激发滤光片波长488 nm,阻断滤光片波长515 nm),拍照。
1.6 荧光定量qRT-PCR检测
取1×106个细胞于1 mL的Trizol中匀浆,进行总RNA的提取,然后进行RNA逆转,将制备好的cDNA进行PCR扩增,反应条件为:预变性95 ℃ 3 min;95 ℃ 5 s,56 ℃ 10 s,72 ℃ 25 s(40个循环)采用2-ΔΔCt计算目的mRNA的相对含量。PCR引物由武汉天一华煜基因科技有限公司合成,引物序列见表1。
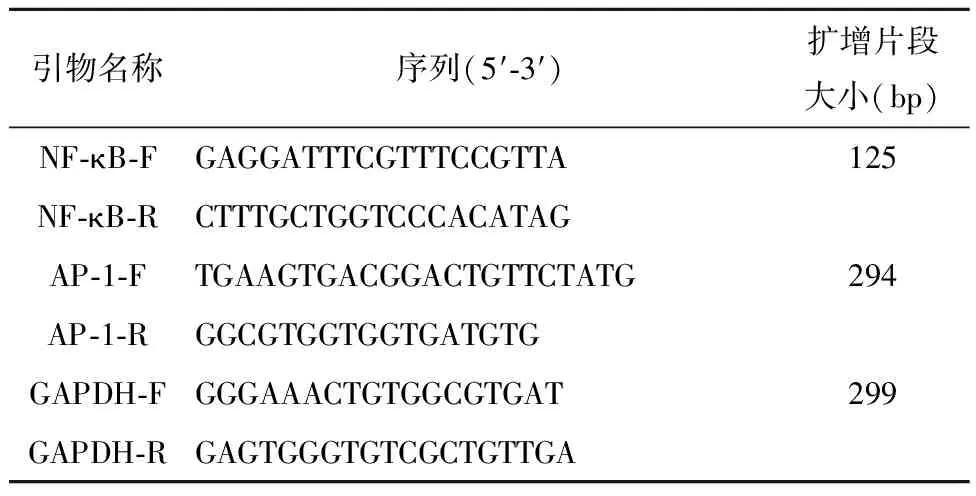
表1 引物序列
1.7 蛋白印迹实验(Western blot)
将蛋白质进行提取,采用BCA试剂盒测定各组的蛋白浓度,在凝胶中(配制12%的分离胶和5%的浓缩胶)加入20 μg蛋白,选择浓缩胶80 V 40 min,分离胶120 V 50 min电泳,恒压90 V转膜50 min,5 %脱脂奶粉室温封闭4℃过夜,加入一抗(1∶1000 NF-κB;1∶1000 p-NF-κB;1∶1000 AP-1;1∶1000 Beclin 1;1∶1000 LC3-Ⅱ;1∶1000 LC3-I;1∶1000 mTOR;1∶1000 p-mTOR;1∶1000 p-S6K;1∶1000 S6K1;1∶1000 GAPDH)室温孵育1 h,洗膜后二抗(1∶10000 Goat anti-Rabbit IgG),室温孵育1 h。加入ECL发光液后置于全自动化学发光分析仪中显色,通过TANON GIS软件读取相关条带灰度值,每组重复3次。
1.8 统计学方法
采用SPSS 19.0软件进行统计学分析,计量资料采用均值±标准差表示。多组间均数比较采用单因素方差分析,均数间两两比较采用LSD-t检验。以P<0.01为差异具有统计学意义。
2 结果
2.1 紫菀酮对Beas-2B细胞增殖活性的影响
通过CCK-8检测不同浓度的紫菀酮干预不同时间对Beas-2B细胞增殖活性的影响。结果如图1,干预24 h的细胞增殖活性始终低于干预48 h的细胞增殖活性。因此,后续实验选择干预时间为24 h。

图1 CCK-8检测细胞的活性
2.2 紫菀酮对LPS诱导的Beas-2B细胞炎症反应的影响
通过ELISA检测LPS诱导后对细胞中IL-6与TNF-α表达的影响。如图2,在干预24 h和48 h后,细胞中IL-6与TNF-α的水平依次随紫菀酮浓度的增加而降低。在紫菀酮浓度为50 μmol/L和25 μmol/L时,干预24 h后细胞中IL-6和TNF-α的水平趋于一致。因此,综合以上指标,选择25 μmol/L的紫菀酮干预24 h进行后续实验的研究。
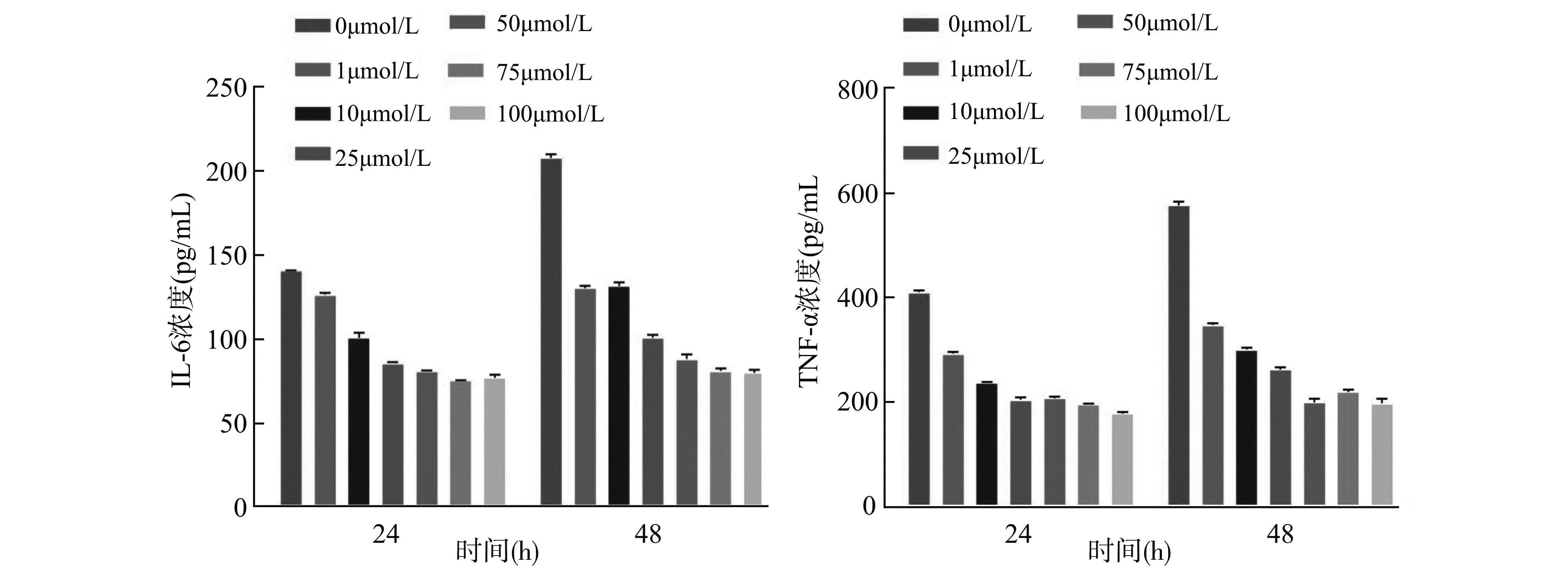
图2 Beas-2B细胞中IL-6与TNF-α表达
2.3 紫菀酮对LPS诱导的Beas-2B细胞NF-κB的激活及AP-1表达的影响
利用qRT-PCR检测各组细胞NF-κB和AP-1转录水平表达,结果发现(图3),与对照组比较,LPS诱导后细胞中的NF-κB和AP-1的相对表达显著升高(均P<0.05)。与LPS组比较,添加紫菀酮显著降低了细胞中NF-κB和AP-1的相对表达(均P<0.05)。同时,我们通过Western blot检测NF-κB、p-NF-κB和AP-1表达。如图4所示,与对照组比较,LPS诱导后细胞中的p-NF-κB和AP-1的相对表达显著升高(P<0.05)。与LPS组比较,添加紫菀酮显著降低了细胞中p-NF-κB和AP-1的相对表达(均P<0.05)。

与对照组比较,*P<0.05;与LPS组比较,#P<0.05

与对照组比较,*P<0.05;与LPS组比较,#P<0.05
2.4 吖啶橙染色观察各组细胞自噬变化
如图5,用吖啶橙染色观察各组细胞自噬变化。结果发现,与对照组比较,LPS组出现橘、红色荧光,有很多点状红色斑点的酸性膜泡,自噬水平增加。而在添加紫菀酮后可以观察到橘、红色荧光明显减少,自噬水平显著降低。
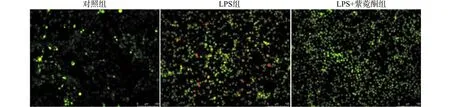
图5 吖啶橙染色结果(×200)
2.5 Western blot观察各组细胞自噬相关蛋白及信号通路的变化
如图6,与对照组比较,LPS组细胞中Beclin 1和LC3-Ⅱ的相对表达显著增加(均P<0.05),LC3-Ⅰ的表达显著降低(P<0.05)。与LPS组比较,LPS+紫菀酮组的Beclin 1和LC3-Ⅱ的相对表达显著降低(均P<0.05),LC3-Ⅰ的表达显著升高(P<0.05)。通过检测mTOR、p-mTOR、p-S6K1和S6K1的相对表达发现,与对照组比较,LPS组细胞中p-mTOR和p-S6K1的表达显著降低(均P<0.05)。与LPS组比较,LPS+紫菀酮组细胞中p-mTOR和p-S6K1的表达显著增加(均P<0.05)。

与对照组比较,*P<0.05;与LPS组比较,#P<0.05
3 讨论
自噬是细胞内一种高度保守的分解代谢过程。细胞在发生自噬时,会产生一系列标志物,如LC3-Ⅱ、LC3-Ⅰ和Beclin 1等[10]。在自噬的调节过程中,Beclin l通过与B淋巴细胞瘤-2相互作用,在自噬过程的触发阶段发挥作用[11]。LC3作为自噬体最常用的标记,在自噬泡的形成过程中,LC3前体被加工成可溶性LC313-1(胞浆型LC3),LC3-Ⅰ可在At97(El样酶)和Atg3(E2样酶)作用下跟磷脂酰乙醇胺结合转变为膜型LC3(即LC3-Ⅱ),参与自噬体膜延伸[12]。在本实验中,通过吖啶橙染色发现,LPS诱导后的Beas-2B细胞中有很多点状红色斑点的酸性膜泡,自噬水平增加。同时,Western blot检测发现LPS诱导后的Beas-2B细胞中LC3-Ⅱ和Beclin 1的表达增加,LC3-Ⅰ的表达降低。而这些情况在添加紫菀酮后发生逆转。说明紫菀酮能够明显抑制Beas-2B细胞自噬的发生。
丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPKs)是细胞内的一类丝氨酸和(或)苏氨酸蛋白激酶,作为细胞应激和损伤反应的主要信号通路,而MAPKs的底物多为转录因子,包括转录因子NF-κB和AP-1等[13],与炎性细胞因子的合成和分泌密切相关。本研究中,通过RT-PCR检测发现,紫菀酮能够显著抑制NF-κB和AP-1的相对表达。NF-κB的激活能够增加多种炎症基因的表达,包括促炎细胞因子和炎症相关酶类的释放等。因此,抑制NF-κB的表达能够减少炎症介质的释放[14]。
mTOR是一种保守的丝氨酸或苏氨酸蛋白激酶,作为细胞增殖、细胞生长、存活、自噬和转录的中心调节剂[15]。有研究证明,在OVA诱导的过敏性小鼠模型中,mTOR的激活能够减少炎症的发生[16]。mTOR信号通路能够调控自噬的发生[17],在过敏小鼠肺中通过mTOR信号通路的激活来抑制自噬进而抑制过敏性气道炎症[16]。本研究中,通过Western blot实验发现,紫菀酮能够上调p-mTOR和p-S6K1的表达。而S6K1作为mTORC1激活后的下游调节因子,经mTOR磷酸化后的S6K1可激活相应核糖体S6蛋白,增加了含嘧啶序列mRNA翻译表达核糖体蛋白和翻译调节蛋白[18]。因此,紫菀酮通过抑制自噬有效缓解了LPS诱导的Beas-2B细胞气道炎症,而这种效应是由mTOR通路激活介导的。
综上所述,本研究通过LPS诱导构建Beas-2B细胞炎症模型,利用紫菀酮干预。结果发现紫菀酮能够上调细胞中p-mTOR和p-S6K1的表达,下调NF-κB、AP-1、LC3-Ⅱ和Beclin 1表达,有效缓解了自噬的发生,其机制可能与mTOR信号通路的激活有关。
