胆汁酸、肠道菌群与结直肠癌免疫检查点治疗
2024-01-09李天赐戚钧文时林森
李天赐, 戚钧文, 时林森
结直肠癌(colorectal cancer,CRC)作为最常见的消化道恶性肿瘤之一,在所有恶性肿瘤发病率及死亡率中均居第三位[1]。环境、饮食等后天因素在散发性结直肠癌发生发展中发挥了重要作用,随着生活方式转变及饮食结构逐渐西化,结直肠癌发病率在国内有逐年增高的趋势。胆汁酸作为机体胆固醇代谢衍生物,既往认为其主要参与机体的糖脂代谢及吸收,但现在越来越多的研究发现胆汁酸可通过与核受体(如FXR、TGR5等)的相互作用,调节细胞增殖、凋亡、迁移和侵袭等信号通路,从而影响结直肠癌的发生。同时,胆汁酸还可以作为细胞内和细胞外信号分子,通过调节免疫应答等机制,进一步影响肿瘤微环境和免疫反应。人体消化道共生菌群在胆汁酸水解、次级、三级胆汁酸合成中发挥了重要作用,同时胆汁酸又可以修饰肠道菌群,二者之间存在动态的反馈和平衡。肠道菌群的平衡失调可能导致慢性炎症、DNA损伤和免疫应答异常,从而增加结直肠癌的风险。
以PD-1,CTLA-4等为代表的免疫检查点(immune checkpoint inhibitors,ICBs)治疗已成为目前临床及基础研究的热点,在CRC中也得到广泛应用并且在部分患者身上也取得了令人鼓舞的效果。但在临床应用中仍存在治疗反应率偏低、缺乏有效、精准疗效预测指标、治疗后耐药等一系列难题。因此,更加深入了解结直肠癌免疫调控的机制和机体自身代谢及免疫系统在ICBs治疗中的具体角色,将有助于CRC免疫治疗的个体化和精准化。
1 胆汁酸代谢及肠肝循环
胆汁酸作为胆汁主要成分,主要通过细胞色素P450系统通过一系列级联反应在肝细胞中以胆固醇为底物合成。其中,经典合成通路约占75%左右,其重要产物为胆酸(cholic acid,CA),而改良途径的产物则为鹅去氧胆酸(chenodeoxy cholic acid,CDCA)[2]。人体胆酸合成后主要与牛磺酸和甘氨酸结合,形成结合初级胆汁酸,储存于胆囊。进食后在胆囊收缩素左右下排入十二指肠,参与脂类营养物质的乳化和吸收。在回肠末端,约95%的胆汁酸通过主动和被动吸收入门静脉系统,通过所谓“肠肝循环”重新回到肝脏,该循环在正常机体每天需要进行6~8次[3],见图1。约5%的胆汁酸可脱离肠肝循环进入远端大肠,在胆酸水解酶(bile salt hydrolases,BSH)作用下形成非结合胆酸,然后经肠道菌群羟基类固醇脱氢酶(hydroxysteroid dehydrogenase,HSDH)的脱羟基作用形成次级、三级胆汁酸。迄今为止,共发现人体次级、三级胆汁酸超过100种之多,但主要仍以来源于CA的脱氧胆酸(deoxycholic acid,DCA)和合成自CDCA的石胆酸(lithocholic acid,LCA)为主[4]。次级胆汁酸在大肠仍有少部分可通过被动扩散作用重新进入肠肝循环,但大部分经粪便排出体外。胆汁酸在消化道主要通过其受体如FXR、TGR5、VDR、S1PR2等反馈控制胆酸合成和发挥其小分子信号物质生理作用。
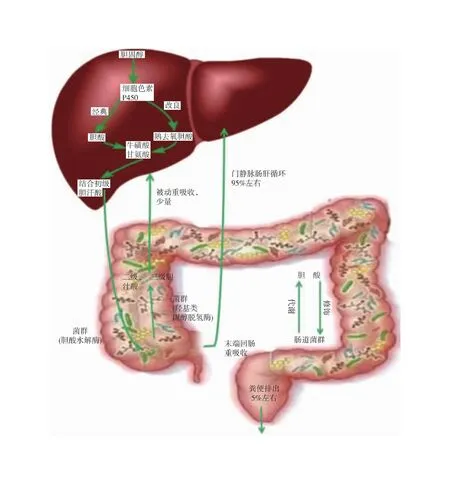
图1 胆汁酸代谢及肝肠循环[5]
2 胆汁酸与肠道菌群的双向调控作用
肠道菌群作为一个庞大而复杂的微生态系统,和机体健康和疾病密切相关[5]。肠道菌群可通过水解、脱羟基等作用改变胆汁酸组成。同时,饮食、疾病、药物等各种外界因素造成的胆汁酸谱改变又可修饰肠道肠道菌群,诱发一系列病理、生理改变。胆汁酸-肠道菌群轴失调在代谢、肿瘤、免疫、感染性疾病中都已得到了证实[6-9]。
胆汁酸对肠道菌群的调控作用主要通过以下途径来实现:①直接的细胞毒性或细胞结构的复杂改变,如DNA损伤,RNA结构改变,蛋白变性,氧化应激压力等[10]。这种作用具有菌株特异性,格兰阳性菌一般较格兰阴性菌更为敏感;②通过作用于肠黏膜的胆酸受体,如FXR,TGR5等,直接激活机体的初始免疫应答,释放抗菌多肽,从而改变肠道菌群组成[11]。
肠道菌群对胆汁酸谱同样具有调控作用,肠道内的肠道菌群具有生物转化作用,肠道菌群能够影响胆汁酸代谢相关酶(CYP7a1、CYP7b1、BSH等)的表达,将结合胆汁酸转化为游离胆汁酸、初级胆汁酸转为化为次级胆汁酸,进而调控胆汁酸谱[12]。
目前,使用合成胆酸小分子或其他手段来调整肠道菌群,从而治疗相关疾病已有相关报道。早在2018年Friedman等[13]就报道了使用胆酸衍生物雌二醇酸可以激活小肠FXR受体,增加肠道格兰阳性菌如普氏栖粪杆,多氏拟杆菌的丰度,从而实现肠道菌群的人工编辑。Xu等[14]的研究发现DCA可以激活肠道黏膜FXR受体从而改变肠道菌群,诱发小鼠肠道自发炎症,而FXR拮抗剂可以阻断这一效应。一项由Tang等[15]发起的横断面研究也证实,熊去氧胆酸(ursodeoxycholic acid,UDCA)对原发性胆汁性胆管炎(primary biliary cholangitis,PBC)的治疗可以提高患者粪便肠道菌群丰度,增加有益菌属如粪杆菌属等的比例,从而缓解胆管的局部炎症。
3 胆汁酸、肠道菌群紊乱与结直肠癌
2013年,由Ou等[16]完成的调查性研究表结果显示,高纤维、低脂肪饮食为主的非洲土著人(CRC发病率<5/100 000)与高脂、低纤饮食的非裔美国人(CRC发病率约 65/100 000)相比,肠道菌群多样性明显高于后者,而后者粪便次级胆汁酸水平明显高于前者。从而证实,肠道菌群衍生的次级胆汁酸在CRC发病中发挥着重要作用。最近的一项回顾性队列研究结果也表明,血清胆汁酸中结合胆汁酸水平和CRC发病率正相关,但游离胆汁酸无明显相关性[17]。但Sinha等[18]的研究结果却表明,溃疡性结肠炎患者术后肠道合成次级胆酸的相关菌群数量降低,可诱导储袋炎的发生,这可能和原有基础疾病和所用研究模型不同有关。
长期高脂、高蛋白、低纤维饮食可刺激肝脏胆酸合成,大量初级胆汁酸进入肠道后又通过直接或间接的菌群修饰作用,导致肠道含7α-脱羟基酶的菌群相对增多,产生大量次级胆汁酸,特别是DCA和CDCA,从而诱发肠黏膜的慢性炎症和CRC的发生[19-20]。众所周知,美国阿拉斯加原住民拥有世界上最高的CRC发病率,约91/100 00,一项针对该人口的横断面研究证实,阿拉斯加原住民较健康对照肠道菌群中具有7α-脱羟基酶的布劳特氏和蓝绿藻菌属丰度明显增多,粪便中DCA浓度也显著增高[21]。
Dermadi等通过长期给予小鼠西式饮食后发现,黏膜胆汁酸代谢紊乱和FXR受体的失活可促进黏膜癌变和结肠肿瘤细胞的增殖[22]。Fu等[23]的研究进一步证实,饮食因素导致的WNT通路失调(APC基因突变)可以改变肠道胆汁酸谱,增高的次级胆酸如DCA等可沉默PXR受体,促进Lgr5+的结肠癌干细胞增殖和DNA损伤。吸烟作为CRC的高危因素之一,同样被证实其可引起肠道菌群失调,包括缓慢爱格士氏菌增多,狄氏副拟杆菌和乳酸杆菌减少,进而合成牛璜脱氧胆酸(taurodeoxycholic acid,TDCA)增多,最终激活MAPK/ERK通路和破坏肠黏膜屏障功能[24]。但是,不同胆酸对肠上皮的作用具有特异性,例如牛璜熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)就被证实可抑制CRC细胞NF-κB通路的激活,减少炎症因子释放,因此可以做为CRC的潜在治疗选择[25]。
肠道菌群作为肠黏膜生物屏障的主体,在正常肠黏膜生理功能维持、病理状态如炎症、损伤、癌变的过程中发挥的重要作用已得到公认,无需赘述。而肠道菌群及其代谢产物如胆酸,短链脂肪酸等,也可修饰肠道的局部免疫微环境,影响CRC的发生。调节性T细胞(Treg)是维持黏膜免疫稳态的重要细胞亚群,消化道胆汁酸可通过胆酸受体尤其是VDR来维持 RORγ+Treg的稳态。LCA的两种重要衍生物,3-oxoLCA可抑制Th17分化,而isoalloLCA则促进Treg细胞分化,口服该化合物的小鼠免疫应答受到明显抑制[26-27]。相反,DCA衍生物3β-羟基脱氧胆酸(isoDCA),则可以通过DC细胞来诱导FoxP3分化,从而增强其免疫抑制功能[28]。同时,DCA可引起肠黏膜局部巨噬细胞的富集和M2极化,促进炎症因子的释放,同时减少免疫球蛋白sIGA分泌,降低肠道的免疫屏障和对病原体的防御功能[29]。
4 胆汁酸、肠道菌群调整与结直肠癌免疫治疗
肿瘤免疫治疗成功的关键在于破除局部免疫抑制微环境(tumor microenvironment,TME),重新激活机体的抗肿瘤免疫系统。肠道菌群及其代谢产物,在CRC局部免疫TME的构成中,也发挥了举足轻重的作用[30]。早在2013年,Iida等[31]就率先证实了肠道菌群失调可以通过增强肿瘤TME中髓系来源抑制细胞功能,从而影响CpG寡核苷酸免疫疗法在CRC中的治疗效果。在2015年,ICBs抑制剂问世不久,Marie等[32]就发现了CTLA-4靶向药物疗效和肠道共生菌,尤其是脆弱拟杆菌和多形拟杆菌密切相关,而在抗生素预处理或无菌小鼠几乎无效,从而证实了肠道菌群在ICBs治疗中的重要作用。
关于肠道菌群重塑肿瘤局部TME,影响ICBs治疗的具体机制,目前为止远未完全阐明。该领域已经引起相关学者的高度兴趣,大量的研究结果也在近期不断发表。主要理论大概有以下几种:①通过肠道菌群调整,可以改变肿瘤中效应/抑制淋巴细胞比例,形成抗肿瘤的局部TME[33];②菌群抗原通过APC的递呈促进DC细胞的活化,经过细胞因子的释放,最终激活TME中效应T细胞,如CD8+T细胞,肿瘤特异性CD4+T细胞等,增强TH1抗肿瘤免疫[34-35]。③通过其代谢产物,如胆酸、短链脂肪酸,肌酐等,直接作用于免疫细胞,进而影响其功能[36-38]。
传统的肠道菌群修饰技术如益生菌、抗生素、营养、饮食调整等,虽广泛使用,但存在疗效不可靠、无法量化、欠缺精准性等缺点。近年来,以标准化粪菌移植(fecal microbiota transplants,FMT),特异性菌株分离和纯化技术的不断兴起和成熟,使肠道菌群的个体化、标准化人工编辑成为可能[39]。目前Clinical trials注册的关于FMT和肿瘤ICBs治疗相关临床研究共7项(NCT05273255、NCT04729322、NCT05279677、NCT04130763、NCT04758507、NCT05251389、NCT04577729)(表1)。期待更多的高质量随机对照研究结果能为临床提供更高级别证据。
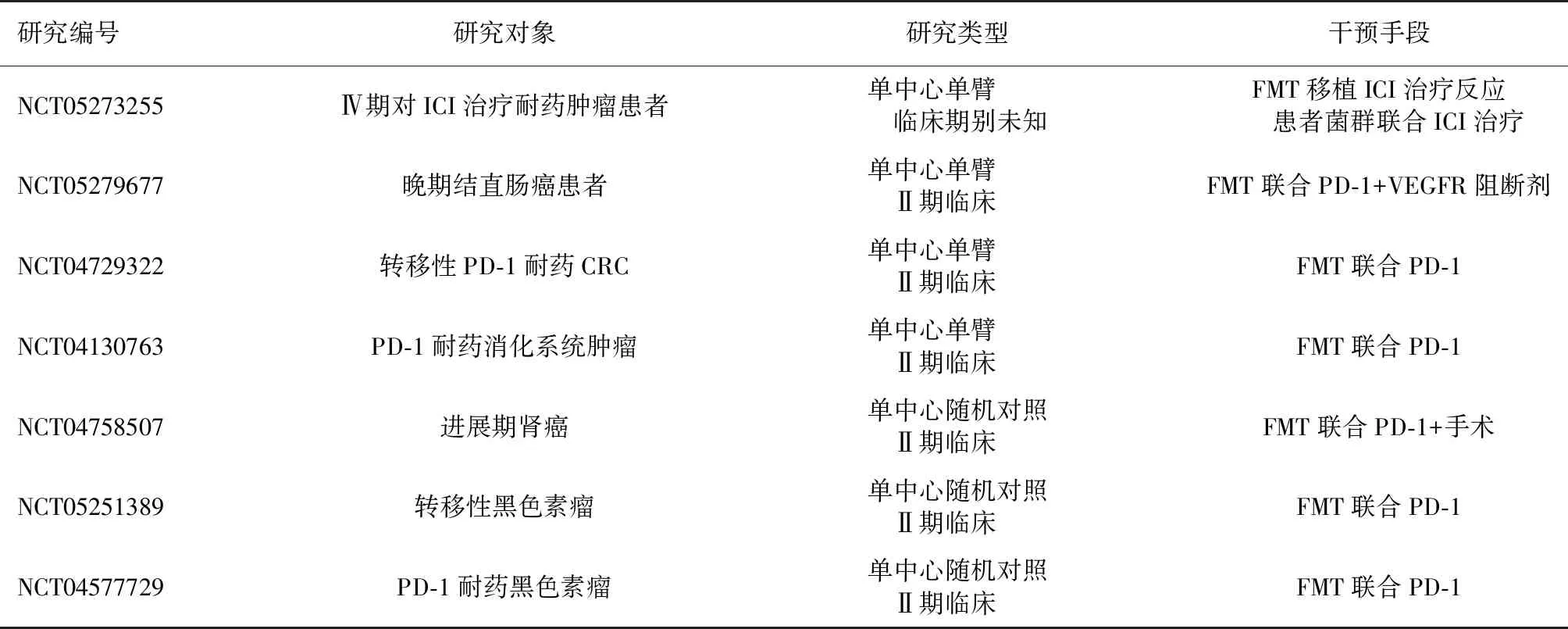
表1 正在进行的关于FMT联合肿瘤免疫检查点治疗的相关临床研究
虽然已有不少的研究报道了FMT联合免疫治疗能够明显影响肿瘤患者对抗肿瘤免疫疗法的反应,但是粪便中何种成分带来FMT疗法的成功尚未得到澄清。因此验证粪便中各种成分独立的作用机制可能为FTM联合免疫治疗提供新的治疗方案。
益生菌和益生元等菌群调控制剂联合免疫治疗可能会增加ICBs的疗效,进而提高肿瘤免疫治疗的反应性[40]。尽管益生菌联合免疫治疗在结直肠癌的临床治疗中少有报告,但Dizman等[41]在一项临床试验中发现予转移性肾细胞癌患者纳武利单抗+伊匹木单抗治疗的时候,辅以益生菌口服药物CBM588来联合治疗,能极大地改善中位无进展生存期。因此菌群调控制剂联合免疫治疗在CRC的具体作用和效果值得进一步开展系统、多中心、随机对照的临床试验。
关于肠道菌群修饰和CRC的ICBs治疗,多项研究已经进行了相关报道。Zhang等[42]将小鼠肠道菌群使用广谱抗生素进行清除后,FMT植入CRC患者菌群能使PD-1治疗疗效减低,而植入健康捐献者粪便菌群联合膳食纤维能明显增强PD-1治疗反应,其机制可能是通过增加肿瘤TME中CD8+T细胞浸润和功能。同时,肠道菌群紊乱造成的3型天然淋巴细胞(ILC3)减少和比例失调,是造成PD-1治疗在CRC耐药的原因之一[43]。L.paracasei sh2020作为人工分离纯化的乳杆菌菌株,在小鼠体内可以明显增加肿瘤TME中效应T细胞浸润,增强PD-1治疗反应[44]。目前,关于胆酸和CRC免疫检查点治疗的相关研究较少,但在其他疾病,如肝癌中已有相关报道[45]。
5 总结及展望
肿瘤的免疫治疗在近年来得到了前所未有的重视和快速地发展,先是在黑色素瘤、淋巴瘤等病种中取得了巨大成功,而后又逐渐扩展到消化道、妇科、呼吸道肿瘤等领域。CRC作为一种炎症相关性肿瘤,长期的慢性炎症导致的局部免疫抑制TME和肿瘤细胞免疫逃逸是CRC发生、发展的重要原因之一[46]。自2017年FDA正式批准PD-1单抗作为转移性微卫星不稳定型(microsatellite high,MSI-H)CRC的一线治疗以来[47],肿瘤的ICBs在CRC治疗中正式由“幕后”走向“台前”,吸引了越来越多的目光。KEYNOTE-177更进一步证实了PD-1单抗较化疗在MSI-H 转移性CRC中具有更高的治疗反应率(83%vs.35%)和更长的无进展生存期(16.5个月vs.8.2个月)[48]。
即使ICBs治疗在MSI-H亚型CRC中取得了令人鼓舞的结果,但仍然面临不小的压力和挑战。毕竟MSI-H亚型在所有散发性CRC中只占15%左右,剩余的大部分MSI-L亚型CRC患者如何从免疫治疗中获益?即使在MSI-H中,仍有约29.4%的患者在PD-1治疗中疾病进展[49],因此CRC的ICBs治疗方案仍有很大的优化空间,亟待更好的分子标志物和疗效预测的指标;更好地理解CRC免疫抑制TME中免疫细胞的功能变化及调控网络,乃至提出可行的TME修饰策略,如借助肠道菌群及其代谢产物,将会是治疗成功的关键[50]。
在全世界的众多科学家都将目光聚集并且投身于肿瘤免疫治疗的巨大工程中,我们所经历的可能是肿瘤治疗史上一次伟大的变革。面对中国日益增长的CRC病例,国内的结直肠外科及肿瘤医师如何在基础理论及临床科研领域发出自己的声音,努力成为CRC免疫治疗赛道的“领跑者”,将是我们不懈努力的方向和目标。
