TSP1在泌尿系统中的研究进展
2024-01-09龙军陈林汪松周鑫杨进吴金邦吴波
龙军, 陈林, 汪松, 周鑫, 杨进, 吴金邦, 吴波
细胞外基质(extracellular matrix,ECM)是由细胞分泌到细胞外间质中的大分子物质所构成的复杂网架动态结构,由间质基质和基底膜构成,占机体质量的1/3以上。细胞外基质包括许多成分,例如结构蛋白(胶原纤维、弹性纤维等),连接蛋白(整合蛋白、纤维粘连蛋白、层粘连蛋白等),非结构蛋白(基质细胞蛋白、聚糖蛋白、透明质酸等),在组织重塑和维持结构稳定中起着重要作用[1-2]。
血小板反应蛋白(thrombospondins,Thbs/TSPs)属于钙结合的细胞外基质聚糖蛋白,依据其低聚状态以及结构特点分为三聚体(TSP1/2)和五聚体(TSP3/4/5)两类[3-7]。由于TSPs具有多结构域的特点,因此在某一微环境下,能与不同的分子相结合从而发挥不同的生物学功能,调节细胞之间以及细胞与基质之间的相互作用。
TSP1是发现最早同时也是研究最为广泛的TSPs家族成员,在许多种细胞(树突细胞、巨噬细胞、血管平滑肌细胞、上皮细胞等)中均有表达[8],通过与受体或其他细胞外基质成分直接或间接互作发挥调控作用,包括细胞增殖与分化、细胞迁移、细胞粘连、细胞凋亡以及血管生成稳态、免疫及伤口愈合等,参与了多种疾病的发生发展,如非肿瘤疾病中的纤维化调控和肿瘤疾病中的血管稳态调节作用[3, 9-13]。充分认识和深入研究TSP1在泌尿系统疾病中的作用,将为泌尿系疾病的诊断和治疗提供新的策略。
1 TSP1的概述
1.1 TSP1的结构 TSP1是血小板α颗粒中释放的一种细胞外基质糖蛋白,具有多结构域特性,包括N端域、前胶原同源域、I 型重复域、Ⅱ 型重复域(EGF样Ⅱ型重复域)、Ⅲ型重复域及C端域[3, 7, 14-19](图1)。每种结构域都能与不同的配体或受体结合从而发挥不同的生物学功能。N端域作用受体包括肝素(heparin)、糖脂(glycolipid)和低密度脂蛋白受体相关蛋白等,参与调节新生血管的生成;I 型重复域能与基质金属蛋白激酶2/9(MMP2/9)及CD36等相互作用,起到抑制新生血管生成的作用;Ⅱ 型重复域又称为EGF样Ⅱ型重复域,能与表皮生长因子受体(epidermal growth factor receptor, EGFR)等受体互作,主要在中枢神经系统调节中发挥功能;Ⅲ型重复域也能通过结合碱性成纤维细胞生长因子(fibroblast growth factor 2,FGF2)进而抑制新生血管形成。通过作用于不同的对象,TSP1在许多信号通路中都起着关键的调控作用,在病理状态下影响疾病的发生发展。
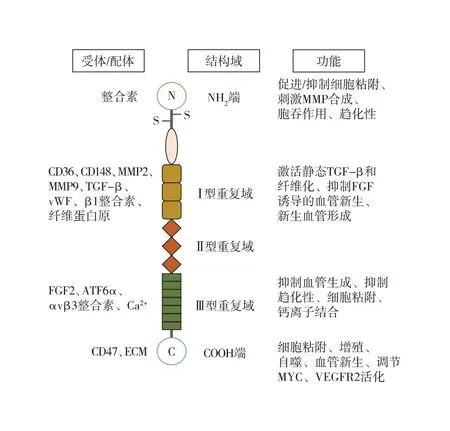
图1 TSP1结构及相关功能
1.2 TSP1的功能 肿瘤的发生发展依赖丰富的血液供应,其基础离不开新生血管的形成。TSP1作为一种抗血管生成因子,在肿瘤疾病中的生物学功能很早便开始受到研究人员的关注。其潜在机制包括抑制内皮细胞的迁移和增殖并诱导内皮细胞凋亡[20]。此外,TSP1的表达受机体原癌基因与抑癌基因的共同调控,在一定程度上影响肿瘤的发生发展过程[3, 10]。既往研究表明,TSP1在诸多良恶性肿瘤疾病中表达水平明显降低,实验中通过恢复TSP1的表达水平,可以观察到肿瘤细胞的生长和迁移等被抑制,包括肾癌[21]、前列腺癌[22]。最新研究表明,TSP1在肿瘤免疫调控中也同样发挥重要作用[17]。
炎性反应是机体对内外源性损伤作出的防御反应,无论是肿瘤疾病或者非肿瘤疾病,病理状态下都或多或少存在炎性反应。研究发现,TSP1的N端结构域与细胞膜受体CD36和CD47结合参与炎性反应过程[23]。动物实验表明,TSP1缺陷小鼠较对照组更易发生急性结肠炎[24]。TSP1在巨噬细胞活化中也具有调控作用,体内实验证实,抑制TSP1能降低巨噬细胞的炎症表型,调控方式表现为结合CD36后激活巨噬细胞TLR4通路,此外,TSP1还能刺激NF-kB以及TNF-α的表达增加。有牙周炎疾病模型研究发现,LPS能刺激TSP1表达升高,后者又能同时刺激巨噬细胞产生炎症因子;在她们后续研究中发现,TSP1通过p38MAPK信号通路介导MMP2、MMP9高表达[25-26]。
TSP1参与细胞外基质重塑过程[27]。在许多纤维化疾病,例如心血管疾病[5, 7]、肝纤维化[28-29]、肺纤维化[30-31],均发现其呈高表达状态。慢性压力负荷过载是导致心肌肥厚和心衰的主要原因,TSP1缺陷小鼠早期心肌肥厚和晚期心腔扩大程度比野生型小鼠更为显著,MMP3、MMP9表达水平增加[7, 32]。Min-DoBartolo等[28]发现TSP1通过调节PPARα信号通路和氨基酸代谢通路介导非酒精性脂肪肝纤维化过程,抑制TSP1能降低α-SMA以及Ⅰ型胶原的表达水平。这些研究数据表明,TSP1是一种潜在抗纤维化治疗靶点。
2 TSP1与泌尿系肿瘤
2.1 TSP1与肾透明细胞癌 肾癌在泌尿系肿瘤中发生率很高,病理类型多,常见的包括肾透明细胞癌、乳头状细胞癌和嫌色细胞癌,其中肾透明细胞癌最为常见[33]。肾透明细胞癌组织血供非常丰富,提示促血管生成与抗血管生成稳态的失衡,细胞因子水平表现为促血管生成因子表达增加[如血管内皮生长因子(vascular endothelial growth factor, VEGF)]及抗血管生成因子(如TSP1)表达降低。作为血管生成抑制因子,TSP1与肿瘤细胞生长、增殖和迁移侵袭等行为联系密切。既往研究表明,低氧在肿瘤血管生成过程中起着重要作用。低氧诱导VEGF在肾透明细胞癌中表达增加,并抑制TSP1的表达,然而其机制是通过PI3K/AKT信号通路而非缺氧诱导因子(hypoxia inducible facotr,HIF),且这种由低氧导致的低TSP1经由低氧感应器PHDs介导[34]。TSP1对肿瘤的影响受原癌基因和抑癌基因的调控。抑癌基因VHL与肾透明细胞癌关系密切,其编码的蛋白pVHL在α或β结构域的改变显著抑制了TSP1表达进而促进肾透明细胞癌细胞迁移和侵袭,而这种调控不是通过与pVHL直接互作产生,且不依赖HIF[35]。p53基因突变存在于绝大多数肿瘤疾病中,包括肾细胞癌,且与VHL基因相互干扰导致DNA损伤[36]。Iubac等[37]通过对肾透明细胞癌临床样本的研究,发现TSP1的表达与肾透明细胞癌预后有关,且与p53、微血管密度(microvessel density,MVD)、Ki-67及TNM分期存在负相关性,TSP1是癌症特异性生存独立预后因素。这表明TSP1在肾透明细胞癌的发生发展中起着重要作用,影响癌细胞的血管生成、增殖、浸润。因此TSP1具有作为肾透明细胞癌预后标志物的潜在价值。
2.2 TSP1与膀胱癌 膀胱癌在我国泌尿生殖系统肿瘤中发病率最高[38]。到目前为止,TSP1在膀胱癌中的研究主要集中在肿瘤新生血管生成。无论是浅表的膀胱癌或者浸润性膀胱癌,均观察到TSP1的表达水平较正常膀胱组织细胞明显降低甚至缺乏[39-40]。新生血管的形成这一过程涉及到众多病理生理改变,包括细胞外基质改变,细胞的增殖、迁移、侵袭、分化等。在膀胱癌发病机制中,新生血管形成是重要环节,该过程中关键点是抗血管生成因子TSP1表达降低进而诱导血管新生表型的转化。在膀胱癌中,TSP1的表达受到p53基因的调节。正常情况下,p53基因产物能促进TSP1表达增加,但在膀胱癌中由于p53基因突变,导致TSP1更易出现表达降低,这一改变又反过来增加了肿瘤微血管生成的可能性[39]。多项临床研究表明,TSP1是独立于TNM分期和肿瘤分级的一种预测因素,TSP1在肿瘤细胞中的表达水平与膀胱癌的复发和总体生存率显著相关,其表达水平越低,肿瘤复发率越高,癌症患者5年生存率也更低[3, 41]。但也有研究人员发现,TSP1的表达水平与肿瘤的分期、分级及淋巴结转移等特征不存在相关性[39]。此外,TSP1在肿瘤基质中的表达情况与癌症分期和分级也呈现出负相关性,在肿瘤基质重塑中发挥调节作用。在癌症疾病中,TSP1可以抑制MMP9的表达并呈现出强负相关性;另外,TSP1还能抑制MMP2前体活性从而抑制MMP2的表达。其机制可能是在正常状态下,TSP1调节组织基质金属蛋白激酶抑制因子(TIMPs)与MMPs之间的平衡,而肿瘤组织中,由于TSP1表达水平发生改变,进而对MMP信号通路及其相关功能产生影响。
2.3 TSP1与前列腺癌 前列腺富含5α还原酶,该酶能将睾酮转化为作用更强的双氢睾酮,对雄激素的生成、代谢和转化起着重要作用,当双氢睾酮积累过多则会引发前列腺增生或癌变等病理改变。前列腺的生长过程中十分依赖血管生成,无论是良性前列腺增生还是前列腺癌,都能观察到前列腺组织中血管及相关血管生成因子的含量增加、血管密度增加。前列腺彩超也提示病理组织内血管分支增多,血流速度加快。
前列腺癌的发生发展根本上依赖于新生血管的生成,TSP1是抗血管生成因子,在前列腺癌的进展中具有重要作用。正常的前列腺组织及前列腺增生患者中TSP1均表达增加,而在前列腺上皮内瘤和前列腺癌患者中表达水平却明显降低并影响诸多病理特征[42]。其表达水平以及功能状态受雄激素抑制并呈现出浓度依赖性。体外研究发现,雄激素在正常上皮细胞中维持血管生成活性,但在基质细胞中作用却相反[43-41]。雄激素能通过调节新生血管的生成从而在一定程度促进控前列腺的生长,其中TSP1发挥着不可忽视的作用。研究表明,相比于肿瘤患者的低TSP1表达水平,接受去势治疗患者中,TSP1表达水平明显增加[43]。
TSP1发挥抗血管生成作用主要通过激活TGF-β,后者通过抑制正常上皮细胞增殖和促进细胞凋亡及基质分化等从而发挥抑制新生血管生成的作用。前列腺癌早期,TGF-β仍能发挥作用抑制肿瘤进展,但随着病情的加深,TSP1表达逐渐缺失,这就导致抗血管生成和激活TFG-β这两个抑制肿瘤进展的屏障被打破,微血管密度增加,在一定程度上提示患者预后不良。也有研究者观察到TSP1在前列腺癌中表达升高的情况。此外,体内外实验证实,TSP1还与前列腺癌细胞迁移、增殖和黏附呈负相关性[44-45]。
3 TSP1与泌尿系良性疾病
3.1 TSP1与肾纤维化、糖尿病肾病、急性肾损伤 TGF-β参与ECM的合成和降解,具有很强的致纤维化特性,其介导的功能信号通路在纤维化相关疾病中研究甚广。TSP1表达于多种细胞类型,在足细胞、小管上皮细胞等均有表达[21, 29, 46-47]。当肾损伤发生后,这些部位均检测到TSP1表达水平增加,其表达增加程度与肾小管间质纤维化程度呈现正相关性,shRNA抑制TSP1能有效缓解肾小管间质纤维化[48]。肾移植后间质纤维化/小管萎缩(interstitial fibrosis/tubular atrophy, IFTA)患者尿液中TSP1基因表达水平升高,AUC=0.80,能有效区分IFTA患者与正常人[49]。因此,TSP1可作为非侵入性检查标志物,有望应用于肾脏纤维化类疾病损伤严重程度的评估以及疗效的评价。
在糖尿病肾病研究中,TSP1/TGF-β/Smad信号通路起着重要作用。无论是Ⅰ型糖尿病还是Ⅱ型糖尿病患者,其TSP1的表达水平均显著升高,并且与TGF-β/Smad的表达水平呈现正相关性[50-52]。小鼠糖尿病肾病模型研究表明,转录因子USF2能诱导TSP1表达增加,并使TGF-β、Ⅰ型胶原表达增加进而加剧糖尿病肾病的发展。USF2与TSP1的相互作用关系在急性肾损伤的研究中也得到证实[53]。
3.2 TSP1与膀胱良性疾病 膀胱组织是一个容量器官,处于反复充盈和排空的状态,因此与心脏类似,受应力刺激影响较大。常见的如尿道狭窄、膀胱出口梗阻性疾病均会导致排尿期膀胱内压力增加,长期负荷过载将导致膀胱平滑肌细胞代偿性增生、膀胱顺应性降低以及膀胱壁纤维化等病理改变,更大的危害则是影响上尿路功能甚至损害肾功能。我们课题组前期研究发现,体外周期性机械应力刺激人膀胱平滑肌细胞能促进增殖反应的发生,SGK1- NFAT2-TRPV1信号通路发挥了重要作用,并能进一步调控膀胱出口梗阻(bladder outlet obstruction,BOO)后的膀胱重塑[54-55]。整合素在应力调控中起着重要的枢纽作用。在伤口愈合研究中发现,αvβ6通过激活TGF-β1和TSP1介导纤维化的快速发生,而抑制αvβ6后观察到TSP1表达水平降低[56]。此外,周期性机械应力刺激可以促进细胞分泌TSP1,TSP1又直接结合αvβ1诱导蛋白沉积,介导细胞外基质重塑。信号通路TSP1/TGF-β和Thbs1/integrin/YAP已被证实参与这些生物过程的调控[57]。由此可见,TSP1与膀胱病变关系密切。
3.3 TSP1与良性前列腺增生 Doll等[58]提取良性前列腺增生(benign prostatic hyperplasia,BPH)患者和正常人的前列腺上皮细胞用于体外实验,发现前列腺增生患者来源的细胞产生的促进血管生成的细胞因子FGF2和VEGF增多,而TSP1表达水平降低,提示TSP1在前列腺增生过程中调控着新生血管的形成。此外,慢性炎症也是前列腺增生的病理机制之一,在BPH患者前列腺组织样本中检测到多种炎症因子的改变,比如IL-18。在基因和蛋白质水平均检测到IL-18的高表达,而后作用于前列腺平滑肌使AKT磷酸化,刺激平滑肌细胞产生TSP1促进细胞增殖,最终导致前列腺增生[59]。然而,TSP1表达水平在前列腺增生的研究中出现相反的结果,可能是因为在疾病不同进展阶段多种因素共同作用的结果,其具体原因还有待进一步研究。
4 TSP1与药物治疗靶点
由于TSP1具有多结构域的特点,能与多种配体或受体相结合,从而参与不同信号通路的调控,在许多疾病中发挥着重要作用。因此,针对TSP1的拮抗剂和药物应运而生。LSKL是位于TGF-β LAP上的一段序列,其与TSP1的KRFK序列相结合暴露出受体结合位点,从而激活静态TGF-β[52, 60]。LSKL肽是一种由LAP-TGF-β衍生而来的四肽,能竞争性抑制TSP1。最新研究结果表明,LSKL处理后可一定程度预防由博莱霉素继发的肺形态异常改变,降低胰腺导管腺癌细胞的增殖迁移、增加了对化疗药物的敏感性以及促进细胞凋亡。其改善肾间质纤维化的作用也已被验证。YAO等[61]研究发现,TSP1可以作为抗血管药物阿帕替尼的作用靶点。RNA和蛋白组测序结果显示,阿帕替尼处理胶质癌细胞后,TSP1是唯一共同表达降低的基因。通过免疫共沉淀和免疫荧光观察到TSP1与MYH9共定位并相互作用,且抑制MYH9可以抑制胶质细胞迁移和侵袭即使过表达TSP1。这就提示阿帕替尼能通过THBS1/MYH9轴发挥抗肿瘤血管生成作用。这些研究结果为靶向TSP1治疗药物的研发提供了新的理论依据。
5 结语与展望
泌尿系统作为人体八大生命系统之一,其健康的生理功能是维持生命活动所必需。泌尿系统肿瘤在人类目前所有肿瘤疾病中都占有很高的发生率和死亡率;而前列腺增生、BOO、肾损伤等非肿瘤疾病,严重影响患者的生活质量,患者因尿频、尿失禁等症状出现睡眠障碍和抑郁等表现。早期发现并及时有效干预,对挽救患者生命、改善患者生活质量及减少家庭及社会医疗负担十分有效且必要。因此找寻新的疾病靶点、探究其潜在作用机制并研制新的靶点药物或老药新用将为疾病的防治带来新的出路。
TSP1是重要抗新生血管生成抑制因子之一,因其多结构域多功能特性,在泌尿系肿瘤和非肿瘤疾病中均能介导其发生发展,包括但不限于调节肿瘤微环境、介导肿瘤微血管发生、调节细胞增殖、黏附、迁移侵袭并具有一定程度的肿瘤分期分级及预后诊断价值;作为细胞外基质蛋白,参与细胞外基质重塑的发生发展、与整合素等受体或配体结合参与炎症、免疫以及纤维化等信号途径。目前已经有TSP1相关拮抗剂应用于基础科研领域并证实了其有效性,如LSKL,但目前仍缺少临床研究。此外,本文中发现TSP1在泌尿系非肿瘤疾病中的研究较肿瘤疾病更少,目前尚缺乏TSP1在膀胱纤维化等膀胱非肿瘤疾病等相关研究,仅查阅到TSP1与之存在间接的关联。而这些疾病对人类健康的影响不容忽视,因此进一步探究TSP1在膀胱非肿瘤疾病中的作用及潜在机制并寻找可能的防治干预措施将为疾病的防治带来新的视角和希望。
