Akap5组蛋白乙酰化在孕期运动改善高血压子代血管功能中的作用
2024-01-08单美玲丁小真刘晓东张严焱石丽君
邱 方,单美玲,丁小真,刘晓东,张严焱,2,3,石丽君,2,3*
(1.北京体育大学 运动生理学教研室,北京 100084;2.北京体育大学 运动与体质健康教育部重点实验室,北京 100084;3.国家体育总局运动应激适应重点实验室,北京 100084;4.上海对外经贸大学体育健康学院,上海 201620)
高血压是心血管疾病的主要危险因素之一,我国目前有心血管病患者3.3 亿,其中高血压患者2.45 亿(中国心血管健康与疾病报告编写组,2023)。90%的高血压属于原发性高血压,由环境因素及遗传因素相互作用导致(Rossier et al.,2017)。健康与疾病的发育起源学说(developmental origins of health and disease,DOHaD)认为高血压的疾病根源可追溯到胚胎发育的胎儿时期。母亲孕期不良环境暴露(如妊娠期高血压、肥胖、糖尿病、营养不良、缺氧和吸烟等)会导致胎儿易受到不利的子宫内环境干扰,增加子代成年后罹患高血压的风险(Guarner-Lans et al.,2020),这一现象被称为“高血压的胎儿编程”(fetal programming of hypertension)(Alexander,2006)。表观遗传学是指基因的核苷酸序列不发生改变,而基因的表达和功能发生改变,并产生可遗传的表型变化,包括DNA 甲基化、组蛋白修饰和非编码RNA 调控,在高血压的发生发展中发挥着重要作用(Barker,1998; Wise et al.,2016)。胎儿发育关键可塑期是表观遗传学修饰的不稳定“窗口期”(Safi-Stibler et al.,2020)。在此阶段,对母亲孕期生活方式的干预,如孕期运动、饮食调控等,可以重编程胎儿组织并产生永久性“印迹”,从而在一定程度上逆转或延缓子代成年后心血管疾病的发展(Moholdt et al.,2020)。因此,从生命早期探索高血压的发病机理,寻找诊治新策略具有重要意义。
规律有氧运动作为治疗高血压、肥胖、2 型糖尿病等疾病的非药物辅助手段在学术界得到广泛认可(Pelliccia et al.,2020)。母亲孕期运动能否改善子代健康也受到越来越多的关注。研究表明,孕期运动对母体、胎儿和子代成年后的心血管及代谢健康都具有短期和长期的积极效应(Barakat et al.,2016; Brislane et al.,2021; Harris et al.,2018)。已有证据表明孕期运动可预防母亲妊娠期高血压风险,控制子代出生时体重,同时减少子代患有慢性疾病的风险(Barakat et al.,2016);孕期运动可以降低胎儿的静息心率,增加心率变异性,这与训练有素的成人静息时心脏反应相似(May et al.,2010);母亲孕期运动可以降低子代12 周龄时颈动脉内-中膜厚度(Brislane et al.,2021),改善子代血管舒张功能(Bahls et al.,2014)。作为一种原发性高血压的重编程动物模型,关于自发性高血压大鼠(spontaneously hypertensive rat,SHR)的前期研究发现,母亲孕期运动可以通过表观遗传学改变(如DNA 甲基化)重编程SHR 子代成年后的血管功能(Li et al.,2021; Shan et al.,2023),但其潜在机制尚未完全阐明。
血管平滑肌细胞(vascular smooth muscle cell,VSMC)是动脉血管壁的主要细胞类型,L 型电压门控钙通道(Ltype CaV1.2 channel,CaV1.2)是VSMC 膜上重要的Ca2+通道,控制细胞外Ca2+内流,在高血压的血管张力和血管收缩功能调节中起着重要作用(Joseph et al.,2013)。AKAP150 是A 激酶锚定蛋白(A-kinase anchoring protein,AKAP)家族成员,可将多种酶类聚集于特定细胞区域,从而提高信号转导效率(Diviani et al.,2016)。在VSMC 中AKAP150 可锚定蛋白激酶C(protein kinase C,PKC)α,靶向激活细胞膜上CaV1.2,产生持续性钙星,通过“兴奋-收缩”耦联,增加血管张力,在血压调节中起着重要作用;此外,AKAP150 基因全身敲除小鼠(AKAP150-/-)表现出低血压特征且血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)无法诱导高血压(Navedo et al.,2008)。前期研究发现,有氧运动可有效抑制3 月龄SHR 动脉平滑肌AKAP150“兴奋-收缩耦联”途径,降低CaV1.2 功能,缓解血管张力增高,提示AKAP150 确为运动改善高血压动脉功能的重要靶点(张严焱 等,2020)。此外,还有研究发现,AKAP150 基因(Akap5)受表观遗传学调控,与组蛋白H3K9ac(组蛋白H3第9 位赖氨酸乙酰化)修饰密切相关(Shepard et al.,2020)。但目前尚不清楚母亲孕期运动是否通过调控高血压子代Akap5基因组蛋白乙酰化实现对子代血管功能的重编程。
因此,本研究选用SHR 和正常血压Wistar-Kyoto(WKY)大鼠建立孕期游泳运动模型,探讨母亲孕期运动是否可重编程高血压子代的血管功能及Akap5基因组蛋白乙酰化在其中的调控机制,旨在为高血压生命早期的孕期运动干预及潜在靶点提供科学依据。
1 材料与方法
1.1 实验动物分组与运动方案
选用SPF 级、11 周龄雌性、12 周龄雄性的SHR 及其正常血压对照WKY 大鼠作为配种鼠,均购买于北京维通利华实验动物技术有限公司,生产许可证号为SYXK(京)2021-0053。同品系雌、雄鼠交配,将见栓且见精子的雌鼠确定为孕鼠妊娠第1 天(gestation day 1,GD1)。之后将孕鼠随机分为4 组,每组各24 只:WKY 孕期安静组(p-WKYSED)、WKY 孕期运动组(p-WKY-EX)、SHR 孕期安静组(p-SHR-SED)和SHR 孕期运动组(p-SHR-EX)。运动组孕鼠需进行孕期无负重游泳训练(水深为40 cm,水温为34~35 ℃),孕期前4 天为适应性训练,从GD1 开始训练20 min/d,之后每天递增10 min,到GD5 进入正式训练,60 min/d,6 天/周,直至GD20 结束,具体孕期运动方案参考Volpato 等(2009)。为避免水环境对孕鼠的影响,将安静组孕鼠放置于水深10 cm 的相同水环境中作为对照。
由于在高血压的胎儿编程动物模型中,子代雄性患高血压的风险高于雌性(Dasinger et al.,2016;Grigore et al.,2008),选取雄性子代胚胎21 天(embryonic day 21,ED21)胎鼠和3 月龄(3 month old,3M)大鼠为研究对象。子代安静饲养至3M,采用CODA 尾动脉无创血压系统监测大鼠清醒安静状态下的收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)和平均动脉压(mean arterial pressure,MAP)。各组孕鼠食用国家标准啮齿类动物繁殖专用饲料,子代大鼠给予国家标准啮齿类动物专用饲料,自由进食、饮水,分笼饲养于北京体育大学动物房,湿度45%~55%,温度22~24 ℃,12 h 昼夜光照循环。
1.2 微血管环张力测定
子代3M 雄鼠腹腔注射戊巴比妥钠(50 mg/kg)麻醉后,开腹取出肠系膜动脉(mesenteric arteries,MAs),剥离周围脂肪组织并制备3 级MAs 血管环,使用钨丝将其固定于离体微血管环张力测定仪(620 M,DMT,丹麦)的浴槽中,槽中含有5 mL Krebs 缓冲液(mmol/L):131.5 NaCl、5 KCl、1.2 NaH2PO4、1.2 MgCl2、2.5 CaCl2、11.2 glucose、13.5 NaHCO3和0.025 EDTA,pH 为7.4,持续通95% O2和5% CO2。使用LabChart 软件系统(AD Instruments,澳大利亚)的DMT 标准化模块设定各个血管环的最佳初始张力(IC100),平衡60 min 左右。将60 mmol/L KCl 刺激血管收缩的最大张力幅值作为100%最大收缩张力(%Kmax)。在正式药物加入之前,加入一氧化氮合酶抑制剂Nω-硝基-L-精氨酸甲酯(Nω-nitro-L-arginine methyl ester,L-NAME,10-4mol/L)孵育20 min,用以排除内皮功能的影响。为了观察CaV1.2 通道在血管张力中的调节作用,分别加入CaV1.2 通道激动剂Bay K8644(BayK,10-5mol/L)、在去甲肾上腺素(norepinephrine,NE,10-5mol/L)预收缩达到平台后加入CaV1.2 通道阻断剂 Nifedipine(Nif,10-9~10-5mol/L)测定血管反应性。
1.3 膜片钳电生理记录
子代3M 雄鼠麻醉后,取2~3 级MAs 采用酶-机械消化法急性分离VSMC(Shi et al.,2015)。采用传统全细胞膜片钳技术记录CaV1.2 通道全细胞钙电流,记录方案为:VSMC 钳制电压为-80 mV,-70~+70 mV给予连续脉冲电压,阶跃为 10 mV,刺激时间为200 ms。信号经Axon 700B amplifier 放大,低通滤波为2 kHz,采样频率为10 kHz。采用Clampfit 10.2 软件进行A/D、D/A 转换,采用pCLAMP 10.2 软件包进行数据采集及分析。首先记录基础CaV1.2 通道全细胞电流,之后分别加入Bay K8644(5 μmol/L)及Nifedipine(100 nmol/L)观察CaV1.2 通道电流变化。电极外液(mmol/L):10 BaCl2、10 Hepes、5 glucose、1 MgCl2、124 choline chloride,用CsOH 调pH 至7.4,采用Ba2+替代Ca2+作为电荷载体以增大记录电流。电极内液(mmol/L):130 CsCl、10 Hepes、3 Na2ATP、0.1 Na2GTP、1.5 MgCl2、10 glucose、10 EGTA 和0.5 MgATP,用CsOH 调pH 至7.3。
1.4 细胞免疫荧光
将子代3M 雄鼠MAs 采用酶-机械消化法进行急性分离VSMC(Shi et al.,2015),贴壁于玻底培养皿30 min 左右,加入4%多聚甲醛固定 30 min。采用细胞标记物5 μg/mL Alexa FluorTM594-conjugated 小麦胚芽凝集素(Wheat Germ Agglutinin,WGA)避光孵育VSMC 10 min。0.2% Triton X-100 膜打孔10 min;10%山羊血清封闭非特异性蛋白结合位点1 h。免疫反应需滴加一抗Rabbit polyclonal to Anti-AKAP150 Antibody(1∶200,Millipore),4 ℃孵育过夜;次日晨加入荧光二抗Alexa FluorTM488 Goat anti-RabbitIgG antibody(1∶1 000)室温孵育1 h。用抗淬灭封片剂(prolong gold antifade reagent)封片,24 h 后使用激光共聚焦成像系统(SP8 TCS,Leica,德国)进行拍片:HC PL APO CS2 63×/1.40 油镜,488/552 nm 激发光。采用ImageJ软件进行免疫荧光共定位分析,并采用RG2B 插件获取共定位区域(Coloc)。
1.5 Western blotting
提取子代3M 雄鼠MAs 的总蛋白,测定样品蛋白浓度,制备蛋白2 μg/μL 上样体系;每个孔道加入10 μL 上样蛋白、3%~8% Tris-Acetate 凝胶电泳分离蛋白;使用iBlot2 干转仪将蛋白干转至PVDF 膜上,根据marker 剪取目的蛋白条带,5% BSA 室温封闭90 min;之后,将PVDF膜条带分别放入对应的一抗:Anti-AKAP150 Antibody(1∶500,Milipore)、H3K9ac(1∶1 000,Abcam)、H3(1∶1 000,Abcam)、β-actin Antibody(1∶2 000),4 ℃孵育过夜。第二天,加入对应二抗anti-rabbit IgG-HRP 或anti-mouse IgGHRP(1∶10 000,Proteintech Group)孵育1 h。配制ECL 化学发光液(1∶1),均匀地滴加到PVDF 膜上,置于Bio-Rad ChemiDOC XRS+凝胶成像系统进行成像。
1.6 qPCR
根据TRIzolTMPlus RNA Purification Kit(Cat.No.12183555,Thermo Fisher)说明书提取子代3M 雄鼠肠系膜动脉组织的总RNA。采用NanoDrop 紫外-可见分光光度计测定RNA 浓度。采用Maxima First Strand DNA Synthesis Kit(K1671,Thermo Fisher)反转为cDNA,配制20 μL 反应体系,反应条件为:25 ℃ 10 min,50 ℃ 15 min,85 ℃ 5 min。根据Power SYBR Green PCR Master Mix(A25742,Thermo Fisher)配制10 μL 扩增反应体系,反应条件为:50 ℃ 2 min,95 ℃ 2 min;40 个循环(95 ℃ 3 s,60 ℃ 30 s)。引物序列见表1。目的基因的相对表达量采用2-ΔΔCt。

表1 qPCR引物序列Table 1 Primer Sequence of qPCR
1.7 染色质免疫共沉淀(ChIP-qPCR)
取子代雄性ED21 胎鼠的肠系膜动脉组织,使用1%甲醛交联15 min,之后采用终浓度125 mmol/L 甘氨酸终止交联反应。加入蛋白酶抑制剂破碎组织分离细胞,研磨2 min,收集并裂解细胞,离心沉淀细胞核。采用超声5 min破碎DNA,获得200~1 000 bp 之间的DNA 片段。之后取20%片段化的染色质作为Input 组,置于-20 ℃保存待用。剩余的DNA 片段化用于免疫共沉淀,分别加入ChIP 级别的抗体H3K9ac(ab10812,Abcam)作为IP 组、加normal rabbit IgG(Cell Signaling Technology,美国)作为阴性对照NC组,4 ℃孵育过夜。次日,加入DynabeadsTMProtein G磁珠至IP组和NC组,形成磁珠-抗体-蛋白质-DNA 复合物;磁力架沉淀磁珠,用低盐溶液、高盐溶液、LiCl 溶液和TE 溶液依次洗涤,弃掉未结合的DNA 上清,纯化并洗脱蛋白质-DNA 复合物。之后用蛋白酶K 和ChIP 洗脱缓冲液在62 ℃下孵育2 h,解离交联DNA-蛋白复合物,得到DNA片段。然后用酚/氯仿/异戊醇混合液(25∶24∶1)提取纯化DNA,70%乙醇沉淀,风干沉淀后,加入20 μL 10 mmol/L Tris-HCl pH 8.0 溶解沉淀,测定DNA 浓度。采用qPCR 检测纯化后DNA 中Akap5基因启动子区域的H3K9ac 富集程度。在大鼠Akap5基因启动子区域设计ChIP-qPCR 引物序列为:正向引物5’-ACGGACTACAAGGTCGCCAG-3’,反向引物5’-CCCCAGAAAACCCCTAAAGAA-3’。ChIPqPCR 数据采用2-△△Ct法进行分析。
1.8 统计方法
数据以均值±标准误(M±SEM)表示,采用GraphPad Prism 9 软件进行统计学分析。各年龄段4 组之间的数据采用双因素方差分析(two-way ANOVA)进行统计检验(高血压×运动),P<0.05 表示具有显著差异,P<0.01 表示具有非常显著差异。
2 结果
2.1 孕期运动增加高血压子代胎鼠的胎盘效率
如图1 所示,p-SHR-SED 组子代雄性ED21 胎鼠体重均明显低于p-WKY-SED 组,孕期运动可明显增加p-SHREX 组雄性ED21 胎鼠体重(P<0.01)。p-SHR-SED 组ED21胎盘重量明显高于p-WKY-SED 组,但孕期运动对胎盘重量无显著影响(P>0.05)。p-SHR-SED 组ED21 胎盘效率均明显低于p-WKY-SED 组,孕期运动可明显增加p-SHREX 组胎盘效率(P<0.01)。
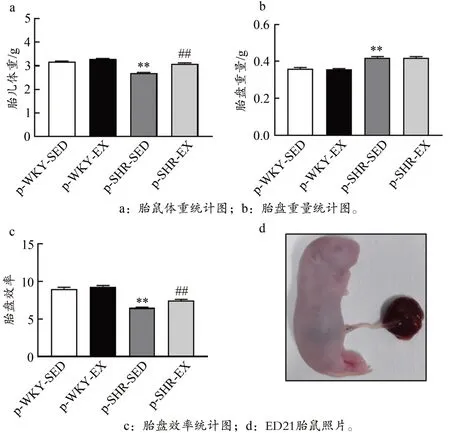
图1 高血压子代ED21胎鼠的胎盘效率Figure 1.Placental Efficiency in Hypertensive ED21 Fetal Rats
2.2 孕期运动降低高血压子代3M大鼠血压
如表2 所示,与p-WKY-SED 组相比,子代3M 大鼠雄性p-SHR-SED 组的SBP、DBP 和MAP 均显著增加(P<0.01),孕期运动可明显降低雄性子代p-SHR-EX 组SBP(P<0.01)、DBP(P<0.05)和MAP(P<0.05)。

表2 高血压子代3M大鼠血压Table 2 Blood Pressure in 3M Hypertensive Offspring RatsmmHg
2.3 孕期运动抑制高血压子代3M 大鼠CaV1.2 通道功能上调
如图2 所示,Bay K8644(10-5mol/L)可诱导各组子代3M 大鼠血管收缩,Bay K8644 诱导的血管张力以%Kmax表示。p-SHR-SED 组子代3M 雄鼠的Bay K8644 诱导血管收缩反应明显高于p-WKY-SED 组(P<0.01),p-SHR-EX 组Bay K8644 收缩反应明显低于p-SHR-SED 组(P<0.01)。此外,在NE(10-5mol/L)诱发血管收缩达到平台期后,给予剂量累积性Nif(10-9~10-5mol/L)可诱导血管舒张。Nif诱导的血管舒张反应以NE(10-5mol/L)诱导血管收缩作为100%Kmax,用pIC50表示药物达到50%抑制效果时所对应的有效浓度的负对数,评价MAs 对Nif 药物敏感性。各组子代3M 雄鼠对Nif 药物敏感性(pIC50)表现为:p-SHRSED 组>p-WKY-SED 组(P<0.01),p-SHR-SED 组>p-SHR-EX 组(P<0.05),p-WKY-EX 组>p-WKY-SED 组(P>0.05)。

图2 CaV1.2通道在调节高血压子代3M大鼠血管张力中的作用Figure 2.Role of CaV1.2 Channels in the Regulation of Vascular Tone in 3M Hypertensive Offspring Rats
如图3 所示,在各组子代3M 雄鼠中,CaV1.2 通道激动剂Bay K8644(5 μmol/L)可增加Ca2+内向电流峰值(+10 mV),促使峰值Ca2+电流密度从+10 mV负向转移至0 mV,而CaV1.2 通道阻断剂Nif(100 nmol/L)几乎完全阻断了内向Ca2+电流,提示记录的内向Ba2+电流确实是通过CaV1.2 通道开放产生。采用CaV1.2 通道电流相对膜电容(pA/pF)表示电流密度,以去除由于细胞表面积不同对CaV1.2 通道电流造成的影响,得到电流-电压(I-V)曲线图。p-SHR-SED组子代3M 雄鼠的CaV1.2 通道全细胞最大钙电流密度明显高于p-WKY-SED 组(P<0.01);p-SHR-EX 组CaV1.2 通道电流密度明显低于p-SHR-SED 组(P<0.05)。

图3 高血压子代3M大鼠CaV1.2通道电流图Figure 3.CaV1.2 Channel Currents Recorded in 3M Hypertensive Offspring Rats
2.4 孕期运动下调高血压子代3M 大鼠 AKAP150表达抑制CaV1.2通道功能增强
如图4a 所示,p-SHR-SED 组子代3M 雄鼠AKAP150蛋白表达均显著高于p-WKY-SED 组,p-SHR-EX 组AKAP150 蛋白表达明显低于p-SHR-SED 组(P<0.01)。
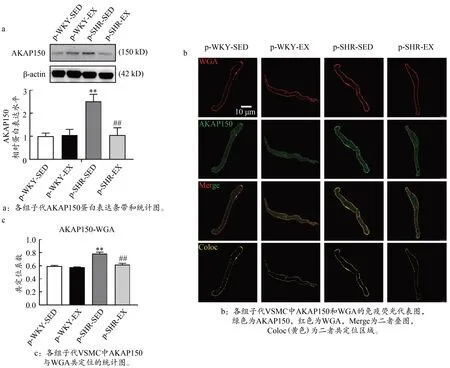
图4 高血压子代3M大鼠AKAP150 蛋白表达和VSMC膜定位Figure 4.AKAP150 Protein Expression and VSMC Membrane Localization in 3M Hypertensive Offspring Rats
在免疫荧光激光共聚焦成像中,采用能与细胞膜糖复合物结合的WGA 标记VSMC 细胞膜。如图4b 和4c 所示,各组子代3M 大鼠均有AKAP150(绿色)与WGA(红色)的共定位荧光信号(黄色区域),AKAP150(绿色)荧光信号虽然基本分布于VSMC 细胞膜表面,但在细胞质内也有少量表达。共定位分析结果显示,在MAs VSMC 中,p-SHR-SED 组子代3M 雄鼠AKAP150 与WGA 共定位免疫荧光信号均显著高于p-WKY-SED组;p-SHR-EX组AKAP150与WGA 共定位免疫荧光信号均明显低于p-SHR-SED 组(P<0.01)。说明高血压子代AKAP150 在VSMC 肌膜上表达明显增加,孕期运动可能通过下调AKAP150 表达改善高血压雄性子代成年大鼠CaV1.2 通道功能。
2.5 孕期运动降低高血压子代大鼠AKAP150 mRNA 和蛋白表达
如图5 所示,在子代雄性胎鼠ED21 MAs 中,p-SHRSED 组AKAP150 蛋白表达明显高于p-WKY-SED 组(P<0.01),孕期运动可显著降低p-SHR-EX 组AKAP150 蛋白表达(P<0.05)。

图5 高血压子代大鼠AKAP150 mRNA和蛋白表达Figure 5.AKAP150 mRNA and Protein Expression in Hypertensive Offspring Rats
qPCR 结果显示,在子代雄性胎鼠ED21 和成年3M 大鼠MAs 中,p-SHR-SED 组Akap5mRNA 水平明显高于p-WKY-SED 组(P<0.01),孕期运动可显著降低p-SHR-EX组Akap5mRNA 表达(P<0.05)。
2.6 孕期运动降低高血压子代大鼠Akap5 基因启动子区H3K9ac水平
如图6 所示,在子代雄性胎鼠ED21 和成年3M 大鼠MAs 中,p-SHR-SED 组H3K9ac 表达明显高于p-WKY-SED组(P<0.01),孕期运动可显著降低p-SHR-EX 组H3K9ac表达(P<0.05)。

图6 高血压子代大鼠Akap5基因启动子H3K9ac富集水平Figure 6.the H3K9ac Enrichment Level of Akap5 Gene Promoter in Hypertensive Offspring Rats
采用ChIP-seq 检测高血压大鼠子代ED21 胎鼠MAs H3K9ac 富集的基因,结果显示Akap5基因启动子区存在一个明显的H3K9ac 富集峰(Peak)区域,具体位置为chr6:99356367-99357640(位于转录起始位点的上游-141 bp 至下游+1132 bp),富集倍率为4.77 倍(P<0.05),Peak 顶点位置距离转录起始位点为+282 bp。因此,在Akap5基因启动子区Peak 顶点位置处设计一对引物,位于转录起始位点+242~+385 bp。采用ChIP-qPCR 验证各组子代雄性胎鼠ED21 MAsAkap5基因启动子区的H3K9ac 富集水平,p-SHR-SED 组Akap5基因启动子区的H3K9ac 富集倍率明显高于p-WKY-SED 组(P<0.01),孕期运动可显著降低p-SHR-EX 组Akap5基因启动子区的H3K9ac 富集倍率(P<0.01)。
3 讨论
本研究结果表明孕期运动能够降低高血压子代MAs中Akap5基因启动子区H3K9ac,抑制Akap5基因转录,下调AKAP150 蛋白表达。子代雄性成年3M 大鼠在出生后,由于表观遗传“印迹”,血管AKAP150 蛋白表达依然被抑制,进而改善其血管功能,降低血压。本研究发现Akap5基因启动子区H3K9ac 可能是孕期运动改善高血压雄性子代大鼠血管CaV1.2 通道功能的重要机制之一。
胎盘效率是指胎儿体重/胎盘重量,用于评价胎儿生长情况。流行病学研究表明,出生体重过低和胎盘重量增加与子代成年后血压升高密切相关,胎盘较大且出生体重较低的婴儿其成年后血压更高(Barker et al.,1990)。本研究发现,与WKY 大鼠相比,SHR 子代ED21 胎鼠体重较低且胎盘重量较大,胎盘效率下降,这与Johnston(1995)研究结果一致,说明SHR 大鼠宫内胎鼠生长受限。这可能与妊娠期高血压子宫血管阻力增加,导致子宫血流减少,胎盘灌注不良和胎鼠营养供应不足有关(Hu et al.,2021)。本研究还发现,孕期运动可增加高血压子代胎鼠体重、提高胎盘效率,这与多项前人研究结果一致(Abate et al.,2012; Gilbert et al.,2012),说明孕期运动可促进高血压子代胎鼠的生长发育。这可能与孕期运动能够创造一种短暂的子宫缺氧环境有关,从而刺激胎盘血管新生,代偿性增加了胎盘营养物质供应及运输功能,增加子宫-胎盘血流,促进胎儿生长发育(Abate et al.,2012; Clapp,2003;Son et al.,2019)。
本研究发现孕期运动可显著降低高血压子代3M 成年雄鼠SBP、DBP 和MAP,这可能是由于孕期运动改善了宫内环境,促进了胎鼠生长发育,降低了高血压子代成年后雄性大鼠血压。宫内环境对子代成年后高血压有重要影响,SHR 是人类原发性高血压模型,采用SHR 与WKY大鼠之间胚胎移植或交叉哺乳喂养的相关研究已证明子宫环境和出生后环境对SHR 血压发展的影响,将SHR 胚胎移植至WKY 子宫环境内可明显降低SHR 子代成年后的血压(Lee et al.,2010)。说明子宫环境改变可影响SHR成年后血压,宫内环境和遗传基因共同决定血压水平。
VSMC 收缩主要依赖于胞浆内Ca2+浓度增加,CaV1.2 是细胞外Ca2+内流诱发VSMC 收缩的主要途径(Joseph et al.,2013)。VSMC 上CaV1.2 通道功能上调是高血压的标志性特征之一(Cheng et al.,2019)。本研究发现孕期运动可明显抑制SHR 大鼠雄性成年子代CaV1.2 通道功能的上调,这与前期研究结果一致(张严焱 等,2018;Shi et al.,2015; Zhang et al.,2020)。SHR 大鼠VSMC CaV1.2 通道功能上调与其通道活性有关。Navedo 等(2008)研究发现,AKAP150/PKCα 途径激活是Ang II诱导高血压VSMC中CaV1.2 通道活性增加并产生持续性钙星所必需的,AKAP150 可锚定结合PKCα,靶向肌细胞膜上CaV1.2 通道,激活其通道以高活性持续性模式开放,产生持续性钙星,导致动脉肌细胞大量Ca2+内流,胞内Ca2+浓度增加,进而激活肌球蛋白轻链,诱导血管收缩,使血管张力增加(Nieves-Cintron et al.,2008)。而未能与AKAP150/ PKCα结合的CaV1.2 通道只能产生随机短暂的低活动性钙星,导致有限的Ca2+内流(Nieves-Cintron et al.,2008; Santana et al.,2009)。且AKAP150-/-小鼠无法产生持续性钙星,导致胞浆Ca2+浓度下降,Ang II无法诱导高血压发生(Navedo et al.,2008)。因此,AKAP150 是调节高血压时VSMC 中CaV1.2通道功能上调所必需的。为了明确血管平滑肌AKAP150在血压调控中的作用,本实验室构建了平滑肌特异性过表达AKAP150 基因敲入模式小鼠(AKAP150 smKI),采用金标准的植入式生理信号无线遥测系统监测血压发现,AKAP150 smKI小鼠SBP、DBP 和MAP 均显著高于同龄野生型小鼠,说明平滑肌AKAP150 过表达引起血压升高。前期研究结果表明,在成年SHR 大鼠VSMC 中,AKAP150/PKCα 信号通路的激活是高血压CaV1.2 通道活动上调的原因,而有氧运动可有效抑制高血压VSMC 中AKAP150 表达和PKCα 膜转运,进而减弱高血压引起的CaV1.2 通道功能上调,证实血管平滑肌上AKAP150 是运动调控血压的一个关键靶点(单美玲 等,2019; 张严焱等,2020)。本研究也发现,SHR 大鼠VSMC 肌细胞膜上AKAP150 定位和蛋白表达均明显增加,孕期运动可显著抑制SHR 雄性子代VSMC 肌膜上AKAP150 定位及蛋白表达的上调,提示血管平滑肌AKAP150 是孕期运动改善高血压雄性子代CaV1.2 通道功能所必需的关键靶点。
本研究发现AKAP150 表达在高血压雄性子代胎鼠和成年3M MAs 中均明显上调,孕期运动可明显抑制高血压子代AKAP150 表达的上调,说明孕期运动对高血压子代胎儿时期AKAP150 表达的抑制作用一直持续至成年。孕期运动可明显抑制高血压雄性子代和成年大鼠MAs 中Akap5mRNA 表达上调,提示Akap5mRNA 表达受转录机制调控。基因表达受基因启动子区的DNA 甲基化和组蛋白修饰调节。胎儿时期是表观遗传学修饰的“窗口期”,此时易受到环境的影响,对成年后个体高血压的编程具有重要影响(Wise et al.,2016)。最近研究表明母体孕期运动可诱导子代某些组织表观遗传学改变进而改善子代长远健康(Kusuyama et al.,2021; Li et al.,2021)。例如,孕期运动通过上调高血压子代动脉Agtr1a基因启动子区DNA 甲基化进而改善SHR 子代血管功能(Shan et al.,2023)。另有研究报道AKAP150 表达与组蛋白乙酰化修饰密切相关(Shepard et al.,2020)。组蛋白修饰作为另一种重要的表观遗传学修饰方式,通过调控染色质结构和可及性进而影响靶基因的转录,一般认为组蛋白乙酰化可促进基因转录,而组蛋白去乙酰化则抑制基因转录(Stoll et al.,2018)。经查阅UCSC 基因库发现Akap5基因受表观遗传学调控,存在组蛋白H3K9ac 修饰,本研究发现孕期运动明显抑制高血压子代MAs H3K9ac 表达。由于大鼠基因库中缺乏Akap5基因ChIP-seq 数据,无法进一步检测Akap5基因启动子区的组蛋白乙酰化H3K9ac 水平,为了精确设计Akap5基因启动子区H3K9ac 的ChIPqPCR 引物,本研究采用ChIP-seq 检测SHR 胎鼠MAs H3K9ac 富集的基因,发现Akap5基因启动子区存在一个明显的富集峰(Peak),因此针对该富集Peak 顶点处设计ChIP-qPCR 引物。本研究发现孕期运动可显著下调高血压子代MAsAkap5基因启动子区H3K9ac 富集水平,导致染色质结构致密,抑制Akap5基因转录,进而下调AKAP150蛋白表达。
虽然本研究阐明了Akap5基因组蛋白乙酰化在孕期运动改善高血压子代血管功能的作用,证实了孕期运动通过降低高血压子代VSMC 中Akap5基因启动子区H3K9ac,抑制Akap5基因表达,改善子代血管功能,但是母体孕期运动如何引起SHR 子代表观遗传学改变还有待进一步研究。
4 结论
母亲孕期运动可降低高血压子代肠系膜动脉肌细胞中Akap5基因启动子区H3K9ac 水平,抑制Akap5基因转录,下调AKAP150 蛋白表达,进而改善血管CaV1.2 通道功能,最终降低高血压子代成年大鼠血压。
