β-磷酸三钙复合改良型富血小板纤维蛋白对兔成骨细胞增殖与分化的影响*
2024-01-08高也,芦帅,孙勇
高 也,芦 帅,孙 勇
(1.西南医科大学口腔医学院,四川泸州 646000;2.蒲江县人民医院口腔科,成都 611630;3.西部战区总医院口腔科,成都 610083)
β-磷酸三钙(β-tricalcium phosphate,β-TCP)属于陶瓷磷酸钙类人工骨材料,具有良好的骨传导性能和生物降解性能,还具有一定的骨诱导性[1-3]。改良型富血小板纤维蛋白(advanced platelet-rich fibrin,A-PRF)来源于自体血液,包含较多白细胞、骨祖细胞、血小板和细胞因子,具有良好的骨诱导性[4],能有效促进软硬组织的创伤愈合和修复重建[5-6],并通过促进血管形成来刺激骨缺损愈合[7-8]。上述两种材料联合应用,不仅可以弥补传统骨支架材料骨诱导性能欠佳的问题,而且在满足骨替代材料支架作用的同时,可以增加材料的骨诱导和成骨性能;此外,还可以避免异体骨和异种骨导致的疾病传播和伦理风险,有望成为理想的骨移植材料。本研究旨在探讨β-TCP和A-PRF复合材料对成骨细胞的影响,为后期研究提供基础。
1 材料与方法
1.1 材料
1.1.1实验动物
健康成年雄性新西兰大白兔6只,3月龄,体重(2 500±500)g,清洁级;新西兰乳兔同胎4只,出生24 h内,体重20~25 g,清洁级,均购于成都达硕生物科技有限公司。实验操作遵循《关于善待动物的指导性意见》。
1.1.2主要仪器与试剂
β-TCP(上海贝奥路生物材料有限公司),A-PRF工具盒(法国Nice公司),A-PRF真空塑料管(德国Greiner bio-one公司),细胞计数试剂盒8(CCK-8,日本株式会社同仁化学研究所),兔Ⅰ型胶原蛋白(collagen-Ⅰ,Col-Ⅰ)、兔碱性磷酸酶(alkaline phosphatase,ALP)、兔骨钙素(osteocalcin,OCN)ELISA试剂盒(上海桥杜生物科技有限公司),茜素红染剂(北京索莱宝科技有限公司);扫描电子显微镜(日本Hitachi公司),电子分析天平(德国Sartorius公司),倒置相差显微镜(日本Olympus公司),酶联免疫检测仪(美国Themor公司),低速离心机(美国Beckman Coulter公司)。
1.2 方法
1.2.1兔成骨细胞的制取
取新西兰乳兔(出生<24 h)4只,颈椎脱臼法快速处死后,浸泡于75%乙醇内10 min,移至无菌培养皿内,于无菌操作台分离取出兔颅顶骨,采用组织块贴壁培养法联合改良二次酶消化法[9]的复合培养方法培养,经传代培养取对数生长期的第3代细胞(P3)备用。
1.2.2β-TCP的预备
将包装完整的无菌β-TCP颗粒(直径<0.1 mm)和β-TCP圆片(直径6 mm,高度2 mm)去包装后,分别缓慢浸没于完全培养基中,轻柔震荡,进行湿润处理,24 h后取出,见材料完全浸没并沉淀于培养皿底部。移液管轻轻吸取多余培养基,加入磷酸盐缓冲液(PBS)冲洗3次后,最后一次吸干液体,收集剩余湿润β-TCP材料,备用。
1.2.3兔A-PRF的制备
取成年雄性新西兰大白兔6只,称重后固定制动,聚维酮碘消毒,使用A-PRF专用离心管Vacuette(A-PRF不抗凝真空玻璃涂层塑料管)快速采集兔耳中央动脉血4管,每管约10 mL。迅速将A-PRF离心管放入离心机内,配平后2 000 r/min离心24 min,取出室温下静置5 min。弃上清液,轻柔剥离下部红细胞层后,获得中间A-PRF凝胶层,并于A-PRF专用工具盒内压制成约1.0 mm厚的膜,制备成大小约1.0 mm×1.0 mm的碎屑,备用。另将A-PRF压制成约2 mm厚的膜,并修剪为直径约6 mm的膜片,备用。
1.2.4材料复合
将上述完成制备的β-TCP颗粒/圆片和兔A-PRF碎屑以1∶1的质量比进行混合[10],备用。
1.2.5实验分组
实验分为4组,包括无材料对照组(空白组)和3个实验组。实验组分别为β-TCP组(β-TCP颗粒/圆片)、A-PRF组(A-PRF碎屑/膜片)及复合组(β-TCP颗粒/圆片+A-PRF碎屑),将预先制备的材料移至孔板内,要求3个实验组材料重量一致。每组设置3个副孔,依次加入P3细胞,共培养。
1.2.6扫描电镜观察细胞形态和黏附
取湿润β-TCP圆片和A-PRF膜片,分别行扫描电镜检测,以观察β-TCP和A-PRF样品的表面形貌及纳微结构特征。分别在各实验组材料与细胞共培养第1、3、5天同一时间点取出培养板中β-TCP圆片和A-PRF膜片,进行扫描电镜检测。操作时注意正反面,贴近培养板底部为反面,远离培养板底部为正面,正面为检测面。
1.2.7CCK-8检测细胞增殖
取24孔板,按照上述实验分组将各实验组材料均匀覆盖于孔板底部,材料与细胞共培养(空白组不放置任何材料,纯细胞培养),第1、3、5、7、9、14天分别取上清液加入CCK-8试剂检测细胞增殖情况,测得450 nm处吸光度[A(450)]值。实验重复3次。
1.2.8ELISA检测成骨相关蛋白分泌
同1.2.7材料与细胞共培养(空白组不放置任何材料,纯细胞培养),采用ELISA试剂盒于第2、4、8天分别检测各组细胞Col-Ⅰ、ALP的分泌量,第12、14、16、18天检测各组细胞OCN的分泌量。实验重复3次。
1.2.9茜素红染色及矿化结节定量分析
取24孔板,预先在孔板内放置无菌玻片,同1.2.7材料与细胞共培养(空白组不放置任何材料,纯细胞培养),每组3个副孔,同时4组分别加设空白材料对照(即不接种任何细胞),消除材料导致的干扰因素。材料与细胞共培养,第4周时镜下各组均见无定形物质形成,即矿化结节,取出玻片经茜素红染色后,各组矿化结节呈形态不一的橘红色结节状。采用10%十六烷基氯化吡啶溶解着色矿化结节染料,测得570 nm处吸光度[A(570)]值,定量分析矿化结节生成情况。
1.3 统计学处理
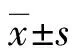
2 结 果
2.1 扫描电镜观察细胞形态和黏附
β-TCP和实验制得A-PRF样品的表面形貌及纳微结构特征见图1。A-PRF圆片、β-TCP圆片及复合物(β-TCP圆片和A-PRF碎屑复合)分别与成骨细胞共培养24 h后,扫描电镜检测可见少量细胞在材料表面及孔隙中黏附,伸出多个长短不一的包浆突起紧紧黏附在材料表面及孔隙内,细胞形态为不规则多边形;培养第3天时,细胞形态变大,细胞继续伸展,伸出更多伪足并相互连接,与材料黏附更加紧密;培养第5天,细胞数目继续扩增,细胞边缘伸出较多突起、伪足,并向四周伸展与相邻细胞间突起伪足相互连接,融合成片,横跨材料孔隙,细胞及细胞分泌的细胞外基质覆盖材料表面。4组观察结果显示,兔成骨细胞在β-TCP与A-PRF材料表面及多孔β-TCP内部孔隙内黏附、生长、增殖,形态多样。随时间延长,材料上细胞数量增加,并大量分泌细胞外基质,细胞与基质逐渐融合成片状,覆盖支架材料表面。单位观察视野内复合组与A-PRF组细胞数目较多,其中复合组增殖最明显,β-TCP组细胞数目相对较少,见图2。

A:A-PRF;B:β-TCP。
2.2 CCK-8检测细胞增殖
细胞增殖曲线图显示:除β-TCP组,其余3组细胞培养第1~5天,细胞数量呈对数增长;培养第5天开始,细胞增殖速度略微减慢;培养第10天后生长逐渐进入平台期。β-TCP组在培养的前5天,细胞增殖稍受抑制,培养5 d后进入快速增殖期,见图3A。统计分析结果显示:同一时间点复合组和A-PRF组细胞数量明显高于β-TCP组(P<0.05),且复合组最高,见图3B。
2.3 ELISA检测成骨相关蛋白分泌量
各组成骨细胞内Col-Ⅰ、ALP、OCN分泌量随着培养时间延长而逐渐增多。统计分析结果显示:各组成骨细胞同一时间点Col-Ⅰ、ALP、OCN分泌量β-TCP组最高,复合组和A-PRF组次之,空白组最低(P<0.05),见图4。

A:Col-Ⅰ分泌量的统计分析柱状图;B:ALP分泌量的统计分析柱状图;C:OCN分泌量的统计分析柱状图;a:P<0.05,与空白组比较;b:P<0.05。
2.4 茜素红染色
材料与细胞共培养4周后,镜下各组均见无定形物质形成,即矿化结节,经茜素红染色后,各组矿化结节呈形态不一的橘红色结节状,复合组生成结节最多,β-TCP组和A-PRF组次之,空白组最少(P<0.05),见图5。

A:茜素红染色后肉眼观(左上顺时针依次为空白组、A-PRF组、β-TCP组和复合组);B:茜素红染色镜下观(40×,左上顺时针依次为空白组、A-PRF组、β-TCP组和复合组);C:矿化结节的统计分析柱状图;a:P<0.05,与空白组比较;b:P<0.05。
3 讨 论
骨移植材料在临床上用以恢复骨缺损空间,促进缺损区恢复良好的骨量和较高的骨密度。理想的骨移植材料应具备以下4个重要性质:生物相容性、良好的机械性能、生物可吸收性和三维高孔隙率结构[11]。β-TCP属于目前研究较多的人工骨替代材料,具有良好的骨引导作用和一定的骨诱导性能。但是由于β-TCP降解速度过快,与成骨速度不相匹配,常常需要与其他材料相结合,本实验中β-TCP与自体来源、新鲜制备的A-PRF材料复合,不存在任何疾病传播、免疫原性和致畸致癌风险,复合后用骨水泥的方式进行骨缺损注射填充,引导和诱导骨组织再生,是一种安全有效的骨缺损再生方法。
骨移植材料的作用本质为刺激周围骨相关细胞在材料表面定植增殖和分化成骨,移植材料的化学成分、晶体结构和表面形态是调节细胞黏附生长、增殖分化、钙盐沉积和新骨形成的关键[12-13]。磷酸钙材料在接触培养溶液后释放出钙离子,使得材料表面带有正电的Zeta电势增加[14-15],吸引带负电荷的纤维连接蛋白(fibronectin,FN)结合,进而促进整合素附着[16-17]。整合素是一种跨膜受体,能与特定的细胞基质蛋白组分,如Ⅰ型胶原蛋白和FN等结合形成细胞黏附位点,从而介导细胞黏附[18],增加材料表面对成骨的增殖和分化作用[19-20]。除了磷酸钙材料表面蛋白吸附作用,材料周围渗透压和pH值的变化也是影响细胞生物特性的重要因素。细胞培养环境在一定范围内适当碱化,能促进体外细胞黏附和生长,增强成骨细胞分化和成骨功能[21]。然而,随着材料溶解增加,培养环境中渗透压和pH值过高时,细胞运动明显减少,甚至产生完全不可逆的运动抑制,从而导致细胞凋亡[22]。而A-PRF来自身血液,对成骨细胞具有较好的亲和性,培养过程中缓慢释放生长因子、细胞因子等成分[23],具有诱导成骨细胞、促进成骨细胞的趋化和增强有丝分裂的作用,进而促进骨细胞的增殖和合成活性,调节骨折愈合和缺损重塑[24]。
本实验中,成骨细胞分别与β-TCP、A-PRF及二者的复合材料进行共培养,在细胞共培养早期主要由整合素介导进行细胞黏附,特异性基质蛋白成分主要来源于培养基,β-TCP的Zeta电位作用与A-PRF的蛋白亲和性使得各组之间蛋白定植情况基本相似[25],细胞的黏附也无明显差异,细胞形态符合正常成骨细胞形态结构,细胞生物相容性良好。
随着培养时间延长,因β-TCP材料析出钙磷离子增加,材料周围渗透压和pH值升高,细胞培养环境的适当碱化能一定程度上促进体外细胞黏附和生长,增强成骨细胞分化和成骨功能。然而,当β-TCP材料继续溶解时,过多的溶解产物会导致培养环境渗透压和pH值进一步增加,当培养环境中渗透压和pH值过高时,细胞不能适应这种培养条件,细胞运动和增殖明显减少;而A-PRF能持续释放生长因子等活性成分,促进糖酵解和细胞增殖[26],因此A-PRF组细胞增殖呈现稳步快速上升,且见细胞外基质的形成和堆积。复合组各含一半质量的β-TCP和A-PRF,结合两种材料的优势,避免高渗透压和pH值,细胞增殖效应大于单一材料组,因此观察到成骨细胞的快速增殖且分泌功能旺盛。此外,随着培养时间延长,培养基的更换,渗透压升高抑制钙离子析出,成骨细胞释放酸性代谢物质,培养基的渗透压和pH值得到改善,因此观察到β-TCP组在经历培养初期细胞生长增殖抑制后,开始快速增殖,但是相对于其他3个组,β-TCP组细胞增殖仍然较慢。在整个增殖过程中,复合组细胞增殖最明显,A-PRF组次之,这与细胞黏附实验结果一致。
β-TCP材料具有较粗糙的多孔材料表面,钙离子的析出使得培养基适当碱化,可促进细胞糖酵解,促进胶原蛋白合成,ALP活性增加,也可促进后期钙沉积和矿化结节生成[15]。A-PRF内存在的生长因子对成骨细胞的增殖分化作用并不是单一促进作用,具有双向多效性,能促进ALP等蛋白分泌,也可抑制成骨细胞终末分化,即矿化结节的形成[6]。但A-PRF的生长因子释放主要集中在细胞培养前10 d,而钙结节的沉积主要在细胞培养3周后[8],所以其最终对钙结节沉积没有明显的抑制作用。复合培养组中β-TCP含量减少,相关蛋白分泌稍有减弱,但由于加入了A-PRF,在细胞培养后期降解产物酸化培养基时可促进β-TCP的钙离子释放,从而促进钙沉积和矿化结节形成。
综上所述,β-TCP联合A-PRF材料复合组综合了两种材料的优势,能有效促进兔成骨细胞的增殖、成骨相关蛋白及矿化结节的形成,有望成为一种良好的骨替代材料。
