基于质谱技术筛选酿酒酵母中Hrr25在自噬中的相互作用蛋白
2024-01-07姜文艳徐佳钰崔艳美
姜文艳, 徐佳钰, 崔艳美, 王 娟
(北京工业大学 环境与生命学部,北京 100124)
自噬是一种高度保守的细胞降解过程[1].在自噬过程中,细胞质成分被隔离在称为自噬体的双膜囊泡中,并被转运到溶酶体或液泡中进行降解[2].自噬可以以非选择性和选择性的方式发生[3],选择性自噬包括细胞质到液泡靶向途径(cytoplasmic to vacuolar targeting pathway,CVT)、过氧化物酶体自噬、线粒体自噬等.酵母中的遗传筛选鉴定自噬相关基因揭示了自噬过程的分子机制.迄今已鉴定出40多种自噬相关蛋白(autophagy-related protein,Atg),有19种直接参与了饥饿诱导的自噬体的生物发生.自噬对于维持能量平衡和保护细胞免受压力至关重要,在发育和传染病、神经变性和癌症等疾病中起着重要作用[4-5].
Hrr25是酿酒酵母中I型酪蛋白激酶家族成员,具有丝氨酸/苏氨酸蛋白激酶活性.Hrr25蛋白质结构域可分为N-端激酶结构域(氨基酸1~290)和“中心域”(氨基酸290~394),以及C-端脯氨酸/富含谷氨酰胺的结构域[6].其可以定位于细胞核、内吞部位、芽颈、纺锤体和高尔基体等[7-11].最初研究发现 Hrr25可以参与DNA修复及影响细胞分裂,随着研究的深入发现Hrr25通过与多种蛋白的相互作用参与自噬[12-18]、囊泡运输[19]、钙离子调节[20]、弱有机酸胁迫途径[21]、核糖体生物发生[22-26]、微管组装[27]等多个细胞过程,对于酿酒酵母维系自身稳态、应对环境压力至关重要.在选择性自噬过程中,Hrr25可以磷酸化选择性受体Atg19,Atg34和Atg36影响与支架蛋白Atg11的相互作用,从而调控选择性自噬的发生.而在饥饿诱导的非选择性自噬过程过程中,Hrr25可以磷酸化COPⅡ衣被蛋白Sec24,而调节自噬体的数量以及与Atg9 C端的相互作用[28-29].虽然现在关于Hrr25在自噬中的作用和作用机制的研究已有一些重要进展,但Hrr25在自噬过程中还有哪些尚未鉴定的新底物参与仍有待研究.本研究通过质谱筛选酿酒酵母中Hrr25在自噬中新的相互作用蛋白,为解析Hrr25调控自噬的分子机制,准确认识Hrr25与自噬的关系,深入了解自噬调控网络提供新信息.
1 材料与方法
1.1 材料与试剂
1.1.1 酿酒酵母菌株
MATaura3-1-his3-i1,15trp1-1-1lev2-3,112ade2-1can1-100
1.1.2 主要实验试剂
Phanta Max Super-fidelity DNA Polymerase(南京诺唯赞生物股份科技有限公司),FastDigest XhoⅠ,FastDigestBamHⅠ,FastDigestNcoI(Thermo Fisher Scientific),Clon Express One Step Cloning Kit(南京诺唯赞生物科技公司),DH-5α感受态细胞(北京天根生物科技有限公司),T3 Super PCR Mix(北京擎科生物科技有限公司),琼脂糖凝胶DNA回收试剂盒、普通DNA产物纯化试剂盒、快速质粒小提试剂盒(北京天根生物科技有限公司).引物序列由北京擎科生物科技有限公司合成,其引物序列如表1.

表1 引物序列Tab.1 Primer Sequence
1.2 实验方法
1.2.1 质粒构建
使用pRS305-Hrr25(+145~+1482)正向及pRS305-Hrr25(+145~+1482)反向引物以及酵母基因组为模板调取目的基因片段,同时使用XhoⅠ和BamHⅠ酶切载体.将PCR调取的核酸片段及酶切后的载体进行琼脂糖凝胶电泳及核酸片段回收.核酸片段回收后进行同源重组,并将同源重组产物转化到DH-5α感受态细胞中,待单克隆在含有抗性的培养基中长出,挑取单克隆,进行PCR验证.验证出阳性菌株后提取质粒并送测序.
1.2.2 菌株的构建
将构建好的pRS305-Hrr25-13MYC质粒使用限制性内切酶NcoI线性化处理,将线性化后的核酸片段通过酵母转化转入到酵母菌株中.将转化处理后的菌株涂在筛选培养板SC-Leu上,待单克隆长出后进行菌落PCR和Western Blot验证.
1.2.3 质谱样品制备
收集生长期的菌株100 OD(光密度,optical density,OD),在SD-N培养基中饥饿处理4 h.对应的收集生长期的菌株100 OD不做饥饿处理.然后再次收集菌株并用蜗牛酶处理菌株获得原生质体.将原生质体重新悬浮在1 000 μL的裂解缓冲液(25 mmol/L tris-HCl,pH 7.4,150 mmol/L NaCl,1 % triton X-100,1 mmol/L EDTA,5 %甘油,蛋白酶抑制剂)中,冰上孵育10 min设置条件为12 000 r/min,4 ℃离心10 min.取上清到新的离心管中,即获得蛋白样品.将获得的蛋白样品先与Myc抗体在室温孵育1 h,然后再与磁珠室温孵育1 h.用TBST清洗磁珠4~5次后加入2×SDS-PAGE Loading Buffer,100 ℃金属浴煮10 min.然后进行SDS-PAGE电泳,待样品跑到分离胶1 cm处,停止电泳.用考马斯亮蓝对胶块染色1 h,脱色液脱色.胶块寄送北京蛋白质组研究中心进行LC-MS/MS分析.样品使用Orbitrap Fusion质谱仪搭载easy-nLC 1000 nanoflow高效液相色谱系统,设置质谱参数如下:Orbitrap 扫描的自动获得控制目标(automatic gain control target,AGC target)为5×105,最大注入时间50 ms,MS/MS二级扫描AGC target为5×103,最大注入时间35 ms,动态排除设定18 s.
1.2.4 与Hrr25相互作用蛋白筛选
将不同条件下质谱筛选出的蛋白输入韦恩图制作软件Venny 2.1,得出在诱导自噬条件下特异与Hrr25相互作用的蛋白.
1.2.5 基因本体论(GO)功能分析和京都基因和基因组百科全书(KEGG)通路富集分析
将所得到的诱导自噬特异性表达基因导入David数据库(https://david.ncifcrf.gov/summary.jsp)进行GO的生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cell component,CC)及KEGG通路富集分析,并将结果可视化.
2 实验结果
2.1 质粒构建
构建pRS305-HRR25-13MYC质粒,HRR25选择的基因片段为+145~+1 482.用合成的引物pRS305~Hrr25(+145~+1 482)-Forward及pRS305-Hrr25(+145~+1 482)-Reverse以酵母基因组为模板进行PCR,调取所需核酸片段.如图1a核酸片段从酵母全基因组上调取出来,大小为1 391 bp.然后利用同源重组的方法将调取的核酸片段与载体结合,并热激转化到DH5α细胞.利用菌落PCR和琼脂糖凝胶电泳检测单克隆菌株确定阳性菌株,质粒的阳性菌株PCR结果预计阳性大小1 391 bp,如图1b获得阳性菌株,阳性结果条带大小与预计大小一致.进一步将阳性单克隆菌株提取质粒并进行DNA测序确定质粒构建成功.

a.调取HRR25基因核酸片段,核酸片段大小为1 391 bp;b.pRS305-HRR25-13MYC-ADH1 terminator质粒构建验证,PCR阳性结果1 391 bp.图1 质粒构建Fig.1 Plasmid Construction
2.2 酵母菌株构建
以W303菌株为模式菌株,制备可以表达 Hrr25-13Myc蛋白的酿酒酵母菌株.首先用限制性内切酶NcoI线性化pRS305-Hrr25(+145~+1 482)-13MYC-ADH1 terminator质粒,并通过酵母转化将线性化的pRS305-HRR25(+145~+1 482)-13MYC-ADH1 terminator核酸片段转入到酵母菌株中.由于pRS305质粒上所带的筛选标记为LEU2,所以将转化好的酵母菌株涂布在SC-Leu营养缺陷型培养基上筛选阳性克隆.待单克隆在筛选培养基SC-Leu中长出,挑取单克隆在分子水平和蛋白水平进行验证.在分子水平使用引物Hrr25-+62正向引物和pRS305-R进行PCR验证,阳性菌株PCR大小为1 444 bp.如图2a所示,验证出阳性菌株.验证出的阳性菌株,再对加入标签后的目的基因序列进行酵母PCR并送测序,确认标签正确加到目的基因位置.在蛋白水平上,将PCR验出的阳性菌株在SC-Leu液体培养基中培养,并提取蛋白质进行Western Blot验证,用Myc抗体进行孵育.如图2b所示,结果与阴性对照对比Myc标签融合蛋白基因已成功整合到菌株基因组并成功表达,即表达Hrr25-13Myc蛋白的菌株构建成功.

图2 表达Hrr25-13Myc菌株分子(a)和蛋白水平验证(b)Fig.2 Molecular(a)and Protein(b)Level Validation of Hrr25-13Myc Strain
2.3 免疫沉淀联合质谱筛选和鉴定与Hrr25相互作用蛋白
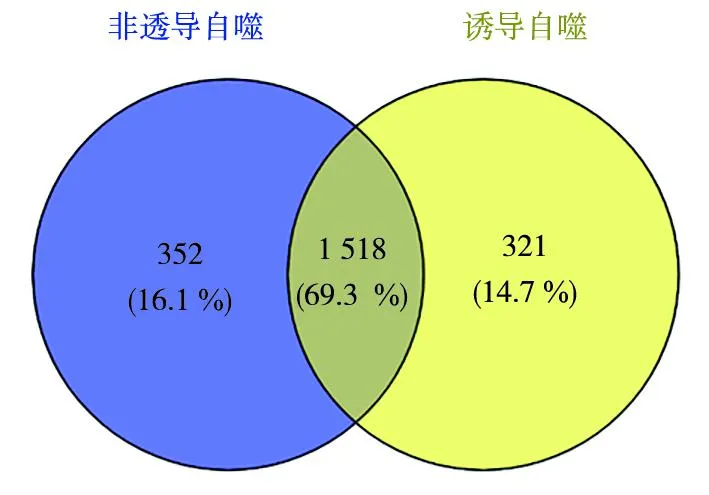
图3 Hrr25相互作用蛋白韦恩图Fig.3 Venny Diagram of Hrr25 Interacting Protein
为了找出与Hrr25相互作用影响自噬的蛋白,以成功表达Hrr25-13Myc蛋白的菌株为模式生物进行实验.首先对表达Hrr25-13Myc蛋白的菌株进行不同的处理,一组菌株进行饥饿处理诱导自噬,对应的另一组菌株不进行饥饿处理.然后利用免疫沉淀的方法,用Myc抗体以Hrr25-13Myc为靶蛋白进行免疫沉淀,分别从饥饿和非饥饿处理后菌株中将Hrr25及其相互作用的蛋白沉淀下来.蛋白样本制备完成后,先用蛋白免疫印记实验进行验证确认Hrr25-13Myc靶蛋白沉淀下来,然后再将免疫沉淀的样品进行SDS-PAGE并用考马斯亮蓝染色后送质谱检测.质谱结果去除置信度较低的一批蛋白后,在非饥饿条件下鉴定出1 869种候选蛋白,在饥饿条件下鉴定出1 838种候选蛋白.将2种状态下与Hrr25相互作用的蛋白,运用Venny 2.1绘制韦恩图.如图3所示,只在非诱导自噬条件下与Hrr25相互作用的候选蛋白有352种,只在诱导自噬条件下与Hrr25相互作用的候选蛋白有321种,在2种状态下都与Hrr25相互作用的候选蛋白有1 518种.
2.4 Hrr25的互作蛋白功能分析
对在自噬诱导条件下特异与Hrr25相互作用的321种蛋白进行分析.通过David数据库对这321种蛋白进行GO和KEGG富集分析.GO分析可以通过将差异基因或蛋白进行富集分析后统计显著富集的区域,对321种蛋白进行GO分析可显示其在分子功能、生物过程和细胞组成中的分类.根据P<0.05,GO富集共得到23项生物过程(biological process,BP),主要涉及CVT途径、高尔基囊泡内介导的转运、RNA聚合酶Ⅱ启动子的转录、糖异生负调控蛋白质转运,自噬前体结构的蛋白质定位等.16项细胞组成(cellular component,CC)相关主要涉及高尔基膜,高尔基转运复合体,过氧化物酶体,自噬前体结构,内质网到高尔基体转运囊泡等.21项分子功能(molecular function,MF)主要涉及蛋白质异二聚活性、氧化还原酶活性、DNA结合、蛋白质复合物支架等.如图4所示,选择P值排名前10的生物过程、细胞组成、分子功能进行可视化.在富集的生物过程中,CVT途径排名最靠前,富集到11种候选蛋白其中包括自噬相关蛋白:Atg9,Atg27,Atg3,Atg4,Atg11,保守寡聚高尔基体(conserved oligomeric golgi,COG)复合物亚基:Cog1,Cog5,Cog6,Cog7,Cog8,SNARE(soluble N-ethylmaleimide-sensitive factor attachment protein receptor)蛋白Vam7.
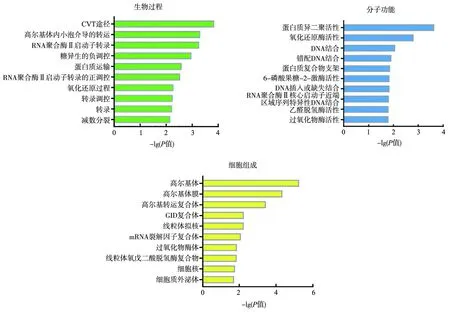
图4 GO富集分析结果Fig.4 Analysis Results of GO Enrichment
对321种蛋白进行KEGG富集分析.根据P<0.05,KEGG富集共得到14条通路.如图5所示,其中主要包括自噬、过氧化物酶体、碳代谢、柠檬酸循环(TCA循环)、不匹配修复、抗坏血酸和醛酸代谢、基础转录因子、氨基酸代谢等.

图5 KEGG富集分析结果Fig.5 Analysis Results of KEGG Enrichment
3 讨 论
自噬是细胞中一种进化保守的生物学过程,可以通过降解受损的细胞器和多余的蛋白质使细胞在应激损伤时能够维持正常的平衡.Hrr25作为压力应对型激酶在自噬过程中发挥多种作用.为了筛选Hrr25在自噬中的相互作用蛋白,首先构建了可以整合到酵母基因组上的pRS305-Hrr25-(+145~+1482)-13Myc质粒,并使用构建好的质粒构建出表达Hrr25-13Myc蛋白的酵母菌株;待构建好的酵母菌株培养到生长期,分成2组,一组进行饥饿诱导自噬,另一组正常培养;用Myc抗体以Hrr25-13Myc为靶蛋白进行免疫沉淀,将免疫沉淀的样品进行SDS-PAGE,并用考马斯亮蓝染色后送质谱检测.
LC-MS/MS结果去除置信度较低的一批蛋白后,检测发现在非饥饿条件处理菌株中鉴定出1 869种蛋白与Hrr25-13Myc存在相互作用,在饥饿条件处理菌株中鉴定出1 838种蛋白与Hrr25-13Myc存在相互作用.利用韦恩图找出差异性蛋白321种.对321种差异蛋白质进行GO分析,在生物过程中主要涉及CVT途径、高尔基囊泡内介导的转运、RNA聚合酶Ⅱ启动子的转录、糖异生负调控蛋白质转运,自噬前体结构的蛋白质定位等.其中在CVT途径中,富集到11种候选蛋白Atg9,Atg27,Atg3,Atg4,Atg11,Cog1,Cog5,Cog6,Cog7,Cog8,Vam7.并且通过KEGG富集分析发现相互作用的蛋白在自噬通路中发挥作用.
在自噬过程中,Atg9是核心Atg蛋白中唯一的跨膜蛋白,可以定位于前自噬结构(pre-autophagosomal structure,PAS)和线粒体附近的外围结构,以循环转运方式在自噬体的形成过程中对隔离膜的扩张起着关键作用[30],在饥饿时,Atg9可以结合到高尔基复合体和线粒体网近端的外围结构的一个称为Atg9囊泡的囊泡中,并且在Atg11,Atg23,Atg27和Atg41的帮助下,Atg9囊泡从外围结构招募到PAS,作为隔离膜的初始膜源[31].保守寡聚高尔基体(conserved oligomeric Golgi,COG)复合物是一种含有螺旋杆的拴留复合物[32].在饥饿诱导自噬过程中,cog突变体中Atg9在PAS的定位明显减少,Atg9循环受到影响[33].并且在营养丰富条件下,Cog8可以与激活的Arl3和Arl1相互作用,调节Atg9囊泡从反式高尔基转移至PAS而参与CVT过程[34].
Atg8脂质化在自噬体的形成中发挥重要作用.Atg8蛋白的C端首先被Atg4家族蛋白酶蛋白水解切割,暴露甘氨酸残基.Atg8随后在ATP消耗下转移到E1样酶Atg7中的半胱氨酸残基.从那里,Atg8被转移到E2样酶的Atg3,Atg3通过其C端甘氨酸介导Atg8与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)的头基的连接形成Atg8-PE[35].Atg8-PE参与自噬体形成的多个步骤,包括隔离膜扩张和闭合.此外,Atg8-PE可以被Atg4裂解将Atg8从膜中释放出来以供重复使用,并且该反应还可以调节自噬体的形成.以上筛选出的蛋白说明Hrr25可能通过与多种参与自噬的蛋白相互作用而影响自噬的发生.但这些筛选出的候选蛋白是否与Hrr25相互作用影响自噬的发生有待进一步研究.综上所述,本研究的结果为进一步探究Hrr25在自噬中的调控机制提供新的方向.
