砷在不同物候期香蒲中的分布及其生理影响
2024-01-05罗维纲张晋龙刘云根
罗维纲,张晋龙,刘云根,3
1.西南林业大学生态与环境学院,云南 昆明 650224 2.中国科学院地理科学与资源研究所,北京 100101 3.云南省山地农村生态环境演变与污染治理重点实验室,云南 昆明 650224
湖滨带作为湖泊与陆地之间的过渡地带,承担着拦截陆源污染、降解污染物、改善水质和维护生物多样性等多重生态作用,是维护湖泊水环境安全的关键环节[1]。目前,湖滨湿地存在一定程度的重金属污染问题,由于重金属具有难降解性和生物富集性,对动物与植物造成了较大的生态伤害[2]。重金属污染不仅会影响水环境安全,还会随着食物链将危害传递给人类[3],影响人类健康。已有的研究表明,许多湿地都受到一定程度的重金属污染[4-6]。As是一种具有致癌性和毒性的重金属元素,其对植物的光合作用、叶绿素的生物合成及抗氧化酶系统均有一定干扰,当它的浓度积累到一定程度的时候,会对植物正常的生理代谢功能产生较大影响,从而对植物生长产生抑制作用,甚至会导致植物枯萎[7-9]。
挺水植物是湖泊生态系统中最主要的生物群落之一,已被广泛用于湖滨水体重金属污染治理中。它在吸收外来污染、拦截流域沉积物、优化底泥环境和微生物群落建设中具有重要意义[4]。香蒲是中国最具代表性的湖滨湿地水生植物之一,具有生物量大、覆盖率高、能耐高浓度重金属污染等特点,同时对生活和工业废水中的氮、磷和有机物有较强吸附富集能力,已被大量引入中国的湿地生态修复建群种中[10-11]。在评价植物对重金属的吸收效能时,系统考察植物各生长阶段内重金属含量变化情况,确认植物最佳收获时间,对于植物修复重金属污染非常必要。目前As污染对陆地植物、农作物、藻类[12-13]等的影响机制研究已取得一定进展,但对生长在湖滨湿地的相关植物研究较少。因此,该研究将香蒲作为研究对象,采用水培模拟实验,研究其对水环境中重金属As污染的修复过程。利用差速离心技术对香蒲叶组织亚细胞成分进行分离,对As在香蒲叶内亚细胞水平的分布特征及香蒲对As产生的生理响应进行研究,拟揭示香蒲对As的耐性和解毒机理,以期为重金属在植物细胞中的分子机理研究提供参考。
1 实验部分
1.1 实验材料
香蒲购自昆明市泛亚育苗基地(均在无As条件下生长),花盆(上口径为19 cm、下口径为13 cm、高为23 cm),定植篮(直径为20 cm,高为6 cm,底径为13.5 cm),鹅卵石购自石材加工厂。培养液以改进的Hoagland配方为基础,As以Na2HAsO4·7H2O形式添加。
1.2 实验设计
采用水培模拟实验,选择生物量与高度彼此接近的植株,将其种植在花盆里,把定植篮和鹅卵石放在花盆上方,以便固定植株。将植株放在改进的Hoagland营养液中预培养15 d,再置于浓度为0、0.5、2.0、5.0、10.0 mg/L的As处理液(分析纯)中。每次处理都设定3个平行实验,每个平行实验都有3株植物,一共获得45份样品。用去离子水维持溶液体积,每周更换一次培养液。在滇中高原,香蒲幼苗期为4月上旬—6月上旬,花果期为6月下旬—9月下旬,枯黄期为10月上旬—12月上旬。该实验拟在生长期(7月7日)、花果期(9月7日)和枯黄期(11月7日)采集并检测香蒲的对应指标。
1.3 测定指标及方法
将采集的香蒲叶直接用去离子水冲洗,再用吸水纸吸取叶片上的水分。将处理后的新鲜植物样本剪成小块,称取1 g样品,用15 mL硝酸隔夜浸泡,使用湿法消解(硝酸与高氯酸的体积比为3∶1,试剂均为分析纯),将样本消解到澄清状态,并用去离子水过滤,定容到50 mL。采用双通道原子荧光光度计(北京吉天仪器有限公司)测量As含量,并通过以下方程来计算香蒲叶细胞组织中As的富集系数。
富集系数(BCF)=香蒲叶细胞组织内
As含量/营养液中As浓度
1.3.2 香蒲亚细胞组分的分离及As的测定
参考WANG等[14]的方法进行亚细胞组分分离,将1 g鲜样按照料液比为1∶10进行称量,将10 mL提取液、250 mmol/L蔗糖、50 mmol/L Tris-HCL (pH为7.4)、1 mmol/L二硫赤藓糖醇(C4H10O2S2)于4 ℃进行研磨以使浆料均匀。将300 g匀浆液离心2 min,得到的沉淀物是没有破裂的残余物与细胞壁;用2 000 g上清液离心15 min,得到的是含有细胞核与叶绿体组分的沉淀物;用10 000 g上清液离心20 min,得到的是含有线粒体组分的沉淀物以及上清液中的可溶性组分(包括细胞浆、细胞液、核糖、蛋白质等)。各工序的匀浆都在4 ℃左右条件下参与实验。用15 mL硝酸隔夜浸泡全部样品,以湿法消解(硝酸与高氯酸的体积比为3∶1,试剂均为分析纯),使样品变得澄清,并以去离子水过滤,定容至50 mL。采用双通道原子荧光光度计(AFC-810,北京吉天仪器有限公司)测定As含量,进一步计算As在香蒲亚细胞组织中的富集系数,计算公式如下。
富集系数(BCF)=香蒲亚细胞组织内
As含量/营养液中As浓度
1.3.3 抗氧化酶活性及丙二醛含量的测定
不同抗氧化酶及丙二醛含量的测定方法见表1。

表1 不同抗氧化酶及丙二醛含量的测定方法Table 1 Methods for determination of different antioxidant enzymes and malondialdehyde content
1.4 数据分析
使用 Excel 2018对原始数据进行整合与处理,利用SPSS 21.0对数据进行差异性分析(P<0.05为显著性差异水平,P<0.01为极显著差异水平),利用Origin 2021绘制图表。
2 结果
2.1 不同浓度As胁迫下不同物候期香蒲叶内As的累积特征
As胁迫下香蒲叶不同物候期的As含量及富集系数见图1。
取小鼠部分子宫组织,经研磨、裂解、匀浆、离心,取上清液,进行BCA蛋白定量,SDS-PAGE凝胶电泳、转膜。浸于5% BSA封闭,分别用MMP-9、TLR4及NF-κB一抗低温过夜孵育(1∶2 000,4 ℃)。次日漂洗后更换二抗孵育30 min(1∶5 000,常温),漂洗后ECL化学发光、显影。ImageQuant软件扫描并分析相应灰度值,检测需重复3次。
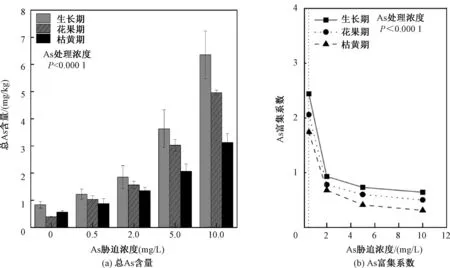
图1 As胁迫下香蒲叶不同物候期As含量及富集系数Fig.1 As content and enrichment coefficient of Typha angustifolius L. leaves at different phenological stages under As stress
从图1(a) 可以看出,在As浓度为0、0.5、2.0、5.0、10.0 mg/L胁迫下,香蒲叶不同物候期As含量总体呈增长趋势。随着胁迫浓度的增加,香蒲叶中As含量逐渐增加;随着胁迫时间的延长,香蒲叶中的As含量呈下降趋势,生长期香蒲叶内的As含量最高,表明香蒲在生长期对As的积累能力最强;当As浓度提高时,香蒲叶片中As的含量明显高于对照组(P<0.05)。当As胁迫浓度达到2.0 mg/L以上时,香蒲叶中As含量增长速度明显增加,说明高浓度As胁迫环境对香蒲去除As有促进作用。
在生长期、花果期、枯黄期中,As胁迫使香蒲叶片As含量为对照组的1.47~7.65、2.64~12.72、1.55~5.57倍,随着胁迫时间的延长,生长量呈递减趋势。在同一外源As胁迫条件下,香蒲叶中As的浓度随香蒲的生长而降低,在枯黄期,As浓度仅为生长期的49.13%~67.47%。
As胁迫生境下,香蒲对As的富集系数(BCF)如图1(b)所示。生长期、花果期、枯黄期,香蒲叶对营养液中As的BCF数值变化范围分别为0.64~2.44、0.50~2.06、0.31~1.74;随着As浓度的增加,各时期香蒲叶BCF均呈逐渐减小的趋势,As浓度为10.0 mg/L时,各时期的BCF均达到最小值。
根据BCF范围可以看出,香蒲叶对As的富集吸收能力水平一般。
2.2 同浓度As胁迫下不同物候期香蒲亚细胞组分变化情况
2.0 mg/L的As胁迫下不同物候期香蒲亚细胞各组分的As含量及占比见图2和图3。
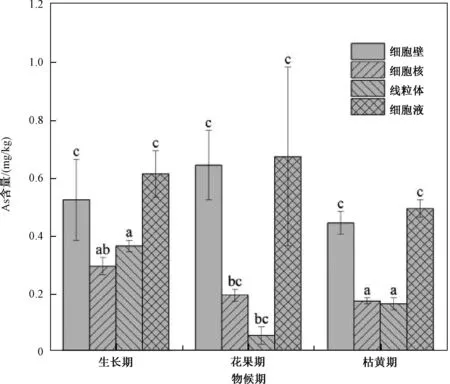
图2 2.0 mg/L As胁迫下不同物候期香蒲亚细胞各组分As含量Fig.2 As content of subcellular components of Typha angustifolius L. under 2.0 mg/L As stress at different phenological stages

图3 2.0 mg/L As胁迫下不同物候期香蒲亚细胞各组分As含量占比Fig.3 The percentage of As content in each component of Typha angustifolius L. subcellular at different phenological stages under 2.0 mg/L As stress
由图2可知,在2 mg/L As浓度胁迫下,As在不同物候期香蒲叶各亚细胞组分中的含量分布均表现为细胞壁和细胞液>细胞核和线粒体。在不同物候期,细胞壁和细胞液As含量之和为细胞核和线粒体的1.75~5.55倍,虽然各时期有所差异,但差异不明显;不同生长阶段,线粒体中As累积含量差异显著,具体表现为生长期最高,花果期最低,生长期线粒体中As累积含量为花果期的7.2倍。由图3可知,随着香蒲的生长,As在叶细胞壁与细胞液的分布占比总和达到63.5%~84.5%,说明细胞壁及细胞液是香蒲叶内As的重要储库。
2.3 As胁迫对香蒲酶活性及MDA含量的影响
As胁迫下香蒲叶酶活性及MDA含量变化情况见图4。
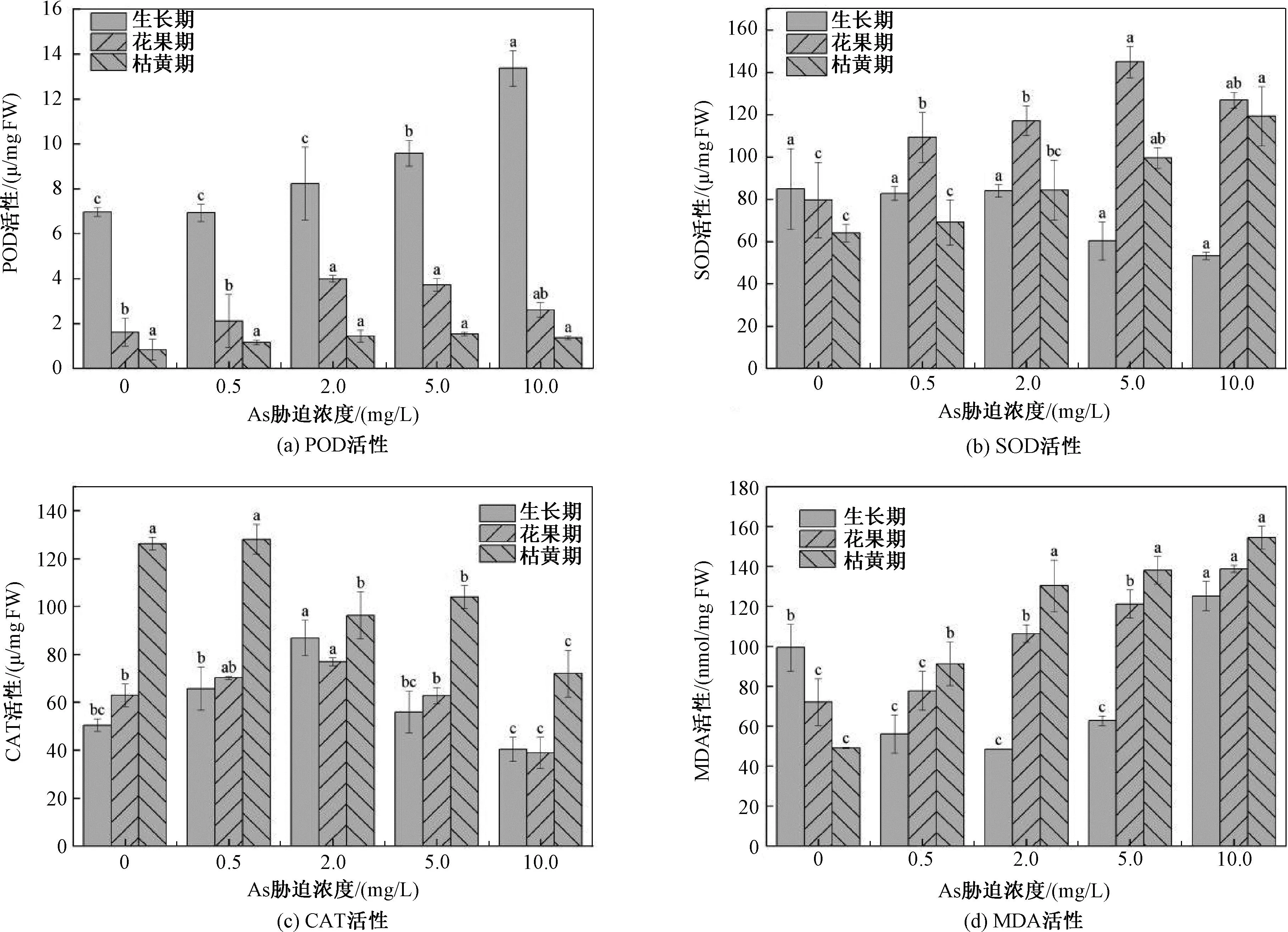
图4 As胁迫下香蒲叶酶活性及MDA含量变化Fig.4 Changes of enzyme activity and MDA content in Typha angustifolius L. leaves under As stress
由图4可知,As胁迫下,过氧化物酶(POD)生长期活性随As浓度的增加呈上升的趋势,除As浓度为0.5 mg/L外,其余的As浓度下,POD活性均明显高于对照组。当As浓度为10.0 mg/L时,POD活性为13.36 μ/mgFW,为对照组的1.92倍;花果期POD活性增长幅度与生长期对比相对较低,枯黄期POD活性与对照组持平。花果期和枯黄期,超氧化物歧化酶(SOD)活性均比对照组显著增加,在As浓度为5.0 mg/L 时,花果期SOD活性为145.05 μ/mgFW,为对照组的1.82倍,但生长期SOD活性与对照组相比,变化幅度不大。生长期和花果期,过氧化氢酶(CAT)活性均呈先上升后下降的趋势,枯黄期CAT活性总体呈下降趋势。花果期和枯黄期不同浓度As胁迫下,丙二醛(MDA)含量均显著增加,生长期MDA含量呈先下降后上升的趋势,不同时期MDA含量在10.0 mg/L As胁迫时均达到最大值,分别为对照组的1.26、1.93、3.14倍。As对不同物候期香蒲叶中POD活性的影响与As浓度呈正相关,对CAT活性具有低促高抑的效果,且在不同的物候期,POD与CAT之间呈现互补性,随着 As含量的提高和香蒲的生长,SOD和MDA的含量明显升高。
3 讨论
3.1 As在香蒲叶内的累积特征
基于植株生物量、代谢能力及根系活力等多方面因素的影响,不同物候期的植物对生长环境中的重金属表现出不同的积累特征[16]。该研究结果显示,生长期香蒲叶内的As含量一直都最高,表明生长期的香蒲对As的积累能力最强。这可能是由于在香蒲生长初期,污染生境中各元素相对充足,植物根系会快速吸收环境中的矿物元素[17],体内积累速度较快,导致地下部As更多地被转移至地上。从图1可以看出,花果期和枯黄期香蒲体内As的积累量明显下降,可能是由于生长后期植株个体生命衰退,皮层组织老化,对As的积累能力下降[18]。
As对植物的影响在很大程度上取决于胁迫浓度和胁迫周期[19]。As含量和它的富集系数是衡量植株富集金属能力的一个重要指标[20]。研究显示,在生长期、花果期和枯黄期,As的胁迫浓度≤10.0 mg/L时,香蒲的BCF值分别为0.64~2.44、0.50~2.06、0.31~1.74,2.0 mg/L是As胁迫浓度的分界点(图1),当As的胁迫浓度大于2.0 mg/L时,BCF值小于1.0,说明香蒲叶对As的富集作用不大。
这可能是由于As(Ⅴ)是通过PHT被吸收的[21],而As(Ⅲ)通过水通道蛋白进入植物体内[22],损害蛋白质,改变根系的生理特征,抑制As向地上部转移,从而使其在根中积累更多。在非超富集As植物中,As主要累积在植物根系部分,张晋龙等[23]研究也发现,在所有的As胁迫浓度下,香蒲根的As质量分数均较大,是叶的10.04~25.08倍,说明香蒲叶对As的富集能力不如根系部分。
3.2 As在香蒲亚细胞组分的分布特征
As在香蒲不同亚细胞组分中的选择性分布存在着明显的差别,其分布特征揭示了植物对重金属的解读机制[24-25]。孙宇等[26]通过对水稻的研究发现,As的分布部位以细胞液为主;ZVOBGO[27]研究表明,As在烟草细胞中的分布部位以细胞壁为主;TURNER等[28]观察到,根癌农杆菌耐高浓度Zn的能力似乎和Zn与细胞壁结合的程度呈正相关。据NISHIZONO等[29]报道,山羊草中70%的Cu、Zn和Cd元素储存在根的细胞壁中,其中大部分以离子形式存在,或与纤维素、木素等结构性物质结合[30]。BOOMINATHAN等[31]对超富集植物和非超富集植物的纤维细胞中重金属分布的研究表明,大部分重金属在纤维细胞内是从细胞壁中被分离出来的。笔者研究结果显示,As在香蒲叶细胞壁和细胞液内比例分别为29.2%~41.3%、34.3%~43.2%,表明细胞壁和细胞液是香蒲中As的主要储存部位,BORA等[32]提到,因为在大型水生植物的细胞壁中包含较多的阴离子多糖(如半乳糖酸)等亲金属离子配位基团,能够与重金属离子发生高效的结合作用,进而增加细胞壁上的重金属浓度,这与笔者研究结果一致。同时,WU等[33]采用差速离心法及同步辐射 X射线荧光光谱学技术,发现小白菜细胞液中铅的富集量仅次于细胞壁,也与笔者研究结果相符合。
3.3 As对香蒲抗氧化性和MDA含量的影响
CAT是一种重要的抗氧化蛋白,其最大成分在细胞的过氧化物体内,作用是将过量的H2O2清除到细胞外[34],以保持细胞内H2O2的平衡,并保护细胞膜[35]。该研究表明,在受到的As胁迫大于等于2.0 mg/L时,不同物候期香蒲叶的CAT活性均有所下降,尤其是生长期和花果期较为明显,CAT下降,细胞膜通透性增加,对As的富集吸收量也增加。
SOD是一种具有清除超氧自由基功能的酶,适度逆境条件可增强其活力,提高植物对胁迫的抗逆能力[36]。研究显示,香蒲叶经As胁迫后,抗氧化性随As胁迫强度而增强,当As的胁迫浓度为10.0 mg/L时,抗氧化性有所下降,这可能是由于该浓度超过了植物机体承载能力,抗氧化性随之降低。
POD活性变化非常明显,当As的胁迫浓度为2.0 mg/L时,POD活性迅速增加,当As的胁迫浓度为10.0 mg/L时,POD依然能保持很高的活性。与前2种酶相比,POD具有很强的抗氧化功能,这一结论与王友保等[37]所做的有关小麦的实验结果有相似之处。POD是一种普遍存在于植物中的具有催化降解毒性化合物作用的氧化还原酶,在环境受到污染时,同工酶水平将发生显著变化。POD活性的提高,是因为As在进入植物体后,植物体会产生对自身不利的过氧化物,POD使用H2O2对这些过氧化物进行氧化分解,因而,在植株中,随着过氧化物酶底物含量的提高,POD活性也随之提高[38]。
MDA是膜脂过氧化产物中的一种,反映了细胞内脂质过氧化反应的水平以及膜系统的损伤程度。该研究结果显示,随香蒲的生长衰老以及As胁迫的增加,MDA含量显著增加,但在生长期,MDA呈先减后增的趋势。当As的胁迫浓度为2.0 mg/L时,MDA含量最低,这是由于植物在正常条件下,活性氧的生成与去除是均衡的,对植物造成的伤害很小,但植物在胁迫条件下会以多种方式产生活性氧,而且植物对活性氧的清除能力下降,导致活性氧大量累积,对植物产生严重的伤害[39]。该研究表明,当As的胁迫浓度大于等于2.0 mg/L后,生长期香蒲叶的氧自由基产生速率逐渐增加,随着时间的延长,香蒲受到的伤害增大,细胞膜的抗氧化性下降。
4 结论
1)在As胁迫下,不同物候期香蒲叶中As含量总体呈增长趋势,且与胁迫浓度呈正相关,随着As浓度的增加,香蒲叶中的As含量较对照组增加显著(P<0.05);不同物候期,香蒲叶对As的吸收能力表现为生长期>花果期>枯黄期,并由富集水平可以看出,香蒲叶对As的富集能力一般。
2)在同一浓度的As胁迫下,不同物候期香蒲叶内各细胞组分的As含量有所差异,但差异不明显。结果表明,细胞壁和细胞液内As含量分布比例之和为63.5%~84.5%,是香蒲叶中主要的储As部位。
3)As对不同物候期香蒲叶中POD活性的影响与As浓度呈正相关,对CAT活性产生低促高抑的作用。在不同物候期,POD和CAT存在互补关系,表明抗氧化酶相互协作是香蒲应对As胁迫的重要策略,SOD和MDA含量随香蒲生长和As浓度增加均显著增加,表明香蒲通过限制As细胞壁的固持和细胞液的区隔化来降低As的毒害。
