甜菜BES1基因家族鉴定与生物信息学分析
2024-01-05刘云赫王宇光
刘云赫,石 晶,耿 贵,王宇光
(黑龙江大学现农业与生态环境学院,哈尔滨 150080)
0 引言
油菜素内酯(BRs)是一种甾醇类激素在植物体内广泛分布,主要存在于花和未成熟的种子中,在植物一系列生理调控以及生物和非生物胁迫反应中起至关重要作用[1,2,3]。BES1是介导油菜素内酯 (BRs) 反应基因表达的关键转录因子[4]。BES1、BZR1及四种BES1/BZR1同源物(BEH1-BEH4)共同组成BES1/BZR1基因家族[5]。研究发现拟南芥中BES1与其同源蛋白BZR1的序列相似度高达88%,分别具有抑制和激活转录的作用[6]。在对BR信号通路成员进行鉴定的过程中,人们发现拟南芥bzr1-1D突变体与BRs缺失突变个体在性状上一致,经染色体分析发现其中包含4个已被注释的开放阅读框,突变发生在拟南芥第1号染色体的体臂底端,基因序列中一个单碱基对的变化导致翻译后的氨基酸由脯氨酸变为亮氨酸,将这个基因命名为BZR1[7]。后续人们又从其抑制突变体bes1-D中分离得到BZR1的高度同源蛋白并命名为BES1[8]。BES1蛋白由三个结构域组成,包括油菜素内酯不敏感磷酸化结构域2(BIN2)、氨基末端结构域和羧基末端结构域[9,10,11],具有识别并结合DNA的能力,BES1转录因子可能通过调控其他转录因子来参与植物生长发育的调节[12]。由于测序技术的不断发展,很多物种的全基因组数据已经被鉴定出来,到目前为止已在拟南芥[5]、高粱[13]、水稻[14]、大豆[15]和白菜[16]等多个植物中鉴定出BES1蛋白,然而对甜菜BES1家族基因的认识显然不足。
甜菜(BetavulgarisL.)二年生草本植物,是制糖的重要原料,可被食用和饲用[17,18]。甜菜制糖的副产物糖蜜还可以用来生产丙酮、甲醇、乙醇、甘油和甜菜碱等化学物质[19]。除此之外,制糖废料滤泥还可以作为肥料中和土壤中的游离酸等物质[20]。提高作物产量和质量是农业生产的两个主要目标,在至关重要的植物甾醇类激素中,BRs参与多种细胞反应通过这些反应可以提高作物产量,在甜菜叶丛快速生长期以及糖贮藏期,BRs可以通过提高甜菜叶绿素含量、叶片的净光合速率和气孔导度最终提高甜菜产量[21]。尽管已经在甜菜中研究了许多种转录因子,但对甜菜中的BES1家族的研究较少,本研究利用生物信息学技术对甜菜BES1基因家族进行全面研究,并从基因结构、蛋白理化性质、进化关系、序列特征、染色体定位和启动子顺式作用元件等方面进行分析,旨在为后续研究甜菜BES1基因家族生物学功能和农业生产中的潜在应用提供借鉴参考,为鉴定和表征其他物种的BES1基因提供了基础。
1 材料方法
1.1 BvBES1基因家族的鉴定
从NCBI 网站(https://ncbi.nlm.nih.gov/)和Pfam网站(http://pfam.xfam.org/)中获取甜菜的蛋白组数据和BES1结构域的隐马尔科夫文件(PF05687),利用HMMER软件筛选出甜菜基因组中潜在的BES1蛋白,将这些筛选结果提交至SMART在线网站(https://smart.embl.de/)以确认保守结构域的具体组成,并进一步验证筛选结果的准确性,最后在 NCBI 网站中提取已鉴定的BvBES1蛋白对应的基因组序列及CDS序列。
1.2 BvBES1基因家族的分析
1.2.1 蛋白理化性质分析
利用在线程序ProtParam(https://web.expasy.org/protparam/)对目标基因的基本理化特性进行分析,对BvBES1蛋白的蛋白长度、分子量及等电点进行预测。利用Wolf PSORT在线网站(https://wolfpsort.hgc.jp/)来预测BvBES1蛋白的亚细胞定位信息,并从NCBI网站中获取染色体位置信息。
1.2.2 系统进化分析
使用MEGA5软件对拟南芥AtBES1、波菜SpBES1、大豆GmBES1、水稻OsBES1及甜菜BvBES1蛋白的序列进行多序列比对,基于比较结果,采用最大简约法(Maximum-parsimony),并将Bootstrap数值设定为1000以此来构建系统发育进化树,然后使用iTOL在线网站(https://itol.embl.de/)来对系统发育进化树进行美化处理。
1.2.3 基因结构及蛋白Motif分析
将BvBES1基因家族的基因组序列和CDS序列输送到GSDS(http://gsds.gao-lab.org/)在线软件中,以此观察BvBES1基因的内含子和外显子结构。利用MEME在线软件(http://alternate.meme-suite.org/tools/meme)对BvBES1蛋白的保守基序进行深入分析,设定10个预测值。接着利用TBtools软件对保守基序进行可视化处理,并据此生成了相应的图片[22]。
1.2.4 基因家族启动子分析
提取BvBES1基因CDS序列上游2000bp的序列片段,并将其上传到PlantCARE在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/h-tml/),以获取上游启动子功能元件的数量及种类信息。
2 结果与分析
2.1 BvBES1家族基因定位及蛋白理化性质
通过比对筛选,共鉴定出7个甜菜BES1基因,根据这些基因在基因组中的位置对其进行排序。分别命名为BvBES1-001-BvBES1-007(表1),其中BvBES1-001定位于甜菜1号染色体;BvBES1-002被定位于甜菜4号染色体;BvBES1-003、BvBES1-004、BvBES1-005三个基因位于甜菜5号染色体上;BvBES1-006和BvBES1-007分别被定位在甜菜6号和8号染色体上(图1)。蛋白理化性质预测结果显示7个蛋白的长度在147.00-703.00 aa之间,BvBES1-003蛋白最短、BvBES1-001蛋白最长,相对分子质量范围为16.25-78.63 kDa、等电点范围为5.62-9.40。Wolf PSORT网址预测的蛋白亚细胞定位结果表明除BvBES1-003和BvBES1-004蛋白位于细胞质以外,其余5个蛋白均位于细胞核内。
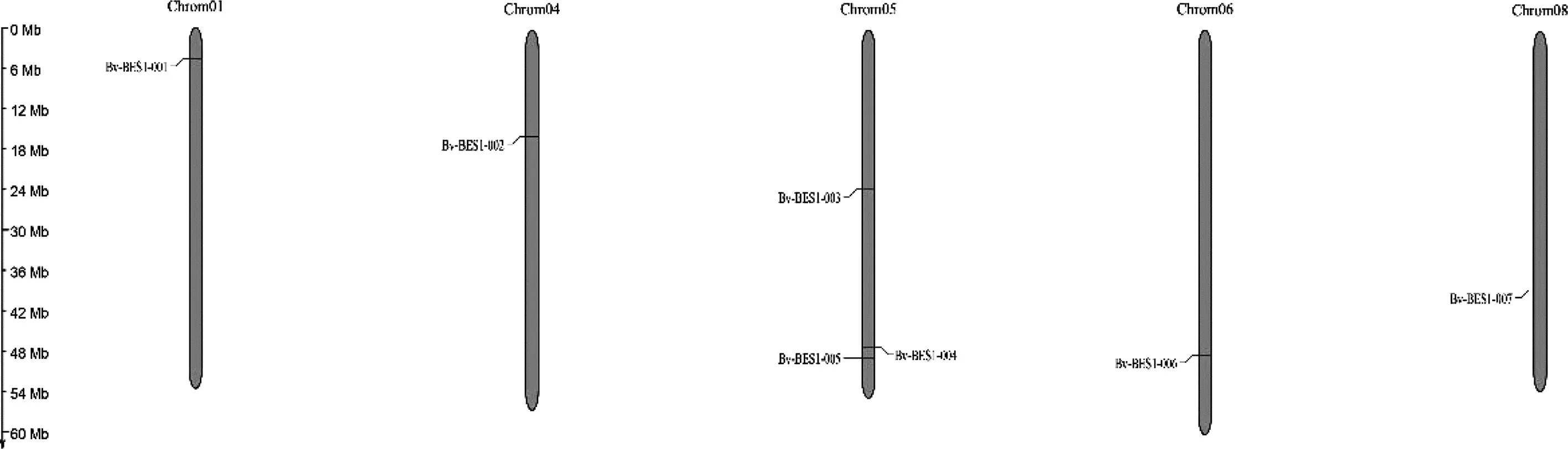
图1 BvBES1基因染色体定位Fig.1 Chromosomal localization of theBvBES1 gene
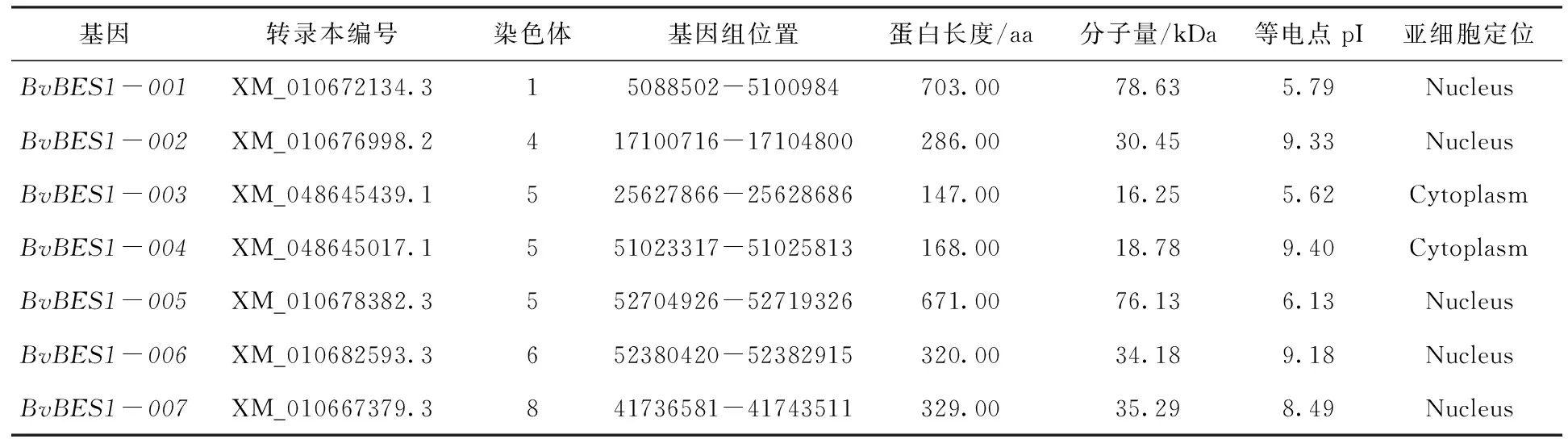
表1 BvBES1基因家族基本信息Tab.1 Basic information about the BvBES1 gene family
2.2 BvBES1蛋白系统发育进化树
基于7个甜菜BvBES1蛋白、6个波菜SpBES1蛋白、6个水稻OsBES1蛋白、11个大豆GmBES1蛋白和8个拟南芥AtBES1蛋白共38个蛋白,利用MEGA5软件构建蛋白系统发育进化树。如图2所示,参照拟南芥AtBES1蛋白家族分类将38个BES1蛋白分为5组,其中A组共7个成员包括2个拟南芥AtBES1蛋白、B组6个成员BvBES1-006蛋白和2个拟南芥AtBES1蛋白归于这组,C组最大共15个成员包含2个拟南芥AtBES1蛋白和BvBES1-002、BvBES1-007蛋白。D组同样包含7个成员2个拟南芥AtBES1蛋白和2个甜菜BvBES1-001、BvBES1-005蛋白,最后最小的E组只有3个成员BvBES1-003和BvBES1-004及1个波菜SpBES1蛋白。一个分支中包含多个物种,而同一物种的蛋白分散在不同分支中,说明BES1蛋白具有一定的多样性,推测BES1蛋白的分化过程发生在菠菜、水稻、大豆、拟南芥和甜菜的进化之前。

图2 BES1家族蛋白系统发育进化树Fig.2 Phylogenetic evolutionary tree of BES1 family proteins
2.3 BvBES1基因结构和蛋白Motif分析
由基因结构分析(图3B)可知,BvBES1家族7个基因结构差异较大,结合蛋白系统发育进化树结果,发现BvBES1-001和BvBES1-005、BvBES1-002和BvBES1-007进化距离较近其基因结构除长度外也基本相同。而进化距离相对较远的蛋白其基因结构也有着明显的差异,如BvBES1-003和BvBES1-006。说明BvBES1家族具有一定的特异性。为了解BES1蛋白结构的多样性,采用MEME分析预测甜菜BES1家族蛋白的保守基序结果如图3B,其中motif1(图4)在全部7个基因中均存在,表明其具有相似的功能,推测为BvBES1家族的保守序列(图3C)。
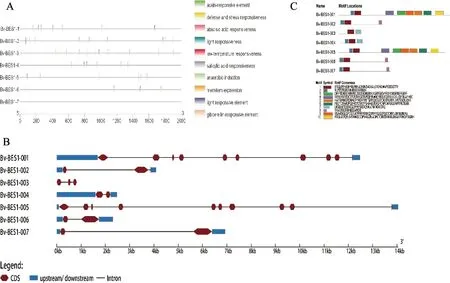
图3 BvBES1基因家族基因结构图A 启动子顺式元件分析图;B BvBES1蛋白保守基序分析图;CBvBES1基因结构图Fig.3 Gene structure of theBvBES1 gene familyA promoter cis-element analysis; B BvBES1 protein conserved motif analysis; C BvBES1 gene structure diagram

图4 蛋白保守Motif1序列图Fig.4 Sequence map of the protein conserved Motif1
2.4 BvBES1顺式元件分析
使用PlantCARE分析了翻译起始位点上游约2000bp的序列预测结果如图3A。总共发现了 66个顺式作用元件,其中与激素响应相关的元件数量最多共25个,其次是胁迫响应元件23个,而光响应元件最少只有3个,说明BvBES1基因家族参与激素响应、胁迫响应及光响应等生命过程。每个基因不仅拥有不同数量的顺式作用元件,而且在元件的具体类型上也存在的差异。在对BvBES1家族成员启动子中的激素响应元件类型进行更深入的分析后共识别出赤霉素、水杨酸、茉莉酸和脱落酸四种不同类型的激素响应元件。其中,赤霉素主要负责调节和促进植株生长,而其他三种则主要负责促进植株成熟。
3 讨论
BRs作为一种近几十年来发现的植物激素,被称为继生长素、细胞分裂素、赤霉素、脱落酸和乙烯之后的第六种激素,BRs密切参与植物生长和各种应激反应[23]。BES1转录因子对BR信号的调控过程已被证明与植物胁迫响应有关,如水分胁迫、热胁迫、冷胁迫等,BES1还在植物生长和发育的多个方面起着至关重要的作用[24]。本研究利用生物信息学方法共鉴定出7个甜菜BES1基因。为更好地了解不同物种之间的进化联系将拟南芥、菠菜、水稻和大豆蛋白加入到系统进化树中,38个BES1蛋白共分5组,7个甜菜BES1蛋白分别划分在B、C、D、E四组中,这与前人研究的结果一致[25]。结果显示BES1蛋白在不同物种间的系统进化关系较近,而同一物种中的进化关系相对较远,这表明BES1蛋白本身具有一定的多样性,该蛋白的分化过程远在菠菜、水稻、大豆、拟南芥和甜菜的进化之前,BES1基因在拟南芥、波菜、水稻、大豆和甜菜可能具有不同的作用。
通过分析甜菜BES1家族的基因结构、序列特征、染色体定位、启动子顺式作用元件等。发现甜菜BES1蛋白都包含典型的BES1_N结构域具有高度特异性与系统发育进化树结果一致。同时不同基因拥有不同数量不同种类的顺式作用元件,在多种胁迫及激素反应过程中具有潜在的生物学作用,推断不同BES1基因在甜菜中具有不同的作用。前人基于全基因组序列,分别在拟南芥、波菜、水稻和大豆中鉴定出8、6、6和11个BES1基因,相较下甜菜BES1基因家族包含的成员要少得多。小麦中共鉴定出23个TaBES1家族成员,研究发现TaBES1-3B2、TaBES1-3D2和TaBES1-6D可能是干旱胁迫相关基因。此外,TaBES1-3B2和TaBES1-3D2还可能在低温诱导的雄性不育信号通路中发挥作用[26]。在黄瓜基因组中鉴定出6个CsBES1基因家族成员,根据系统进化树将其划分为3个分支,相比较下甜菜BES1家族成员数量与之相近但分类更为丰富。黄瓜CsBES1基因对激素诱导有反应、对大多数胁迫表现出显著的响应、CsBZR6在各种黄瓜组织中高表达,可能是调控黄瓜生长发育的重要基因[27]。BES1在不同葡萄器官中的表达也存在差异,在盐胁迫和热胁迫下,BES1在不同葡萄品种中表达存在差异,葡萄VvBES1的表达也随着盐胁迫处理时间的延长而变化[28],在甜菜BES1基因中也发现了响应胁迫的顺式作用元件,推测BES1基因在甜菜多种胁迫中也扮演重要的角色。本研究结果为揭示该家族在甜菜BRs信号通路中的功能和调控机制奠定了基础,同时也为该家族在其他物种中的研究提供了建议。
