利用分子标记技术鉴定甜菜单胚不育系的混杂程度
2024-01-05陈姝源吴则东
陈姝源,吴则东
(黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
甜菜是世界上重要的糖料作物之一,也是我国的第二大糖料作物[1]。我国每年甜菜糖的产量大约在150万吨左右,2021年我国甜菜的播种面积为26.2万公顷,2021年我国甜菜产量为785.09万吨。糖甜菜为异花授粉、二年生作物, 育种方法目前主要为三系育种法, 即不育系、保持系和授粉系[2]。尽管甜菜种植面积和食糖产量均不足甘蔗的1/5,但由于甜菜种植简便、机械化程度高、成本低、效益显著,使得近几年甜菜种植面积在稳步提高[3]。目前世界上发达国家的甜菜品种均为单胚品种,国外的甜菜单胚品种均是以单胚细胞质二元雄性不育系为母本,多胚授粉系为父本杂交而成,而国内仅有少数一些育种单位育成的甜菜品种为单交种,其它育种单位也均是采用三交种,因此拥有单胚细胞质雄性不育系和保持系数量的多少就决定了能够配制多少杂交组合或者多少二元不育系。植物雄性不育是作物杂种优势利用的重要途径,并在生产上取得了很大的成功,如我国杂交水稻种植面积占水稻总面积的46%~55%,其产量比常规品种增产20%~30%,同样在甜菜育种上杂种优势利用也很广泛[4]。甜菜单胚不育系和保持系在繁殖的过程中一般都是成对种植,在收获过程中由于人为的原因很容易造成不育系中混杂有保持系或者保持系中混杂有不育系。通过传统的形态学鉴定,无法在早期分辨出甜菜自交系的育性。
分子标记在狭义上是指DNA标记,即DNA水平遗传多态性的直接反映, 表现为核苷酸序列的任何差异[5]。分子标记在20世纪80年代就已经开始应用,它是继形态学标记、细胞标记和生化标记技术之后发展起来的一种遗传标记[6]。近几十年以来,已经有SNP[7]、EST[8]以及ISSR[9]等多种分子标记技术被运用于甜菜遗传图谱的构建和遗传多样性分析中。近年来,随着分子标记技术的快速发展,利用分子标记技术对于甜菜细胞质雄性不育系和保持系的快速鉴定已经成为可能。NISHIZAWA等[10]发现在甜菜线粒体基因组中的数目可变的串联重复序列(VNTR)具有多态性和 4 个不相关的串联重复序列位点(TR1、TR2 、TR3和TR4),而其中TR1串联重复序列的多态性最高,串联重复序列的数量为 2~13 个不等。可以利用作用于甜菜线粒体VNTR位点进行甜菜细胞质的育性鉴定。 CHENG等[11]通过对中国甜菜种质资源的研究发现,不同细胞质育性类型的小卫星序列的拷贝数具有多态性,其中细胞质为 OWEN[12]不育型的 TR1片 段有4个拷贝,细胞质为保持系型的拷贝数为 13个。王有昭[13]也用此方法对甜菜主要品系进行VNTR分子检测时,在叶用甜菜中首次发现了一株特异类型的细胞质,其TR1片段拷贝数为10个。其余试验结果与程大友[14]的结果一致,经过测序发现,其 TR1不育系扩增条带大小在500 bp以下,保持系扩增条带大小在750 bp左右。以这两个作为对照材料进行PCR扩增,可以通过对比条带带型大小的方式来判断甜菜细胞质类型。
细胞质雄性不育系是甜菜杂交制种的基础[15]。由于成对的甜菜单胚不育系和保持系细胞核没有差别,只在细胞质上有差异,并且在育种过程中,作为母本的都是单胚不育系或者二元单胚不育系,因此不育系中混有保持系比保持系中混有不育系对育种的影响更大。因此本研究拟对黑龙江以及新疆共三家育种单位的24份甜菜单胚不育系中是否混有保持系进行分析,了解我国目前甜菜单胚不育系的纯度,对于指导将来甜菜育种具有重要意义。
1 材料与方法
1.1 试验材料
1.1.1 供试的甜菜单胚不育系
试验中所用到的甜菜单胚不育系中有12份来自新疆石河子农业科学院甜菜研究所,10份来自新疆农业科学院经济作物研究所,有两份新改良的单胚不育系来自于黑龙江大学现代农业与生态环境学院。

表1 供试甜菜单胚不育系名称及来源Tab.1 Test varieties and sources
1.2 试验方法
1.2.1 甜菜基因组DNA的提取
目前甜菜DNA提取通常使用改良的CTAB法。CTAB (十六烷基三甲基溴化铵简称CTAB)是一种阳离子去污剂,可溶解细胞膜 ,它能与核酸形成复合物,在高盐溶液中 (0.7 M NaCl) 是可溶的,当降低溶液盐的浓度到一定程度 (0.3 mol/L NaCI) 时从溶液中沉淀,通过离心就可将 CTAB 与核酸的复合物同蛋白、多糖类物质分开,然后将 CTAB 与核酸的复合物沉淀溶解于高盐溶液中,再加入乙醇使核酸沉淀 ,CTAB 能溶解于乙醇中。本试验采用改良CTAB法提取甜菜基因组的DNA[16]。
由于个别不育系发芽率较低,编号6取了12份个体,编号7取了17份个体,编号8取了9份个体,编号9取了11份个体,编号11取了17份个体,编号19取了10份个体,编号20、21取了20份个体,其余编号每份提取24个个体的基因组DNA,用来代表群体。
1.2.2 DNA分子标记
本研究使用的分子标记为引物TR1, 用于识别细胞质的类型,其序列详见表2[17]。

表2 TR1引物序列Tab.2 Primers for TR 1
1.2.3 PCR反应体系与程序
PCR反应体系为10 μL:包括5 μL 2×Taq PCR Master Mix,0.2 μL 上游引物(0.5 μmol/L),0.2 μL下游引物 (0.5 μmol/L),1 μL DNA (100 ng/μL) ,3.6 μL dd H2O[18]。
PCR反应程序为:95℃ 3 min;94℃ 25 s,60℃ 25 s,72℃ 3 min,28个循环;72℃ 5 min。
1.2.4 PCR产物检测
PCR产物经1%琼脂糖凝胶电泳分离,在含有TAE的缓冲液中,130 V、30 min。电泳结束后,凝胶用Gelred荧光核酸染料染色,并通过凝胶成像系统观察[19]。
2 结果与分析
2.1 细胞质育性分子标记鉴定
试验共检测了24个试验材料的302个植株样本,经TR1引物分子标记鉴定检测后,共检测出238个结果。在这238个结果中,共检测出750 bp条带的细胞质类型8份,材料分别为23、24;其余22个材料检测的均为略低于500 bp的条带。23、24检测到的条带分别有750 bp和500 bp,即750 bp为N型细胞质,500 bp为S型细胞质。

图1 D084 经TR1引物PCR扩增后的检测结果Fig.1 Results of D084 detection after PCR amplification with TR 1 primers
2.2 甜菜单胚不育系的混杂程度分析
本次试验鉴定的24个甜菜单胚不育系中混有保持系的株数及混杂率详见表3。从表中可以看出,除了两份改良的甜菜单胚不育系外,其余一直在使用的单胚不育系均没有混杂的现象。
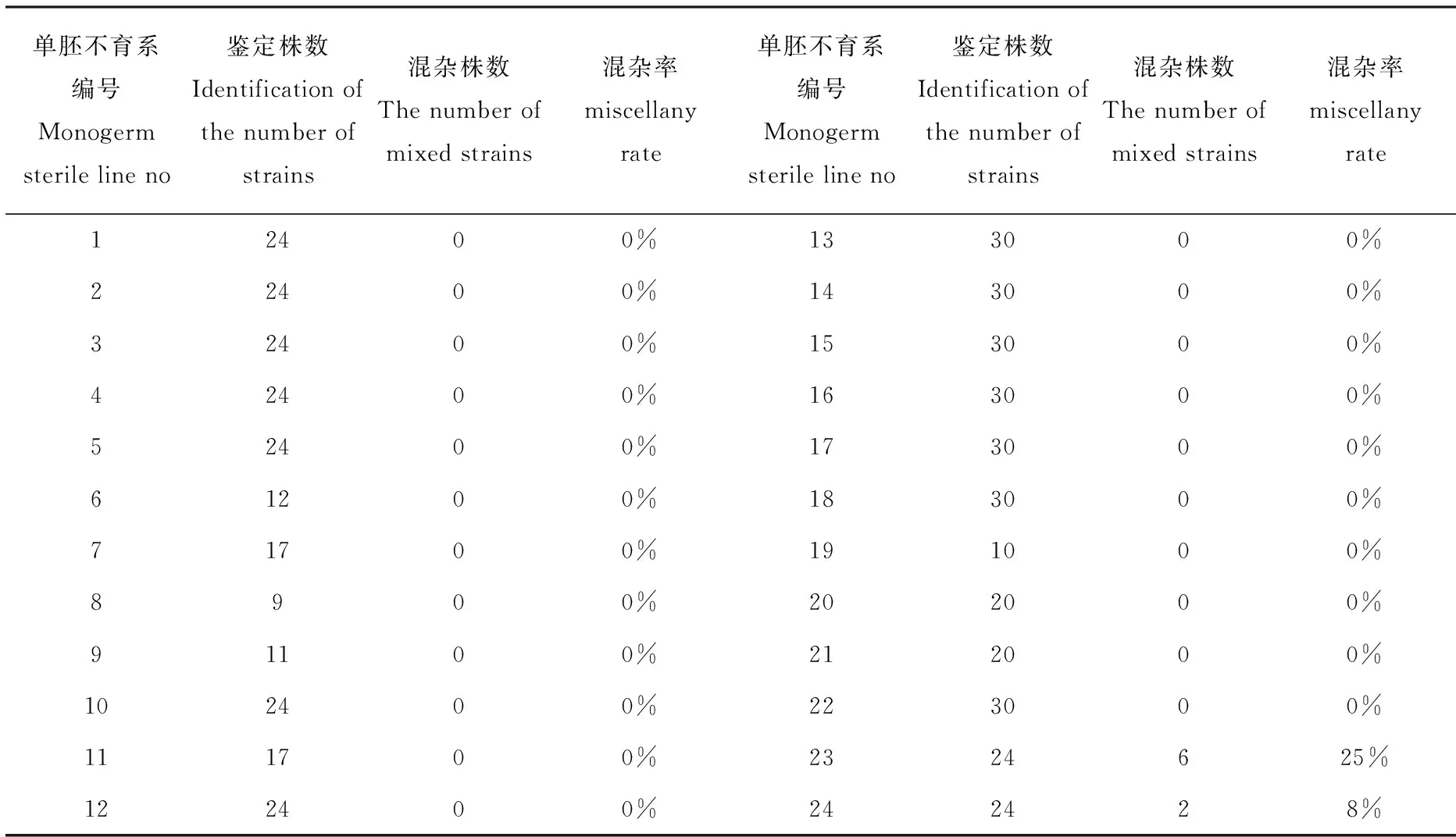
表3 甜菜单胚不育系混杂株数及其混杂率Tab.3 Number of confounding strains and their confounding rates
3 结论
实验结果表明,供试的24份甜菜单胚不育系材料中,有22份经常使用的甜菜单胚不育系材料的不育程度达到100%,可以直接用于甜菜育种中;另外两份由黑龙江大学新改良的单胚不育系出现了混杂的现象。
本研究对国内三家育种机构现有的部分甜菜单胚不育系材料进行了不育系中是否混有保持系的鉴定,研究结果说明这些年来国内对不育系和保持系的隔离采种效果明显,抽样调查结果表明,已经应用的不育系中没有混进保持系的现象。同时也发现了新改良的单胚不育系中仍存在混杂现象,说明在利用多胚改良单胚的过程中,成系之前一定要认真的对不育系和保持系的育性进行认真的调查,在该不育系材料还没有大量地应用于育种实践之前,应及时将混杂株剔除,防止在授粉过程中由于不育系中混有保持系形成自交,导致杂交种不纯的情况发生;同时也可以避免混杂的保持系给其它不育系授粉,严重影响杂交种育种进程。
