TM6SF1基因在肺腺癌细胞中的作用*
2024-01-04刘婷隽
刘婷隽
徐州医科大学实验动物中心,江苏 徐州 221004
肺癌的发生和发展是一个多步骤的过程。它们是由异常基因变化和蛋白质表达引起的肿瘤,导致细胞表型转化和进展[1-3]。非小细胞肺癌(NSCLC)占肺癌总发生率的80%以上,而肺腺癌(LUAD)是原发性肺癌的主要亚类(约85%)[4]。LUAD 潜伏期长,早期症状轻,恶性程度高。通常情况下,LUAD 患者在诊断时已进入晚期,失去治疗机会[5-6]。随着各种靶向药物的发展及其在LUAD 中的应用,LUAD 患者的5 年生存率有所提高,尤其是程序性细胞死亡蛋白1/程序性细胞死亡蛋白配体1(PD-1/PD-L1)等免疫治疗药物的应用[7]。因此,识别新的生物标志物来预测免疫治疗的疗效是非常必要的。
溶酶体是一种高度酸性的膜结合细胞器,参与细胞内和细胞外大分子的转换[8-9]。溶酶体中含有50 多种酸性水解酶,用于细胞成分消化。为了防止这些水解酶和质子的泄漏,从而破坏周围的细胞溶质环境(细胞溶质酸化和蛋白水解),导致细胞死亡[10-11]。因此,细胞需要具有各种高度糖基化的整体蛋白的溶酶体膜来承受管腔酸性微环境。此外,溶酶体膜是与靶细胞器(如内体和自噬体)相互作用的重要桥梁,有效的促进细胞内蛋白质运输[11]。
TM6SF1 位于人类15q24-q26 染色体和小鼠7 号染色体,转录本大小为1.4 kb,编码370个氨基酸的蛋白质,具有6个功能未知的跨膜结构域,是一种广泛表达的溶酶体跨膜蛋白[12]。有研究[12-13]利用荧光细胞成像技术,观察到TM6SF1囊泡与溶酶体膜的一体化融合过程。已被证明在人脑、肺、肝、肾脏、脾脏、睾丸和外周血白细胞中表达。目前研究结果提示,TM6SF1异常高甲基化可能与某些恶性肿瘤的发生发展密切相关。但其在肺腺癌中的作用仍不清楚。
本研究通过GEPIA 数据库分析TM6SF1 蛋白在肺腺癌中的表达情况,同时通过细胞实验观察过表达TM6SF1 后对A549细胞增殖、迁移的影响,进而来探讨TM6SF1基因在判断肺腺癌预后和靶向治疗中应用的可行性。
1 实验与方法
1.1 细胞培养
A549、H1299、H1975、PC9、HCC78 和HBE 细胞生长于含10%胎牛血清的DMEM 培养液中,并加入1%的青链霉素,在37 ℃,5%CO2的饱和湿度下培养。分为空白对照组和实验组,当细胞处于对数生长期时,即可以用于实验。
1.2 GEPIA数据库分析
登录GEPIA 数据库(http://gepia.cancer-pku.cn/),利用General 和Survival Analysis 模块,在线分析TM6SF1 基因在肺癌及正常组织中的表达情况及生存曲线。
1.3 细胞增殖活性检测
将对数生长期的A549 细胞以1× 105个/孔,接种于96孔板。细胞孵箱中培养过夜,每组设置3 个复孔。每孔加入20 μL CCK8,继续培养1~2 h。酶标仪测定各孔OD 值(450 nm),计算分析各组细胞增殖情况。
1.4 过表达TM6SF1细胞株的构建
NCBI网站检索并设计TM6SF1 引物序列,用南京生工公司合成过表达载体513B,BamHI/XbaI 酶切,构建513B-LV-TM6SF1过表达质粒。
1.5 慢病毒包装
使用促转染试剂将构建好的重组质粒、辅助质粒与293T 细胞共转染6 h,更换新鲜培养基继续培养48 h,收集细胞上清液。
1.6 慢病毒感染
将处于对数生长期的A549 细胞以105个/mL 接种于6孔板,按照慢病毒感染复数=20 加入病毒并添加1∶1 500的聚凝胺进行感染,以获取稳定过表达TM6SF1的A549细胞株。12 h 后换新鲜培养基。48 h 后提取蛋白,Western blot检测TM6SF1的过表达效果。
1.7 RNA提取和RT-PCR分析
A549 细胞胰酶消化细胞,PBS 清洗一遍。使用TRIzol试剂从细胞中提取总RNA,并反向转录为cDNA。对于RT-PCR,使用逆转录试剂盒将RNA 逆转录为cDNA。使用SYBR Green I Master 在LightCycler 480 中进行实时定量PCR。TM6SF1 引物序列:正义:5'-CGGCCCAGCATGATTCCT-3',反义:5'-TCCCGGGGTGGTTTTCTTTT-3',扩增产物为103 bp。GAPDH 引物序列:正义5'-TGCACCACCAACTGCT-TAGC-3', 反义5'-GGCATGGACTGTGGTCATGAG-3',扩增产物为87 bp。
1.8 细胞划痕实验
将对数生长期的A549细胞以5× 105个/孔,接种于6孔板,细胞孵箱中培养过夜。第二天用10 μL 枪头在培养皿中以“十”字形划线。用PBS 洗去划下的细胞,加入无血清培养基,同时拍照0 h 照片。继续放入细胞培养孵箱中用不含血清的培养基培养24 h,拍照并分析。
1.9 Transwell实验
取处于对数生长期的细胞,实验前1 d 使用无血清培养基在培养箱中饥饿培养24 h。取出Transwell小室,放入24 孔板中,小室及孔中加入500 μL 37 ℃预热的无血清培养基,置于CO2培养箱2 h,小心吸去小室中的培养液。胰酶消化细胞,然后加入完全培养基吹打为单细胞悬液,1 000 rpm 离心5 min 离心沉淀细胞,吸取上清,PBS 溶液洗涤2 次去除完全培养基,离心沉淀细胞,将细胞沉淀重悬于无血清的培养基中,调整好细胞浓度为1~5× 105/mL,取100 μL 细胞悬液加入Transwell 小室的上部,下室加入600 μL 完全培养基,细胞孵箱中培养24 h。取出小室,PBS 清洗2 次,上下室分别加入600 μL 75%乙醇固定30 min;吸除乙醇, PBS 清洗2 次,0.1%结晶紫染色30 min,双蒸水清洗3 次后,自然晾干,于显微镜镜下随机选取10 个视野拍照并计数细胞。
1.10 Western blot
A549 细胞经胰酶消化,PBS 清洗一遍,并用RIPA 裂解缓冲液(在冰上裂解30 min。使用BCA方法检测蛋白质浓度。将等量的蛋白质装载到凝胶上进行分离,转移到Hybond NC 膜上。在室温下用5%脱脂乳封闭膜1 h,并在4 °C 下与一级抗体孵育过夜。一级抗体如下:第二天,清洗膜,并在室温下与适当的辣根过氧化物酶(HRP)结合二级抗体孵育1 h。使用化学发光检测系统检测印迹。
1.11 统计学方法
数据采用SPSS 22.0 软件通过One-way ANOVA 多及t检验进行统计分析。以P<0.05 为差义有统计学意义(*P<0.05,**P<0.01,***P<0.001)。
2 结果
2.1 GEPIA数据库分析结果
通过GEPIA 数据库分析得知,与正常组织相比,TM6SF1 在肺腺癌中的表达降低(*P<0.05)(图1A);且TM6SF1 高表达肺腺癌患者生存时间明显长于TM6SF1 低表达患者(**P<0.001)(图1B)。另外,TM6SF1 与细胞增殖相关的核抗原Ki-67 具有负相关性(***P<0.001)(图1C)。这提示TM6SF1 在肺腺癌中可能具有抑制肿瘤的作用。
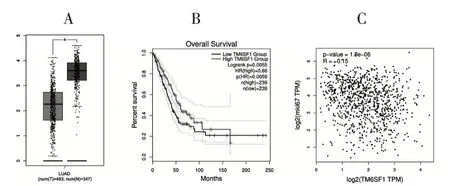
图1 GEPIA数据库分析结果
2.2 TM6SF1 基因在肺腺癌细胞系中的表达及过表达TM6SF1细胞系的构建
用WB 及qRT-RCR 分析5 株人肺腺癌细胞系中TM6SF1基因的表达情况。从WB结果可以看出,与正常支气管上皮细胞HBE 相比,TM6SF1 蛋白在人肺腺癌A549、H1299、H1975、PC9 细胞中表达下调,而在HCC78 中不明显(图2A)。qRT-RCR 结果显示,除H1975 细胞以外,TM6SF1 基因在其他4 株肺腺癌细胞中的表达均下调(图2A)。我们取TM6SF1 表达较低的A549 细胞系进行后续实验。
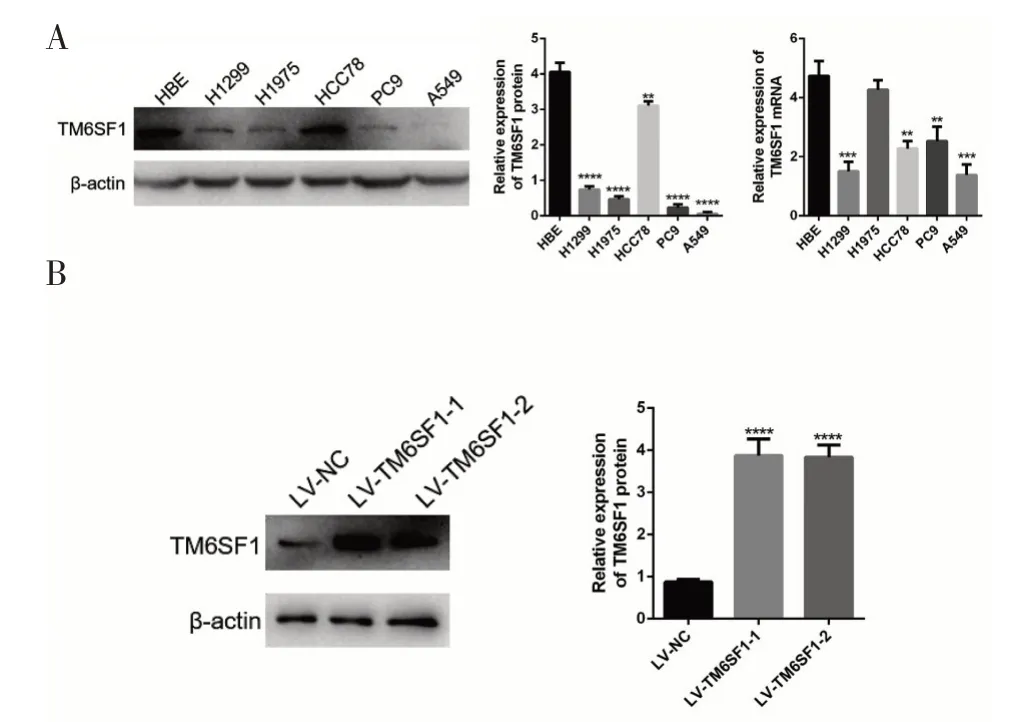
图2 TM6SF1在肺腺癌细胞系中的表达及过表达细胞株的鉴定
为了研究TM6SF1 在肺腺癌发生、发展中的生物学作用,研究在A549 细胞中转染目的基因TM6SF1。将转染成功的细胞裂解,提取细胞总蛋白,WB 结果显示,与转染LV-NC 相比, 转染LV-TM6SF1-1 和LV-TM6SF1-2 后的A549 细胞中TM6SF1 表达明显增加(图2B),因此该细胞株即为稳定表达TM6SF1的A549细胞株。
2.3 TM6SF1基因对A549细胞增殖的影响
为了进一步研究TM6SF1对A549细胞增殖的影响,研究者进行了细胞增殖实验。CCK8实验结果见图3。在培养48 h 后,过表达TM6SF1 的A549 细胞与对照组相比,细胞数量明显受到抑制,说明TM6SF1 抑制A549 细胞的增殖。

图3 TM6SF1对A549细胞增殖的影响
2.4 细胞划痕及Transwell实验结果
为了阐述TM6SF1 在肺癌细胞侵袭和转移过程中的作用,研究采用划痕实验和Transwell 小室来检测TM6SF1 对侵袭和转移的影响。实验结果显示,A549 细胞中TM6SF1的表达上调后,肺癌细胞的侵袭和转移能力减弱(图4A)。在划痕实验中,过表达TM6SF1 后,A549 细胞的伤口愈合能力减弱。(图4B)。这表明TM6SF1 在肺癌中起到抑制细胞转移的作用。
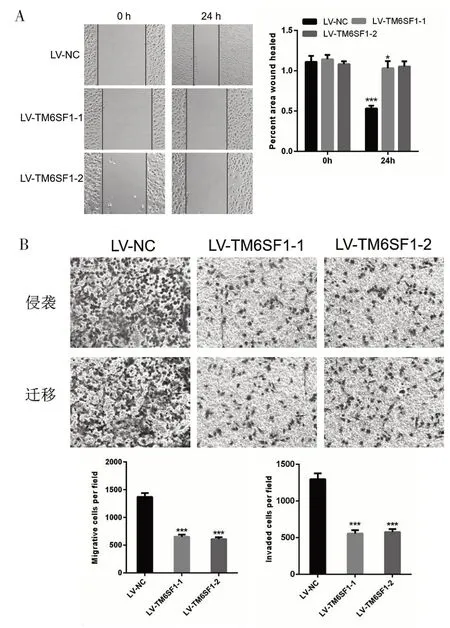
图4 TM6SF1对A549细胞的侵袭和迁移的影响
2.5 Westren blot检测PI3K/Akt通路相关蛋白
PI3K/Akt 通路参与调控体内细胞增殖、凋亡和分化等多种生物学功能,是目前NSCLC 最常见的调控途径之一[14]。为了进一步研究TM6SF1 是否参与调控PI3K/Akt 通路,采用WB 检测PI3K/Akt 通路相关蛋白的表达。实验结果,见图5,过表达TM6SF1 后, p-PI3K/PI3K 和p-Akt/Akt明显降低。

图5 TM6SF1对PI3K/Akt通路中Akt、pAkt、PI3K、p-PI3K表达量的影响
3 讨论
近年来肺癌发病率和死亡率均呈上升趋势,位于我国恶性肿瘤死亡率之首,备受临床及流行病学研究者的关注。而LUAD 是肺癌中常见的病理类型,它起源于小气道上皮中分泌粘液的II 型肺泡细胞。转移和侵袭率高是LUAD 最显著的特征之一,尽管在手术切除、化学疗法和放射疗法方面已取得一定进展,但其5 年生存率仍较低[15],抗肿瘤药物耐药是导致肿瘤治疗失败的重要原因之一。如何有效的预防和抑制肺腺癌转移是肺癌有效治疗的关键因素。
TM6SF1 是六跨膜蛋白超家族的重要成员之一,其表达调控在很大程度上是未知的,但已证实该基因是miR-155 和miR-K12-11 的靶点[16]。此外,TM6SF1 在肝癌和肾癌中发生过甲基化[13,17],这意味着TM6SF1 的表达以表观遗传方式受到高度调节。研究[18]发现,其异常高甲基化可能与癌症的发生发展有一定的相关性。但其在肺腺癌中的作用还没有报道。
在本实验中,通过GSPIA 数据库分析得知TM6SF1 在肺腺癌中的表达低于正常组织,且TM6SF1 与细胞增殖相关抗原Ki-67 具有负相关性。高表达TM6SF1 的肺腺癌患者具有更长的生存期。同时,在4 株肺腺癌细胞中证实,TM6SF1 低表达。在此基础上,本研究构建过表达TM6SF1的A549细胞系,并发现过表达TM6SF1能明显促进肺腺癌细胞增殖、迁移和侵袭,但具体是通过何种作用机制还需要进一步研究。另外,本研究只是通过GSPIA 数据库分析得知TM6SF1 在肺腺癌中的表达低于正常组织,但在临床样本中的实际表达情况还不清楚,接下来研究者将分析临床样本中TM6SF1 的表达与癌症分化程度、患者生存情况的相关性。在多数肿瘤中,PI3K/Akt 通路处于持续激活状态,抑制PI3K/Akt通路可抑制肿瘤细胞的增殖、侵袭和迁移[19]。TM6SF1 是否调节PI3K/Akt 通路影响细胞增殖尚不明确。本研究发现,过表达TM6SF1 可下调PI3K/Akt 通路相关激酶的表达,下游信号通路受到抑制。溶酶体跨膜蛋白和自噬有着密切的关系。小鼠或细胞中一些溶酶体蛋白LAMP1、LAMP2 的缺失可引起自噬的发生,而LAPTM4B则可以抑制自噬。那么,TM6SF1 是否参与调节自噬,若参与自噬,其具体的机制是什么有待于进一步的研究。
综上所述,本研究结果为明确TM6SF1 在肺腺癌中的作用机制提供了实验基础,TM6SF1 可能作为一种新的抑癌基因,为肺癌的诊断治疗提供新的证据。
