盐诱导激酶3基因表达在人类肿瘤中的预后与免疫浸润相关性分析
2024-01-04陈雅明苏慧琳曾元宁王秋红
陈雅明,苏慧琳,曾元宁,,王秋红
1.黑龙江中医药大学教育部北药基础与应用研究重点实验室·黑龙江省中药及天然药物药效物质基础研究重点实验室,黑龙江 哈尔滨 150040;2.广东药科大学中药学院·广东省中药饮片规范化炮制工程技术研究中心,广东 广州 510006
盐诱导激酶3(SIK3)是盐诱导激酶家族成员之一,属于5’-AMP 活化蛋白激酶(AMPK)相关激酶家族[1]。SIK3基因对调节肝脏糖异生[2]、调控细胞周期以及对肿瘤细胞[3]的生长有重要作用,在人体中各部位均有表达。有研究[4]表明,SIK3 蛋白在卵巢癌中和三阴性乳腺癌过度表达,能促进乳腺癌细胞的G1/S细胞周期的进程以及特异性趋化因子CXCR4 的释放以诱导乳腺癌细胞增殖,增强mTOR 介导小鼠的有氧糖酵解[5]。此外,SIK3 基因的表达能抑制肿瘤细胞的生长[6],能促进急性髓系白血病的发生[7]。在晚期浆液性卵巢癌中,SIK3在低表达患者的总生存期(OS)和无进展生存期(PFS)低于高表达患者,敲除部分SIK3 基因的卵巢癌细胞能增加对紫杉醇加顺铂治疗的化学抗性[8]。
SIK3基因对癌症的发生和发展发挥着重要作用,可能是癌症治疗和预后生物标志物的潜在重要靶点。基于已有研究中癌症发生发展与SIK3基因之间的联系,本研究对SIK3基因表达在人类肿瘤中进行了泛癌化分析,使用TCGA数据库和GEO 数据库等探究SIK3 基因在肿瘤中的基因表达、生存状态以及蛋白质磷酸化位点,并进行了SIK3基因与肿瘤相关成纤维细胞浸润相关性分析,以研究SIK3基因在不同癌症中的发病机制和临床预后中的作用。
1 材料与方法
1.1 SIK3基因泛癌分析
分别在TIMER2(http://timer.cistrome.org/)和GEPIA2(http://gepia2.cancer-pku.cn/#index) 中点击“检索”“基因”并输入“SIK3”,检索出SIK3 基因在肿瘤与正常组织之间的基因表达差异。
1.2 SIK3蛋白泛癌分析
在 Ualcan (http://ualcan.path.uab.edu/index.html) 和GEPIA2 的“Expression Analysis”模块中的“Expression DIY”以获得在TCGA 肿瘤组织不同病理阶段(Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期)中SIK3 基因型表达的小提取图(P≤0.01)。
1.3 SIK3蛋白质磷酸化分析
在Ualcan 数据库中输入“SIK3”检索,分析在原发性肿瘤和正常组织中SIK3细胞磷酸化位点,包括乳腺癌、卵巢癌、结肠腺癌、肾透明细胞癌、子宫内膜癌、肺腺癌。
1.4 泛癌分析SIK3基因的预后情况
利用在线工具GEPIA2 的“Survival Analysis”模块中输入“SIK3”以获取“Overall Survival”和“Disease Free Survival”生存曲线图。通过Cutoff-high (50%) and cutoff-low (50%) values作为高表达和低表达组的阈值。
1.5 SIK3基因遗传变异分析
登录cBioPortal 网站(https://www.cbioportal.org/),选择“Query”中的“TCGAPanCencer Atlas Studies”,并输入“SIK3”用于检索SIK3 基因变异特征。变异的结果在“Cancer Types Summary”对所有TCGA 肿瘤的频率、突变类型和CNA(拷贝数改变)进行展示。
1.6 SIK3与肿瘤相关成纤维细胞浸润相关性分析
使用TIMER2数据库的“Immune”模块来探索SIK3表达与所有TCGA 肿瘤免疫浸润之间的关联,免疫细胞选择CD8+T 细胞和肿瘤相关成纤维细胞。根据CIBERSORT、CIBERSORT-ABS、 QUANTISEQ、 XCELL、 MCPCOUNTER 和EPIC 算法估计免疫浸润。根据P 值与偏微分方程相关性(cor)值调整纯度后的获得数据,以热图和散点图展示。
1.7 统计学方法
使用TIMER 数据库和GTEx 数据库中下载的正常组织和肿瘤组织中的SIK3 mRNA 表达数据,进行Kaplan-Meier生存曲线分析,并采用Log-rank 检验。使用SPSS 16.0 软件进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 SIK3基因在不同肿瘤中的表达
使用TIMER 数据库和GTEx 数据库联合分析正常组织和肿瘤样本中SIK3 mRNA 的表达水平。如图1、图2 所示,相比于正常组织,SIK3 基因在13 种癌症中低表达,包括膀胱尿路上皮癌(BLCA)、乳腺癌(BRCA)、结肠腺癌(COAD)、多形性胶质母细胞瘤(GBM)、肾透明细胞癌(KIRC)、 肾乳头状细胞癌(KIRP)、 肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、前列腺癌(PRAD)、直肠腺癌(READ)、甲状腺癌(THCA)、子宫内膜癌(UCEC)、睾丸生殖细胞瘤(TGCT),差异均有统计学意义(P<0.05)。

图1 TIMER数据库中SIK3基因在不同癌症中的表达情况

图2 GTEx数据库中SIK3基因在不同癌症中的表达情况
2.2 SIK3蛋白在不同肿瘤中的表达
与正常组织相比,SIK3 蛋白在BRCA、KIRC、LUAD中为低表达,见图3。使用HEPIA2A 数据库后在病理分期图中显示,SIK3 表达与癌症病理的不同时期有显著差异,包括在BLCA、BRCA、KIRC、胰腺癌(PAAD)、THCA,见图4。

图3 SIK蛋白在不同癌症中的表达情况
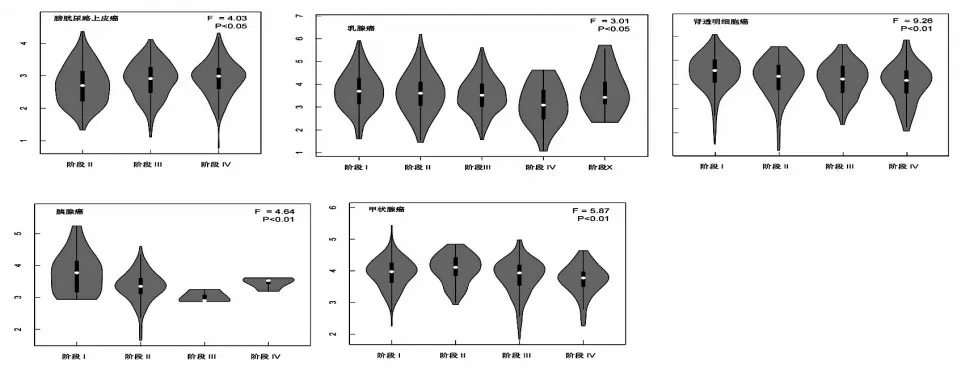
图4 SIK蛋白在不同癌症时期中的表达情况
2.3 SIK3生存分析数据
使用TGCA和GEO数据库根据SIK3蛋白表达水平将肿瘤病例进行分类,并绘制Kaplan-Meier曲线以研究SIK3的表达与不同肿瘤患者的预后情况。SIK3的高表达与肾上腺皮质癌(ACC)预后不良存在相关性(P=0.014),预后SIK3 低表达存活率更高;SIK3 的低表达与KIRC、脑低级别胶质瘤(LGG)、间皮瘤(MESO)、PAAD、胆管癌(CHOL)、THCA 预后不良存在相关性,特别在KIRC 中,SIK3低表达导致生存率显著降低,见图5。
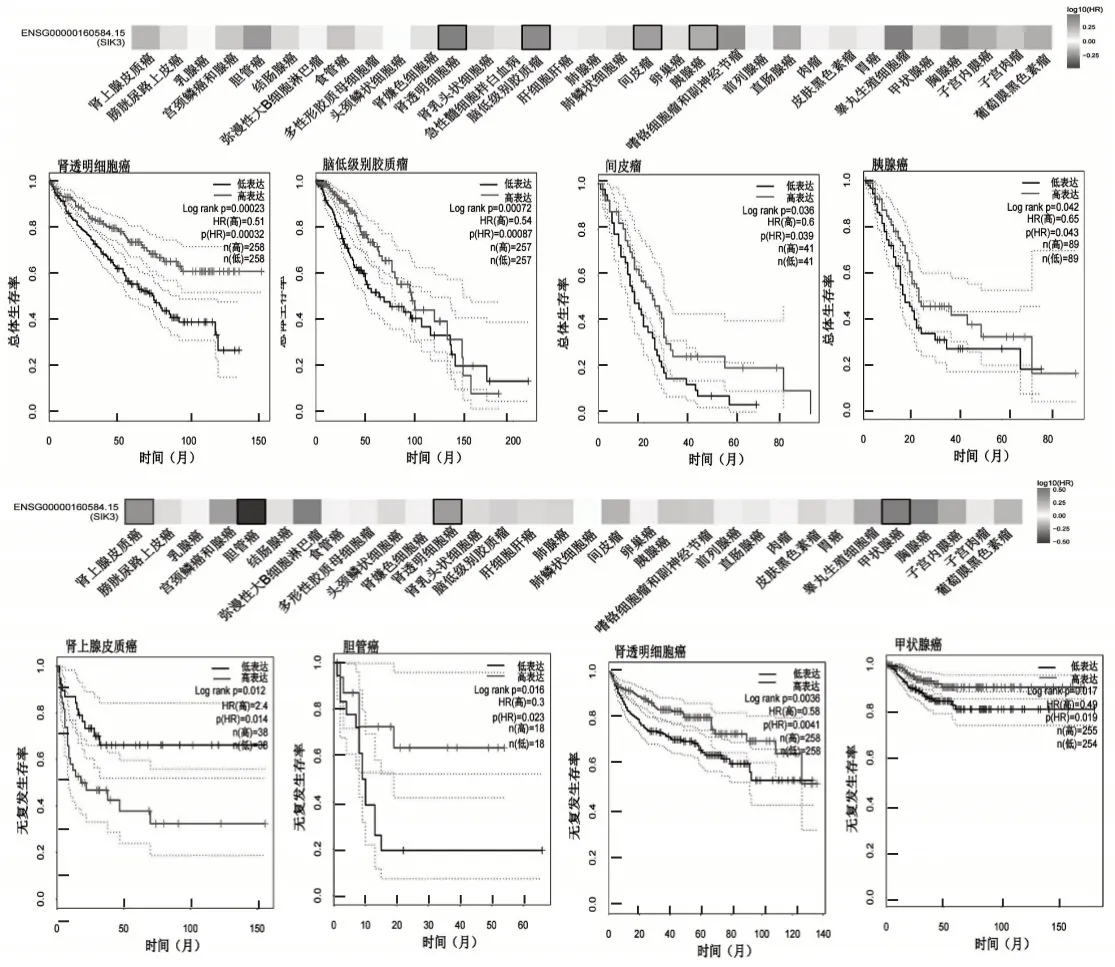
图5 SIK3基因表达水平与不同癌症预后关联性分析
2.4 SIK3基因突变频率在多种癌症中的表达
使用cBioportal 工具研究SIK3 基因在各种肿瘤中的变异情况,见图6。其中,子宫肌瘤中的SIK3 突变率为9.07%,其中突变频率为8.51%(45/529),扩增频率为0.19%(1/529),基因缺失频率为0.38%(2/529)。

图6 多种癌症中SIK3突变频率
2.5 SIK3蛋白在各种癌症中的磷酸化位点及表达水平
使用Ualcan工具比较正常人与患者的组织和肿瘤之间SIK3蛋白磷酸化水平差异。使用CPTAC数据集,对6种类型肿瘤进行分析,包括BRCA、肾细胞癌(RCC)、COAD、LUAD、卵巢癌(OV)、UCEC。在乳腺癌中SIK3磷酸化水平降低,在RCC 中SIK3 磷酸化水平升高,在COAD 中SIK3 磷酸化水平降低,在LUAD 中SIK3 磷酸化水平降低,在OV 中SIK3 磷酸化水平降低,在UCEC 中SIK3 磷酸化水平降低,见图7。
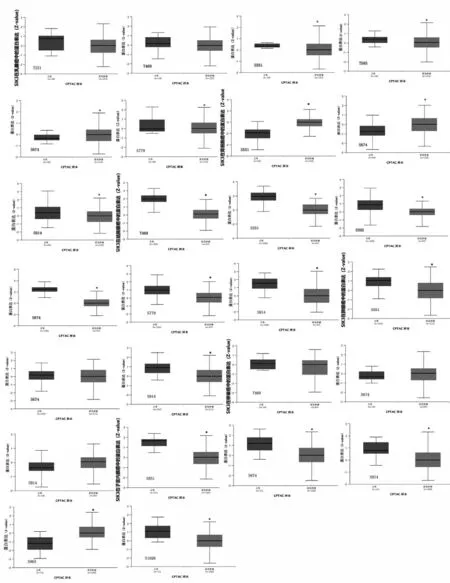
图7 SIK3蛋白在不同癌症中的磷酸化位点和表达水平
2.6 SIK3与肿瘤相关成纤维细胞浸润的相关性分析
使用TIMER2 工具并根据EPIC、 MCPCOUNTER、TIDE算法用于研究在TGCA中SIK3与肿瘤相关成纤维细胞浸润相关性分析,生成肿瘤的散点图数据。SIK3在免疫浸润T 细胞表达中,与COAD、头颈鳞状细胞癌(HNSC)、HPV 感染的头颈部鳞癌(HNSC-HPV +)、 PAAD、READ、胃癌(STAD)、TGCT、胸腺癌(THYM)呈正相关,与LGG 呈负相关。例如,基于MCPCOUNTER 算法,COAD 中SIK3 表达水平与癌相关成纤维细胞浸润水平呈正相关(RHO=0.421,P=2.88e-13),见图8。

图8 SIK3与肿瘤相关成纤维细胞浸润的相关性分析
3 讨论
本研究通过对SIK3基因在人类肿瘤进行泛癌分析,探究了SIK3基因的表达情况、预后情况、基因变异、蛋白磷酸化位点及表达水平,最后对SIK3与肿瘤相关成纤维细胞浸润的相关性进行分析。结果表明,SIK3在多种癌症中异常表达,与正常组织相比,SIK3 基因在13 种癌症中低表达,在不同癌症的不同病理阶段中SIK3蛋白的表达也有显著差异,揭示了SIK3 基因的表达可能影响了BLCA、BRCA、 COAD、 GBM、 KIRC、 KIRP、 LUAD、 LUSC、PRAD、READ、THCA、UCEC 和TGCT 等多种癌症的发生和发展。已有研究表明,SIK3 基因可参与小鼠的生命过程,调节关节的稳态[9],经敲除后能导致小鼠骨骼严重畸形,大多数在出生时死亡[10]。此外,SIK3 基因敲除后可导致小鼠发育过程中出现衰老[11],同时还会出现糖异生缺陷[12]和内毒素休克的超敏反应[13]。Armouti 等[14]研究表明,16 周龄雌性小鼠SIK3 基因经敲除后,卵巢缺乏排卵前泡和黄体,并含有大量出血性卵泡,并内有均匀、无细胞、嗜酸性物质的沉积物。
通过Kaplan-Meier 生存分析发现,SIK3 的高表达与ACC 预后不良存在相关性,预后SIK3 低表达存活率更高,揭示了SIK3 基因可能在ACC 中起促癌基因的作用。SIK3的低表达与KIRC、LGG、MESO、PAAD、CHOL、THCA预后不良存在相关性,特别在KIRC 中,SIK3 低表达导致生存率显著降低,揭示SIK3基因可能在KIRC、LGG、MESO、PAAD、CHOL、THCA 中起抑癌基因的作用。此外在子宫肌瘤中SIK3 基因突变概率较高。进一步分析发现,SIK3 蛋白在RCC 中磷酸化水平升高,在BRCA、COAD、LUAD、OV和UCEC 5种癌症中磷酸化水平降低。
已有研究[15]表明,SIK3 基因表达促进组蛋白乙酰化酶磷酸化后能诱导细胞增殖和恶性肿瘤的发生,SIK3过表达能促进细胞周期的进程并通过激活cSrc-磷酸肌醇3-激酶通道诱导细胞增殖,随后p21 Waf/Cip1 下调,增加小鼠肿瘤的发生[14]。SIK3 能诱导促炎精氨酸代谢,通过MMP-9 激活诱导肿瘤转移性蛋白CXCR4 的表达。三阴性乳腺癌细胞经高盐和IL-17 共同刺激多种乳腺癌细胞后,SIK3蛋白表达特异性上调,协同诱导癌细胞的炎症反应和增殖[16]。
肿瘤浸润性免疫细胞作为肿瘤微环境的重要组成部分,与癌症的发生、发展或转移密切相关。据报道[17],肿瘤微环境基质中的肿瘤相关成纤维细胞参与调节各种肿瘤浸润免疫细胞的功能。根据EPIC、MCPCOUNTER、TIDE算法研究在TGCA 中SIK3 基因在免疫浸润T 细胞中的表达,发现SIK3 基因与COAD、HNSC、HNSC-HPV+、PAAD、READ、STAD、TGCT、THYM 呈正相关,与LGG呈负相关,显示了SIK3基因表达的预后价值。肿瘤微环境具有多种炎性细胞因子和趋化因子,已被证明可介导癌症的进展和增殖。在肿瘤微环境中,虽然肿瘤细胞产生的抗炎活性氧和活性氮增加,但肿瘤细胞周围存在相反的抗炎巨噬细胞表型,以抑制癌细胞的免疫消除,SIK3可能会根据细胞类型和单个细胞表型的细胞分化状态发挥不同作用,这些细胞表型积累作用以促进肿瘤生长。有研究[18]表明,SIK3在多发性骨髓瘤和急性髓系白血病细胞系表达居较高水平。而实验[19]表明,大黄素和小檗碱联合用药能显著降低SIK3活性,抑制乳腺癌细胞的生长、阻滞细胞周期和凋亡。
综上所述,SIK3基因的表达与人类多种肿瘤进程密切相关,SIK3在多种肿瘤细胞与正常细胞间存在显著的差异表达,与ACC 等癌症的预后和多种免疫浸润T 细胞的表达存在相关性,表明SIK3 在肿瘤免疫微环境中起重要作用,可能作为肿瘤潜在诊断标志物以及癌症治疗新靶标。后续可研究SIK3 基因在癌症细胞和正常细胞中的蛋白表达差异,进一步研究其在癌症中的作用机制及相关通路分析。
