体外膜肺氧合辅助 循环崩溃高风险经导管主动脉瓣置换术技术要点专家共识
2024-01-04中国医疗保健国际交流促进会胸痛学分会
中国医疗保健国际交流促进会胸痛学分会
山东省医学会心肺复苏与体外生命支持多学科联合委员会
《体外膜肺氧合辅助循环崩溃高风险经导管主动脉瓣置换术技术要点专家共识》专家组
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)是在非直视条件下以X线和超声等影像技术为引导,在导管内嵌入人工生物瓣膜经不同血管入路使其能够在主动脉瓣病变部位释放的微创技术[1-2]。2002年Cribier等[3]完成了世界首例TAVR,2010年引入我国,目前国内已有多家医院开展该项技术。随着科学发展和技术进步,TAVR已成为不能耐受外科手术治疗的重度主动脉瓣狭窄(aortic stenosis,AS)患者的有效替代治疗手段[4-6],2011年至2019年TAVR术的30 d死亡率为2.5%~7.2%[7]。2021年欧洲心脏病学会和欧洲心胸外科协会指南提出,对于高龄(≥75岁)和高风险患者推荐使用TAVR治疗(Ⅰ类推荐,A级证据)[8],与外科主动脉瓣置换术相比能够减少1年大出血事件、延长生存时间[9-10]。但是循环崩溃高风险TAVR患者合并症更多,围术期发生心搏骤停、急性心力衰竭、恶性心律失常、急性肾功能衰竭等严重并发症的风险也更高。对需要循环支持的循环崩溃高风险TAVR患者,迫切地需要适合的辅助支持手段,以期改善该类患者预后并提高生存率。
体外膜肺氧合(ex tracorporeal m em brane oxygenation,ECMO)是一种重要的体外生命支持技术,通过完全或部分代替心肺功能进行循环支持,为患者争取治疗时间,已在危重症循环衰竭患者中得到不同程度的应用[11]。随着ECMO的普及,2020年以来国内外瓣膜病中心尝试在循环崩溃高风险TAVR患者围术期应用ECMO,并且取得了不错的效果[12-14]。对于TAVR术前存在血流动力学不稳定的急危重症患者,如心原性休克、急性心力衰竭等[15],适合应用静脉-动脉ECMO(venous-arterial ECM O,VA-ECM O)。预防性或紧急使用VAECMO可以维持TAVR患者血流动力学稳定并且减轻心脏负担[16],对于高风险TAVR患者术中联合使用ECMO的效果可能更好,可在很大程度上改善患者预后[2]。根据国内外文献复习,需要ECMO支持的TAVR手术占总手术量的2%~5%,低左心室射血分数TAVR患者中,应用ECMO的比例高达10%,根据2022年全球TAVR总手术量估算,大约2 000例需要ECMO进行循环辅助装置,因此开展TAVR的中心,建议具备提供ECMO或其他循环支持系统的能力。ECMO是TAVR围术期有效、实施快速、相对安全的机械支持装置,但目前对于ECMO辅助TAVR的技术要点尚无系统、规范的专家共识。为此,由中国医疗保健国际交流促进会胸痛学分会、山东省医学会心肺复苏与体外生命支持多学科联合委员会牵头,组织国内急危重症医学、心血管内外科、医学影像、康复医学等领域的专家,梳理了国内外最新循证医学证据和重要进展,结合专家临床实践经验,共同制订了《体外膜肺氧合辅助循环崩溃高风险经导管主动脉瓣置换术技术要点专家共识》,旨在规范TAVR围术期ECMO的主要技术要点,以期优化TAVR围术期管理,进一步提高我国TAVR患者的手术成功率,改善患者预后。
1 专家共识制订步骤和方法
1.1 成立共识撰写组和专家组
共识撰写小组成员主要负责文献检索与筛选,确定共识主题、临床问题及主要内容,组织专家论证,收集整理专家意见,并对共识内容进行调整和修改。以“TAVR”、“TAVI”和“ECMO”为主题词,截止至2022年10月22日,共检索文献460篇,其中Pubmed 89篇,Embase 298篇,Webofscience 71篇,Cochrane 2篇。
专家组主要负责共识内容的评价、论证及审核。
1.2 共识主题和主要内容制订
共识的制订方法采用共识会议以及专家投票的方式进行。主要过程包括:选定和申请题目、成立专家共识撰写小组、明确关键问题、通过文献检索及经验总结制定共识框架内容。
1.3 专家论证和撰写终稿
撰写专家共识初稿、初稿提交共识编写组的专家审核、收集和整理专家反馈意见、修订后召开专家讨论会,确定终稿、再次提交共识编写组专家审核定稿,最终专家组成员得出一致性程度较高的推荐意见。
本专家共识已经在国际实践指南注册平台(International Practice Guidelines Registry Platform,http://www.guidelines-registry.org)注册,注册号:PREPARE-2022CN793。专家共识计划书可在注册平台获取。
2 循环崩溃高风险TAVR的定义和风险评估
TAVR已成为当前治疗重度AS的可靠方法[17]。在适合TAVR手术的患者中,一部分人群由于年龄、合并症状、身体基础状态及自身主动脉瓣膜解剖结构的不同在TAVR的围术期中存在较高的并发症风险和较差的预后[18-20]。因此需要对这部分患者进行识别并寻求可能的辅助支持。
专家意见1:推荐将美国胸外科医师协会评分(Society of Thoracic Surgeons,STS)≥8分,且合并急性心力衰竭、血流动力学不稳定、心搏骤停、左心室射血分数≤30%、左心室舒张末期内径≥70 mm、频发室性心动过速和心室颤动等恶性心律失常、多脏器功能衰竭等其中一项及以上定义为循环崩溃高风险TAVR。
进行术前评估来筛选循环崩溃高风险TAVR患者继而进行ECMO的辅助支持极为重要[21]。欧洲心脏手术风险评估系统(European System for Cardiac Operative Risk Evaluation,EuroSCORE)和STS评分(https://riskcalc.sts.org/stswebriskcalc/calculate)作为目前应用较为广泛的外科手术风险评估方法可以在术前综合判断TAVR患者状态,对后续ECMO辅助循环崩溃高风险TAVR手术开展具有积极意义[22-23],研究发现STS评分对TAVR患者长期预后的预测更好,因此本共识采用STS评分进行危险分层。但由于各种评分方法存在评估患者状态的不足之处,因此对于循环崩溃高风险TAVR患者的充分术前评估还需要多学科团队(multi-disciplinary team,MDT)的协同合作[22,24]。
专家意见2:术前需要使用STS评分和影像学评估综合判断患者接受TAVR手术的风险,识别包括冠状动脉闭塞高风险的循环崩溃高风险TAVR患者,并由包括急危重症ECMO医师团队、心血管TAVR医师团队、手术麻醉医师团队、医学影像医师团队以及康复随访管理医师团队的ECMO-TAVR MDT协同执行(图1)。
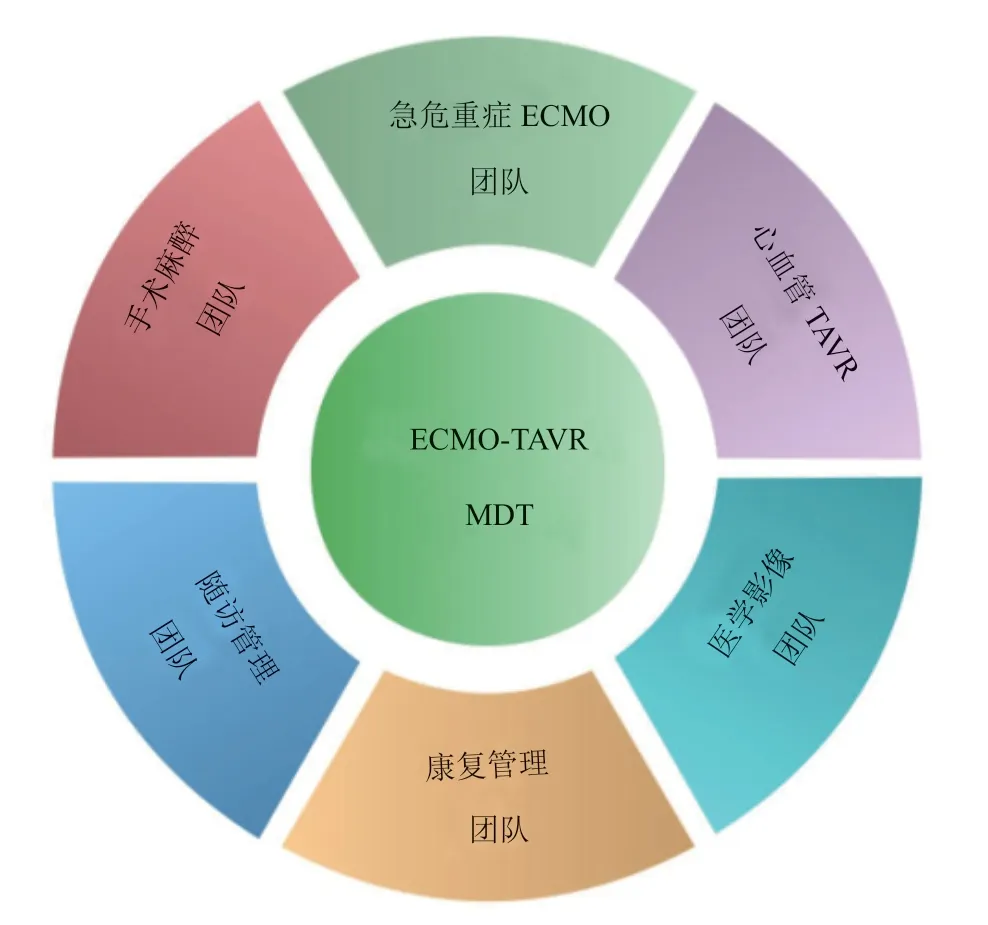
图1 ECMO 辅助循环崩溃高风险TAVR 的MDTFigure 1 ECMO assisted hemodynam ic collapse high-risk TAVR MDT
超声心动图检查具有实时成像、动态、无辐射、可床旁操作和便于长期随访等优点,是心血管疾病早期识别、鉴别诊断以及预后评估最主要的无创辅助检查技术[25]。超声心动图术前能够评估主动脉瓣根部复杂结构,同时能在介入手术中确定人工瓣膜支架置入位置是否正确,人工瓣膜功能是否良好,而且能在术中及术后即刻监测和评估TAVR相关并发症。部分高危的拟行TAVR患者,术前不能耐受CT检查或者未完善CT检查,使用三维超声心动图对主动脉根部解剖进行评估,可为手术策略的制定提供重要参考信息。但是在传统诊疗模式下,主要依靠医师主观判读影像数据,结果存在异质性,且人力有限,难以满足不断增长的临床需求。因此,使用人工智能辅助诊断系统有希望代替人类进行大量重复性、机械性的工作,减少图像采集时间,同时也能加快诊疗进程,提高诊断结果的准确性和可重复性[26]。
专家意见3:推荐在常规应用CT评估患者病情的基础上,应用超声心动图对循环崩溃高风险TAVR患者进行术前评估,术中及术后的监测。
3 ECMO辅助支持循环崩溃高风险TAVR手术的适应证及禁忌证
目前TAVR常规手术的适应证及禁忌证如下[22,27]。
3.1 适应证
(1)AS包括二叶式和三叶式,并且传统外科手术高危定义为STS评分≥8分、中危为STS评分≥4分或者低危但高龄(年龄>70岁);(2)外科手术高危的主动脉瓣反流;(3)主动脉瓣位人工生物瓣结构衰败。
3.2 禁忌证
严重感染,合并严重出血性疾病,Stan f o rd A型主动脉夹层等。相对禁忌证:年龄<60岁且不具有明显外科手术高危因素、30 d内急性心肌梗死病史、左心室附壁血栓、合并严重左心室流出道梗阻、有破裂风险的升主动脉瘤、其他解剖形态不适合行TAVR、非心脏原因导致的预期生存期<1年。
在此基础上,若患者术前综合评估为循环崩溃高风险TAVR,且术前血流动力学不稳定或合并急性心力衰竭,建议在排除ECMO禁忌证后,考虑联合ECMO辅助支持。循环崩溃高风险TAVR定义同“专家意见1”。
4 术前评估
部分循环崩溃高风险TAVR患者,常因主动脉瓣病变继发急性心力衰竭发作,甚至伴有严重的血流动力学障碍,术中进行超声评估并直接进行手术[28]。而对于这部分需要急诊TAVR干预的高危患者,发生围术期血流动力学崩溃的风险更高,常规药物治疗效果欠佳,需行急诊TAVR干预,如果CT检查尚未完善,VA-ECMO可以作为优先选择的机械辅助装置[29],因为其不仅具备呼吸支持功能,还可给予循环支持,能快速改善失代偿心功能不全,维持循环稳定。诱导麻醉后行ECMO置管以维持基本循环,有望改善患者预后[30]。拟行TAVR患者在ECMO辅助下的救治流程建议详见图2。
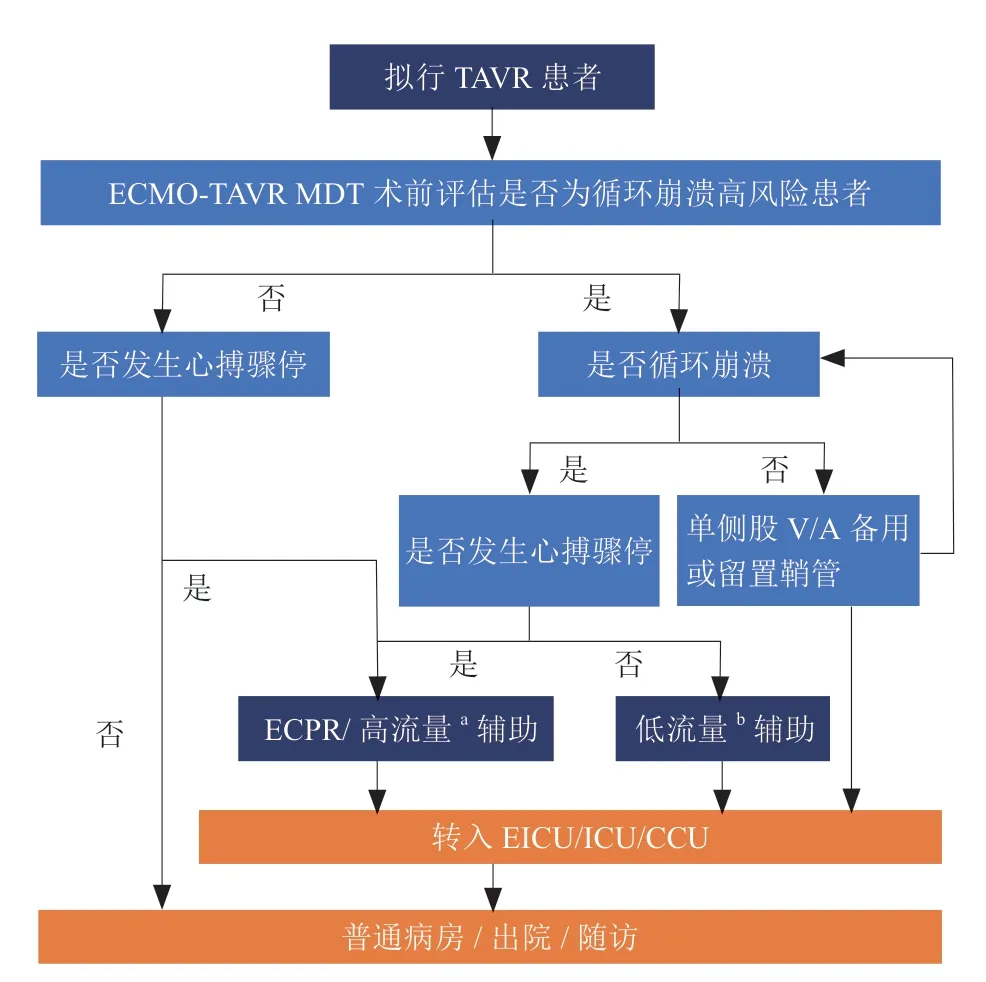
图2 ECMO 辅助循环崩溃高风险TAVR 流程 (TAVR 及ECPR 手术的环节见相关指南及专家共识,不在本共识讨论范围)Figure 2 Flow chart of high-risk TAVR patients w ith ECMO assisted circulatory collapse
专家意见4:推荐由麻醉医师在TAVR术前对患者进行充分麻醉预评估,对难以药物纠正的急性心力衰竭发作/心原性休克患者,先局部麻醉,行ECMO置管并维持基本循环后再进行全身麻醉,避免麻醉后加重血流动力学的不稳定。
5 ECMO辅助循环崩溃高风险TAVR技术要点
5.1 ECMO辅助循环崩溃高风险TAVR常规手术入路选择策略
目前国内常用TAVR入路包括经股动脉、经心尖、经颈动脉和升主动脉路径等[18]。股动脉入路作为最常用的外周动脉入路,具有创伤小、患者易于接受且对ECMO常用入路影响小,利于手术的开展。杂交手术室是近年来新兴的手术室模式,可以同时实施影像学检查、血管介入治疗和心血管外科手术,满足了TAVR手术实施过程中的各项要求,有利于手术的顺利开展[29]。
专家意见5:推荐在杂交手术室进行TAVR,建议对于围术期血流动力学崩溃高风险TAVR患者,术前应充分利用CT或者超声评估外周入路情况,在TAVR主入路以外其他血管,做好ECMO入路准备。TAVR手术入路为主入路,尽量选择同侧下肢动静脉路径,ECMO入路选择对侧的下肢动静脉路径,动脉导管选择15 Fr以下以减少造成远端动脉缺血等血管并发症。股动脉入路可以选择穿刺或者切开。术前有条件者建议进行血管条件评估,根据评估血管情况适当调整血管入路。
5.2 ECMO辅助循环崩溃高风险TAVR术中管理策略
ECMO辅助TAVR术中ECMO回路及人工瓣膜易形成血栓,荟萃分析显示:即使在ECMO运行期间进行了抗凝,血栓的发生率仍有8%~12%,其中主要以回路及氧合器血栓、脑卒中及置管侧肢端缺血为主[31]。而抗凝最常见的并发症是出血,根据国际体外生命支持组织登记和荟萃分析,ECMO患者出血发生率为17%~51%[32-33]。因此,ECMO支持期间如何选用合适的抗凝药物,既能防止管路、氧合器血栓形成,又能减少患者出血风险,成为ECMO抗凝关注的焦点。
专家意见6:术中根据患者血流动力学选择合适的ECMO流量,建议在保证器官灌注前提下尽量选择低流量辅助(1.5~2.2 L/m in),体外心肺复苏(extracorporeal cardiopulmonary resuscitation,ECPR)患者可根据具体情况选择较高流量辅助,必要时可联合主动脉内球囊反搏(intra-aortic balloon counter-pulsation,IABP)支持。抗凝剂首选肝素,但谨防肝素诱导的血小板减少症的发生,其次可选择阿加曲班、比伐芦定等,抗凝目标根据TAVR术中要求,建议活化凝血时间(activated clotting time,ACT)控制在250~350 s。
5.3 ECMO辅助循环崩溃高风险TAVR术后管理策略
5.3.1 术后镇痛镇静管理策略 术后对患者进行镇痛镇静的管理在ECMO辅助循环崩溃高风险TAVR围术期发挥着重要作用。不仅能维持患者基础生命状态稳定,减少疼痛躁动等导致的氧需求,相应降低心肺负担,而且对后续治疗技术支持和护理也提供帮助[34]。但对患者术后镇痛镇静管理要全面评估,慎重选择镇痛镇静药物的剂量和镇静程度,以免引发血流动力学的不稳定[30,35]。
专家意见7:术后给予常规镇痛镇静治疗,并采用重症监护患者疼痛评估(chronic pain outcome tool,CPOT评分)[36]、Richm ond镇静-躁动评分(Richmond agitation and sedation scale,RASS评分)[37]对镇痛镇静深度进行密切监测,在充分镇痛基础上,根据患者器官功能情况选择镇静深度。建议CPOT评分≤2,RASS评分0~-2,使患者保持浅镇静水平,并根据患者情况,尽早停用镇静药物。
5.3.2 术后急性心力衰竭预警及重要脏器功能评估 急性心力衰竭作为循环崩溃高风险TAVR定义中所包含的严重合并症,在ECMO辅助循环崩溃高风险TAVR患者围术期中备受医疗团队重视关注[38]。尽早应用急性心力衰竭早期预警SUPER-score评分(表1)[39]能进行早期预警,可降低围术期急性心力衰竭发生率,有助于循环崩溃高风险TAVR患者疾病的治疗和恢复。ECMO辅助支持TAVR过程中,需要密切监测重要脏器的功能,通过表格化精细化管理(参考附件1和附件2见本刊网站全文下载),以保护重要脏器功能。
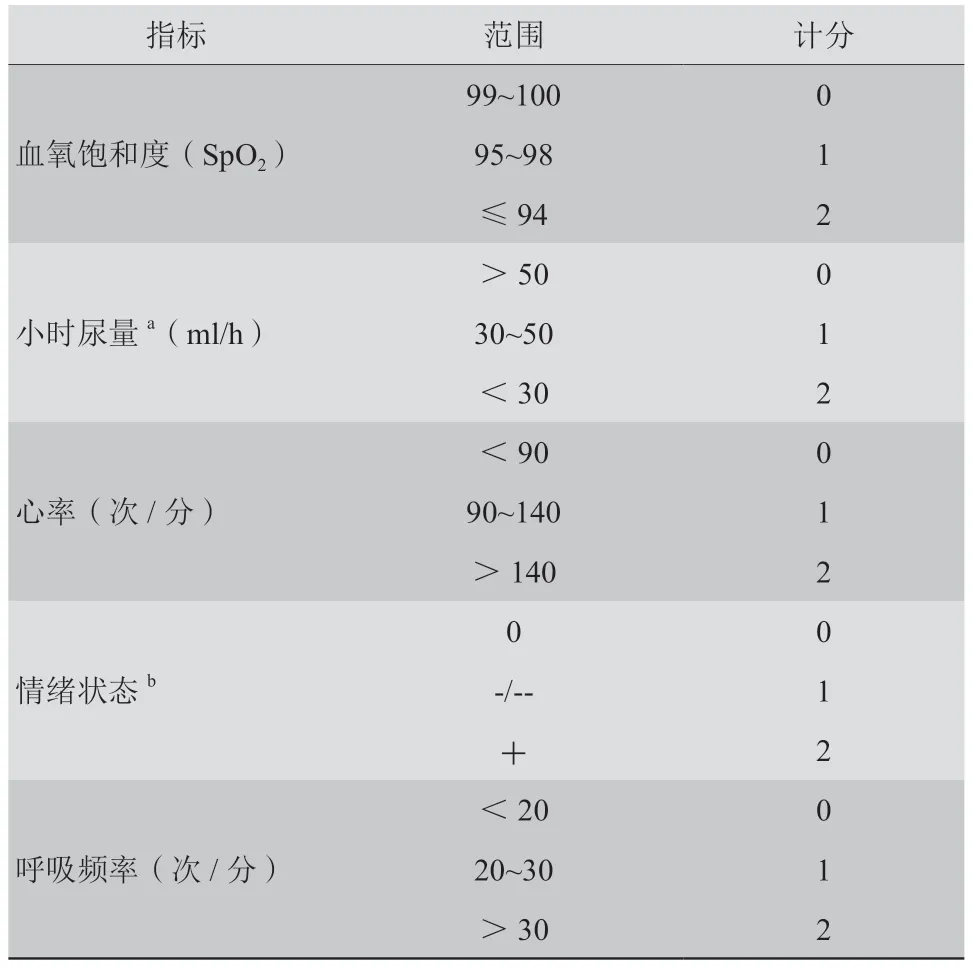
表1 SUPER-score 急性心力衰竭早期预警评分系统cTable 1 SUPER-score Early Warning Scoring System for Acute Heart Failure
专家意见8:推荐采用急性心力衰竭早期预警SUPER-score评分工具进行早期预警,预防急性心力衰竭再次发作。
专家意见9:推荐采用ECMO患者每日管理表格对患者进行精细化管理,重点关注患者重要脏器功能的早期动态监测、评估、支持与保护。
5.3.3 术后ECMO管理策略 在TAVR术后突然发生的循环衰竭是危及生命的事件,可能导致心搏骤停或心原性休克[40]。这可能与瓣膜置入后立即心肌顿抑、瓣膜错位/移位、严重的瓣周或瓣中反流、冠状动脉阻塞、瓣环破裂有关[22,41]。由于血流动力学不稳定,治疗可能具有挑战性。在这种情况下,维持血流动力学稳定和氧合在治疗并发症方面发挥重要作用。ECMO可提供有效的心肺支持,为心脏功能恢复赢得时间。研究发现,对这类患者在术后使用ECMO进行支持性管理很有必要[42-43],还需关注适合TAVR术后的ECMO患者的通气设置以及凝血功能管理。
专家意见10:TAVR术后出现血流动力学崩溃,推荐优先使用ECMO稳定生命体征,后积极寻找血流动力学崩溃原因,并对因处理。推荐支持期间根据患者血流动力学选择ECMO流量,采用低流量(1.5~2.2 L/m in)目标,早期评估撤机,维持短程支持。应注意下肢血运,必要时在超声引导下行动脉顺行灌注管置入术,改善下肢末端血运。
5.3.4 术后抗凝管理策略 出血或栓塞等凝血系统相关并发症是影响ECMO患者死亡率的主要因素之一,平衡抗凝和出血的矛盾是ECMO管理的重中之重[44],目前在ECMO期间最常用的抗凝药物仍是普通肝素[45],对于存在抗凝血酶(antithrombin,AT)明显抵抗(AT<50%)的患者可以补充AT,其他抗凝药物有直接凝血酶抑制剂(direct throm bin inhibitors,DTIs)如比伐芦定、阿加曲班等。抗凝监测的常用指标为活化部分凝血活酶时间(activated partial thromboplastintime,APTT)、ACT、抗Xa因子活性[46]。术后ECMO使用时必需使用抗凝措施以预防血栓形成。通常在ECMO插管前先首次给予肝素,使得ACT维持在一定范围内。运行过程中持续泵注肝素,维持ACT水平在140~220 s 范围内[47]。在出现过敏或肝素诱导的血小板减少症或存在普通肝素的其他禁忌证时,比伐芦定可作为替代抗凝剂[48]。最佳的抗凝治疗依赖于对多种抗凝措施的标准化全面评估,并综合考虑患者的临床状态及其出血或血栓并发症风险[49]。
专家意见11:推荐术后抗凝的目标维持低抗凝强度(ACT 140~160 s,APTT 60~75 s)、抗凝药物可以选择肝素、阿加曲班或比伐芦定等。
5.3.5 术后呼吸功能管理策略 患者在TAVR术后常伴有一定程度的低氧血症,如合并心功能不全或休克,可加重低氧血症,部分患者甚至发生呼吸、心搏骤停。因此在循环崩溃高风险TAVR术后根据情况恰当选择氧疗措施,对于需要机械通气患者均需采用保护性肺通气策略,避免继发性肺损伤,采用措施预防呼吸机相关肺炎(ventilator-associated pneumonia,VAP)发生。根据动态监测结果综合评定患者心肺功能,尽早撤机。
专家意见12:TAVR术后需要机械通气患者要采用保护性肺通气策略,预防VAP发生,动态评估心肺功能,尽早拔除气管插管,采取预防措施减少VAP的发生。
5.3.6 术后抗生素等药物应用策略 保证术中无菌操作规范化,术后合理规范地使用抗生素是预防ECMO辅助TAVR感染的重要手段。术后抗生素的应用策略主要包括预防性抗菌药物和治疗性抗菌药物的使用。通常不建议预防性应用抗生素。对于有术后发热、咳痰等感染征象患者,应进行相应辅助检查,实验室确诊的细菌性感染是治疗性应用抗生素的指征,在未获知细菌培养及药敏结果前,可根据感染部位、基础疾病、严重程度、既往抗生素用药史及治疗反应等综合考虑给予经验性治疗。同时应及时留取合格标本送病原学检测,以尽早明确病原菌和药敏结果,据此降阶梯治疗[50]。
专家意见13:不建议预防性应用抗生素。术后常规监测患者体温、血常规、C反应蛋白、降钙素原、血清淀粉样蛋白A、炎症因子如白介素6和床旁胸片等指标,必要时根据可疑感染部位和感染来源,经验性选用青霉素类或二、三代头孢菌素。有高龄、免疫缺陷、长期住院或老年病院居住、近期(90 d内)抗生素应用史等耐药菌感染高危因素患者,经验性选用酶抑制剂复合制剂或特殊使用级广谱抗生素,并尽量在抗生素应用之前采集可疑感染部位标本送检,尽快明确病原菌和药敏情况并积极降阶梯治疗。
5.3.7 术后机械辅助装置的撤除顺序 由于循环崩溃高风险TAVR患者病情复杂,常用的辅助器械包括ECMO、IABP、有创呼吸机等,多种器械辅助的协调和管理尤为重要。尽早撤除呼吸机,行清醒ECMO治疗,有助于早期康复、减少呼吸机相关性肺炎风险、减少血管活性药物用量,早期经口进食有利于减少肠道菌群紊乱、营养不良和感染等并发症的风险[51],根据脏器功能评估确定辅助设备撤离顺序。ECMO患者容易发生出血、感染、下肢动脉缺血、神经系统损伤等各种并发症[52],原则上在血流动力学稳定的情况下应尽早撤除ECMO辅助,撤机前需对心肺功能充分评估[53]。IABP可有效减轻心脏后负荷,改善冠状动脉灌注,提供部分心功能替代治疗,且操作和监护相对简易,在ECMO之后撤除更安全[51]。
专家意见14:ECM O辅助循环崩溃高风险TAVR围术期患者拟撤除机械性辅助装置时,应根据患者血流动力学情况,可选择TAVR术后直接撤除ECMO或短期辅助。ECPR或血流动力学不稳定,联合气管插管有创呼吸机通气、IABP、连续性肾替代治疗(continuous renal replacement therapy,CRRT)等器械患者,撤机时应根据具体情况,推荐首先撤除呼吸机行清醒ECMO。
6 ECMO辅助循环崩溃高风险TAVR并发症管理策略
循环崩溃高风险TAVR患者尤其是急诊TAVR术中发生心搏骤停等并发症的风险明显升高,针对不同的围术期并发症,合理选择机械辅助装置,规范技术要点,能提供较好的治疗效果。
6.1 心搏骤停
由于TAVR术中瓣膜释放瞬间血流动力学不稳定以及患者高龄、心功能差等不利因素,循环崩溃高风险TAVR患者有可能出现心搏骤停等严重并发症[20,54],给予ECMO辅助支持治疗,是改善患者预后的关键措施[42,55]。发生心搏骤停的循环崩溃高风险TAVR患者,常伴有低血压、外周灌注不足、或伴炎症风暴、多器官功能衰竭等多种不良情况,给予IABP、CRRT、床旁超声指导、抗炎药物等治疗可改善患者预后[56],并参照《不同情况下成人体外膜肺氧合临床应用专家共识(2020版)》[47]推荐流程对患者进行管理。
专家意见15:循环崩溃高风险TAVR围术期或非循环崩溃高风险TAVR但术中发生心搏骤停的患者,包括术前、术中及术后发生的心搏骤停,建议根据ECPR管理策略进行管理。
专家意见15.1:推荐ECMO及大剂量血管活性药仍无法维持血流动力学平稳时,积极进行血流动力学评估,确定休克原因及分型;可联合应用IABP支持治疗,降低患者心脏后负荷,改善患者冠状动脉及大脑循环血供[57-58]。如患者出现急性肾损伤、合并炎症因子风暴或有潜在对比剂肾病可能,应早期行CRRT[59],必要时可加用血液灌流,清除炎症因子。推荐处于炎症风暴的循环崩溃高风险TAVR患者早期使用药物[60]进行抗炎治疗。采用床旁超声评估心功能及容量,指导救治。推荐该类患者早期管理采用EICU方案(E:ECMO;Ⅰ:IABP;C:CRRT;U:U ltrasound)。
多模态神经功能监测指应用当前最前沿的技术实时监测大脑病理生理变化和评估大脑功能[61],从而减少二次脑损伤的发生[62],通常包括颅内压监测技术、脑组织氧监测、脑代谢监测、脑电监测、脑血流监测等。随着医疗科技的发展和普及,多模态神经功能监测技术开展应用越来越普及。神经系统损伤是心搏骤停最严重的并发症之一,甚至影响患者循环和(或)呼吸恢复,严重影响患者预后,并且由于ECMO患者特殊的病理生理状态,许多神经损伤的危险因素无法轻易缓解[63-64],因此使用多模态神经功能监测及早识别神经系统损伤,及时干预具有重要意义。
专家意见15.2:推荐有条件的单位早期对行ECPR的患者进行多模态神经功能监测,动态评估神经功能状态,指导诊疗方案调整,改善患者神经功能预后。
6.2 下肢缺血
下肢缺血是股动脉置管时的常见并发症,可能的原因为插管口径选择不当、置管后管路阻塞、非搏动血流、全身情况或药物引起的外周血管收缩、静脉血流瘀滞等[65]。由于手术操作过后、病态肥胖、目标血管管径较细及心搏骤停、动脉无搏动或搏动较弱、大剂量血管活性药物引起血管痉挛等,ECM O置管困难常见。经皮穿刺时穿透血管可以引起大出血,也可形成动静脉内瘘或假性动脉瘤。置入导引钢丝和破皮也可能引起动脉夹层,或将管路引入错误位置导致血流不畅。
专家意见16:建议安装ECMO管路前超声测量动脉管径选择合适的动脉插管;必要时术中导管室X线指导下置管;术后密切监测下肢动脉(如足背动脉)搏动,观察下肢的皮温、颜色、硬度、腿围、关节活动度变化,同时可借助超声技术测量下肢动脉血流频谱。对于清醒ECMO的患者,可定期询问有无肢端感觉异常。发现下肢缺血时建议给予8 F鞘管建立动脉侧支,改善远端肢体灌注。
6.3 血栓栓塞
预防血栓栓塞并发症在ECMO支持的患者管理中至关重要。可能的栓子来源包括血管内血流瘀滞,以及ECMO管路的任何部位,尤其侧支管路血流量较低更易出现血栓。应经常检查氧合器及早发现血栓形成,评估气体交换效率,监测膜肺跨膜压力。
专家意见17:侧支管路出现血栓时建议更换侧支导管;管路血栓影响ECMO正常运行时可更换整套ECMO装置。该类并发症应以预防为主,定期检查ECMO管路有无血栓,动态监测ACT、APTT、血栓分子标记物和D-二聚体,完善抗凝治疗等。
6.4 出血
经皮穿刺时穿透血管可以引起大出血,切开置管后可能出现刀口大量渗血,临床表现为低血压,低流量,氧供不足甚至死亡。
专家意见18:建议视情况直接压迫;必要时输注红细胞、血浆等;优化抗凝方案;外科干预。
心律失常、瓣周漏、心脏压塞、人工瓣膜中心性反流等TAVR常见并发症详见TAVR相关专家共识,不在本次讨论范围。
7 总结
ECMO在循环崩溃高风险TAVR患者中的应用越来越广泛,ECMO团队及TAVR团队的配合日益密切,在循环崩溃高风险TAVR患者中ECMO的精细化管理流程是显著改善循环崩溃高风险TAVR患者的预后及生存率的关键。但目前针对ECMO辅助循环崩溃高风险TAVR患者中的应用尚缺乏大型、随机对照临床研究,仅有少量病例报道评价了ECMO辅助的可行性、有效性及安全性,目前该领域还需进一步开展研究、总结经验,完善ECMO辅助循环崩溃高风险TAVR的管理流程,从而为更多循环崩溃高风险TAVR患者手术的开展提供更加安全、高效的支撑。
编写组组长:陈玉国(山东大学齐鲁医院),徐峰(山东大学齐鲁医院),李传保(山东大学齐鲁医院)
专家组成员(按姓名汉语拼音排序):安贵鹏(山东大学齐鲁医院),边圆(山东大学齐鲁医院),卜培莉(山东大学齐鲁医院),陈文强(山东大学齐鲁医院),冯沅(四川大学华西医院),谷兴华(山东大学齐鲁医院),韩小彤(湖南省人民医院),姜正明(郑州大学第一附属医院),李瑞建(山东大学齐鲁医院),李勇(山东大学齐鲁医院),刘汝刚(山东大学齐鲁医院),刘巍(北京积水潭医院),刘先宝(浙江大学医学院附属第二医院),吕瑞娟(山东大学齐鲁医院),潘文志(复旦大学附属中山医院),庞佼佼(山东大学齐鲁医院),秦历杰(河南省人民医院),宋光远(首都医科大学附属北京安贞医院),王焱(厦门大学附属心血管病医院),魏捷(武汉大学人民医院),魏述建(山东大学齐鲁医院),邢金燕(青岛大学附属医院),薛丽(山东大学齐鲁医院),翟茜(山东大学齐鲁医院),张国强(中日友好医院),张海涛(同济大学附属东方医院),张劲松(江苏省人民医院),张俊杰(南京市第一医院),张龙岩(武汉亚心总医院)
执笔人:边圆(山东大学齐鲁医院),刘海雁(山东大学齐鲁医院),高璐瑶(山东大学齐鲁医院),杨秀婷(山东大学齐鲁医院),曹盛川(山东大学齐鲁医院),韩宇(山东大学齐鲁医学院),刘维康(山东大学齐鲁医学院),刘湘国(山东大学齐鲁医学院),夏亚楠(山东大学齐鲁医学院)
利益冲突 所有作者均声明不存在利益冲突
