DWI对高强度聚焦超声治疗子宫腺肌病早期消融效果的评价
2024-01-04唐明梅王璐张珂潘缘蕊刘惠吕发金
唐明梅,王璐,张珂,潘缘蕊,刘惠,吕发金
作者单位:1.重庆医科大学生物医学工程学院(超声医学工程国家重点实验室),重庆 400016;2.重庆医科大学重庆市生物医学工程学重点实验室,重庆 400016;3.重庆医科大学附属第一医院放射科,重庆 400016
0 前言
子宫腺肌病是育龄期女性常见的一种子宫良性疾病,由于子宫内膜腺体及间质向肌层侵入性生长,导致子宫局部或弥漫性体积增大,并出现痛经、经量增多、贫血及不孕等一系列症状[1-3]。子宫腺肌病病灶常常边界不清甚至弥漫分布,局部切除术存在困难,保留子宫的传统治疗方法效果有限[4-6]。高强度聚焦超声(high intensity focused ultrasound,HIFU)作为一种新兴的微创治疗技术,利用体外发射超声波聚焦到体内病变组织,使病灶出现不可逆的组织细胞凝固性坏死,从而达到靶向破坏病变的目的,已被证实应用于子宫腺肌病的治疗是安全有效的[7-9]。
根据目前中国专家共识[10-11],HIFU 术后早期影像学评价能确定治疗靶区凝固性坏死灶的存在及范围,早期疗效评估以增强MRI(contrast-enhanced MRI, CE-MRI)非灌注区体积(nonperfused volume,NPV)作为消融体积,将NPV 比作为评价消融率的指标,被认为是评估消融成功的关键[12-13]。NPV 比率越大,病灶体积缩小越多,症状改善越明显,中、远期持续症状缓解的可能性更高[14-16]。但CE-MRI 检查耗时长、价格贵,扫描中使用的钆对比剂可能造成潜在的不良影响[17-19]。
磁共振扩散加权成像(diffusion weighted imaging, DWI)不使用对比剂,可在分子水平层面反映病灶消融前后的变化情况[20-22]。目前,将DWI 用于评估子宫肌瘤HIFU术后早期消融效果的价值已经得到证实[20,23-24]。然而,关于DWI 能否有效评估子宫腺肌病HIFU 术后早期消融效果的研究尚有不足;有学者[25-26]仅对子宫腺肌病HIFU 术后早期DWI 上消融灶表观扩散系数(apparent diffusion coefficient,ADC)值或体积单一指标进行评价,尚不足以充分说明DWI能有效评估其消融效果。因此,本研究进一步探讨DWI 对HIFU 治疗子宫腺肌病早期消融效果的价值,旨在为临床提供一种不使用对比剂的有效评估方式。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经重庆医科大学第一附属医院伦理委员会批准,免除受试者知情同意,批准文号:K2023-115。本研究回顾性分析了2016 年1 月至2019 年6 月因子宫腺肌病在重庆医科大学第一附属医院接受HIFU 治疗的82 例患者资料,所有患者治疗前、后均行MRI 检查,术后MRI 检查在48 h内进行。
纳入标准:(1)年龄>18周岁的绝经前妇女;(2)经临床或MRI确诊的症状性子宫腺肌病患者;(3)同意接受HIFU治疗,并完成HIFU术前及术后MRI检查;(4)有安全清晰的声学通路。排除标准:(1)非首次HIFU 治疗,或HIFU 治疗前接受其他微创、外科手术等治疗;(2)疑似或确诊盆腔恶性肿瘤、盆腔急性炎症;(3)临床或影像资料缺失;(4)影像图像存在明显伪影,影响观察结果。
1.2 HIFU治疗
采用超声引导下海扶刀®聚焦超声肿瘤治疗系统(JC200 型,重庆海扶医疗科技股份有限公司,功率300~400 W)。所有患者在治疗前均严格充分准备,术中俯卧于治疗台上,在清醒镇静及超声实时监控下进行HIFU消融手术。治疗从病灶深部到浅部逐层进行,并根据超声图像上显示病灶区域的灰度变化及患者治疗中的反馈调整超声能量,当病灶出现明显灰度变化或超声能量达到阈值时治疗终止。
1.3 MRI检查
所有患者于HIFU 术前及术后48 h 内均采用3.0 T MRI(Singal HD Excite, GE Healthcare,USA)扫描仪进行盆腔平扫及增强检查,选择8通道体部相控阵线圈,扫描体位为仰卧位。主要扫描序列及参数如下:T2WI 序列,TR 4200.0 ms,TE 107.3 ms,FOV 28.0 cm×22.4 cm,矩阵288×224,层厚5.0 mm,层间距1.5 mm;T1WI 序列,TR 175.0 ms,TE 1.8 ms,FOV 40.0 cm×28.0 cm,矩阵320×224,层厚5.0 mm,层间距1.0 mm;DWI 序列(b=0、600~1000 s/mm2),TR 4475.0 ms,TE 65.3 ms,FOV 38.0 cm×38.0 cm,矩阵128×128,层厚5.0 mm,层间距1.5 mm;增强T1WI序列,TR 4.0 ms,TE 1.9 ms,FOV 40.0 cm×32.0 cm,矩阵320×224,层厚4.0 mm,层间距0.0 mm,对比剂为钆喷酸葡胺注射液(Gd-DTPA,Bayer Pharma AG,德国),剂量为0.2 mL/kg,推注速率为2.0 mL/s。
1.4 影像分析
所有MRI 图像由两名分别具有10 年和6 年腹部MRI 诊断经验的放射医学主治医师独立分析,当意见发生分歧时通过商讨或与第三名具有30年相关诊断经验的放射医学主任医师商讨后形成一致意见。评估HIFU 术后消融灶DWI 信号变化区情况、测量消融灶体积及治疗前后病灶ADC 值,CE-MRI 的NPV 由第一名观察者测量。DWI信号变化区即术后DWI显示与术前信号特点明显不同的区域[20,23],NPV 即为CE-MRI 无对比剂填充区域的体积[27-28]。
评估HIFU 术后DWI 信号变化区形态及测量消融灶体积时,需独立观察DWI 及CE-MRI 图像以避免两者相互影响,但可参考其他平扫序列图像以便更准确地评估。术后DWI 信号变化区形态分型[26](图1):Ⅰ型,斑点状或无明显信号改变(图1A);Ⅱ型,斑片状信号改变(图1B);Ⅲ型,环状信号改变(图1C、1D)。将Ⅲ型消融坏死灶按信号环的完整与否分为完整信号 环(图1C)与 非 完 整 信 号 环(图1D)[23]。采 用ITK-SNAP 3.8 软 件(Cognitica, Philadelphia,PA),选取术后DWI 高b 值图像及CE-MRI 静脉期图像沿消融灶外缘逐层手动勾画创建感兴趣区(region of interest, ROI),自动计算体积(图2)[23,29]。I 型病灶较术前信号改变不明显,无法清晰判断消融区,故放弃DWI 上体积测量。使用AW 服务器工作站(AW-server workstation, 4.7, GE Healthcare)自带的Readview 软件,选取消融前后b 值相同的DWI原始图像分别生成ADC 图,结合CE-MRI 图定位,在显示病灶最大截面层面勾画ROI,ROI 在不超过病灶边缘3~4 mm 区域尽可能多地包含病灶,测量ADC 值,测量三次求平均值(图3)[23,30]。

图1 子宫腺肌病患者HIFU 治疗后DWI上消融灶信号变化形态分型。1A:女,44岁,HIFU 治疗后DWI(b=800 s/mm2)图呈斑点状或无明显信号改变,分为Ⅰ型;1B:女,34岁,HIFU治疗后DWI(b=800 s/mm2)图呈斑片状信号改变,分为Ⅱ型;1C:女,45岁,HIFU治疗后DWI(b=800 s/mm2)图呈完整信号环,分为Ⅲ型;1D:女,45岁,HIFU治疗后DWI(b=800 s/mm2)图呈非完整信号环,分为Ⅲ型。HIFU:高强度聚焦超声;DWI:扩散加权成像。Fig.1 Morphology of signal changes in ablation areas on DWI after HIFU treatment for adenomyosis.1A: Female, 44 years old, post-treatment DWI (b=800 s/mm2)show spot-like or no obvious signal change, divided into type I; 1B: Female, 34 years old, post-treatment DWI (b=800 s/mm2) show patchy signal change, divided into type Ⅱ; 1C: Female, 45 years old, post-treatment DWI (b=800 s/mm2) show complete signal ring, divided into type Ⅲ; 1D: Female, 44 years old, post-treatment DWI (b=800 s/mm2) show incomplete signal ring, divided into type Ⅲ.HIFU: high intensity focused ultrasound; DWI: diffusion weighted imaging.
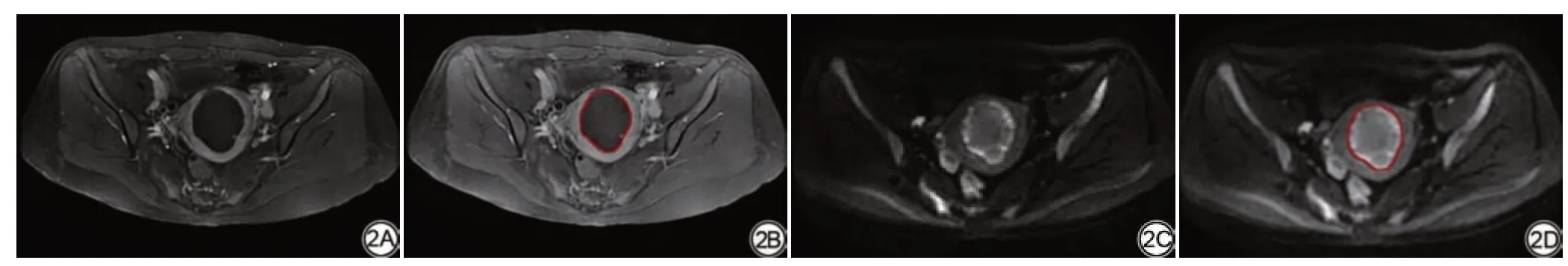
图2 女,44岁,子宫腺肌病患者CE-MRI与DWI的ROI勾画示意图。2A:CE-MRI静脉期图像,消融灶无对比剂充填呈低信号;2C:DWI高b值(b=800 s/mm2)图像,消融灶呈高信号,周边呈环状更高信号;2B、2D:CE-MRI 及DWI 图像上勾画消融灶ROI。CE-MRI:增强磁共振成像;DWI:扩散加权成像;ROI:感兴趣区。Fig.2 ROI schematics of CE-MRI and DWI (b=800 s/mm2) in a 44-year-old patient with adenomyosis.2A: CE-MRI venous phase image indicate a non-perfused area with low signal; 2C: DWI with high b value depict the area of ablation with high signal and higher signal ring in the periphery; 2B, 2D: ROI schematics of ablation necrosis tissue outlined by the doctor on T2WI and CE-MRI.CE-MRI: contrast-enhanced magnetic resonance imaging; DWI: diffusion weighted imaging;ROI: region of interest.

图3 女,39 岁,子宫腺肌病患者HIFU 治疗前后病灶ADC 值测量示意图。3A:HIFU 治疗前DWI(b=800 s/mm2)图,病灶呈稍高信号;3B:HIFU 治疗前ADC图,病灶轻度弥散受限,ADC 值=1.03×10-3 mm2/s;3C:HIFU 治疗后DWI(b=800 s/mm2)图,病灶呈明显环样信号,中心呈稍低信号、外周呈高信号;3D:HIFU治疗后ADC图,病灶中心弥散受限减轻,ADC值=1.21×10-3 mm2/s。HIFU:高强度聚焦超声;ADC:表观扩散系数;DWI:扩散加权成像。Fig.3 Schematics of measuring ADC values before and after HIFU treatment in a 39-year-old patient with adenomyosis.3A: Pre-treatment DWI (b=800 s/mm2)show the lesion with slightly high signal; 3B: Pre-treatment ADC show the diffusion was mildly limited, and the ADC value is 1.03×10-3 mm2/s; 3C: Post-treatment DWI (b=800 s/mm2) show a distinct ring-like signal with a slightly lower signal in the center and a higher signal in the periphery; 3D: Post-treatment ADC show the diffusion limitation in the center of the lesion is reduced, and the ADC value is 1.21×10-3 mm2/s.HIFU: high intensity focused ultrasound; ADC: apparent diffusion coefficient; DWI: diffusion weighted imaging.
1.5 统计学分析
使用SPSS 27.0 软件(IBM, Armonk, NY, USA)进行统计学分析。计数资料以率表示,符合正态分布的计量资料以均数±标准差()表示,非正态分布的数据以中位数和四分位数间距M(Q1,Q3)表示。采用Kappa 检验评估两名观察者间DWI 信号变化区形态分型的一致性。观察者间DWI 信号变化区体积及DWI 与CE-MRI 上消融灶体积的差异性分别采用Wilcoxon符号秩检验、Mann WhitneyU检验,消融前后病灶ADC 值变化采用配对样本t检验,P<0.05为差异有统计学意义。通过Spearman相关性分析判断DWI信号变化区体积与CE-MRI上NPV的关系。
2 结果
2.1 一般资料
收集82例子宫腺肌病患者资料,共计82个消融坏死区。在CE-MRI上测量的NPV为1.09~188.90 cm3,中位体积为38.62(20.15,82.39)cm3。DWI 信号变化区形态分型:72 例呈环状高信号,4 例呈斑片状高信号,3 例呈斑点状高信号或无明显信号改变,另有3 例呈环状低信号,即Ⅰ型3 例、Ⅱ型4 例、Ⅲ型75例(表1)。
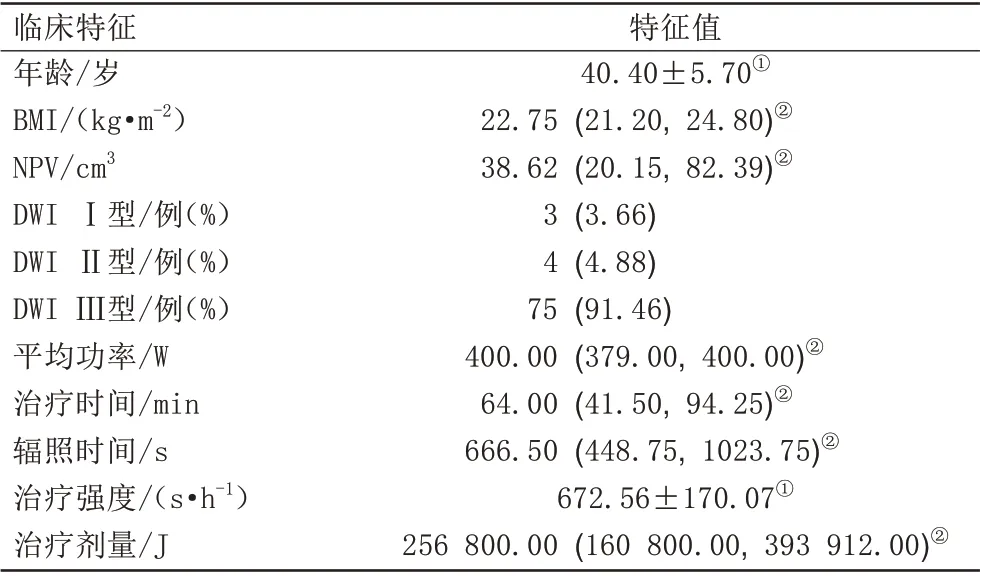
表1 研究对象基线特征Tab.1 Baseline data of adenomyosis
2.2 DWI信号变化区形态分型一致性
两名观察者对Ⅰ型3例、Ⅱ型3例及Ⅲ型74例消融灶判断结果一致,具有非常好的观察者间一致性(k=0.848,P<0.001;表2)。
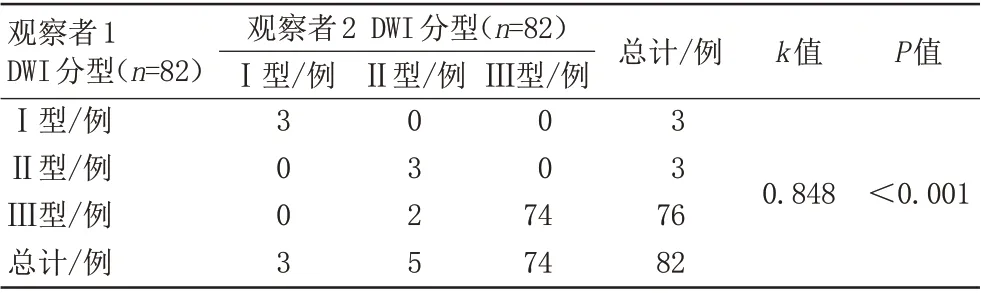
表2 两名观察者DWI信号变化区形态分型结果比较Tab.2 Comparison of morphological classification of DWI signal change areas
2.3 DWI信号变化区体积与CE-MRI上NPV情况
DWI 信号变化区分型为Ⅰ型者共3 例,CE-MRI 上NPV分别为1.09 cm3、1.79 cm3和3.70 cm3,最大体积为3.70 cm3。Ⅱ型、Ⅲ型病灶共79例占96.34%,两名观察者DWI 上所测体积分别为39.75(24.43,85.60)cm3、41.79(25.40,82.62)cm3,观察者间可靠性良好(Z=-0.552,P=0.581);CE-MRI 上NPV 为41.71(20.72,87.03)cm3,与DWI上体积具有良好的一致性,差异无统计学意义(Z=-0.085,P=0.932)。Ⅲ型病灶中表现为完整信号环者41 例,非完整信号环者34 例,两组中DWI上体积与NPV差异均无统计学意义(P>0.05;表3),两组中HIFU治疗各参数差异亦无统计学意义(P>0.05;表4)。通过Spearman相关性分析判断DWI信号变化区体积与CE-MRI上NPV的关系,绘制散点图显示两者之间存在显著正相关关系(r=0.975,P<0.001;图4)。
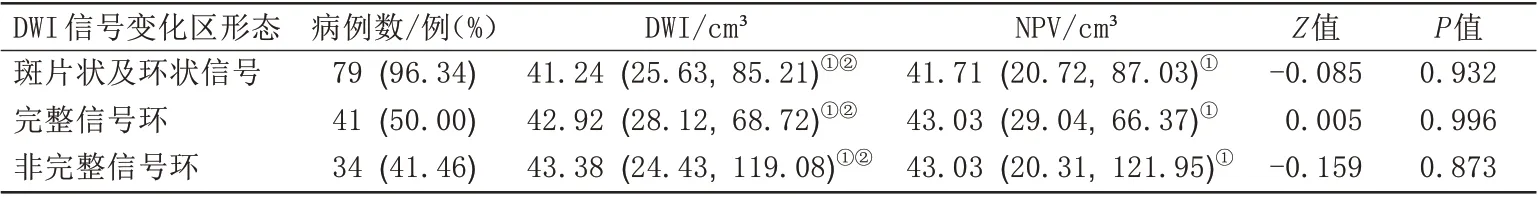
表3 DWI上不同形态表现的消融灶体积与CE-MRI上NPV比较Tab.3 Comparison of the volume of ablation lesions with different morphologies on DWI and nonperfused volume on CE-MRI
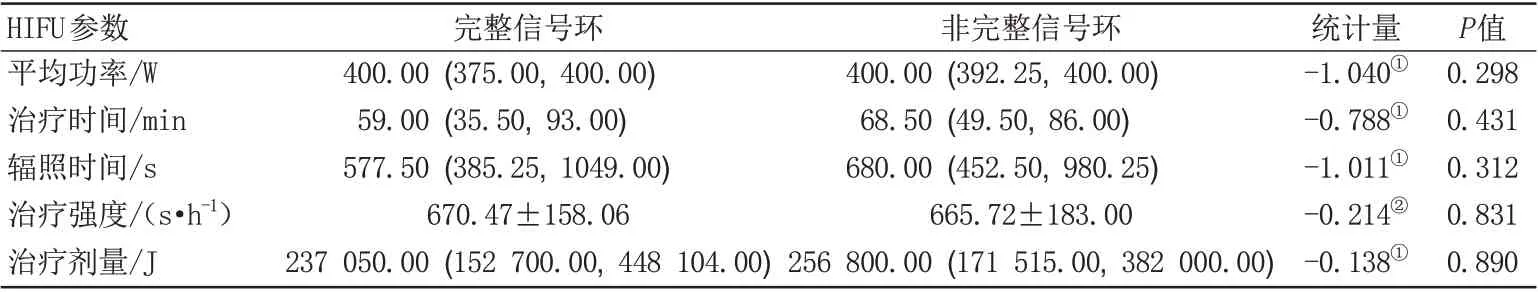
表4 DWI上不同类型信号环病灶HIFU治疗情况Tab.4 Treatment parameters of HIFU for lesions with different ring-like signals on DWI
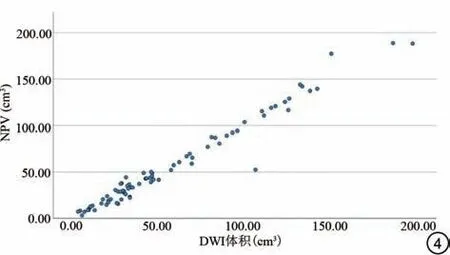
图4 DWI上信号变化区体积与CE-MRI上NPV相关性散点图,两者存在显著的正相关关系。DWI:扩散加权成像;CE-MRI:增强磁共振成像;NPV:非灌注区体积。Fig.4 Scatter plot of the volume of signal change areas on DWI with nonperfused volume on CE-MRI.And there is a significant positive correlation between them.DWI: diffusion weighted imaging; CE-MRI:contrast-enhanced magnetic resonance imaging; NPV: nonperfused volume.
2.4 HIFU治疗前后病灶ADC值变化情况
HIFU 术后子宫腺肌病病灶ADC 值为0.90~1.33(1.17±0.09)mm2/s,术前病灶ADC 值为0.82~1.52(1.09±0.13)mm2/s,差异有统计学意义(t=-4.106,P<0.001)。
2.5 不良反应
本研究中主要不良反应包括:手术过程中,18 例(21.95%)患者下肢放射痛,39 例(47.56%)患者骶尾骨或臀部不适,18例(21.95%)患者皮肤灼热感,56例(68.29%)患者治疗区疼痛,5 例(6.10%)患者腹股沟痛;手术后,73例(89.02%)和22例(26.83%)患者分别出现治疗区及骶尾骨轻度疼痛,13 例(15.85%)患者出现阴道排液,最长症状持续时间不超过两天,全部患者无严重并发症发生。
3 讨论
本研究通过观察82 例子宫腺肌病患者HIFU 术后早期病灶DWI信号特征,测量表现为斑片状或环状信号的79 个消融灶体积,将DWI 上测量的体积与CE-MRI 上NPV 进行比较,同时观察消融前后病灶ADC值变化情况。研究结果提示,DWI 可以确定子宫腺肌病HIFU 术后早期消融灶的存在与范围,并可定量评价,可用于术后早期疗效评价,这将明显减少钆对比剂的使用,减少不良事件发生,节约扫描时间,降低检查费用,使检查更加安全和经济。
3.1 DWI应用于HIFU术后消融效果评价
3.1.1 HIFU术后消融灶DWI特征变化
DWI是MRI平扫中应用最广泛的一种功能成像序列,其ADC值不仅可反映水分子在细胞内及细胞间的自由扩散情况,而且能有效反映出微循环的变化,从而在分子水平上反映组织的细胞环境及微结构变化,ADC值与水分子扩散运动呈正相关,DWI图像信号则与水分子弥散呈负相关[21,31-32]。
与既往研究相同,本研究中HIFU治疗子宫腺肌病术后48 h 内消融灶ADC 值较术前升高,DWI 上主要表现为环样(87.80%)或斑片状(4.88%)高信号,环样信号内部呈相对低信号[20,23-24]。王晓燕等[33]及丁立等[25]则分别报道HIFU术后48 h与5 d内消融灶ADC值较术前减低;分析原因,可能与术后复查时间不同病灶凝固性坏死进程不同,消融区ROI未完全避开边缘的细胞水肿区域等有关[23,25,33]。其生物学机制可能是HIFU的多种生物学效应,引起病灶内细胞蛋白质变性、细胞膜功能异常、细胞坏死等病理生理改变,致使病灶内出现不可逆的组织凝固性变性坏死,阻碍水分子扩散,同时微循环消失或减少,故术后24 h 内ADC 值降低[24,34];而24 h后,随着细胞裂解,细胞膜破坏,细胞液释出,水分子扩散能力逐渐增加,水分子弥散更加自由,ADC值增高[20,23-24];DWI周边高信号环则可能与消融灶边缘细胞水肿导致水分子弥散受限有关[20,23,34]。此外,本组有3例呈环状低信号,结合病灶在T1WI、T2WI上均表现为环状低信号,考虑可能为消融灶周围微出血所致[34-35]。提示,HIFU治疗后DWI上病灶信号及ADC值明显变化,DWI能明确显示消融灶的发生。
3.1.2 HIFU术后消融灶体积评价
本研究对子宫腺肌病HIFU 术后DWI 上信号变化区形态分型,斑点状或无明显信号改变(Ⅰ型)、斑片状信号改变(Ⅱ型)及环状信号改变(Ⅲ型)[26],两名观察者间一致性良好(Kappa 值为0.848),说明该分型方法具有较高的可靠性。对Ⅱ型及Ⅲ型病灶测量体积,DWI信号变化区体积与NPV差异无统计学意义,且存在显著的正相关关系(r=0.975,P<0.001),说明DWI 信号变化区与CE-MRI 上NPV 所代表区域的边缘近似、具有较好的形态一致性,与既往研究相同[20,24,26]。LIAO 等[23]观 察 子 宫 肌 瘤HIFU 术 后DWI 特征,发现DWI上消融灶表现为非完整高信号环时,DWI信号变化区与CE-MRI上非灌注区体积差异有统计学意义。与此不同,本研究结果显示,无论DWI 上消融灶是否表现为完整信号环,所测体积与NPV差异均没有统计学意义;并且两组中治疗能量、时间、强度、剂量等差异均无统计学意义,表明信号环的完整与否与HIFU 治疗的参数无关。分析原因,在本研究中术后DWI 上部分消融灶虽表现为非完整信号环,但其环状信号所缺失的部分多可以通过显示的部分信号环及参考其他平扫序列图像勾勒出边界。此外,本组3例DWI上显示消融效果不理想的Ⅰ型病灶,CE-MRI上消融效果亦不理想,最大消融灶体积仅为3.70 cm3。提示,DWI信号变化区体积可有效评估子宫腺肌病HIFU术后早期消融体积。
3.2 本研究的局限性
本研究的不足之处:本研究为单中心回顾性研究,病例数相对较少,所得参数及结果可能存在偏倚,同时本研究中只纳入了子宫腺肌病HIFU 术后48 h 内复查的影像学资料,有待于以后纳入影像学及临床症状等指标对子宫腺肌病HIFU术后早、中、远期疗效进行多中心、大样本、前瞻性、随机对照研究。
4 结论
综上所述,DWI 序列作为MRI 平扫常用的功能成像序列,不使用对比剂即可以确定消融灶的发生及范围,并可定量评价,DWI 能够有效评估子宫腺肌病HIFU 术后早期消融效果。该方法安全、经济、简单、易行,具有较高的临床价值。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:吕发金指导设计本研究方案,对稿件重要内容进行了修改,获得了超声医学工程国家重点实验室开放课题资助;唐明梅起草和撰写稿件,在收集、整理、统计及分析数据等方面完成大量工作;王璐、张珂、潘缘蕊、刘惠在收集、整理及分析数据等方面做了贡献,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
