T2WI、DWI序列联合血清CA125在子宫肉瘤与非典型子宫肌瘤鉴别诊断中的应用
2024-01-04潘缘蕊刘洋唐明梅刘惠张珂吕发金
潘缘蕊,刘洋,唐明梅,刘惠,张珂,吕发金,*
作者单位:1.重庆医科大学生物医学工程学院(超声医学工程国家重点实验室),重庆 400016;2.重庆医科大学重庆市生物医学工程学重点实验室,重庆400016;3.重庆医科大学附属第一医院放射科,重庆 400016
0 前言
子宫肉瘤(uterine sarcoma, US)是一种罕见且极具侵袭性的恶性肿瘤,在子宫体恶性肿瘤中所占比例不到10%。由于US进展和扩散速度较快、预后极差,五年的总体生存率约17.5%~54.7%,主要治疗方式是包括或不包括双侧附件切除的子宫全切术[1-2]。子宫肌瘤(leiomyoma, LM)是女性生殖系统中最常见的一种良性肿瘤,常见于育龄期妇女,发生率约为70%~80%,患者可选择手术治疗,同时也可选择包括随访、药物治疗,或子宫动脉栓塞术(uterine artery embolization, UAE)和高强度聚焦超声(high-intensity focused ultrasound, HIFU)等多种微无创治疗方法[3-4]。不当的治疗方式可能导致疾病进展,美国食品药品监督管理局(Food and Drug Administration, FDA)就曾报道一例因将肉瘤诊断为肌瘤而选择腹腔镜下的肌瘤粉碎术导致了肿瘤腹腔播散的病例[5]。因此,术前对两组疾病进行鉴别就显得尤为重要。
目前,MRI 在US 和LM 的鉴别上已被广泛使用[6-8],然而非典型子宫肌瘤(atypical leiomyoma, ALM)由于水肿、囊变、出血等多种退行性改变和富于细胞型子宫肌瘤的存在,导致病变在T1WI和T2WI序列上出现高信号[9],造成与US的鉴别困难。因此,有学者对T2WI和扩散加权成像(diffusion weighted imaging, DWI)序列在US和LM鉴别中的价值进行了研究[10-13]。除了影像技术外,也有学者对血清学指标在两种疾病鉴别中的价值进行了探索。癌抗原125(cancer antigen 125, CA125)以往作为卵巢癌的肿瘤标记物在卵巢癌的诊断、治疗、进展及其复发监测和治疗选择中发挥较大作用[14]。近年来,有研究显示US 患者的血清CA125水平明显高于LM患者,说明其在这两组子宫疾病的鉴别中也具有一定的价值[15-16]。但目前国内外对 于T2WI 和DWI 序 列 联 合 血 清CA125 在US 和ALM 鉴别中的研究较缺乏。因此,本研究旨在探索T2WI 和DWI 信号强度及平均表观扩散系数(mean apparent diffusion coefficient, mADC)值联合血清CA125 单独及联合使用在US 与ALM 鉴别诊断中的价值,为临床术前治疗方式的选择提供帮助。
1 材料与方法
1.1 研究对象
回顾性分析2011 年1 月至2023 年2 月间我院由病理证实的59例US和256例ALM(包括变性子宫肌瘤和富于细胞型子宫肌瘤)患者的血清学及MRI 资料。纳入标准:(1)经手术病理证实为US 或者ALM 患者;(2)术前MRI 数据完整(包括T2WI和DWI序列)和术前血清CA125数据完整。排除标准:(1)术前放疗、化疗、激素治疗、介入治疗和HIFU治疗患者;(2)MRI图像不清晰或者血清标志物不全;(3)外院行病灶切除术;(4)合并妊娠、其他腹盆腔恶性肿瘤、急性感染性疾病(如上呼吸道感染或白细胞计数≥10×109/L 等情况)或者严重血液系统疾病(缺铁性贫血除外);(5)合并严重脏器功能障碍者;(6)术后依据国际妇产科联盟(Federation of Gynecology and Obstetrics,FIGO)分期的Ⅳ期患者。考虑到数据的平衡性,按1∶2 比例随机选取256 例ALM 患者中的118 例作为对照组。
本研究遵守《赫尔辛基宣言》,经重庆医科大学附属第一医院伦理委员会批准,免除受试者知情同意,批准文号K2023-122。
1.2 研究方法
1.2.1 临床资料
所有患者的信息在收集、整理过程中均进行加密处理,以保护患者的隐私。采集的临床资料包括年龄、临床症状(异常阴道流血、流液;无明显症状;肿瘤压迫症状)、绝经状态及实验室检查包括术前血清CA125。所有资料均为获得最终病理当次入院时的信息。血清学指标正常参考值如下:CA125<35.00 U/mL。
1.2.2 MRI扫描
所有患者均使用美国通用电气公司生产的3.0 T Signa HDxt MRI 扫描仪,八通道体部线圈,行盆腔检查。T2WI序列扫描参数:TR 4400.0 ms,TE 106.6 ms,视野28.0 cm×22.4 cm,矩阵288×224,层厚5.0 mm,层间距1.5 mm,激励次数1.0 次;DWI 序列扫描参数:TR 4375.0 ms,TE 65.6 ms,视野36.0 cm×27.0 cm,矩阵128×128,层厚5.0 mm,层间距1.5 mm,激励次数5.0次,b值0、800 s/mm2。
1.2.3 MRI图像分析
T2WI 和DWI 信号强度评估由两名分别具有10 年(主治医师)和3 年(住院医师)腹部MRI 诊断经验的放射科医师在不知患者临床和病理信息的情况下进行。任何意见不一致均在仔细商讨或与第三名具有30 年相关诊断经验的放射医学主任医师商讨后取得一致性意见。在T2WI 图像上,通过与子宫肌层信号比较,将肿瘤实性成分信号强度分为:(1)低信号,低于子宫肌层信号;(2)等信号,等于子宫肌层信号;(3)高信号,高于子宫肌层信号。在较高b 值DWI 图像中,通过与子宫肌层和子宫内膜信号比较,将肿瘤实性成分信号强度分为:(1)低信号,等于或低于子宫肌层;(2)等信号,高于子宫肌层低于子宫内膜;(3)高信号,等于或高于子宫内膜。定量评估包括对病变最大径和ADC 值的测量。在轴位压脂或非压脂T2WI图像中测量肿瘤最大左右径、前后径,在矢状位压脂或非压脂T2WI图像中测量肿瘤最大上下径,三者最大值作为最终的肿块最大径值。ADC值根据DWI原始图像经GE 后处理工作站(AW-server workstation,4.7, GE Healthcare)上自动生成相应的ADC 图进行测量,在ADC 图上放置一个圆形的感兴趣区域(region of interest, ROI),ROI 大小约481(273,786)mm2。通过T2WI 和增强图像避开病变内的出血、坏死和囊性部分,在ADC图上测量实性部分最大区域的ADC值,最终选取mADC值进一步分析。
1.2.4 统计学分析
所有统计分析采用SPSS 26.0 软件(IBM,Armonk, NY, USA)进行。采用Mann-WhitneyU检验比较两组血清标志物的分布、肿瘤最大径和mADC值,采用独立样本t检验比较两组的年龄分布,采用卡方检验对定性数据进行评估。计算CA125、T2WI、DWI、mADC 值及联合检测方式的敏感度和特异度。利用各指标的预测概率构建受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC)和最佳截断值。P<0.05为差异有统计学意义。
2 结果
2.1 US和ALM患者病理类型分布
US 组中各个亚型占比由高到低依次为子宫内膜间 质 肉 瘤(endometrial stromal sarcoma, ESS)30 例(50.8%),子宫平滑肌肉瘤(leiomyosarcoma,LMS)21 例(35.6%),其他类型8 例(13.6%)。ALM 不同的类型中,以48 例玻璃样变最为常见(40.7%),其余依次为水肿变性19例(16.1%),富于细胞型子宫肌瘤18例(15.3%),红色样变13例(11.0%),脂肪平滑肌瘤10 例(8.5%),黏 液 样 变7 例(5.9%)和 钙 化3 例(2.5%),并且一个肌瘤可同时伴有多种变性。
2.2 US 和ALM 组间临床资料、T2WI 信号、DWI 信号、mADC值和血清学指标的差异性分析
US 组患者临床多表现为异常阴道流血、流液(P<0.001)。US 组和ALM 组患者血清学指标的组间比较显示,US 组的血清CA125 显著高于ALM 组(P<0.05)。US 和ALM 组患者MRI 指标的组间比较显示,在T2WI 序列上,US 组肿瘤实性成分相较于ALM 组更多地表现为高信号。在DWI序列上,US组肿瘤实性成分相较于ALM 组更多的表现为高信号,且mADC 值显著低于ALM组(P均<0.001)。详见图1~3,表1。
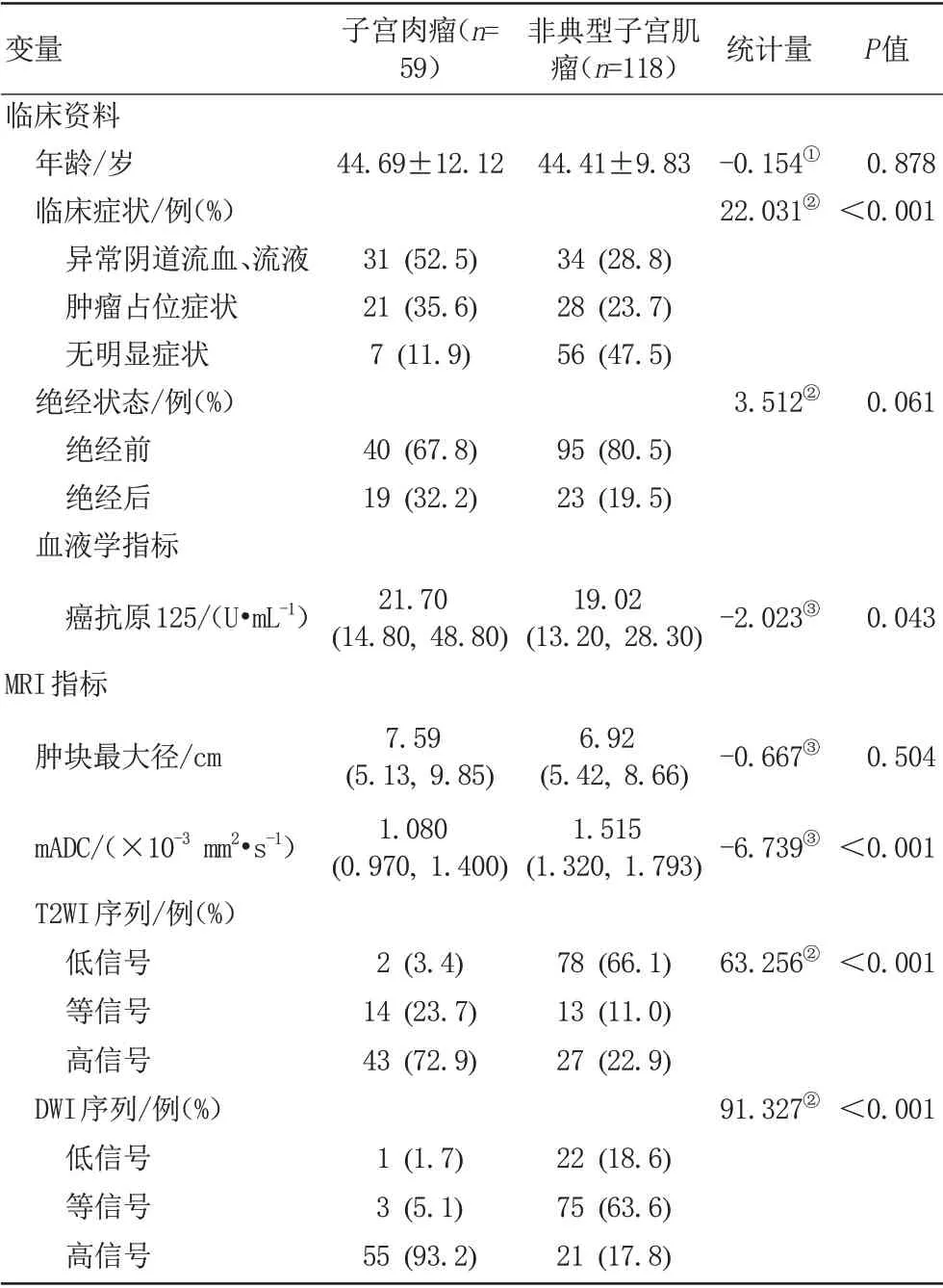
表1 子宫肉瘤和非典型子宫肌瘤组临床和MRI指标比较Tab.1 Comparison of clinical and MRI indices between atypical leiomyomas and uterine sarcomas
2.3 T2WI、DWI、mADC值和血清CA125在US与ALM中的鉴别诊断效能
DWI、T2WI、mADC 值和血清CA125 作为独立指标在US 与ALM 的AUC 分别为0.876、0.827、0.811、0.593。以≥23.41 U/mL 作为截断值时,血清CA125 的特异度为69.5%,敏感度为49.2%。T2WI的特异度为66.1%,敏感度为96.6%。DWI 的特异度为82.2%,敏感度为93.2%。以≤1.165×10-3mm2/s为截断值时,mADC值的特异度为59.3%,敏感度为89.8%(表2)。T2WI、DWI、mADC值联合血清CA125 鉴别US 和ALM 的AUC 为0.981(P<0.001),敏感度为98.3%,特异度为92.4%(图4)。
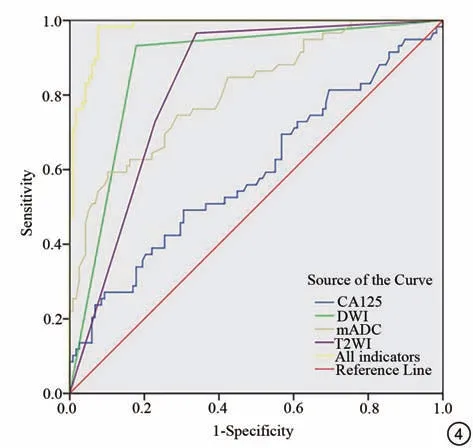
图4 术前T2WI、DWI、mADC、血清CA125 各独立指标及联合指标的受试者工作特征曲线。DWI:扩散加权成像;mADC:平均表观扩散系数;CA125:癌抗原125Fig.4 The receiver operating curves of preoperative model combination of T2WI, DWI, mADC, serum CA125 and combined indicators.DWI:diffusion weighted imaging; mADC: mean apparent diffusion coefficient;CA125: cancer antigen 125.
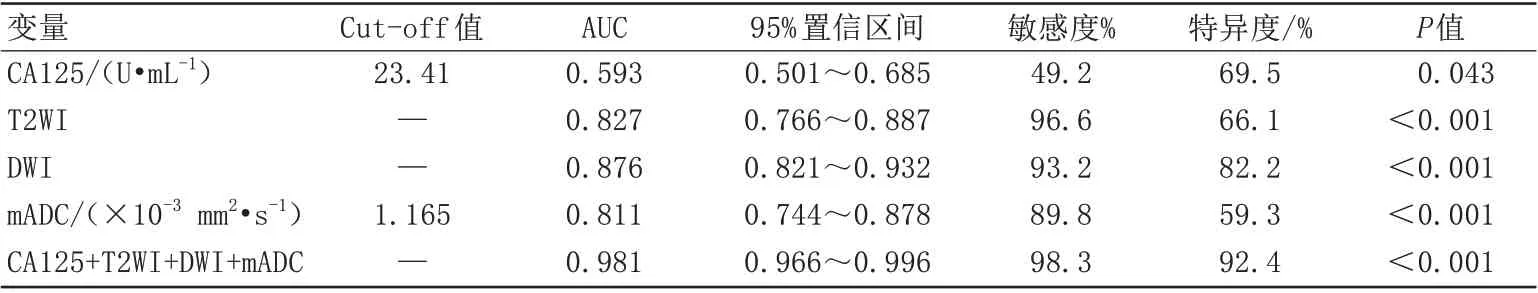
表2 T2WI、DWI、mADC、CA125评价诊断效果Tab.2 T2WI, DWI, mADC, CA125 evaluation of diagnostic results
3 讨论
本研究基于T2WI 信号强度、DWI 信号强度及mADC 值联合血清学CA125 构建logistic 回归模型用于US和ALM(包括变性子宫肌瘤和富于细胞型子宫肌瘤)的鉴别诊断,取得了较好的诊断效能,其AUC、敏感度和特异度分别为0.981、98.3%和92.4%,联合模型的诊断效能优于单一指标模型,联合模型的构建更好地为临床治疗方式的选择提供参考,具有一定的临床意义。
3.1 临床资料在鉴别诊断US与ALM中的影响分析
本研究发现US的临床表现主要为异常的阴道流血、流液,而ALM多为无明显症状的偶然发现,与既往研究一致[17]。这可能是由于US 起源于肌层或内膜间质,加之其恶性肿瘤浸润性生长的特性,导致子宫内膜极易受到侵犯,进而引起异常阴道流血、流液症状。而ALM作为良性肿瘤,生长方式多以膨胀性生长为主,所以多无症状,只在生长体积较大时,引起压迫症状[18]。同时本研究结果显示,US 患者的年龄和绝经状态与ALM 比较虽有差异,但并无统计学意义(P=0.878、0.061)。既往有研究认为US 组更易发生于绝经后较高龄的妇女[2,19]。我们考虑这可能是由于以往的研究在US 组中纳入了癌肉瘤,而有研究显示癌肉瘤的发病年龄一般要高于US[20]。根据最新的WHO 女性生殖器官肿瘤分类癌肉瘤已被归类为去分化的子宫内膜癌,而不作为子宫肉瘤的亚型[21]。本研究以病理为分组标准排除了癌肉瘤,这可能是造成两组患者年龄无显著性差异的主要原因。
3.2 血清CA125在US与ALM中的鉴别诊断价值
CA125 为人体腔上皮细胞表面抗原,当含有CA125 抗原组织呈现异常时,患者血清CA125 的浓度将会升高。CA125在卵巢癌患者的病情评估及疗效、预后监测中的价值目前已得到广泛认可[14,22],但在US 诊断中的价值仍处于探索阶段。YAN等[16]发现US组患者术前血清CA125高于LM组,敏感度为55.0%,特异度为61.9%。ZHANG 等[23]发现LMS 组患者术前血清CA125 高于变性子宫肌瘤组,敏感度为36.8%,特异度为90.2%。而SKORSTAD等[24]的研究发现血清CA125对LMS的敏感度较差,但CA125 的异常与疾病的进展有关,其高值可以较好用于预测晚期疾病。本研究结果也显示,US 组患者术前血清CA125 显著高于ALM 组,其鉴别两种疾病的敏感度较低,为49.2%,特异度为69.5%,AUC为0.593。但与以往研究不同的是,本研究对照组纳入的患者为ALM(变性子宫肌瘤和富于细胞型子宫肌瘤),这说明即使用于鉴别US和伴有继发性改变的子宫肌瘤和富于细胞型子宫肌瘤,CA125 仍有一定的价值。同时本研究结果显示,CA125 用于两者鉴别的最佳临界值为23.41 U/mL,既往研究提出的最佳临界值范围为21.67~30.85 U/mL[16,23],均处于正常值范围内(<35.00 U/mL),这一结果说明,仅通过CA125 这一指标对两者进行鉴别存在一定难度,本研究进一步的单因素分析也证实了这一点。此外本研究还发现,纳入ESS、腺肉瘤、横纹肌肉瘤等其他US亚型后发现血清CA125 对于两组疾病的鉴别仍有一定价值,这是对既往仅纳入平滑肌肉瘤的研究进一步补充。但基于本组数据,仅应用血清学指标对两组疾病进行鉴别仍有较大的局限性。
3.3 T2WI和DWI序列在US与ALM鉴别诊断中的价值
US 易发生坏死、囊变和出血,这与变性肌瘤难以鉴别,故本研究中通过观察肿瘤的实性成分来区分二者。T2WI 序列上的信号强度可反映细胞丰富度、组织含水量、纤维含量、坏死、水肿等特征。我们观察发现在T2WI序列上US组的实性成分相较于ALM组更多的表现为混杂的高信号,与既往研究一致[12-13,25-26]。同时,通过单因素分析我们发现,T2WI信号单独用于两组疾病鉴别的敏感度和特异度分别为96.6%和66.4%。DWI 序列可以反映组织内水分子运动情况,通过检测水分子自由活动度,可对病灶形态和功能进行准确评估,而恶性肿瘤细胞大量增殖、排列紧密使水分子扩散受限,DWI 信号明显增高,故恶性肿瘤的DWI图像特征与良性病变差异明显。ADC值作为定量指标,不仅受细胞数目和排列方式的影响,还与核浆比、细胞器数目以及微循环有关[27]。DWI 序列用于两组疾病的鉴别已有较多研究,对于其在两组疾病鉴别中的价值也得到了较为广泛的认可[28-31]。VALLETTA 等[32]与TOYOHARA 等[33-34]研 究 结 果 指 出,在DWI 序列上LMS 相较于LM 更多的表现为高信号。HIMOTO 等[35]的 研 究 也 指 出,在DWI 序 列 上LG-ESS 相较于LM 也更多表现为高信号。KUMAGAI 等[36]的研究则表明ADC 值在LMS 与LM 的鉴别诊断中可作为独立的影响因素(AUC=0.855)。与上述研究一致,我们观察到在DWI 序列上US 的实性成分相较于ALM 更多的表现为高信号,而mADC 值显著低于ALM。但是,以往研究中只纳入其中一种US 的亚型,模型的普适性还值得进一步探索。而本研究纳入了LMS、ESS、腺肉瘤、横纹肌肉瘤等多种US亚型,说明DWI序列在US与ALM 的鉴别中仍存在一定的价值。同时,通过单因素分析我们发现,DWI 信号单独用于两组疾病鉴别的敏感度和特异度分别为93.2%和82.2%。mADC 值单独检测的敏感度和特异度分别为89.8%和59.3%。多因素分析则显示,T2WI、DWI、mADC 联合血清CA125 提供了比任何指标单独应用时更高的敏感度和AUC。
3.4 本研究的局限性
本研究还存在一定的局限性:首先,本研究是一项单中心的回顾性研究,选择可能存在一定的偏倚;其次,本研究没有外部数据的验证;最后,在ADC图上手动绘制ROI 测量mADC 值在不同经验的医生之间可能存在一定的误差。后续将结合多中心、前瞻性研究,进一步验证其有效性及普适性。
4 结论
综上所述,基于T2WI、DWI 序列定性和定量指标联合血清CA125 构建的logistic 回归模型对鉴别US和ALM具有较好的预测效能,可为临床治疗方式的选择提供参考。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:吕发金酝酿和设计试验,对稿件重要内容进行了修改,获得了超声医学工程国家重点实验室开放课题资助;潘缘蕊在实验数据的收集、统计分析、结果分析等方面完成了大量工作,起草和撰写文章稿件;刘洋、唐明梅、刘惠、张珂在实验数据的收集、数据的分析和统计分析等方面做了贡献,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
