凡纳滨对虾细菌的分离与鉴定
2024-01-03钱诗悦王兴强邹易恒曹梅刘栩华李永
钱诗悦 王兴强 邹易恒 曹梅 刘栩华 李永
摘要以凡纳滨对虾(Litopenaeus vannamei)为研究对象,通过DNA提取和PCR扩增分离鉴定样本中的欧文斯弧菌(Vibrio owensii)、哈维氏弧菌(V.harveyi)、溶藻弧菌(V.alginolyticus)、副溶血性弧菌(V.parahaemolyticus)、新喀里多尼亚弧菌(V.neocaledonicus)、创伤弧菌(V.vulnificus)、坎式弧菌(V.campbellii)、霍乱弧菌(V.cholerae)、含CTX肠毒素霍乱弧菌(V.cholera CTX)、拟态弧菌(V.mimicu)和河流弧菌(V.fluvialis)11种致病性弧菌。根据样本TCBS平板检测结果,统计样本中所检测弧菌的重复出现率,按出现频率逐级分析,对检出率较高的欧文斯弧菌(V.owens)、哈维氏弧菌(V.harveyi)和溶藻弧菌(V.alginolyticus)进行详细探讨,并根据养殖过程出现的具体情况制定相应的预防和控制策略,为凡纳滨对虾细菌性疾病的防治提供技术支撑。
关键词凡纳滨对虾;细菌;分离;鉴定
中图分类号S 945.4+9文献标识码A
文章编号0517-6611(2023)24-0074-04
doi:10.3969/j.issn.0517-6611.2023.24.016
Isolation and Identification of Bacteria from Litopenaeus vannamei
QIAN Shiyue,WANG Xingqiang,ZOU Yiheng et al
(College of Marine Science and Fisheries,Jiangsu Ocean University,Lianyungang,Jiangsu 222005)
AbstractIn this paper,Litopenaeus vannamei were taken as the research object,11 pathogenic Vibrios,including V.owensii,V.harveyi,V.alginolyticus,V.parahaemolyticus,V.neocaledonicus,V.vulnificus,V.campbellii,V.cholerae,V.cholera CTX,V.mimicu and V.fluvialis were isolated and identified by DNA extraction and PCR amplification.According to the detection results of the sample TCBS plate,the repeated occurrence rate of vibrios detected in the sample were counted,analyzing step by step according to the occurrence frequency.V.owens,V.harveyi and V.alginolyticus with high detection rate were discussed in detail,formulating the corresponding prevention and control strategies according to the specific situation in the breeding process and providing technical support for the prevention and treatment of bacterial diseases of L.vannamei.
Key wordsLitopenaeus vannamei;Bacteria;Separation;Identification
凡納滨对虾(Litopenaeus vannamei)是目前产量最高的养殖甲壳类,它具有生长速度快、抗病能力强和出肉率高等优点。从2010年开始,在人工养殖过程中病害频发,导致成活率显著降低甚至绝收,严重影响其养殖的经济效益。凡纳滨对虾常患的病害包括细菌性疾病,病毒性疾病以及寄生虫病,其中细菌性疾病较为常见,如副溶血性弧菌(Vibrio parahaemolyticus)、鳗弧菌(V.anguillarum)、欧文斯弧菌(Vibrio owensii)、哈维氏弧菌(V.harveyi)、溶藻弧菌(V.alginolyticus)、新喀里多尼亚弧菌(V.neocaledonicus)、创伤弧菌(V.vulnificus)、坎式弧菌(V.campbellii)、霍乱弧菌(V.cholerae)、含CTX肠毒素霍乱弧菌(V.cholera CTX)、拟态弧菌(V.mimicu)和河流弧菌(V.fluvialis)以及假单胞菌(Pseudomonas)等引起的相关疾病,其主要表现有红体、红腿、肠炎和烂鳃等症状。
陈健舜等[1]对浙江地区凡纳滨对虾红体病病原研究后,从病虾体内分离出的病原体大多为弧菌,包括副溶血性弧菌、坎氏弧菌和需钠弧菌(V.natriegens),病菌主要分布在凡纳滨对虾体内、甲壳上皮和结缔组织等部位,处于急性期的对虾通体呈红色,特别是尾扇和游泳足最为明显。研究表明,对虾的肝胰腺受到破坏后能够分泌出大量的肝胰腺类胡萝卜素,引起红体症状[2]。夏秋季雨水较多,养殖水体盐度较低,而养殖水温明显升高,凡纳滨对虾易受嗜水气单胞菌(Aeromonas hydrophila)的感染,可诱发红腿病;当凡纳滨对虾患严重的红腿病时,它的胃壁会呈现红色,肝部表现橙黄色[3]。张玲宏等[4]通过显微镜检查发现,红腿病虾患部红色素细胞呈扩张状态,鳃丝末端也存在大量活动的短杆菌,即弧菌。肠炎病多发于7—8月,主要由嗜水气单胞菌、大肠杆菌(Escherichia coli)和沙门氏菌(Salmonella)等细菌感染引起,肠道、胃部呈血红色,中肠红肿、后肠浑浊[5]。该时期水体温度偏高,加上未按时清理饵料和粪便,易引起缺氧和呼吸困难。当凡纳滨对虾细菌性肠炎发病后,轻则营养吸收能力下降导致对虾营养不良、脱壳困难、生长缓慢和空肠空胃等现象,重则导致凡纳滨对虾体质与抗病力下降,容易继发其他细菌病或病毒病,导致偷死或大面积死亡。黄雪敏[6]对2018年广东省湛江地区春夏季凡纳滨对虾烂鳃病主要病原进行探讨,发现为非发光哈维氏弧菌,加上水体污染进一步引起藻类死亡,病原菌的大量蓄积于对虾鳃部,进一步破坏其组织;病虾鳃丝肿大呈灰色,溃烂,缺氧,影响吃食,呼吸艰难和食欲不振;水中大量的藻类颗粒能够通过呼吸进入鳃部,长时间蓄积则会引起黑鳃病以及烂鳃病。
鉴于凡纳滨对虾细菌性疾病频发的现状,该研究通过DNA提取和PCR扩增分离鉴定样本中的欧文斯弧菌、哈维氏弧菌、溶藻弧菌、副溶血性弧菌、新喀里多尼亚弧菌、创伤弧菌、坎式弧菌、霍乱弧菌、含CTX肠毒素霍乱弧菌、拟态弧菌和河流弧菌11种致病性弧菌,以期为凡纳滨对虾细菌性疾病病原菌的确定和对症下药提供技术支撑。
1材料与方法
1.1DNA提取
利用试剂盒提取弧菌DNA,提取的DNA可置于2~8 ℃保存,3 d内使用,或-20 ℃以下长期冻存。
1.2PCR扩增
PCR管中分别加入17 μL的扩增反应液,然后向每个PCR管的液面下加入3 μL对虾样本DNA模板或阴性对照,加入后对样本进行轻轻吸打,之后将盖子盖上,离心数秒备用。根据PCR标准程序扩增,50 ℃ 2 min;94 ℃ 4 min;(94 ℃ 30 s,52 ℃ 30 s,72 ℃ 20 s),40循环;(94 ℃ 30 s,68 ℃ 30 s,72 ℃ 20 s),3循环;4 ℃保存。当扩增反应完成后,马上检测PCR产物或置于-20 ℃保存。
1.3弧菌芯片鉴定
必须在其他的通风房间内进行,切勿与样本DNA提取、PCR扩增的操作在同一环境内进行。试验过程中,需提前20 min把微孔板恒温振荡器打开,温度控制在45 ℃。将对应样本数量的晶格取出,进行标记编号。每份样本应将600 μL 反应液1和待检样本的20 μL PCR扩增产物加入反应槽中。将晶格转入微孔板恒温振荡器,1 500 r/min 振荡10 min。反应结束后,把晶格取出,打开盖子,然后将晶格稍微倾斜,让反应槽内的液体都被吸净。根据实际的检测数量,将预先准备好的混合反应液1和反应液2放置到15 mL的试管中,反应液1每份取量为600 μL,反应液2每份取1 μL。向每个反应槽内分别加入600 μL反应液1和反应液2预混合液,振荡仪1 500 r/min振荡3 min。打开盖子,把晶格稍微倾斜,以使反应槽内的液体被吸收干净。在每个反应槽中加入2 mL的buffer,盖盖,置于恒温振荡仪,1 500 r/min,2 min。为确保将芯片完全浸没,需要在反应槽内加入500 μL的反应液3,然后在恒温条件下,用1 500 r/min 的振荡仪振荡3 min。把自来水依次加入每个反应槽后,缓慢摇晃晶格5 s,观察水中不同芯片上的试验结果。质量控制标准为阴性对照品的膜芯片除HC(用于质控杂交过程的)存在颜色的位置显示外,其他的均不出现任何显色,出现颜色的显示则表示该区域可能存在环境污染情况。
1.4结果判读试验结果如果HC呈阳性,NC探针呈阴性,则可以判断试验结果满足条件,再将不同菌种鉴定试验样本的颜色与芯片探针排布图进行对比,判读致病性弧菌的种类。
2结果与分析
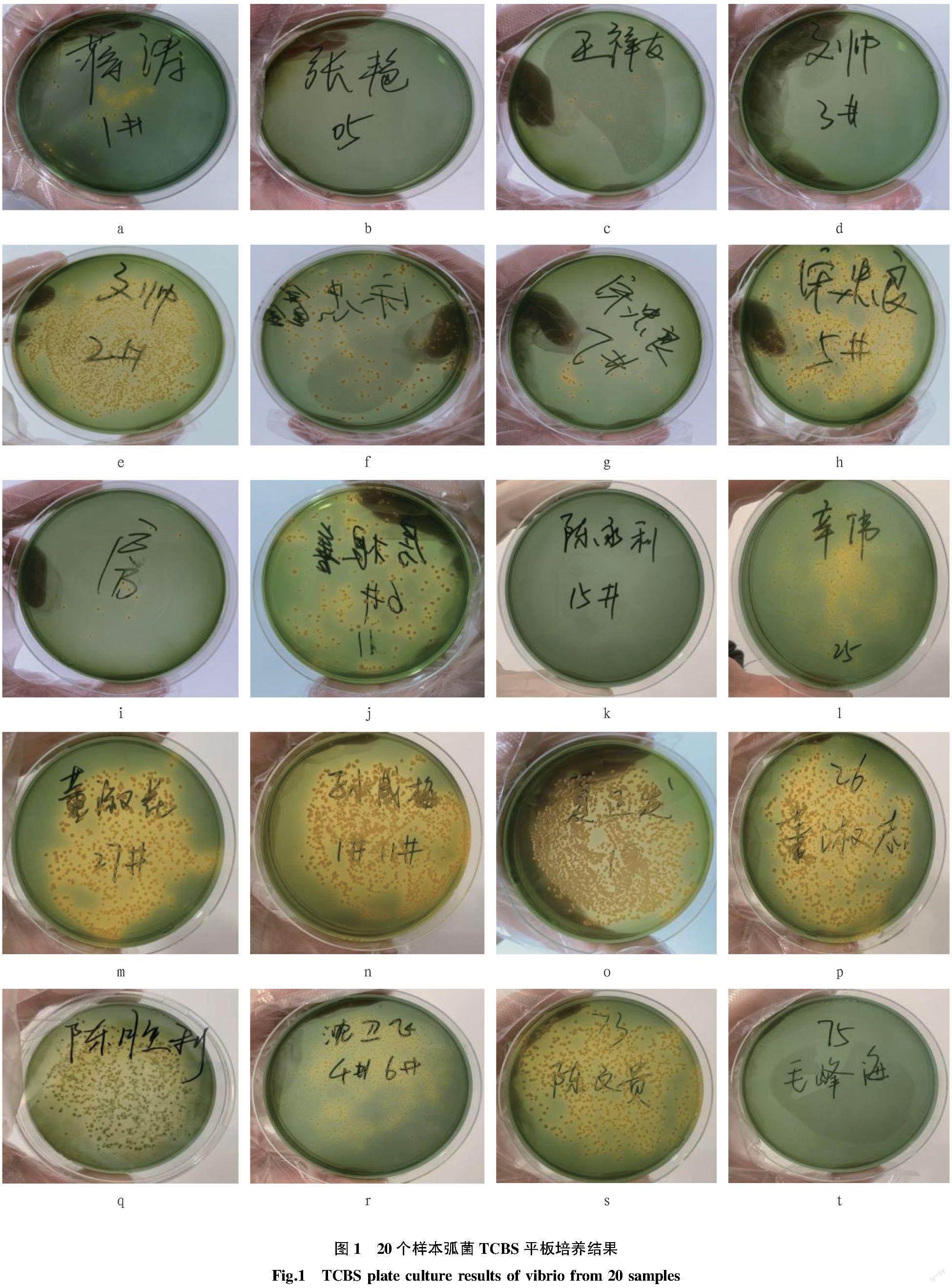
由图1可以看出,蒋涛样本在检测指标内其优势弧菌为哈维氏弧菌和欧文斯弧菌(图1a)。张艳样本TCBS平板培养显示未见黄色菌落与绿色菌落,在检测指标内其存在弧菌为溶藻弧菌和欧文斯弧菌(图1b)。王祥友样本TCBS平板培养显示黄色菌落,在检测指标内其存在弧菌为副溶血性弧菌和欧文斯弧菌(图1c)。文帅第2个样本TCBS平板培养显示为少量黄色菌落,在检测指标内未检出弧菌(图1d);第2个样本TCBS平板培养显示黄色菌落,在检测指标内其存在优势弧菌为副溶血性弧菌,存在弧菌为哈维氏弧菌(图1e)。宋忠鑫样本TCBS平板培养显示为黄色菌落和绿色菌落,在检测指标内其存在弧菌为溶藻弧菌、创伤弧菌和欧文斯弧菌(图1f)。宋忠良第1个样本TCBS平板培养显示为黄色菌落,在检测指标内其优势弧菌为哈维氏弧菌,存在弧菌为溶藻弧菌(图1g);第2个样本TCBS平板培养显示黄色菌落,在检测指标内其存在弧菌为溶藻弧菌、新喀里多尼亚弧菌和欧文斯弧菌(图1h)。房根善第1个样本TCBS平板培养显示为黄色菌落,在检测指标内其存在弧菌为副溶血性弧菌、溶藻弧菌和欧文斯弧菌(图1i);第2个样本TCBS平板培养显示为黄色菌落和少量绿色菌落,在检测指标内其优势弧菌为溶藻弧菌,存在弧菌为哈维氏弧菌和欧文斯弧菌(图1j)。陈永利样本TCBS平板培养未显示菌落,在检测指标内未检出弧菌(图1k)。辛伟样本TCBS平板培养显示为黄色菌落,在检测指标内存在弧菌为哈维氏弧菌和欧文斯弧菌(图1l)。董淑花样本TCBS平板培养显示为黄色菌落,在检测指标内其优势弧菌为哈维氏弧菌和欧文斯弧菌(图1m)。孙成梅样本TCBS平板培养显示为黄色菌落,在检测指标内其优势弧菌为副溶血性弧菌、哈维氏弧菌和欧文斯弧菌(图1n)。夏正发样本TCBS平板培养显示为黄色菌落,在检测指标内其优势弧菌为溶藻弧菌和哈维氏弧菌,存在弧菌为副溶血性弧菌和新喀里多尼亚弧菌(图1o)。董淑志样本TCBS平板培养显示为黄色菌落和绿色菌落,在检测指标内其优势弧菌为欧文斯弧菌,存在弧菌为溶藻弧菌和哈维氏弧菌(图1p)。陈胜利样本TCBS平板培养显示为绿色菌落,在检测指标内其存在弧菌为新喀里多尼亚弧菌和欧文斯弧菌(图1q)。沈卫飞样本TCBS平板培养显示为黄色菌落,在检测指标内未发现弧菌(图1r)。陈文贵TCBS平板培养显示为黄色菌落,在检测指标内优势弧菌为新喀里多尼亚弧菌和欧文斯弧菌,存在弧菌为副溶血性弧菌和溶藻弧菌(图1s)。毛峰海TCBS平板培养显示无菌落,在检测指标内未检测出弧菌(图1t)。
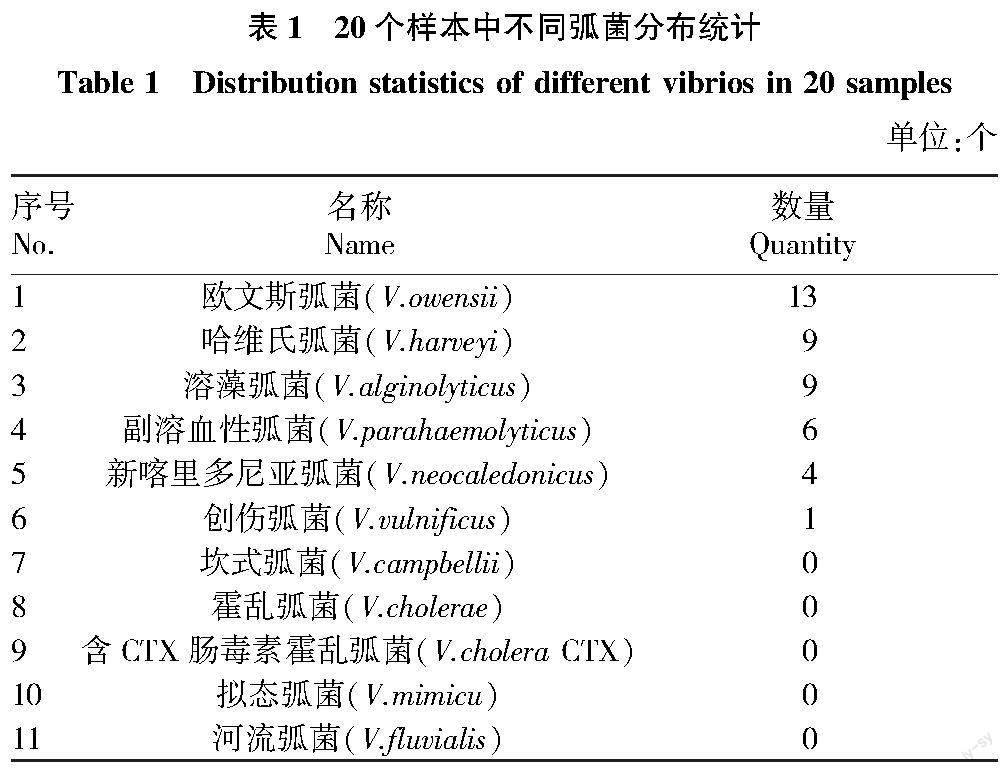
经过对20个样本中不同弧菌分布统计发现,欧文斯弧菌在样本中存在数量为13个,哈维氏弧菌和溶藻弧菌存在数量均为9个,副溶血性弧菌存在数量为6个,新喀里多尼亚弧菌存在数量为4个,创伤弧菌存在数量为1个,其余弧菌种类在样本中未能发现(表1)。
3结论与讨论
欧文斯弧菌可能带导致急性肝胰腺坏死症(EMS)的毒力因子,存在ACMM642等高致病性毒株,水体中含有100 CFU/mL该毒株,即可导致对虾死亡,需要严格防控[7]。哈维氏弧菌是一种重要的致病性海洋弧菌之一,为近海海洋动物体表或体内正常菌群,其在水体或虾体内载量较高时容易导致对虾发光病和胰岛细胞坏死病,该弧菌数量较少时属正常范围[8]。溶藻弧菌是养殖水体主要弧菌病原,数量较多容易直接或间接导致虾苗幼体菌血症、对虾红体症、细菌白斑病,数量较少属于正常[9]。副溶血性弧菌是养殖水体主要病原,即使有少量数量时若在养殖过程中出现毒理蛋白toxinA/B,也可能爆发EMS;由于EMS死亡率较高,故需要严格防控[10]。新喀里多尼亚弧菌在今年最新的报道中指出,该弧菌可能是引发“玻璃苗”的重要病源之一,在玻璃苗中,该菌和溶藻弧菌、副溶血性弧菌为优势菌种[11]。坎氏弧菌可以导致EMS,但世界动物组织尚未将其列入EMS病原菌,但考虑EMS具有较强的致病性,故暂将其定位为需要较严格防控的弧菌种[12]。霍乱弧菌数量较多时易导致對虾红体病,在多处对虾养殖水体中爆发,导致较高的对虾排塘率,该弧菌数量少时属于正常范围[13]。含CTX肠毒素霍乱弧菌致病性较普通霍乱弧菌更强,发病症状为行动呆滞,时而浮头,随着病情加重全身肌肉发白,一般在1周内死亡,需要严格控制[14]。河流弧菌可引发对虾的红体综合征,容易在短期内迅速增殖,故需要严格控制[15]。拟态弧菌能引起水产动物的多种弧菌病,如蟹类的气泡病,黄颡鱼溃烂病等,虽目前未见其对虾养殖影响的明显案例报道,单考虑其含有溶血素、黏附素、外毒素和肠毒素等多种毒素,存在与其他弧菌协同致病的可能,对虾养殖的潜在病原,数量较少时属正常范围[16]。创伤弧菌是三大致病性弧菌之一,同时也是一种人鱼共患病原菌,是人类和水产养殖动物的重要病原弧菌。在水产养殖中,若创伤弧菌超标,可使许多种经济动物患病,如罗非鱼、金鲳鱼、安圭拉鳗鱼、鲟鱼、草鱼和南美白对虾等,该细菌对对虾养殖而言,数量少时属正常范围[17]。
根據20个样本弧菌TCBS平板检测结果,欧文斯弧菌在样本中存在数量最多,哈维氏弧菌和溶藻弧菌存在数量居中,副溶血性弧菌和新喀里多尼亚弧菌存在数量较少,创伤弧菌存在数量最少,因而在购买虾苗时,要选择能提供检验检疫合格证的正规渠道,才能有效地从源头控制病原体进入塘中。虾苗的放养数量不能过大,否则容易减小虾的活动空间,从而虾的摄食量会减少影响营养的吸收,虾的生长将会放慢;同时活动空间减少,会增加虾的相互碰撞刺伤,受伤的虾容易感染病原体从而引发疾病[18]。王淑生[19]研究发现,好的水质对养虾十分重要,想要养好虾需要将水质养好,良好的水质就是水质中具有良好的藻相,这是养殖对虾成功的关键环节。在养殖模式上,主要选用生态养殖方式。生态养殖模式具有水体空间进行了合理的利用,水体的自然净化能力强,从而减少虾的患病等优势,同时生态养殖方式可以减少投入成本,从而提高经济效益。为进一步防治红腿、红体病,应于季节交替时全面消毒养殖池,预防肠炎病的有效措施是定期向水池中泼洒有益活菌,包括EM菌、芽孢杆菌、硝化细菌等。这样可以保持水质优良,水中的氨、氮和亚硝酸盐等含量不超标,同时保持水质中的菌种平衡,不会造成蓝藻过量繁殖[20]。
参考文献
[1]陈健舜,朱凝瑜,丁雪燕,等.浙江省主要养殖区凡纳滨对虾(Litopenaeus vannamei)红体病病原研究[J].浙江大学学报(农业与生命科学版),2014,40(6):697-708.
[2] 周燕侠,余开.说说关于养殖南美白对虾病害的那些事[J].科学养鱼,2013(6):13-16,93.
[3] 姚洪,张吉鹏,杨川,等.辽宁一例凡纳滨对虾大规模死亡的病原研究[J].大连海洋大学学报,2016,31(3):256-260.
[4] 张玲宏,古田.南美白对虾养殖技术与病害防治[J].河南水产,2002(4):17-18.
[5] 王涛.凡纳滨对虾无公害养殖的病害防治技术[J].动物医学进展,2006,27(5):109-111.
[6] 黄雪敏.凡纳滨对虾育苗系统细菌资源挖掘及溶藻弧菌基因组初步分析[D].湛江:广东海洋大学,2020.
[7] LIU F,LI S H,YU Y,et al.Pathogenicity of a Vibrio owensii strain isolated from Fenneropenaeus chinensis carrying pir AB genes and causing AHPND[J].Aquaculture,2021,530:1-9.
[8] ZHAO N,JIA L,HE X,et al.Proteomics of mucosal exosomes of Cynoglossus semilaevis altered when infected by Vibrio harveyi[J].Developmental and comparative immunology,2021,119:1-10.
[9] YIN X L,ZHUANG X Q,LIAO M Q,et al.Andrographis paniculata improves growth and nonspecific immunity of shrimp Litopenaeus vannamei,and protects it from Vibrio alginolyticus by reducing oxidative stress and apoptosis[J].Developmental and comparative immunology,2023,139:1-12.
[10] SANTHOSH P,KAMARAJ M,SARAVANAN M,et al.Dietary supplementation of Salvinia cucullata in white shrimp Litopenaeus vannamei to enhance the growth,nonspecific immune responses,and disease resistance to Vibrio parahaemolyticus[J].Fish and shellfish immunology,2023,132:1-10.
[11] 王印庚,于永翔,刘潇,等.凡纳滨对虾虾苗细菌性玻化症(BVS)的病原、病理分析[J].水产学报,2021,45(9):1563-1573.
[12] PHUKET T R N,CHAROENSAPSRI W,AMPARYUP P,et al.Antibacterial activity and immunomodulatory role of a prolinerich antimicrobial peptide SpPRAMP1 against Vibrio campbellii infection in shrimp Litopenaeus vannamei[J].Fish and shellfish immunology,2023,132:1-9.
[13] JOSEPH T C,MURUGADAS V,REGHUNATHAN D,et al.Isolation and characterization of Vibrio cholerae O139 associated with mass mortality in Penaeus monodon and experimental challenge in postlarvae of three species of shrimp[J].Aquaculture,2015,442:44-47.
[14] KORALAGE M S G,ALTER T,PICHPOL D,et al.Prevalence and molecular characteristics of Vibrio spp.isolated from preharvest shrimp of the North Western Province of Sri Lanka[J].Journal of food protection,2012,75(10):1846-1850.
[15] ALAVANDI S V,VIJAYAN K K,SANTIAGO T C,et al.Evaluation of Pseudomonas sp.PM 11 and Vibrio fluvialis PM 17 on immune indices of tiger shrimp,Penaeus monodon[J].Fish and shellfish immunology,2004,17(2):115-120.
[16] MUNKONGWONGSIRI N,PRACHUMWAT A,EAMSAARD W,et al.Propionigenium and Vibrio species identified as possible component causes of shrimp white feces syndrome (WFS) associated with the microsporidian Enterocytozoon hepatopenaei[J].Journal of invertebrate pathology,2022,192(1):1-10.
[17] JI H,CHEN Y,GUO Y C,et al.Occurrence and characteristics of Vibrio vulnificus in retail marine shrimp in China[J].Food control,2011,22(12):1935-1940.
[18] 高晶,馬力,陈隆升,等.油茶粕制备复合茶皂素清塘剂产品对鱼和虾毒杀效能的研究[J].湖南林业科技,2021,48(3):61-68.
[19] 王淑生.北方地区南美白对虾“135”二茬分级接续养殖技术[J].科学养鱼,2019(6):29-30.
[20] 田国昌.南美白对虾养殖技术与病害防治措施[J].新农业,2022(23):61-62.
