LED光照对灰茶尺蠖成虫保护酶活性的影响
2024-01-03赵筱岑耿书宝武予清张方梅
乔 利, 赵筱岑, 陈 磊, 周 洲, 耿书宝, 武予清, 张方梅,*
(1. 信阳农林学院农学院, 信阳 464000; 2. 河南省农业科学院植物保护研究所, 郑州 450002)
灰茶尺蠖Ectropisgrisescens属于鳞翅目(Lepidoptera)尺蛾科(Geometridae),俗名拱拱虫、拱背虫、吊丝虫,是中国茶树主要害虫之一(陈宗懋等, 2020),分布广泛,全国各产茶区均有发生(王定锋等, 2021)。该虫食量大,繁殖速度快,以幼虫取食茶树幼嫩部分,大发生时可将叶片吃光,严重影响茶叶的产量和品质(罗宗秀等, 2018; Lietal., 2019)。昆虫复眼对黄绿光敏感,在夜晚给予蛾类昆虫一定强度黄绿光照射,可影响其取食、交尾和产卵等活动,从而控制其种群发展(Shimoda and Honda, 2013; 蒋月丽等, 2018)。利用害虫对光的反应或光对其生理特征的影响减少害虫发生量,是一种便捷有效的防治措施,既节能环保又可控制害虫种群数量(Infusinoetal., 2017; Kimetal., 2019; Qiaoetal., 2020; Camachoetal., 2021)。
光对昆虫行为的影响取决于光照波长、光照强度及光照时间(Yangetal., 2012)。夜晚采用波长为565~585 nm,光照强度为10和100 lx的黄光照射10 h,甜菜夜蛾Spodopteraexigua单雌产卵量、产卵历期和成虫寿命显著低于对照组(蒋月丽等, 2020a);夜晚采用光照强度为80 lx的黄光或绿光照射10 h,草地贪夜蛾S.frugiperda成虫寿命、产卵量、孵化率显著降低(蒋月丽等, 2020b);夜间黄光(波长590~595 nm)持续照射(光照强度为50~100 lx) 12 h,灰茶尺蠖的羽化率、产卵量及孵化率均显著低于对照组(乔利等, 2021)。
昆虫受到逆境胁迫时,体内过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)等保护酶和总抗氧化能力(total antioxidant capacity, T-AOC)可以调节自由基的变化,降低活性氧等其他氧化物质对细胞膜系统的破坏(张芸等, 2010; 周冬等, 2014; 方程, 2015; 李品武等, 2016; 卢亚菲等, 2019)。如卢亚菲等(2019)研究发现,短时间紫外辐射能显著提高三叶草彩斑蚜Therioaphistrifolii体内SOD, CAT和POD等保护酶的活性;周冬等(2014)研究发现,麦长管蚜Sitobionavenae受到短期UV-B(280~320 nm)胁迫时,其体内SOD, POD和CAT 3种保护酶活性均升高;方程(2015)研究表明,绿光照射梨小食心虫Grapholitamolesta雌、雄成虫,其体内SOD活性增强;乔利等(2020和2021)研究表明,不同波长的单色光均可引起灰茶尺蠖成虫趋光和避光行为反应,且在波长590~595和520~525 nm条件下灰茶尺蠖成虫单雌产卵量、产卵率和卵孵化率均显著下降。不同波长、不同强度和不同处理时间对灰尺蠖成虫酶活性的影响尚未见报道。本研究以灰茶尺蠖为对象,在LED光两种波长不同光照强度和不同照射时间下,检测雌、雄成虫体内总蛋白含量,POD, SOD和CAT活性及T-AOC在光胁迫下的变化,以阐明其抗逆生理机制,为灰茶尺蠖的综合治理提供理论依据。
1 材料与方法
1.1 供试虫源
灰茶尺蠖试验种群采自河南省信阳市浉河港乡白庙村茶园,于室内人工气候培养箱新鲜茶叶枝条(福鼎大白茶)进行续代饲养,试验用虫为第5代成虫。饲养环境温度为(25±1) ℃,相对湿度为70%±5%,光周期为12L∶12D,光照强度为100~150 lx。
1.2 仪器和试剂
光照培养箱(宁波莱福科技有限公司),-80 ℃冰箱(青岛海信电器股份有限公司), 制冰机(郑州华豫兄弟制冷设备有限公司), 酶标仪(赛默飞世尔科技有限公司),TGL-16S高速冷冻离心机(四川蜀科仪器有限公司),总蛋白含量、 POD, SOD和CAT活性及T-AOC试剂盒(南京建成生物科技有限公司)。
1.3 供试光源
590~595 nm黄色LED光和520~525 nm绿色LED光。
1.4 光照处理
将LED灯安装于纸箱(45 cm×45 cm×37 cm)内,形成灯光反应装置。黄光和绿光光照强度均为40, 80和120 lx,取当天羽化的雌、雄成虫,展翅1 h后,分别置于反应装置内,照射时间分别为1, 2和3 h。每个处理各采用雌、雄成虫20头单独放置,每个处理重复3次。对照组为自然光照射,饲养光周期为12L∶12D。处理后的试虫立即置于液氮中冷冻致死,于-80 ℃超低温冰箱中保存备用。
1.5 酶液提取、总蛋白含量、保护酶活性和T-AOC的测定
将不同波长光照和时间LED光处理后的雌、雄成虫分别装入1.5 mL离心管中,每管装1头试虫,各重复3次。加入50 mmol/L pH 7.0的磷酸缓冲液0.7 mL,冰浴充分研磨,混匀后12 000 r/min 4 ℃下离心15 min,上清液即为酶提取液。总蛋白含量的测定采用比色法,比色波长562 nm;POD活性的测定采用比色法,比色波长420 nm;SOD活性的测定采用WST-1法,比色波长450 nm; CAT活性的测定采用钼酸铵法,比色波长405 nm;T-AOC的测定采用微板法,比色波长405 nm。每样品重复测定3次。测定具体步骤及计算方法参考试剂盒说明进行。
1.6 数据分析
利用SPSS16.0(SPSS Inc., Chicago, IL)进行数据处理。采用单因素方差分析,Duncan氏新复极差法进行差异显著性检验,显著性水平为P<0.05。
2 结果
2.1 LED光照波长、处理时间和强度对灰茶尺蠖成虫总蛋白含量的影响
由表1可以看出,黄光和绿光处理下同一光照强度不同处理时间,灰茶尺蠖雌成虫体内总蛋白含量均显著高于雄成虫的(P<0.05)。随着处理时间的延长,黄光和绿光处理下,灰茶尺蠖雌、雄成虫体内总蛋白含量均随光照强度的增加而呈逐渐增加的趋势,以120 lx光照强度下总蛋白含量最高。

表1 LED光照波长、处理时间和强度对灰茶尺蠖成虫总蛋白含量的影响
40 lx光照强度下,除黄光和绿光处理1 h时的雌成虫总蛋白与对照雌成虫总蛋白含量差异不显著(P>0.05)外,其他处理均与对照的总蛋白含量差异显著(P<0.05);黄光和绿光处理1和3 h时,雌成虫总蛋白含量差异显著(P<0.05),其他处理间差异均不显著(P>0.05);黄光和绿光处理3 h时,雄成虫体内总蛋白含量差异不显著(P>0.05);绿光处理1 h时,雄成虫体内总蛋白含量与其他处理间差异显著(P<0.05)。
80 lx光照强度下,黄光和绿光处理2和3 h时,雌成虫体内总蛋白含量无显著差异(P>0.05),处理1和2 h时雌成虫体内总蛋白含量无显著差异(P>0.05),处理1和3 h时雌成虫体内总蛋白含量差异显著(P<0.05);绿光处理1 h时,雄成虫体内总蛋白含量与其他处理间差异显著(P<0.05)。
120 lx光照强度下,黄光和绿光处理1和3 h时,雌成虫体内总蛋白含量差异显著(P<0.05),其他处理间差异不显著(P>0.05);黄光处理1和2 h时,雄成虫体内总蛋白含量无显著差异(P>0.05);绿光处理1和2 h时,雄成虫体内总蛋白含量差异显著(P<0.05);黄光和绿光处理2和3 h时,雌、雄成虫总蛋白含量均差异不显著(P>0.05);绿光和黄光处理1, 2和3 h时,雌、雄成虫总蛋白含量均与对照差异显著(P<0.05)。
2.2 LED光照波长、处理时间和强度对灰茶尺蠖成虫POD活性的影响
由表2可知,黄光和绿光不同光照强度处理下,随着处理时间的延长,灰茶尺蠖成虫POD活性呈逐渐增加的趋势,除个别雄虫处理1 h之外均高于对照的。同一处理时间随着光照强度的增加,雌、雄成虫POD活性均呈逐渐增加的趋势,且雌成虫中POD活性均显著高于雄成虫中的(P<0.05)。
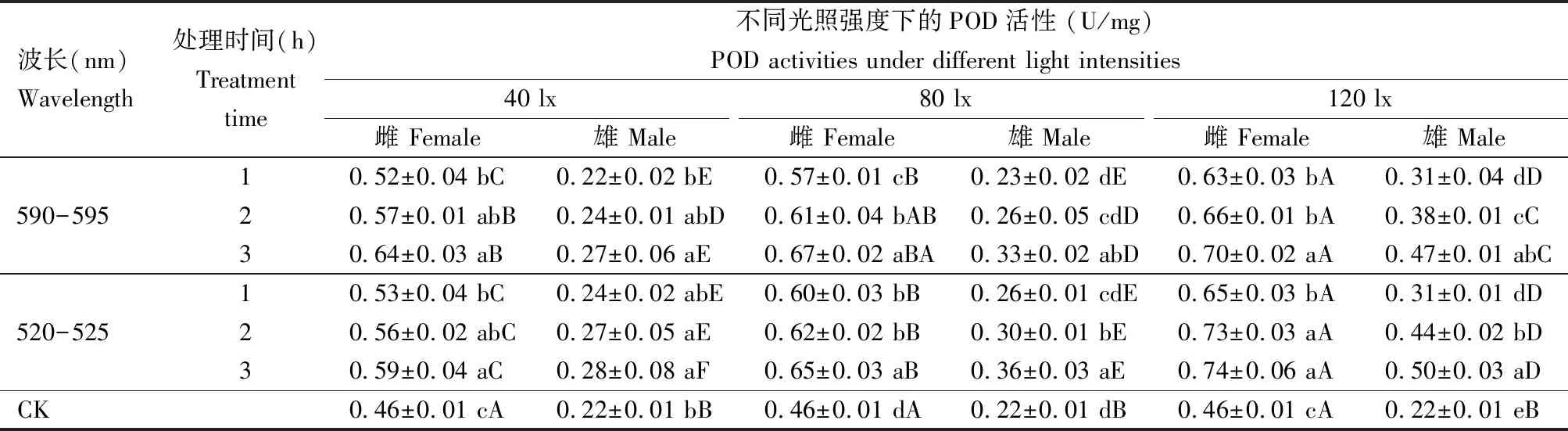
表2 LED光照波长、处理时间和强度对灰茶尺蠖成虫过氧化物酶(POD)活性的影响
40 lx光照强度下,黄光和绿光处理3 h时灰茶尺蠖成虫POD活性均显著高于对照的(P<0.05);雌成虫在黄光和绿光处理1 h时其POD活性无显著差异(P>0.05),且均显著高于对照的(P<0.05);黄光和绿光处理1 h时,雄成虫体内POD活性均与对照无显著差异(P>0.05)。
80 lx光照强度下,两种光处理3 h时POD活性均最高,与其他处理间差异显著(P<0.05);绿光处理1和2 h时,雌成虫体内POD活性差异不显著(P>0.05),雄成虫体内POD活性差异显著(P<0.05);黄光处理1和2 h时,雌成虫体内POD活性差异显著(P<0.05),雄成虫体内POD活性差异不显著(P>0.05)。
120 lx光照强度下,黄光和绿光处理3 h时POD活性均最高,各处理组POD活性均显著高于对照的(P<0.05);黄光处理1和2 h时,雌成虫体内POD活性无显著差异(P>0.05),雄成虫体内POD活性差异显著(P<0.05),均与处理3 h时差异显著(P<0.05);绿光处理下雄成虫体内POD活性的变化趋势同黄光处理下的雄成虫体内POD活性一样,处理1, 2和3 h时,体内POD活性差异均达显著水平(P<0.05);黄光处理下雌成虫体内POD活性表现为处理1和2 h间无显著差异(P>0.05),与处理3 h时差异显著(P<0.05),绿光处理2和3 h间无显著差异(P>0.05),均与处理1 h时差异显著(P<0.05)。
2.3 LED光照波长、处理时间和强度对灰茶尺蠖成虫体内SOD活性的影响
由表3可以看出,在黄光和绿光不同光照强度处理下,灰茶尺蠖雌、雄成虫体内SOD活性随着光照强度的增加呈逐渐增加的趋势,以120 lx光照强度处理下的SOD活性最高,与其他光照强度处理间差异显著(P<0.05)。不同处理下雄成虫体内SOD活性均高于雌成虫体内SOD活性,各处理的雌、雄成虫间SOD活性均差异显著(P<0.05)。3种光照强度处理下,黄光和绿光均表现为随着处理时间的延长SOD活性呈逐渐增加的趋势,各处理组SOD活性均高于对照组的,且各处理以3 h时SOD活性最高。
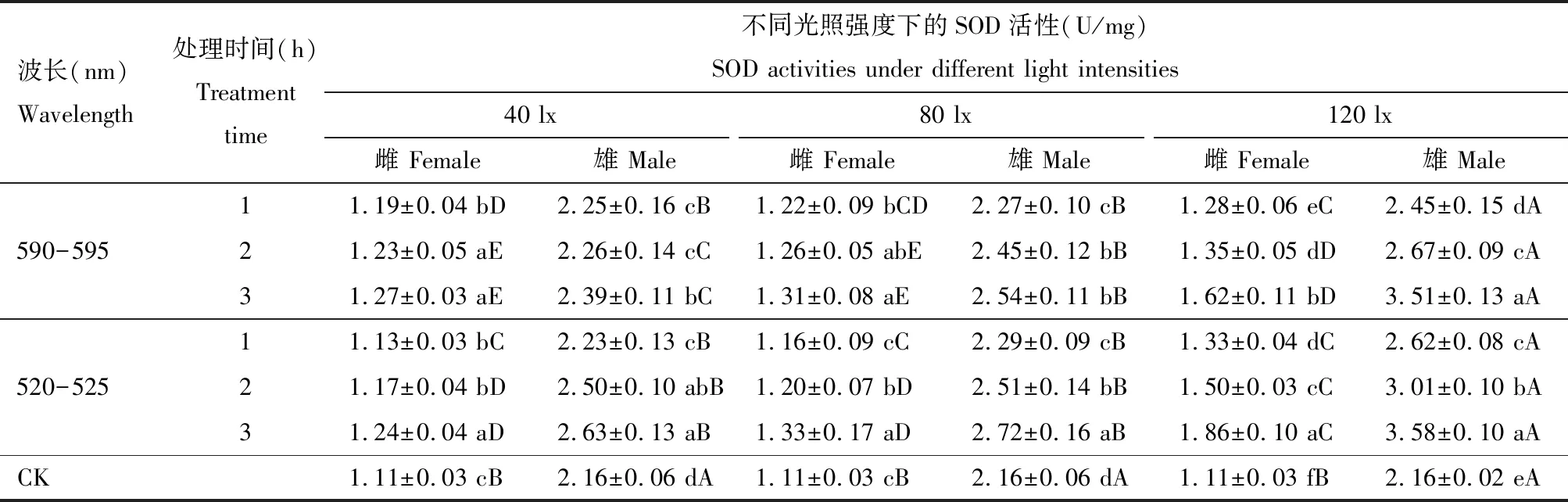
表3 LED光照波长、处理时间和强度对灰茶尺蠖成虫体内超氧化物歧化酶(SOD)活性的影响
40 lx光照强度下,黄光和绿光处理的雌、雄成虫体内SOD活性均与对照差异显著(P<0.05);黄光处理2和3 h时,雌成虫体内SOD活性无显著差异(P>0.05),与处理1 h时的SOD活性差异显著(P<0.05);雄成虫处理3 h时的SOD活性显著高于1和2 h时的(P<0.05);绿光处理2和3 h时,雄成虫间的SOD活性无显著差异(P>0.05),均与处理1 h时的SOD活性差异显著(P<0.05)。
80 lx光照强度下,黄光处理2和3 h时,雌、雄成虫SOD活性无显著差异(P>0.05), 均与处理1 h时雌、雄成虫SOD活性差异显著(P<0.05);绿光处理1, 2和3 h时雌、雄成虫SOD活性差异显著(P<0.05)。
120 lx光照强度下,黄光和绿光处理1, 2和3 h时,雌、雄成虫SOD活性差异显著(P<0.05),且均与对照的SOD活性差异显著(P<0.05)。
2.4 LED光照波长、处理时间和强度对灰茶尺蠖成虫CAT活性的影响
由表4可以看出,不同波长和不同光照强度处理不同时间,灰茶尺蠖成虫CAT活性随着光照强度的增加呈逐渐增加的趋势,120 lx处理不同时间雌、雄成虫体内CAT活性均最高,且各处理均表现为雄成虫体内CAT活性均高于雌成虫的。随着处理时间的延长,CAT活性也呈逐渐增加的趋势,处理3 h时CAT活性最高,且各处理组CAT活性均高于对照组的。

表4 LED光照波长、处理时间和强度对灰茶尺蠖成虫过氧化氢酶(CAT)活性的影响
40 lx光照强度下,黄光处理不同时间雌成虫体内CAT活性无显著差异(P>0.05);处理2和3 h时雄成虫体内CAT活性无显著差异(P>0.05),处理1和2 h间CAT活性差异显著(P<0.05);绿光处理2和3 h时雌成虫体内CAT活性无显著差异(P>0.05),处理1和2 h间CAT活性差异显著(P<0.05),3个处理时间雄成虫体内CAT活性差异不显著(P>0.05)。
80 lx光照强度下,黄光处理3 h时雌成虫体内CAT活性与处理1和2 h间差异显著(P<0.05),雄成虫体内CAT活性在各处理间无显著差异(P>0.05);绿光处理2和3 h时雌成虫体内CAT活性无显著差异(P>0.05),均与处理1 h时差异显著(P<0.05);绿光处理不同时间雄成虫体内CAT活性差异显著(P<0.05)。
120 lx强度处理下,黄光处理后雌、雄成虫体内CAT活性的变化趋势表现一致,均表现为1和2 h处理间无显著差异(P>0.05),均与处理3 h时差异显著(P<0.05);绿光处理下雌成虫CAT活性变化趋势同黄光处理下的,各处理时间雄成虫体内CAT活性差异显著(P<0.05)。
2.5 LED光照波长、处理时间和强度对灰茶尺蠖成虫T-AOC的影响
由表5可以看出,灰茶尺蠖雌、雄成虫在黄光和绿光处理下,随着光照强度的增加T-AOC呈逐渐增加的趋势,以120 lx处理时最高,且雄成虫中T-AOC均高于雌成虫中的。随着处理时间的增加,不同光照强度处理下的雌、雄成虫T-AOC也呈逐渐增加的趋势,处理3 h时最高,且各处理组T-AOC均高于对照的。
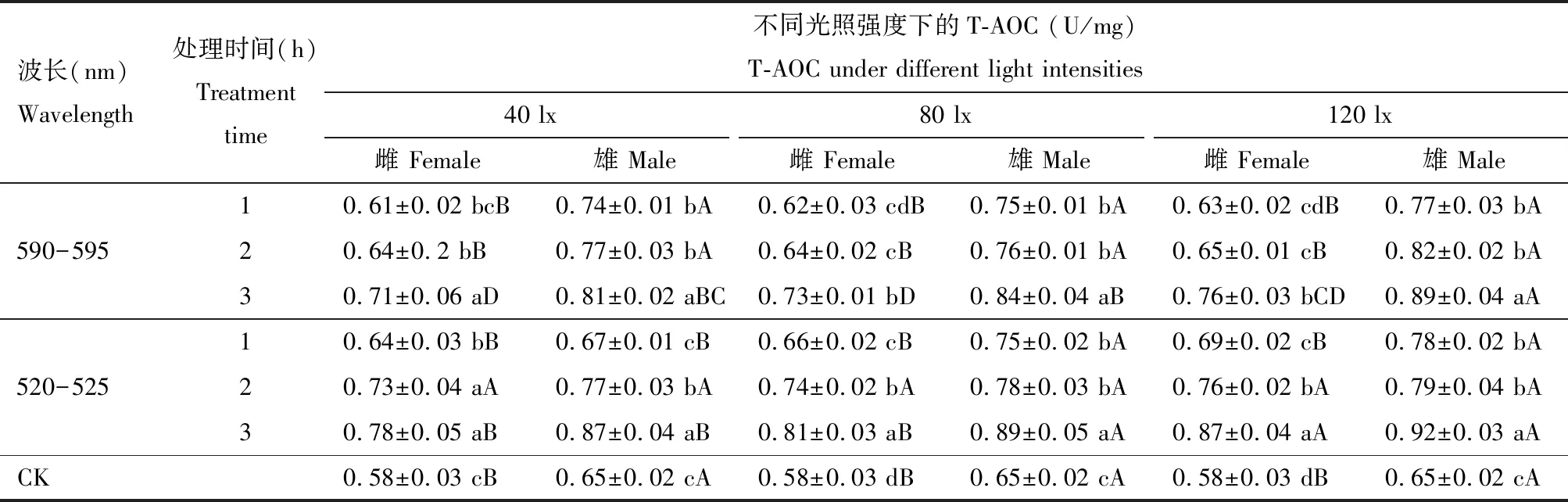
表5 LED光照波长、处理时间和强度对灰茶尺蠖成虫总抗氧化能力(T-AOC)的影响
40 lx光照强度下,黄光处理雌、雄成虫后,T-AOC均表现为处理3 h时与处理1和2 h时差异显著(P<0.05);绿光处理2 和3 h时,雌成虫体内T-AOC无显著差异(P>0.05),与处理1 h时差异显著(P<0.05),雄成虫体内T-AOC则表现为处理1, 2和3 h间差异显著(P<0.05)。
80 lx光照强度下,除绿光处理1, 2和3 h时雌成虫体内T-AOC差异显著(P<0.05)外,其他处理T-AOC均表现为处理1和2 h间无显著差异(P>0.05),均与处理3 h时差异显著(P<0.05)。
120 lx光照强度下,各处理组T-AOC的表现趋势同80 lx光照强度下的。
3 讨论
昆虫在寻找寄主、定位、取食、求偶及产卵等行为过程中,视觉发挥着巨大作用,不同波长的光呈现不同的颜色,使昆虫选择及行为习性发生改变,从而影响成虫的生长和繁殖(Croninetal., 2014; Kimetal., 2020)。乔利等(2020)研究结果表明,370~600 nm范围内的18种不同波长的单色光均可引起灰茶尺蠖成虫趋光和避光反应行为。在波长590~595和520~525 nm,光照强度50~100 lx,持续处理12 h代替黑暗的条件下饲养一代灰茶尺蠖,发现其成虫单雌最高产卵量、产卵率和卵孵化率均显著下降(乔利等, 2021)。在前期研究的基础上,深入研究波长、光照强度和照射时间胁迫对灰茶尺蠖保护酶系活力的变化。研究表明,成虫SOD活性随LED光照强度的增加及照射时间的延长而上升,说明光胁迫可诱导SOD的抗氧化反应,使其活性升高,以清除超氧阴离子自由基,POD和CAT活性也随之增强,从而维持其体细胞的动态平衡,该研究结果与Park(2009)的研究结果一致。说明光照胁迫导致其产卵量、产卵率和卵孵化率生命参数的显著下降而引发的灰茶尺蠖保护酶系活力的显著上升是其加强生化代谢活动以调控生物学方面损耗的生理基础之一。
卢亚菲等(2019)研究发现,三叶草彩斑蚜的POD, SOD和CAT活性随着紫外线的处理时间的增加而增加,在处理时间为40 min出现最大值。本研究中POD, SOD和CAT活性出现最高值的时间为3 h,即处理的最长时间(表2-4);灰茶尺蠖是否随着处理时间的进一步延长,以上保护酶指标是否存在下降的趋势还有待进一步研究。麦长管蚜Sitobionavenae经过中波紫外线(UV-B)(280~320 nm)照射后,POD, SOD和CAT活性增加(周冬等, 2014);桃蚜Myzuspersicae体内CAT, SOD和POD活性随着短波紫外线UV-C强度的增加而上升(李军等, 2005),以上研究结果均与该实验光胁迫下各项指标呈上升趋势的表现一致。用紫光、绿光和蓝光处理梨小食心虫成虫后,其体内的CAT, SOD和POD活性随着处理时间的增加而增加(方程, 2015),该结果与本研究结果也一致。本研究中总蛋白与T-AOC也随着光照强度、光照时间的增加而逐渐增加。
经过检测黄、绿光处理不同时间后茶尺蠖雌、雄成虫体内总蛋白含量, POD, SOD和CAT活性及T-AOC的变化,发现茶尺蠖雌成虫体内的总蛋白含量和POD活性均大于雄成虫体内的(表1, 2),而雌成虫体内的SOD和CAT活性及T-AOC均小于雄成虫的(表3-5),可能与雌、雄成虫趋光的性别差异有关(Altermattetal., 2009; Garris and Snyder, 2010),即同种昆虫不同性别对同种光源的敏感性不同(Meyeretal., 1978)。此外,同种昆虫雌、雄个体最敏感的光强可能不同,在给定光强度下,雌、雄成虫敏感程度也会不一样,对光源做出的行为反应就不相同(程文杰等, 2011),导致体内保护酶含量存在差异。韩永强等(2022)研究表明,保护酶活性的变化,可影响褐飞虱的生理代谢。乔利等(2021)研究表明,波长590~595和520~525 nm下,灰茶尺蠖成虫单雌产卵量、产卵率和卵孵化率均显著下降,两种光胁迫引发灰茶尺蠖保护酶系活力的显著上升,反映了该虫通过调控生化代谢活动以应对产卵量、产卵率和卵孵化率显著下降等生命参数损耗的生化机制。根据不同波长及强度光谱对灰茶尺蠖雌、雄成虫的保护酶含量有明显影响,寻找打破保护酶活性的最佳波长、强度及照射时间,进而干扰灰茶尺蠖正常的生命活动。可于茶园内特定时间提供特定波长和强度的光源照射,扰乱其发育节律,减少其种群数量,达到绿色防控的目的。本研究是在室内条件下进行的,茶园内黄光和绿光照射对灰茶尺蠖种群数量的变化及雌、雄成虫保护酶活性的影响还在进一步深入研究。
猜你喜欢
杂志排行
昆虫学报的其它文章
- 基于转录组数据的中华按蚊细胞色素P450超家族基因不同发育阶段、成蚊不同组织和吸血前后不同时期雌成蚊的表达模式分析
- 狄斯瓦螨VdesNPC2b蛋白的基因克隆、原核表达及其与寄主幼虫信息素结合机制研究
- 亚洲玉米螟对球孢白僵菌分生孢子和芽生孢子-玉米共生体的取食选择和嗅觉反应
- 紫外线辐照被寄生的黑腹果蝇蛹对果蝇锤角细蜂生长发育的影响
- Response of heat inducible heat shock protein 90 gene of Aphis gossypii (Hemiptera: Aphididae) to gossypol and flupyradifurone stresses and mutual effect on transcription factor HSF
- 蜜蜂衰老与寿命调控研究进展
