不同饲料对花绒寄甲生长发育、繁殖和成虫肠道细菌群落的影响
2024-01-03郭佳丽张岑钰唐光辉张正青
郭佳丽, 张岑钰, 张 猛, 唐光辉, 张正青
(西北农林科技大学林学院, 杨凌 712100)
花绒寄甲Dastarcushelophoroides属鞘翅目(Coleoptera)寄甲科(Bothrideridae),是蛀干类害虫天牛的重要寄生性天敌(李孟楼等, 2007)。野外条件下,花绒寄甲初孵幼虫依靠胸足爬行寻找寄主,咬破寄主表皮取食其体内的营养物质;成虫食性较杂,喜好取食树皮枝条、昆虫尸体、天牛幼虫和真菌等(雷琼等, 2003; 路纪芳等, 2016)。现阶段,在生物防治天牛为害的过程中,主要通过大量人工饲养花绒寄甲并释放以达到有效控制目的。在林间释放试验中, 释放花绒寄甲对光肩星天牛Anoplophoraglabripennis的虫口减退率可达90.98%,对黄斑星天牛Aeolestheschrysothrix的防治效果高达70.70%,对松褐天牛Monochamusalternatus总校正寄生效率为65.90%(董广平等, 2013; 仇兰芬等, 2019)。目前,花绒寄甲已经实现室内人工饲养。人工饲养花绒寄甲主要利用替代寄主和人工饲料,尚梅等(2009)依据寄主光肩星天牛体内氨基酸成分及含量,改变人工饲料中氨基酸比例,发现可以提高花绒寄甲的老熟幼虫的体长体宽以及羽化率,并研发出室内有效扩繁花绒寄甲种群的人工饲料。颜学武等(2015)比较分别以黄粉虫Tenebriomolitor、大麦虫Zophobasatratus和松墨天牛Monochamusalternatus幼虫为主要营养物质制作的人工饲料的饲养效果差异,发现各组之间无显著差异,证明了配方人工饲料在室内养殖的适用性。王志华等(2018)综合比对不同种人工饲料对花绒寄甲生长发育及繁殖历期等的影响,发现加入黄粉虫干粉、大麦虫幼虫干粉和氨基酸配制的饲料更有利于花绒寄甲的生长发育。然而,根据花绒寄甲成虫在野外条件下食物来源配制的人工饲料是否适用于现阶段长期室内饲养种群生长发育有待进一步研究。不同配方饲料对花绒寄甲成虫及后代生长发育影响显著,因此,优化饲料配方以利于花绒寄甲生长发育和繁育成为人工扩繁花绒寄甲种群用于释放的迫切需求。
昆虫体内栖居着大量微生物以肠道菌群的形式定殖在消化道内。前人研究表明,饲料的转变会导致昆虫的肠道微生物也发生变化,间接影响昆虫的健康(Shietal., 2010)。其中,肠道细菌广泛参与宿主食物消化,在帮助宿主合成营养物质、参与宿主免疫防御和生殖代谢中发挥主要作用,为保证宿主正常生长发育提供保障(Kaltenpothetal., 2014)。研究发现,蝗虫肠道含有多种分泌纤维素酶的微生物,具有较高的纤维素分解活性(Suetal., 2014)。核桃果峰斑蛾Acrobasisnuxvorella肠道内的一种细菌可以产生单宁酶以降解单宁中的没食子酸酯键,成为该虫可以消化单宁的重要原因(Consueloetal., 2022)。利用抗生素清除或剥离肠道细菌后,昆虫的免疫能力、生长发育、产卵量和存活率均显著下降(Muhammadetal., 2019)。昆虫取食食物不同对其肠道菌群结构影响显著,消化吸收不同的食物成分会有不同的细菌参加其中(杨云秋等, 2018)。梨小食心虫Grapholitamolesta在取食苹果、桃、油桃、梨、李子等果实后,肠道细菌存在差异,取食李子的肠道群落多样性最高,取食苹果的肠道群落多样性最低(Yuanetal., 2021)。斜纹夜蛾Spodopteralitura在取食自然食物与人工饲料后,肠道群落的优势菌目明显不同(Xiaetal., 2018)。花绒寄甲成虫在人工饲养的条件下寿命可达3年之久,成虫羽化后20 d开始产卵,产卵高峰期持续两个月,新羽化成虫取食茧壳补充营养后破茧而出,随后取食饲料,然而,取食不同配方的人工饲料是否会对花绒寄甲成虫肠道菌产生影响,肠道细菌与其生长发育和繁殖间存在怎样的关系还有待进一步研究。
本研究以花绒寄甲成虫为研究对象,分析取食不同配方饲料对花绒寄甲亲代成虫体重、体长、体宽、产卵前期、持续产卵量及子一代孵化率、幼虫历期、寄生效率、结茧率、茧期和羽化率的影响;同时利用16S rDNA基因测序,分析长期取食不同配方饲料后花绒寄甲成虫肠道细菌群落的变化情况,并对肠道细菌核心群落丰度与宿主生长发育和繁殖的关联性进行分析。为优化人工饲料配方,建立适合于室内长期饲养花绒寄甲种群的人工饲料,实现室内大量扩繁花绒寄甲种群奠定基础。
1 材料与方法
1.1 供试昆虫及饲育处理
所用花绒寄甲均来自于西部森林生物灾害治理国家林业局重点实验室。全龄饲养条件为:温度(23±2) ℃,相对湿度75%±5%,光周期16L∶8D。共配制6种人工饲料(饲料Ⅴ为现有人工饲料配方),饲料配方如表1所示。

表1 室内饲养花绒寄甲饲料配方
按配方分别配制6种饲料置于-20 ℃保存备用,饲喂前取出,放置室温下30 min后使用,随机挑选24头新羽化花绒寄甲成虫(雌∶雄=1∶1)放入一个养虫盒内(长×宽×高=10 cm×10 cm×6.5 cm),每隔2 d以不同的配方饲料分别饲喂成虫,每饲料处理3个重复;以新羽化未饲喂饲料成虫为对照。
1.2 花绒寄甲生长发育和繁殖参数测定
每5 d分别统计1.1节取食不同饲料花绒寄甲亲代成虫体重(g)、体长(cm)和体宽(cm);饲喂64 d时,统计花绒寄甲成虫累计死亡率(%);从成虫羽化后至每个饲养盒中雌成虫开始产卵时为止,统计亲代雌成虫产卵前期(d); 从产卵盒发现第1粒卵开始持续观察64 d,统计亲代单雌日均产卵量 (每2 d统计1次求平均) 及观察期内单雌总产卵量。以未取食饲料的新羽化成虫为对照组,每个处理进行3次重复。
将取食不同饲料花绒寄甲亲代产的卵孵化后人工接种至替代寄主大麦虫蛹上,统计取食不同配方饲料花绒寄甲子一代孵化率、幼虫寄生率、结茧率、幼虫历期、茧期和羽化率。将含有卵块的卵片放置培养皿中,在解剖镜下统计卵的孵化率[孵化率(%)=(孵化孔数量/总卵数量)×100],随机选取10头花绒寄甲初孵幼虫接种在大小一致的大麦虫蛹上,统计寄生率[寄生率(%)=(成功寄生幼虫数量/接种幼虫数量)×100],观察结茧率[结茧率(%)=(幼虫结茧数量/成功寄生幼虫数)×100],记录幼虫历期[幼虫历期(d)=幼虫接种至结茧的时间]、茧期[茧期(d)=幼虫结茧至羽化成虫的时间]及羽化率[羽化率(%)=(羽化成虫数量/幼虫结茧数量)×100]。以未取食饲料的新羽化成虫为对照组,各处理进行20个生物学重复。
1.3 花绒寄甲成虫肠道DNA提取及16S rDNA测序
对照组和分别取食不同饲料10, 20和40 d成虫随机挑选5头成虫饥饿24 h后进行肠道无菌解剖, 5条肠道为1组进行基因组DNA提取,每处理3个生物学重复,利用通用引物515F(5′-GTGCCAG CMGCCGCGGTAA-3′)和806R(5′-GGACTACHVG GGTWTCTAAT-3′)(Itohetal., 2014)对16S rDNA V4-V5区进行扩增。PCR扩增体系(25 μL): 2×ES Taq MasterMix (北京康为世纪生物公司)12.5 μL, ddH2O 9.5 μL, 上下游引物(10 μmol/L)各1 μL, DNA模板1 μL。PCR反应程序: 94 ℃预变性5 min; 94 ℃变性1 min, 48 ℃退火1 min, 72 ℃延伸1 min, 30个循环;72 ℃终延伸10 min。PCR 扩增产物经电泳检测后用胶回收试剂盒切胶回收。纯化的扩增子采用Illumina NovaSeq 6000平台进行双末端测序。
1.4 花绒寄甲成虫肠道细菌序列分析
使用fastq(v0.14.1)软件对测序原始序列双端的原始读段数据进行质量剪裁(-W4-M20),并根据序列两端的引物信息利用cutadapt (v4.1)软件去除引物,得到质控后的paired-end Clean Reads(PE reads)。根据PE reads之间的overlap关系,利用usearch-fastq_mergepairs (V10)进行双端序列拼接,再根据不同区域的长度范围对拼接后数据过滤,获得最终Effective Tags。利用Uparse(v7.0.1001)对所有样本Effective Tags进行聚类,默认以97%的一致性(identity)将序列聚类成为可操作分类单元(operational taxonomic units, OTUs)(Haasetal., 2011)。
利用Mothur(v1.40.45)软件OTU代表序列与Silva138数据库(http:∥www.arb-silva.de/)比对进行物种注释分析(设定阈值为0.8~1),在各分类水平下(门、纲、目、科、属、种和OTU)统计各样品群落组成(Edgar, 2013)。使用R绘制成样品各分类学水平下的群落结构图。基于OTU丰度表,取每处理3个重复的平均值,统计OTU在各处理中出现的情况并绘制Venn图,同时选取取食同种饲料不同时间肠道细菌在属水平上平均丰度前15物种,生成ternaryplot(三元相图),以反映不同环境下优势物种的差异。基于OTU丰度表,使用usearch-alpha_div(V10)评估个样品肠道细菌组成的丰富度和均匀性(Alpha多样性),包括Chao 1指数和Shannon指数等,并利用usearch -alpha_div_rare (V10)绘制在不同深度时的上述多样性指数的稀释曲线。基于OTU丰度表,使用R vegan软件进行Beta多样性分析,比较各样品在物种多样性方面的相似性,并基于weighted unifrac距离算法进行主坐标分析(principal coordinates analysis, PCoA),并使用R语言ggplot2包进行绘图。使用PICRUSt(v1.1.0)软件对OTU丰度表进行标准化,通过每个OTU对应的greengene id比对到KEGG(Kyoto Encylopaedia of Genes and Genomes)数据库,对花绒寄甲新羽化成虫和取食饲料不同时间成虫肠道内细菌功能进行预测(Parksetal., 2014)。
1.5 数据分析
采用SPSS(v23.0)软件分析花绒寄甲生长发育和繁殖等数据,结果用平均值±标准误表示,多组比较采用one-way ANOVA中Duncan氏多重检验(邹垚, 2022)。利用R中的Pearson分析单雌日均产卵量随时间变化情况,置信区间95%。使用R Vegan软件进行两组间和多组间的Alpha多样性指数比较,分别进行Welch’st检验和Tukey氏HSD检验。基于Bray-Curtis距离算法,利用Adonis分析检定新羽化成虫与取食饲料后成虫肠道细菌群落结构差异显着性。基于KEGG level 2表,利用Wilcox秩和检验进行两组间通路差异分析。使用R中的Pearson相关系数分析取食不同饲料后花绒寄甲成虫肠道核心细菌属相对丰度与生长发育和繁殖参数的相关性,并以热图表示。
2 结果
2.1 取食不同饲料对花绒寄甲亲代成虫生长发育和繁殖的影响
取食不同饲料的花绒寄甲成虫体宽无显著差异(P>0.05),体重及体长差异显著(P<0.05)(表2)。其中,取食饲料Ⅵ的花绒寄甲成虫体重最大,为0.0287 g;取食饲料Ⅳ的次之,为0.0271 g;取食饲料Ⅰ的体重、体长最小,分别为0.0248 g和7.6250 cm。取食饲料Ⅰ、饲料Ⅱ、饲料Ⅲ、饲料Ⅳ和饲料Ⅵ花绒寄甲成虫64 d内累计死亡率差异不显著(P>0.05),取食饲料Ⅱ的64 d内累计死亡率最高,为18.05%,取食饲料Ⅴ的64 d内累计最低,为6.94%。取食饲料Ⅳ和饲料Ⅵ的花绒寄甲成虫产卵前期最短,从羽化后21 d开始产卵;而取食饲料Ⅰ的花绒寄甲成虫产卵前期较长,羽化后24 d才开始产卵。在整个观察周期中,取食饲料Ⅳ和饲料Ⅵ的花绒寄甲成虫64 d内单雌总产卵量最多,分别为1 068.19和1 199.03粒, 取食饲料Ⅲ的花绒寄甲64 d内单雌总产卵量最低,为732.61粒,整个观察周期内,取食饲料与日均产卵量的相关性分析表明,取食饲料Ⅰ、饲料Ⅳ、饲料Ⅴ和饲料Ⅵ的单雌日均产卵量随取食时间显著增加(P<0.05),而取食饲料Ⅱ和Ⅲ的单雌产卵量随取食时间逐渐降低(图1)。

图1 取食不同饲料后花绒寄甲成虫单雌日均产卵量与取食时间的相关性
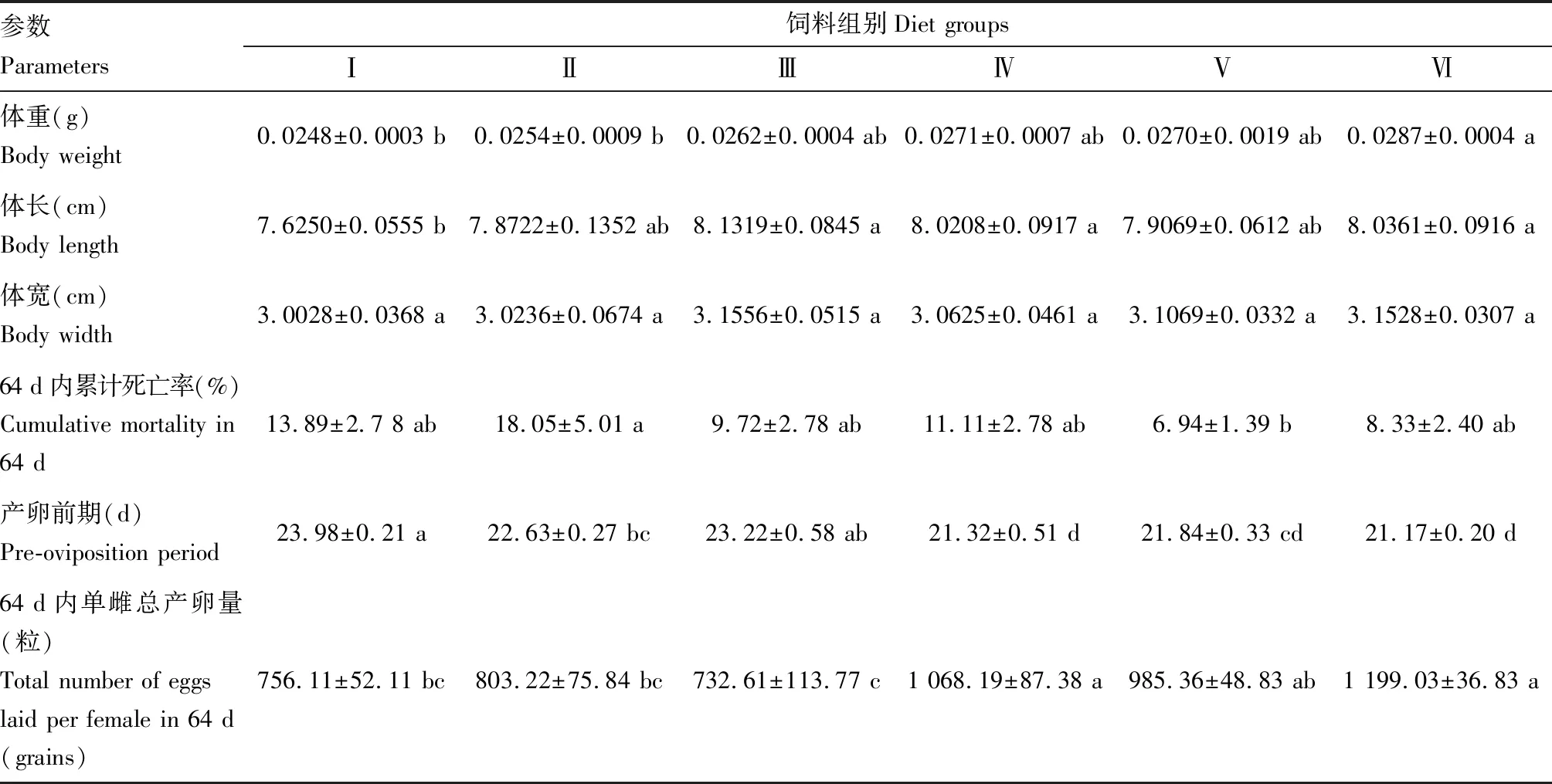
表2 取食不同饲料后花绒寄甲亲代成虫生长发育与繁殖参数
饲料配方见表1。表中数据为平均值±标准误;同一行数据后标注不同小写字母表示经Duncan氏多重比较后在0.05水平差异显著;表3同。For diet formulae, see Table 1. Data in the table are mean±SE. Different letters following the data in the same row indicate significant difference at the 0.05 level by Duncan’s multiple comparisons. The same for Table 3.
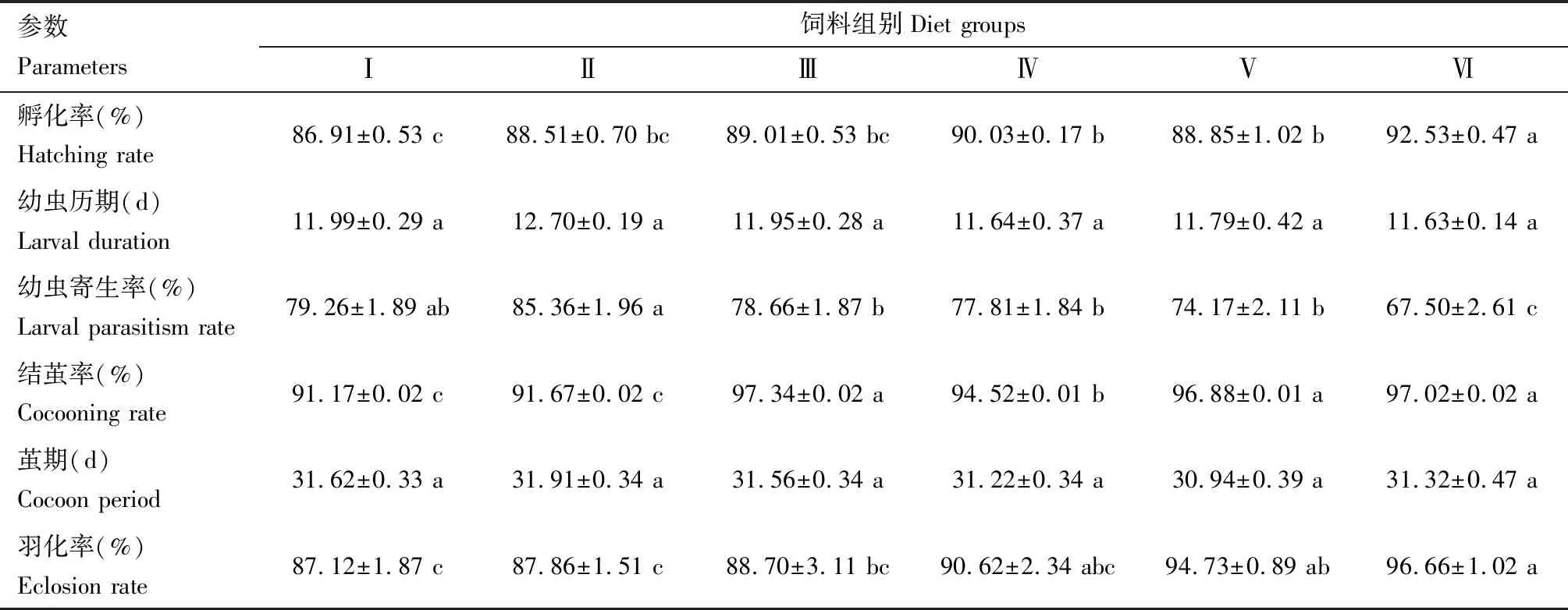
表3 取食不同饲料后花绒寄甲成虫的子一代的生长发育与繁殖参数
2.2 取食不同饲料对花绒寄甲子一代生长发育的影响
取食不同饲料的花绒寄甲成虫子一代幼虫历期和茧期无显著差异(P>0.05),而孵化率、幼虫寄生率、结茧率和羽化率差异显著(P<0.05)(表2)。取食饲料Ⅵ的花绒寄甲子一代孵化率最高, 为92.53%;取食饲料Ⅳ和饲料Ⅴ的次之,分别为90.03%和88.85%;取食饲料Ⅰ的最低,为86.91%。取食不同饲料成虫的子一代结茧率由高到低为:取食饲料Ⅲ>取食饲料Ⅵ>取食饲料Ⅴ>取食饲料Ⅳ>取食饲料Ⅱ>取食饲料Ⅰ;取食不同饲料成虫的子一代羽化率由高到低为:取食饲料Ⅵ>取食饲料Ⅴ>取食饲料 Ⅳ>取食饲料 Ⅲ>取食饲料 Ⅱ>取食饲料 Ⅰ。
2.3 取食不同饲料花绒寄甲成虫肠道细菌16S rDNA序列拼接组装与OTU聚类
取食不同饲料花绒寄甲成虫肠道16S rDNA基因V4-V5区序列测定共得到5 037 493条有效读段序列,进一步优化得到4 781 552条高质量有效序列。整体有效序列所占比例97%以上,满足后续分析要求。对OTU进行聚类得到758个OTUs,分别注释到11门22纲40目63科90属。其中,对照组肠道细菌OTU数量高于取食不同配方饲料成虫的。取食不同配方饲料后花绒寄甲肠道细菌属水平种类随取食时间均有增加。
将同处理下新羽化未取食饲料对照组成虫与取食不同饲料不同时间成虫3个重复的肠道细菌OTU取平均值后进行聚类分析,发现共有的OTU 为 34个,而对照组细菌特有OTU最多,为32个(图2)。随取食时间增加,取食不同饲料成虫肠道内特有细菌OTU数量逐渐增加,其中取食饲料Ⅰ、饲料Ⅱ和饲料Ⅲ 40 d时的花绒寄甲成虫肠道特有细菌OTU数最多,取食饲料Ⅳ、饲料Ⅴ和饲料Ⅵ 20 d 时的特有细菌OTU数最多。分别选取持续取食不同配方饲料10-40 d时花绒寄甲肠道细菌在属水平上平均丰度排名前15的物种,生成的ternaryplot结果表明,优势菌属随着取食时间增加逐渐形成。此外,部分优势菌属如乳球菌属Lactococcus、不动杆菌属Acinetobacter和Hafnia-Obesumbacterium等的丰度随取食时间逐渐增加。

图2 取食不同饲料不同时间点花绒寄甲成虫肠道细菌可操作分类单元(OTU)分布Venn图
2.4 取食不同饲料花绒寄甲成虫肠道细菌Alpha和Beta多样性
Alpha 多样性分析结果表明,与对照组相比,取食饲料后成虫肠道细菌丰富度均显著降低(P<0.05)(图3: A)。取食饲料Ⅰ、饲料Ⅱ、饲料Ⅲ和饲料Ⅳ的成虫肠道细菌Chao 1指数随着取食天数的增加渐渐升高;其中取食饲料Ⅳ成虫肠道细菌丰富度随取食时间显著增加(P<0.05)。Shannon指数用于反映群落的多样性,取食饲料导致肠道细菌多样性与对照组比显著降低(P<0.01)(图3: B)。除取食饲料Ⅰ成虫外,取食其他饲料不同时间成虫肠道细菌多样性无显著差异。

图3 取食不同饲料不同时间点花绒寄甲成虫肠道细菌Alpha多样性Chao 1指数(A)和Shannon指数(B)
PCoA结果表明(图4),基于weighted_unifrac距离矩阵的坐标轴PCoA1和PCoA2的解释度分别为59.2%和34.8%,利用Adonis分析对照组和取食不同饲料成虫肠道细菌各样本间的差异性,得到R2=0.679,P=0.001,说明取食不同饲料显著改变了花绒寄甲成虫肠道细菌群落组成。此外,取食不同饲料不同时间成虫肠道细菌组成聚类接近,可能表明取食现有不同饲料对成虫肠道群落组成影响较小。
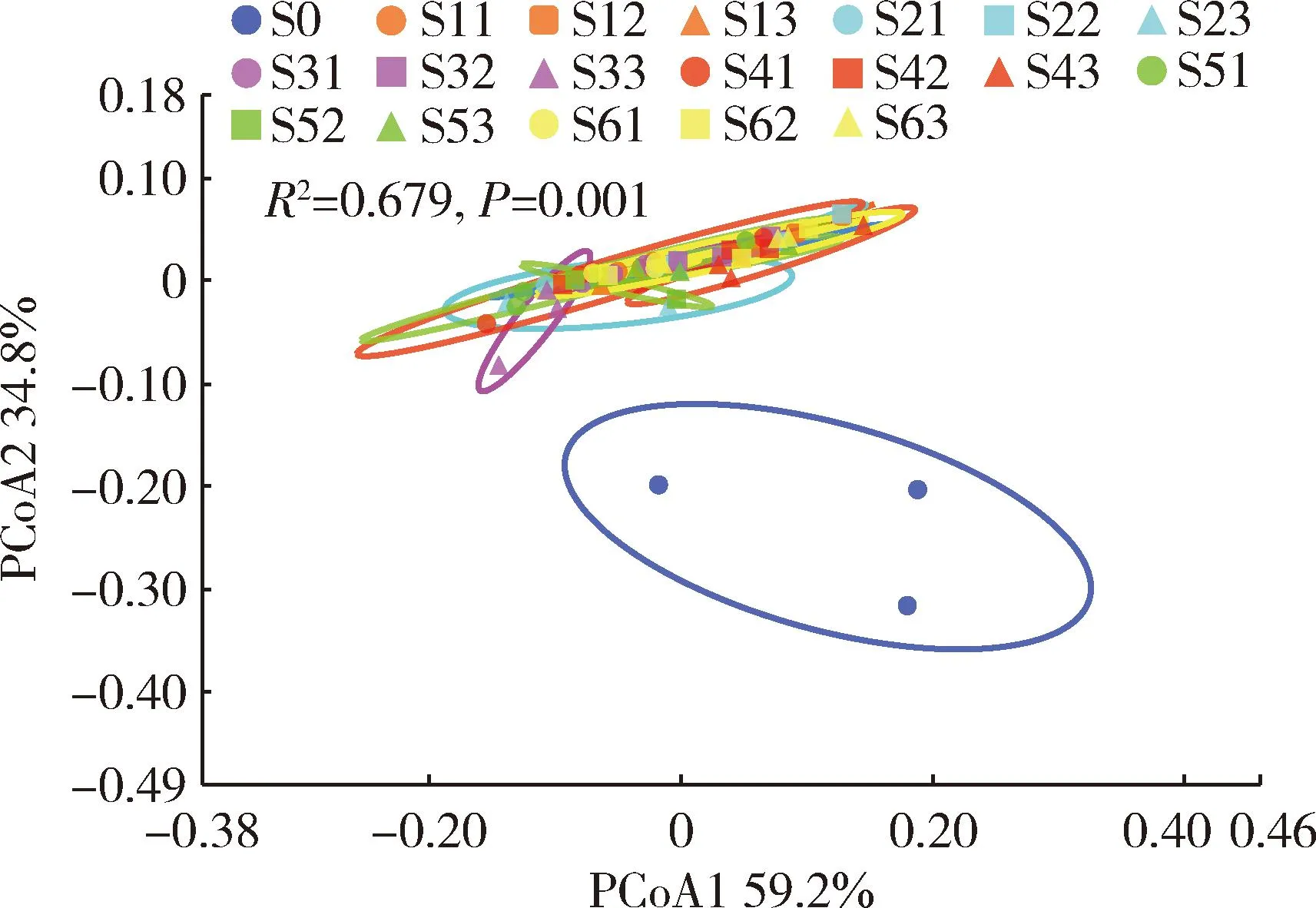
图4 取食不同饲料不同时间点花绒寄甲成虫肠道细菌β多样性主坐标分析(PCoA)
2.5 取食不同饲料花绒寄甲成虫肠道细菌群落结构
对照组花绒寄甲成虫肠道的优势菌门为厚壁菌门(Firmicutes),相对丰度0.588,其次为变形菌门(Protebacteria)和放线菌门(Actinobacteria),相对丰度分别为0.205和0.169(图5: A)。取食不同饲料不同时间成虫间肠道细菌菌群相似,以厚壁菌门和变形菌门为主,与对照组比放线菌门相对丰度降低。此外,随着取食时间增加,相比于取食10 d时,取食饲料Ⅳ-Ⅵ 40 d时的成虫肠道内厚壁菌门丰度分别增加0.224, 0.171和0.170。

图5 取食不同饲料不同时间点花绒寄甲成虫肠道细菌门(A)和属水平(B)相对丰度
在属水平,对照组新羽化成虫肠道丰度排名前6的优势菌属分别为乳球菌属Lactococcus、棒状杆菌属Corynebacterium、芽孢杆菌属Bacillus、葡萄球菌属Staphylococcus、乳杆菌属Lactobacillus和肠球菌属Enterococcus,相对丰度分别为0.183, 0.165, 0.126, 0.089, 0.092和0.054(图5: B)。取食不同饲料后成虫肠道细菌主要由乳球菌属组成,相对丰度较对照组显著增加0.084~0.549 (P<0.05)。其中,取食饲料Ⅳ-Ⅵ成虫肠道乳球菌属的相对丰度随时间逐渐上升,取食饲料Ⅰ和饲料Ⅲ 20 d时成虫肠道乳球菌属相对丰度最高。与对照组相比,取食饲料后未鉴定菌属(unassigned)的相对丰度占比增加,表明成虫在取食饲料后具有较多新物(种)发挥了功能,具有深入挖掘的潜力。此外,取食饲料Ⅰ 20 d时成虫肠道(S12)不动杆菌属Acinetobacter相对丰度最高,为0.073;取食饲料Ⅱ和饲料Ⅲ的成虫肠道中Hydrotalea相对丰度随取食时间增长在取食40 d时的相对丰度占比分别为0.016和0.0149;取食饲料Ⅳ的成虫肠道Hafnia-Obesumbacterium相对丰度随着取食时间增大,取食10, 20和40 d时相对丰度占比分别为0.0052, 0.0463和0.0558。
2.6 取食不同饲料花绒寄甲成虫肠道细菌基因功能
花绒寄甲成虫肠道细菌基因在KEGG level 2共注释到15种代谢通路(图6)。对照组成虫肠道细菌80.74%基因参与新陈代谢相关通路,包括参与碳水化合物代谢(carbohydrate metabolism)(占14.54%)、氨基酸代谢(amino acid metabolism)(占12.55%)以及辅因子和维生素代谢(metabolism of cofactors and vitamins)(占11.89%)。取食不同饲料不同时间成虫肠道细菌基因参与代谢通路与对照组相似,代谢通路数量差异不显著(P>0.05)。
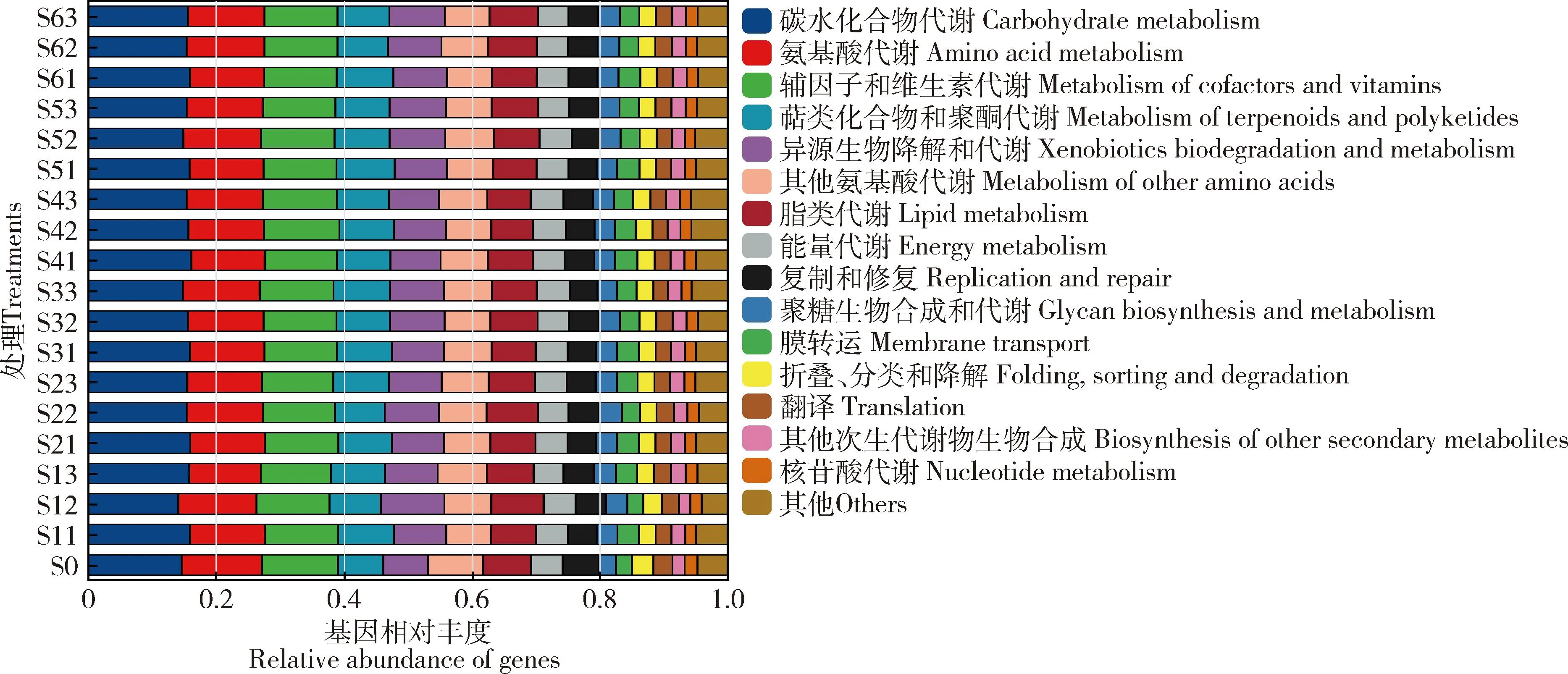
图6 取食不同饲料不同时间点花绒寄甲成虫肠道细菌基因KEGG level 2通路相对丰度分布
2.7 取食不同饲料成虫肠道核心细菌属相对丰度与花绒寄甲生长发育和繁殖的相关性
花绒寄甲成虫肠道核心细菌属水平相对丰度与其亲代繁殖及子代生长发育相关指标关联性分析结果表明(图7),核心细菌相对丰度与亲代成虫体重、体长、体宽、产卵前期、64 d内累计死亡率、64 d内单雌总产卵量以及子一代孵化率、幼虫寄生率、结茧率和羽化率呈现出不同的相关性。其中,亲代成虫体重与乳杆菌属相对丰度显著负相关(P<0.05),而与Mesorhizobium、Phreatobacter、 沙雷氏菌属Serratia、Bradyrhizobium、Boseae和Hydrotalea相对丰度显著正相关(P<0.05)。64 d内单雌总产卵量与Bradyrhizobium和肠球菌属相对丰度呈显著正相关(P<0.05)。子一代孵化率与片球菌属Pediococcus相对丰度极显著负相关(P<0.01),与Lentimicrohium相对丰度显著负相关(P<0.05),幼虫寄生率与肠球菌属相对丰度呈极显著负相关(P<0.01)。花绒寄甲亲代成虫产卵前期与乳杆菌属相对丰度极显著正相关(P<0.01),但与肠球菌属相对丰度呈极显著负相关(P<0.01)。子一代羽化率与芽孢杆菌属相对丰度呈极显著负相关(P<0.01),但与肠球菌属相对丰度呈极显著正相关(P<0.01)。综上,片球菌属可能会降低子一代孵化率,肠球菌属可能缩短亲代成虫产卵前期、降低子一代幼虫寄生率增加羽化率,肠球菌属分别与乳杆菌属在产卵前期以及与芽孢杆菌属在羽化率方面作用相反。

图7 取食不同饲料花绒寄甲成虫肠道核心细菌属与生长发育和繁殖相关性分析
3 讨论
3.1 取食不同饲料对花绒寄甲亲代成虫及子一代适合度影响分析
综合亲代成虫和子一代幼虫生长发育和繁殖的相关指标,研究显示取食饲料Ⅳ和饲料Ⅵ的成虫体重高、体长大、死亡率低、产卵前期短,并且单雌日均产卵量和单雌总产卵量均高于取食其他饲料的花绒寄甲成虫的(表2; 图1)。相比于饲料Ⅲ和饲料Ⅴ,饲料Ⅳ和饲料Ⅵ利用大麦虫粉代替了原有饲料中的蚕蛹粉(表1)。与熟知的黄粉虫幼虫、蚕蛹、蟋蟀、白蜡虫和家蝇相比,大麦虫的蛋白质、氨基酸和能量均居首位,具有很高的营养价值(王利娟, 2014)。大麦虫中含有丰富功能性氨基酸,如精氨酸和亮氨酸等,可参与合成多种生物活性物质,可能有利于花绒寄甲的生殖(周根来和殷洁鑫, 2021)。同时,寄生性天敌昆虫不仅因地理隔离产生种群分化,也可能因寄生不同的寄主产生种群内的分化,从而更加适应寄主的生活特性和栖境条件,形成许多适应性策略,寄生昆虫本身的学习行为,包括产卵期间经历的线索或与寄主接触等过程,也能够修正寄生昆虫的初始选择(王小艺和杨忠岐, 2010)。实验室内长期大量饲养的花绒寄甲种群,主要以大麦虫作为替代寄主,经过多代持续扩繁,其成虫可能已形成适应大麦虫粉作为主要营养物质的人工饲料。营养匮乏不利于昆虫生长发育和生态行为能力(Reimetal., 2019)。本研究所配制的饲料Ⅰ和饲料Ⅱ未添加任何虫粉,相较于其他饲料蛋白营养物质匮乏,不利于寄生性天敌昆虫花绒寄甲的生长发育和繁殖。饲料Ⅱ、饲料Ⅴ和饲料Ⅵ较饲料Ⅰ、饲料Ⅲ和饲料Ⅳ分别添加了木粉(杨树韧皮部表皮与柳树嫩枝研磨成粉),取食前3种饲料雌成虫的总产卵量均有增加,木材由无数小的细胞组成,细胞壁由多糖的纤维素和半纤维素以及具有芳香性的木质素组成,其中纤维素占40%~62%,木质素占18%~38%,半纤维素占8%~37%,淀粉60%以上,糖占6%,蛋白质占1%~2%,这些营养物质可能会促进花绒寄甲的生长发育。取食饲料Ⅳ和Ⅵ成虫单雌日均产卵量均随取食时间显著增加(图1),但取食饲料Ⅵ成虫的64 d内单雌总产卵量和子一代孵化率、结茧率显著高于取食饲料Ⅳ成虫的。研究表明,雌成虫在选择产卵时往往对栖息地的变化和宿主的质量敏感,食物质量和丰度差异是决定后代生长发育关键因素(Smithetal., 2018)。综上所述,综合考虑亲代成虫的生长发育和繁殖以及子一代的适合度,本研究中的配方饲料Ⅵ更适合于室内长期饲养花绒寄甲种群。
3.2 取食不同饲料花绒寄甲成虫肠道细菌结构与组成
对照组和与取食不同饲料成虫肠道细菌共注释到758个OTUs,发现34个共有的OTUs,其中取食饲料Ⅳ的OTU数量较高。S0共注释到32个特有OTUs(图2)。对于完全变态的全变态昆虫,在整个发育过程中肠道定殖细菌可能发生显著变化,当成虫羽化时,其肠道内重新被高密度的存在于蛹室中的细菌种群定殖(Wangetal., 2017)。成虫期持续取食的昆虫羽化1周后,肠道微生物种群基本稳定且不易被其他物种定殖(Dillon and Dillon., 2004)。花绒寄甲肠道细菌优势菌属随着取食时间增加逐渐形成。研究表明,取食不同食物会引起昆虫肠道微环境存在差异,进而导致其肠道微生物多样性的差异(吴晓露等, 2019)。在本研究中,与对照(S0)相比,取食不同配方饲料后成虫肠道细菌多样性显著降低,取食不同的人工饲料成虫间的肠道细菌多样性和群落组成无显著差异(图3)。花绒寄甲成虫肠道细菌种类丰富,共鉴定了11个门22个纲40个目63个科90个属。在门水平,成虫肠道厚壁菌门和变形菌门丰度均占比较大,优势明显,其余门类占比较小(图5: A),与前人利用传统培养方法和PCR-DGGE鉴定结果一致,同时也与其他鞘翅目昆虫如异色瓢虫Harmoniaaxyridis和松墨天牛肠道优势菌门(王伟伟, 2013; 罗巧玉, 2018; 闫裕, 2019)类似。
3.3 取食不同饲料花绒寄甲成虫肠道菌群多样性及特定细菌组成
与对照组(S0)相比,取食不同配方饲料后成虫肠道细菌Alpha和Beta多样性均显著降低(图3),但取食不同饲料成虫肠道细菌多样性和群落组成差异较小(图3)。外源因素如宿主饮食和内源因素如宿主系统发育对肠道微生物群落结构有着强烈的影响,在直翅目昆虫中取食习性和分类地位共同影响其肠道细菌群落组成(Zhengetal., 2021),这与我们的研究结果相似。
在属水平,对照组注释到优势菌属分别为乳球菌属、棒状杆菌属、芽孢杆菌属、葡萄球菌属、乳杆菌属和肠球菌属,而取食人工饲料后成虫肠道细菌主要由乳球菌属组成,且其相对丰度较对照组显著增加(图5: B)。在环境因子胁迫下,具有特殊功能的细菌种类可能会加快繁殖以帮助宿主抵御环境变化,而其他菌株相应减少,以达到群落平衡(孙文雯等, 2023)。花绒寄甲成虫羽化后通常在茧内停留1~2 d,然后咬破茧壳并取食补充营养后再爬出坑道外,室内饲养的成虫主要取食人工饲料,可能是造成新羽化成虫与取食后成虫肠道微生物差异的主要原因(路纪芳等, 2016)。此外,取食不同饲料不同时间成虫肠道内其他菌属,如不动杆菌属、Hydrotalea、Hafnia-Obesumbacterium和未鉴定菌属相对丰度增加,可能原因为成虫在取食饲料后肠道内形成了较多新物(种)发挥重要功能。
3.4 取食不同饲料花绒寄甲成虫肠道乳球菌重要功能
取食不同饲料后花绒寄甲成虫肠道内相对丰度最高细菌的是乳球菌属,其中,取食饲料Ⅳ-Ⅵ成虫肠道乳球菌属的相对丰度随时间逐渐上升,取食饲料Ⅰ和饲料Ⅲ 20 d时成虫肠道乳球菌属相对丰度最高(图5)。乳球菌大量存在于乳制品、牛奶、蔬菜和活性污泥,通常用于食品生产(Choetal., 2008)。花绒寄甲成虫肠道细菌主要参与碳水化合物代谢、萜类化合物和聚酮的代谢、异源生物降解和代谢以及聚糖生物合成和代谢(图6)。王建梅(2020)通过长翅素木蝗Shirakiacrisshirakii和花胫绿纹蝗Aiolopustamulus的消化率与微生物相关性分析发现肠球菌属和乳球菌属与纤维素的消化具有显著相关性。白蚁后肠中分离得到的乳球菌属在以葡萄糖和纤维二糖上培养基上生长消耗氧气,可能与碳水化合物的代谢有关(Baueretal., 2000)。红棕象甲Rhynchophorusferrugineus幼虫的肠道中鉴定出能够通过编码相应的水解酶来降解多糖和蔗糖的细菌种类,如乳酸乳球菌Lactococcuslactis。用环氧虫啶处理后的美洲大蠊Periplanetaamericana前肠中的乳球菌属相对丰度从0.16%增加到10.68%,发现其发酵产物可为产甲烷菌提供碳源,同时可能与水解和产酸有关(Baoetal., 2021)。
3.5 取食不同饲料花绒寄甲成虫肠道核心细菌属与其生长发育和繁殖的关系
分析花绒寄甲肠道丰度较高的核心细菌属的相对丰度与亲代成虫生长发育和繁殖及子代适合度的相关性发现,肠道乳杆菌属相对丰度与成虫体重呈显著显著负相关,而与亲代产卵前期呈显著正相关(图7),说明乳杆菌的大量存在可能导致成虫体重降低、产卵前期延长,乳杆菌属细菌具有合成果胶降解酶、糖苷水解酶和多糖水解酶的能力,可能参与昆虫的营养代谢(张静和张博, 2017)。研究发现,低剂量乳杆菌干预前后,雌鼠肠道菌群结构并不存在显著的变化,而高剂量组雄鼠肠道菌群的多样性则显著降低(何嘉怡, 2018)。肠球菌属相对丰度与成虫产卵量和子一代羽化率呈显著正相关而与亲代产卵前期与呈显著负相,说明,肠球菌的高丰度可以增加成虫产卵量、减少亲代产卵前期并提高子代羽化数量。肠道中的肠球菌属含有与丰富的纤维素、木聚糖和果胶降解相关的酶编码基因,在帮助宿主降解聚合物方面发挥着重要作用(Xiaetal., 2018)。乳球菌属通过促进降解和消化食物给机体补充营养,但本研究发现成虫取食后肠道内高丰度细菌乳球菌的相对丰度与生长发育指标相关性并不显著,可能其作为一种益生菌广泛参与寄主的生长和免疫(Becketal., 2015)。芽孢杆菌属相对丰度与子一代羽化率呈显著负相关,但Toledo等(1999)研究表明,暴露于苏云金芽孢杆菌Bacillusthuringiensisβ-外毒素处理中的幸存成虫在寿命、繁殖力和孵化率(生育能力)方面没有负面影响,高欢欢等(2016)研究表明,枯草芽孢杆菌Bacillussubtilis对韭菜迟眼蕈蚊Bradysiaodoriphaga孵化率、蛹羽化率及成虫产卵量均无影响。体重与Mesorhizobium、Phreatobacter、沙雷氏菌属Serratia、Bradyrhizobium、Bosea和Hydrotalea对丰度显著正相关。研究发现线虫沙雷氏菌对于崇明拟异小杆线虫的繁殖、生长、发育都有明显促进作用(张崇星, 2009)。Hydrotalea是一种纤维素降解菌且食物纤维含量与草鱼肠道中纤维素降解菌群多样性之间存在正相关关系(Lietal., 2016)。
综上所述,取食不同饲料对花绒寄甲成虫生长发育、繁殖及肠道细菌均有显著影响。随着室内长期饲养,花绒寄甲人工种群逐渐适应了以大麦虫为替代寄主和以大麦虫为主要营养物质的人工饲料,新的配方饲料在花绒寄甲体重、产卵量、产卵前期和羽化率上均表现较好。因此,人工饲料Ⅳ和Ⅵ可以作为后续花绒寄甲长期室内饲养种群成虫的食物。同时,本研究首次利用16S rDNA的分析了取食不同饲料花绒寄甲肠道细菌多样性和群落结构;并探索了肠道细菌与成虫生长繁殖和子代适应性的关联性,发现了可能在花绒寄甲生长繁殖种发挥重要作用的乳球菌属,可为下一步改善花绒寄甲室内养殖技术以提高花绒寄甲成虫产卵及幼虫寄生和羽化提供研究基础。
猜你喜欢
杂志排行
昆虫学报的其它文章
- 基于转录组数据的中华按蚊细胞色素P450超家族基因不同发育阶段、成蚊不同组织和吸血前后不同时期雌成蚊的表达模式分析
- 狄斯瓦螨VdesNPC2b蛋白的基因克隆、原核表达及其与寄主幼虫信息素结合机制研究
- 亚洲玉米螟对球孢白僵菌分生孢子和芽生孢子-玉米共生体的取食选择和嗅觉反应
- 紫外线辐照被寄生的黑腹果蝇蛹对果蝇锤角细蜂生长发育的影响
- Response of heat inducible heat shock protein 90 gene of Aphis gossypii (Hemiptera: Aphididae) to gossypol and flupyradifurone stresses and mutual effect on transcription factor HSF
- 蜜蜂衰老与寿命调控研究进展
