还原型谷胱甘肽联合个体化抗结核化疗方案治疗耐多药肺结核的疗效观察
2024-01-03刘红艳邵丹沈聪胡凯
刘红艳, 邵丹, 沈聪, 胡凯
1.承德市第三医院,河北承德 067050;2.廊坊市人民医院,河北廊坊 065099;3.顺平县医院,河北保定 072250
肺结核(pulmonary tuberculosis,PTB)是由结核分枝杆菌(mycobacterium tuberculosis,MTB)感染引起的慢性传染疾病,好发于免疫力低下人群。越来越多的数据显示,耐多药肺结核(multidrug-resistant pulmonary tuberculosis,MDR-PTB)发病逐年增多[1]。此外,肺结核常规化疗药物很多情况下可能会引起患者肝功能受损,如谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、碱性磷酸酶(alkaline phosphatase,ALP)等升高,又或者伴有直接胆红素及总胆红素(total bilirubin,TBIL)等升高。临床上,还原型谷胱甘肽的适应证包括各种肝病,尤其对酒精中毒性肝病、药物中毒性肝病有肯定的疗效,对感染性肝病、乙型病毒性肝炎、丙型病毒性肝炎中的慢性活动型亦有改善症状、体征和恢复肝功能的作用[2],制定个体化抗结核方案较标准化疗方案更具有科学、合理和精准性等优点。本研究通过联合注射用还原型谷胱甘肽对MDR-PTB患者进行治疗,观察其疗效及对肝功能等的影响。
1 资料和方法
1.1 一般资料
选取本院2019年6月—2020年2月收治的80例MDR-PTB患者,采用随机数字表法均分为联合组和化疗组。联合组男26例,女14例,年龄(47.52±8.53)岁,病程(11.25±3.07)个月;化疗组男24例,女16例,年龄(47.41±8.62)岁,病程(11.17±2.98)个月。两组一般资料比较差异无显著性(P>0.05)。纳入标准:①结核分枝杆菌检测阳性,确诊为MDR-PTB,符合《肺结核诊断和治疗指南》[3]诊断标准;②复治肺结核;③首次抗耐多药治疗;④经结核菌培养和药物敏感性试验后确认为MDR-PTB。排除标准:①合并严重肝肾功能障碍、血液性疾病;②合并活动性肝炎、酗酒;③对本研究药物存在使用禁忌、过敏反应。本研究经承德市第三医院伦理委员会批准,所有患者及家属均知情同意并签署知情同意书。
1.2 治疗方法
化疗组行抗结核化疗和保肝治疗,基于MDR-PTB患者药物敏感情况,选用一线药物及二线药物,疗程为18个月,其中强化期6个月,巩固期12个月。保肝药水飞蓟宾胶囊(天津天士力圣特制药有限公司,国药准字H20040299),加强保肝药选择联苯双酯[广州白云山星群(药业)股份有限公司,国药准字H44023176]。
联合组在化疗组基础上给与注射用还原型谷胱甘肽(意大利福斯卡玛生化制药公司,注册证号H20100117)。化疗第1天给药剂量1.5 g/m2,静脉滴注,15 min内滴注完毕。化疗第2~5天给药剂量0.6 g,肌肉注射。化疗1周后开始肝功能复查,强化期每周1次,巩固期每2周1次,连续2次复查转氨酶高于正常值2倍以上则再次静脉注射还原型谷胱甘肽,剂量0.6 g/天,持续给药2周后复查肝功能。两组均持续治疗18个月后观察疗效。
1.3 疗效评价
参考文献[4]进行疗效评价。痊愈:X线显示肺部空洞闭合,痰菌检验阴性;显效:痰菌检验阴性或保持阴性>3个月,病灶吸收面积部分吸收,X线显示肺部空洞缩小;有效:痰菌检验阴性或保持阴性>1个月;无效:痰菌检验和肺部情况均无好转或恶化,病灶无变化、增大或出现新病灶。总有效率(%)=(痊愈+显效+有效)/总数例×100%。
1.4 肝功能和炎症因子的测定
治疗前后均抽取患者静脉血4 mL,采用酶联免疫吸附法检测血清C反应蛋白(C-reactive proteins,CRP)、白细胞介素-6(interlukin-6,IL-6)和γ干扰素(interferon-γ,IFN-γ)水平。采用Beckman DXC800全自动生化分析仪检测血清白蛋白(albumin,ALB)、TBIL、GOT、GPT、ALP和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC),相关检测试剂盒购于上海广锐生物科技有限公司或上海透景生命科技有限公司。
1.5 调节性T细胞表面标志的测定
治疗前后均抽取两组患者静脉血4 mL,采用Beckman FC500 MPL流式细胞仪检测抗原分化簇CD4+调节性T细胞(regulatory T cells,Treg)与CD8+Treg细胞的比值,以及CD4+Treg细胞中的CD4+CD25+Treg细胞、CD4+程序性死亡受体-1(programmed cell death ligand-1,PD-1)+Treg细胞占比和CD8+Treg细胞中CD8+CD28-Treg细胞、CD8+PD-1+Treg细胞占比。相关检测试剂盒购于北京全氏金生物技术有限公司。
1.6 统计学方法
2 结 果
2.1 两组治疗疗效的比较
治疗后,两组治疗总有效率比较差异无显著性(P>0.05;表1),提示还原型谷胱甘肽未显著提高抗结核化疗疗效。
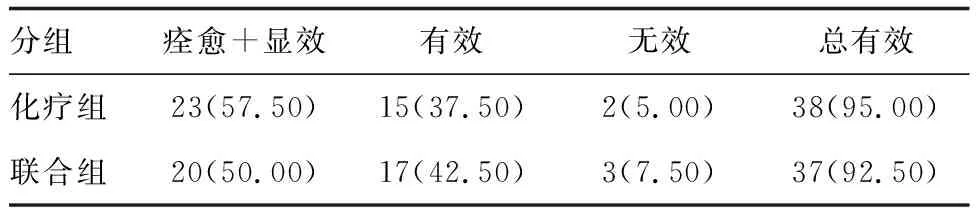
表1 两组治疗疗效比较(n=40) 例(%)
2.2 两组肝功能的比较
治疗后,两组TBIL、GOT和GPT、ALP、HDLC水平均升高,但联合组低于化疗组(P<0.05;表2);与治疗前比较,ALB水平联合组升高,化疗组降低,且治疗后联合组ALB水平高于化疗组(P<0.05;表2),提示还原型谷胱甘肽可规避化疗后肝损伤。
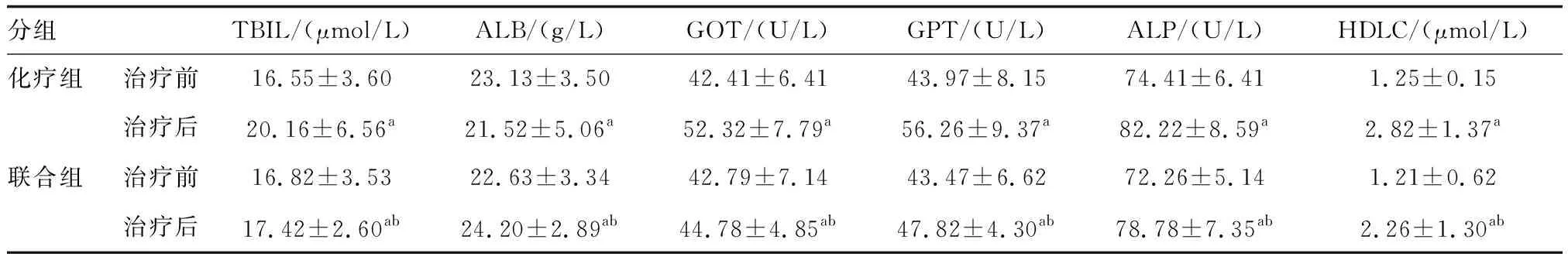
表2 两组肝功能比较(n=40)
2.3 两组Treg细胞表面标志表达情况的比较
与治疗前比较,两组治疗后CD4+/CD8+比值均升高,CD4+CD25+、CD4+PD-1+、CD8+CD28-、CD8+PD-1+比值均降低;且治疗后联合组较化疗组变化更显著(P<0.05;表3和图1)。
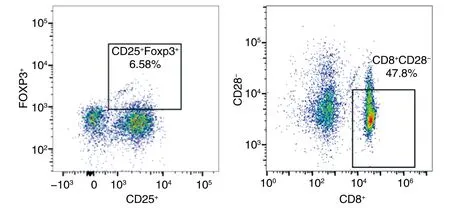
图1 CD25+FOXP3+和CD8+CD28-的流式图
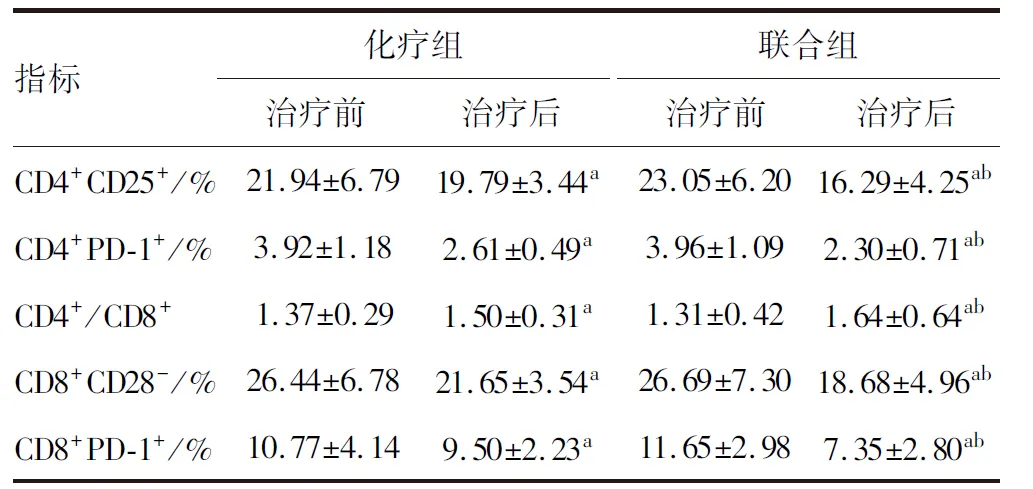
表3 两组Treg细胞表面标志表达情况比较(n=40)
2.4 两组炎症因子水平的比较
与治疗前比较,两组治疗后CRP、IL-6水平均降低,IFN-γ水平升高,且治疗后联合组较化疗组变化更显著(P<0.05;表4),提示还原型谷胱甘肽减少促炎因子的产生,增加抗炎因子的合成。
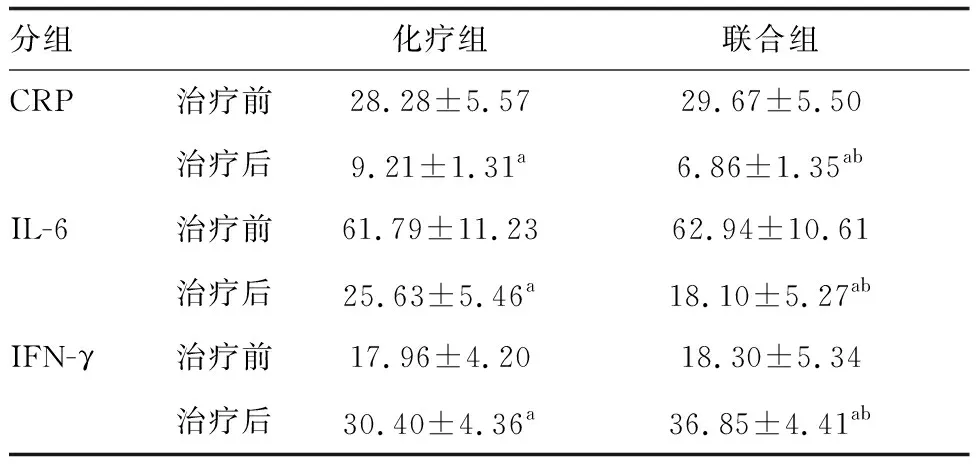
表4 两组炎症因子水平比较(n=40) ng/L
3 讨 论
PTB是由MTB侵入肺部导致的感染性疾病,可通过飞沫、消化道和皮肤接触等途径传播,其中以飞沫传播为主要传播途径。PTB主要病理变化为肺部出现炎性渗出、增生和干酪样坏死等,随着病情进展,可造成进展性肺损伤。PTB在治疗上强调早诊断、早治疗、适量用药,若抗结核药物使用不合理可造成MTB耐药性,可引发MDR-PTB。由于MDR-PTB患者机体内的MTB对多种抗结核药物具有耐药性,对MDR-PTB患者进行化学药物治疗需结合药敏试验结果,针对性地设计个体化抗结核方案[5]。
PTB属于消耗性疾病,MTB毒性可造成机体营养代谢失衡,引起ALB消耗增多,ALB水平降低。治疗PTB的化学药物可造成肝脏损伤,从而导致患者ALB水平进一步降低,TBIL、GOT和GPT水平升高[6-7]。本研究发现,两组患者均疗效显著,且联合组患者血清ALB水平显著高于化疗组,血清TBIL、GOT、GPT、ALP、HDLC水平显著低于化疗组。提示个体化结核化疗方案可有效改善MDR-PTB患者病情,在化疗基础上加用注射用还原型谷胱甘肽,可有效保护MDR-PTB患者肝功能,减少化疗带来的肝功能损伤。分析其原因,可能是还原型谷胱甘肽在体内与自由基等物质相结合,促进毒性物质进行转化和加速排出体外,从而减轻药物对肝脏的毒性反应[8-9]。
本研究结果显示,与治疗前比较,治疗后两组患者CD4+/CD8+比值均显著升高,CD4+CD25+、CD4+PD-1+、CD8+CD28-、CD8+PD-1+比值均显著降低。其原因可能在于个体化抗结核化疗通过有效杀灭MTB,减弱了其对Treg细胞的影响,Treg亚群比例逐步恢复正常,患者的免疫耐受逐渐解除,免疫应答水平逐渐上调,利于MDR-PTB患者病情的进一步改善。
此外,本研究还发现,与治疗前比较治疗后两组患者CRP、IL-6水平均显著降低,IFN-γ水平均显著升高,与部分研究结果相似[10-11]。表明个体化抗结核化疗可有效提高患者免疫力,同时抑制过强炎症反应,加之还原型谷胱甘肽对毒性反应具有拮抗作用,通过抑制巯水基的细胞毒性反应,阻止T细胞产生和激活,进而保护肝脏免疫功能,起到对炎症因子水平的调控作用[12]。
综上所述,个体化抗结核化疗方案治疗MDR-PTB患者可解除患者免疫耐受同时抑制过强炎症反应,联用注射用还原型谷胱甘肽可有效规避化疗后肝损伤的发生,值得在临床上应用和推广。
