基于VEGF/VEGFR信号通路探讨贝伐珠单抗对肠癌SW480细胞生物学行为的影响及其机制
2024-01-02樊叶李超汪志兵
樊叶,李超,汪志兵
(南京医科大学附属南京医院·南京市第一医院消化科,江苏 南京 210006)
肠癌是常见的消化道恶性实体瘤之一,2016年全球癌症发病率和死亡率统计显示,我国等发展中国家肠癌的发病率逐年上升,成为仅次于胃癌和肺癌的第三大癌症[1]。早期肠癌症状不明显,检出率较低,有数据[2]表明,约25%的患者在确诊时已处于晚期,错过了根治性手术切除的最佳治疗时机,同时因肠癌的转移率和复发率较高,放射疗法和化学疗法效果也不佳,且存在严重的毒副作用[3],导致患者预后较差。贝伐珠单抗是近些年来新发现的对于肠癌有较好疗效的人源化单克隆抗体,通过靶向血管内皮生长因子(vascular endothelial growth factor,VEGF)并抑制其生物活性[4],显著抑制肿瘤新生血管生成和肿瘤转移,在肠癌等实体瘤中发挥重要的抑制作用。VEGF是调节血管新生和血管生成动态平衡的高度特异性分子[5],与血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)共同作用,参与调控肿瘤细胞增殖、分化和凋亡等过程[6],影响肠癌等多种恶性肿瘤疾病进展。然而,目前尚不清楚贝伐珠单抗是否可以直接通过调控VEGF/VEGFR信号通路影响肠癌细胞的增殖、迁移、侵袭和凋亡等细胞周期。基于此,本研究拟通过VEGF/VEGFR途径探究贝伐珠单抗对肠癌细胞生物学的影响,并初步了解其作用机制。
1 方法
1.1 细胞培养
人肠癌细胞系SW480购自中国科学院典型培养物保藏委员会细胞库,与含10%胎牛血清和1%青霉素/链霉素的培养液混合,置于改良的无糖RPMI-1640培养基中,保持37 ℃的温度和5%的CO2浓度进行常规培养,每隔3 d更换1次完全新鲜的培养基,待细胞融合至80%以0.25%胰蛋白酶消化后进行传代,取对数生长期细胞进行后续实验。
1.2 药物处理
采用不同浓度(0、25、50、100、200 μg/mL)的贝伐珠单抗(上海罗氏制药有限公司)处理人肠癌细胞系SW480细胞,37 ℃的温度和5%的CO2浓度下培养48 h,收集处理后的含药SW480细胞,检测其增殖、迁移、侵袭、凋亡水平。
1.3 细胞活力检测
采用CCK8计数试剂盒检测细胞活力,取经过上述不同浓度的贝伐珠单抗处理后的各组SW480细胞,按5×103个/孔的密度接种于96孔板中,培养48 h后加入CCK8溶液,每孔各10 μL,严格按照说明书要求操作。共同培养2 h,采用酶标仪(山东竞道光电科技有限公司)分别检测不同时间(0、24、48、72 h)下波长为450 nm处各组细胞的吸光度值,实验重复3次。
1.4 细胞迁移和侵袭能力检测
采用Transwell法检测细胞迁移和侵袭能力,取对数生长期的上述各组细胞,Transwell上室用Matrigel基质胶进行包被或不进行任何操作,然后将细胞按照2×104个/孔放入Transwell上室中,另加600 μL含有胎牛血清的培养液于Transwell下室中,37 ℃的温度和5%的CO2浓度下培养12 h,移除上室细胞,采用4%的多聚甲醛固定Transwell下室中的细胞,再用0.1%的结晶紫染色,倒置荧光显微镜(南京贝登医疗股份有限公司)下观察由上室穿过Transwell滤膜进入下室的细胞数,分析细胞迁移和侵袭情况,实验重复3次。
1.5 细胞凋亡检测
取不同浓度的贝伐珠单抗处理后的各组SW480细胞,采用Annexin V-FITC双染法进行细胞凋亡检测。将各组细胞按照2×106个/孔接种于6孔板中,培养24 h后采用磷酸盐缓冲液(PBS)洗细胞3次,经洗涤过的细胞重悬于150 μL Binding Buffer结合缓冲液中,向缓冲区的细胞悬液中滴加10 μL的Annexin V-FITC试剂以及5 μL碘化丙啶染色液,轻摇离心管使其充分混合,2~8 ℃下避光孵育15 min,采用AnnexinV-FITC/PI凋亡试剂盒(武汉普诺赛生命科技有限公司)说明书检测各组细胞凋亡水平,实验重复3次。
1.6 VEGF/VEGFR信号通路检测
采用Western blot法检测细胞内VEGF/VEGFR信号通路的蛋白表达,取经不同浓度的贝伐珠单抗处理后的各组SW480细胞,移除培养基,PBS洗细胞1次,采用RIPA裂解液裂解细胞后提取蛋白,BCA法检测蛋白含量。将提取到的蛋白经聚丙烯酰胺恒温下1 000 V电泳1 h后转膜,室温封闭2 h后加入VEGF、VEGFR1、VEGFR2和β-actin单克隆抗体(Abcam公司,稀释比均为1∶2 000)室温下孵育过夜,常规洗膜后与二抗(Abcam公司,稀释比均为1∶1 000)室温下孵育1 h,再次洗涤后以ECL发光试剂(湖南一诺唯真科技有限公司)显影,Image J软件扫描并测量感光条带,分析以β-actin作为内参时各组VEGF、VEGFR1、VEGFR2蛋白的相对表达,实验重复3次。
1.7 统计学分析

2 结果
2.1 不同浓度的贝伐珠单抗对肠癌细胞增殖的影响
贝伐珠单抗浓度依赖性地抑制肠癌细胞体外增殖(P<0.05)。见图1。

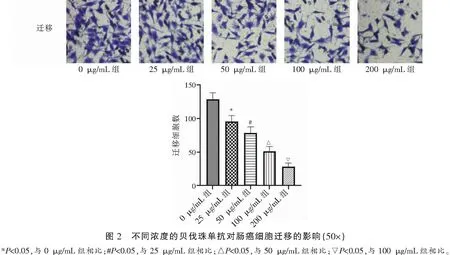
2.2 不同浓度贝伐珠单抗对肠癌细胞迁移的影响
Transwell检测各组细胞迁移水平,结果显示,贝伐珠单抗浓度依赖性地抑制肠癌细胞体外迁移(P<0.05)。见图2。
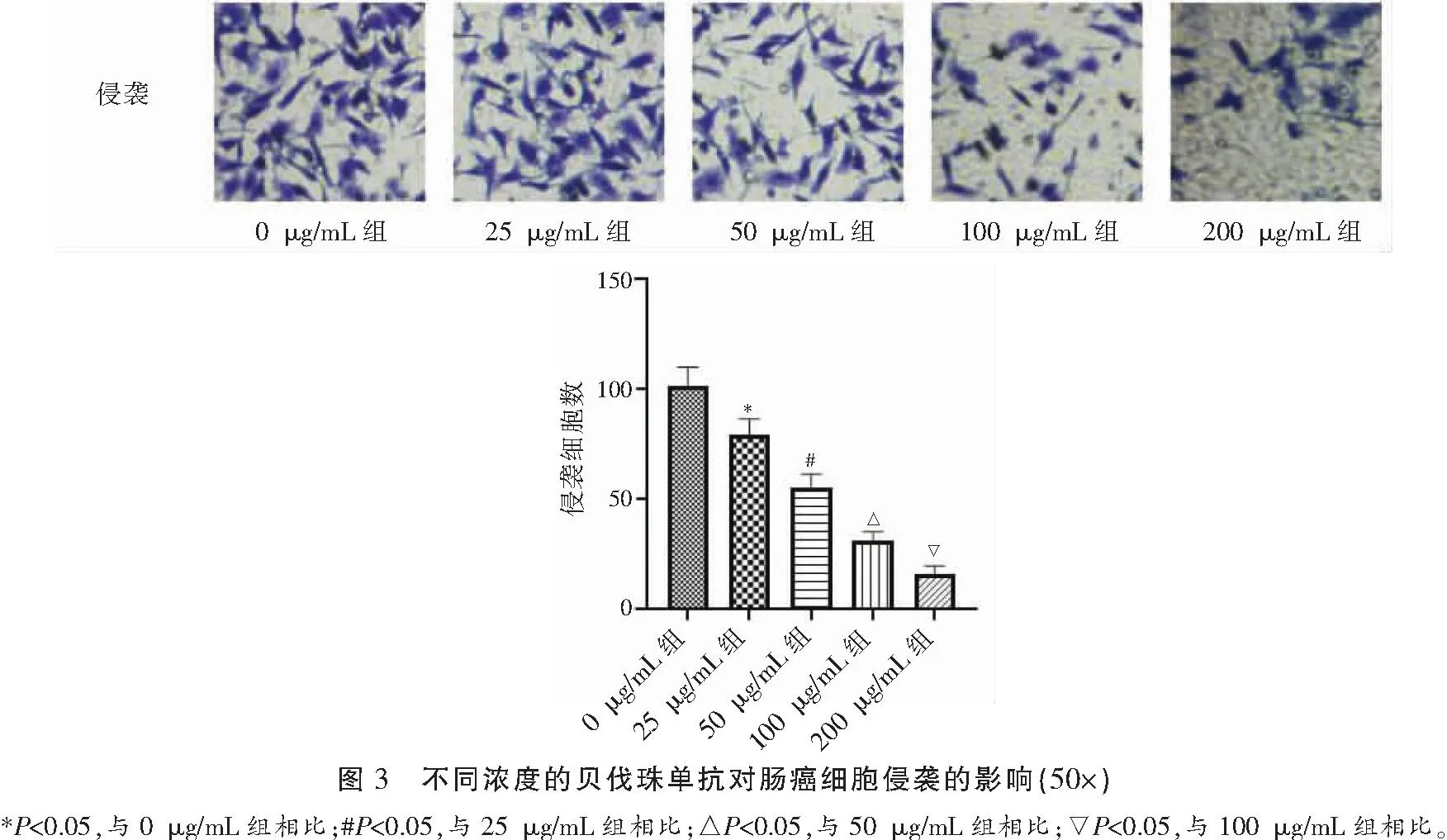
2.3 不同浓度贝伐珠单抗对肠癌细胞侵袭的影响
Transwell检测各组细胞侵袭水平,结果显示,贝伐珠单抗浓度依赖性地抑制肠癌细胞体外侵袭(P<0.05)。见图3。
2.4 不同浓度贝伐珠单抗对肠癌细胞凋亡的影响
AnnexinV-FITC/PI凋亡试剂盒检测各组细胞凋亡情况,结果显示,贝伐珠单抗显著诱导了肠癌细胞的体外凋亡,且呈浓度依赖性(P<0.05)。见图4。

2.5 不同浓度的贝伐珠单抗对肠癌细胞内VEGF/VEGFR信号通路的影响
Western blot检测经不同浓度的贝伐珠单抗处理后的各组肠癌细胞内VEGF、VEGFR1、VEGFR2蛋白表达,结果显示,随着贝伐珠单抗浓度的增加,VEGF的表达显著下调,VEGFR1和VEGFR2的表达显著上调(P<0.05)。见图5。

3 讨论
随着基因技术的发展和对肠癌研究的不断加深,有学者[7-8]提出,肠癌细胞生物学行为受到转化生长因子β1、VEGF等多种细胞因子的影响。VGEFR1和VEGFR2是VEGFR家族中的重要成员,其中VEGFR1在单核细胞等巨噬细胞系的细胞膜中高表达,参与细胞因子和趋化因子之间的信号转导,刺激不同组织的炎症反应和非炎症反应[9],促进肿瘤血管、淋巴管生成和肿瘤转移。VEGFR2具有较强的酪氨酸激酶活性,在血管内皮细胞中高表达,产生主要和直接的血管生成信号[10]。有报道[11-12]称,VEGF在肺癌、卵巢癌、结直肠癌等多种恶性肿瘤中高表达,抑制VEGF的表达可阻断肿瘤新生血管生成,被认为是多种癌症的潜在免疫治疗靶点。本研究发现,VEGF/VEGFR信号通路参与介导肠癌细胞增殖、迁移、侵袭和凋亡,为肠癌的临床治疗提供了新的分子靶点和理论依据,这主要与VEGF与其受体家族中的VEGFR1和VEGFR2结合,可在恶性肿瘤疾病中参与细胞间的信号传递,调控细胞内的多种基因表达,进而影响疾病进展有关[13]。
贝伐珠单抗是治疗胰腺炎、结肠癌等癌症的重要靶向药物,发挥显著抗肿瘤血管生成作用,抑制肿瘤细胞的增殖、迁移和侵袭,抑制肠癌等癌症的病情进展[14]。本研究结果显示,贝伐珠单抗可浓度依赖性地抑制人肠癌细胞系SW480细胞的体外增殖、迁移和侵袭,诱导细胞凋亡,发挥显著的抑癌效应。进一步的机制实验也表明,贝伐珠单抗的抗肿瘤作用是通过抑制血管内皮生长因子VEGF的表达,上调血管内皮生长因子受体VEGFR1/2来实现的。这与贝伐珠单抗特有的生物活性有关,贝伐珠单抗可与VEGFR受体竞争性结合[15],上调VEGFR1、和VEGFR2的表达,阻断VEGF的活性,下调VEGF的表达,抑制肿瘤新生血管和淋巴管生成[16],进而显著抑制肿瘤细胞增殖、迁移、侵袭,并诱导细胞凋亡,与Itatani等[17]的研究结果相符。
综上,贝伐珠单抗通过下调VEGF,上调VEGFR1和VEGFR2的表达,在体外显著抑制肠癌细胞的增殖、迁移和侵袭,诱导细胞凋亡,且贝伐珠单抗的抗癌效应随着药物浓度的增加而增强。
