7种不同类型肿瘤组织内胱抑素B表达的比较研究
2024-01-02敬昊东冯莉王朝莉李丽谢勇恩胡为民杨健敬保迁
敬昊东,冯莉,王朝莉,李丽,谢勇恩,胡为民,杨健,敬保迁
(川北医学院免疫学与分子生物学研究室,四川 南充 637000)
人体内许多重要功能分子通过调节表达方式来调控细胞增殖和分化,介导细胞与细胞间,或细胞与细胞外基质间的相互作用等,维持机体不同组织正常发育分化,若表达失调,可促进肿瘤发生发展及转移[1]。识别和深入研究不同种类癌症组织间差异表达的功能分子或癌症组织与相应癌旁组织间差异表达的功能分子,不仅有利于阐释相关癌症的发生、发展、侵袭、转移的分子机制,而且可寻找到相应的干预或治疗措施。
本课题组之前采用抑制性消减杂交技术从整个转录组水平比较食管鳞状细胞癌组织与相应癌旁粘膜组织间差异表达的基因,发现食管癌旁粘膜组织中组织蛋白酶抑制剂胱抑素B(cystatin B,CSTB)基因发生表达,而食管鳞状细胞癌组织中CSTB基因则不发生表达[2]。由于CSTB在维持机体正常细胞的增殖、分化、及组织形成等中发挥重要作用,近年研究[3-4]表明:肿瘤内CSTB表达失调严重影响肿瘤的发生发展,通过CSTB作用的添加或拮抗可发展肿瘤治疗方法。但直至目前,仍未见同时观察并比较人体内不同类型肿瘤或体外培养肿瘤细胞内CSTB表达的实验报道,不能系统阐释不同正常组织或肿瘤内CSTB的表达特征,及评价人体内各种不同类型肿瘤的发生发展与CSTB表达变化间的关系。本研究拟观察和比较不同癌症组织、癌旁组织和癌细胞株内CSTB的表达特征,为进一步研究不同类型肿瘤治疗和疗效考核中CSTB的意义提供实验基础。
1 材料与方法
1.1 细胞及组织
食管低分化鳞状细胞癌、食管中分化鳞状细胞癌、食管高分化鳞状细胞癌、食管腺癌及相应癌旁粘膜的手术切除组织系在患者及家属知情同意下,由川北医学院附属医院胸外科采集自食管癌患者。
实体癌及相应癌旁组织石蜡样本。其中15例食管鳞状细胞癌与相应癌旁组织,10例喉鳞状细胞癌与相应癌旁组织,22例胃腺癌与相应癌旁组织,12例肺鳞状细胞癌与相应癌旁组织,20例肝细胞癌与相应癌旁组织,12例结肠腺癌与相应癌旁组织及17例膀胱移行细胞癌与相应癌旁组织,均由川北医学院附属医院病理科提供。
食管鳞状细胞癌Eca109细胞株、胃腺癌SGC7901细胞株、肝癌Hep G2细胞株及肺鳞状细胞癌YTLMC-90细胞株系本研究室保存。
1.2 试剂
抗CSTB单克隆抗体与抗β-actin单克隆抗体(美国Santa Cruz公司),羊抗鼠IgG抗体及NBT/BCIP(美国Promega公司),蛋白质定量试剂盒(美国Bio Rad公司),SABC法免疫组化染色试剂盒(福建迈新公司)。
1.3 细胞培养
将食管鳞状细胞癌Eca109细胞株、胃腺癌SGC7901细胞株、肺鳞状细胞癌YTLMC-90细胞株及肝细胞癌HepG2细胞株以含青霉素(100 U/mL)、链霉素(100 U/mL)及10%小牛血清的RPMI 1640复合培养液在37 ℃,5% CO2,饱和湿度下扩增培养。
1.4 Western blot
将收集的食管癌患者手术切除的癌组织及癌旁粘膜组织,分别以蛋白质裂解液[8 mol/L尿素、4% CHAPS、40 mmol/L三羟甲基氨基甲烷、65 mmol/L二硫苏糖醇和10 mmol/L苯甲磺酰氟(PMSF)]室温下裂解,并用蛋白质定量试剂盒,参照使用说明测定各样品蛋白质浓度。然后,取等量的不同类型食管癌病人癌组织与癌旁粘膜组织蛋白质,进行SDS-PAGE电泳,电转移方法将凝胶中蛋白质原位转移至硝酸纤维滤膜上,3%脱脂奶粉封闭1 h后,分别以抗CSTB单克隆抗体、抗β-actin单克隆抗体为一抗(工作浓度为1∶1 000),碱性磷酸酶标记羊抗鼠IgG为二抗(工作浓度为1∶5 000)进行识别,NBT/BCIP为底物进行显色。各免疫识别均进行3次独立重复实验。免疫识别图像用PDQuest1.0计算机软件进行编辑后,比较不同类型及分化程度的食管癌病人间、食管癌患者癌组织与相应癌旁粘膜组织间CSTB表达的变化。
1.5 免疫组化法
参考免疫组化染色试剂盒的使用说明,取的各癌组织及相应癌旁组织石蜡切片,在家用高压锅内以Tris-EDTA 缓冲液(10 mM 三羟甲基氨基甲烷,1 mmol/L EDTA 溶液,0.05% Tween 20,pH 9.0)热诱导抗原表位修复3 min;体外培养癌细胞株制成细胞爬片。将上述处理后的标本片置于37 ℃的湿盒中,以10%小牛血清封闭30 min后,滴加抗CSTB单克隆抗体(工作浓度为1∶500),于4 ℃过夜,PBS洗洗涤(3 min×3),滴加生物素化羊抗鼠IgG,于37 ℃作用15 min,再用PBS洗涤(5 min×3)。各标本片分别滴加SABC试剂与DAB显色试剂,室温显色后,蒸馏水洗涤,再经铁苏木素轻度复染后,脱水,透明,封片。各标本的免疫识别均进行3次独立重复实验。结果由专业临床病理诊断医师对各免疫识别标本片进行判读,比较不同类型实体癌病人的癌组织与相应癌旁粘膜组织间,及体内癌组织与体外培养的相应癌细胞株间CSTB表达的变化。
1.6 统计学分析
采用Prism软件对数据进行统计分析。计数资料以[n(%)]表示,组间比较采用Fisher确切概率法检验,P<0.05为差异具有统计学意义。
2 结果
2.1 食管癌组织与癌旁粘膜组织内CSTB的表达
与β-actin对照比较,食管低分化鳞状细胞癌组织、中分化鳞状细胞癌组织及高分化鳞状细胞癌组织均不表达CSTB,但相应癌旁粘膜组织则表达CSTB,而食管腺癌组织及其癌旁粘膜组织均不表达CSTB。见图1。

2.2 不同类型实体癌组织及癌旁组织内CSTB的表达与分布
所有食管鳞状细胞癌、喉鳞状细胞癌及胃腺癌患者的癌旁粘膜组织均高表达CSTB。在喉粘膜和食管粘膜中,仅表面角化层及紧邻的多边形细胞大量表达CSTB,而基底层细胞及邻近的多边形细胞则不表达(图2A,图2C)。胃腺癌的癌旁胃粘膜中,仅胃底腺细胞大量表达CSTB(图2E),而表层单层柱状上皮细胞不表达CSTB。另外,在95%肝细胞癌患者的癌旁组织中,CSTB呈灶性表达(图2I),这些区域内存在炎性细胞浸润,在无炎性细胞浸润区域的肝组织则不表达CSTB。而肺鳞状细胞癌旁肺组织、结肠腺癌旁结肠粘膜及膀胱移行细胞癌旁粘膜组织不表达或低表达CSTB(图2G,图2K,图2M)。

比较不同类型实体癌患者癌旁组织组织与癌组织内CSTB的表达率,结果发现不同类型实体癌组织内CSTB的表达率呈多样性变化(表1)。(1)食管鳞状细胞癌和喉鳞状细胞癌组织表达CSTB发生显著下调(P<0.05)。仅40%食管鳞状细胞癌患者的癌组织表达CSTB(图2B)。同样,仅40%喉鳞状细胞癌患者的癌组织表达CSTB(图2D)。(2)胃腺癌表达CSTB发生显著下调(P<0.05)。仅50%胃腺癌患者的癌组织中有残存胃底腺细胞表达CSTB(图2F)。(3)肺鳞状细胞癌、结肠腺癌和膀胱移行细胞癌表达CSTB发生显著上调(P<0.05)。有50%肺鳞状细胞癌患者的癌组织表达CSTB,41.7%结肠腺癌患者的癌组织表达CSTB,及64.7%膀胱移行细胞癌患者的癌组织表达CSTB(图2H,图2L,图2N)。(4)90%肝细胞癌患者的癌组织表达CSTB(图2J),而相应患者癌旁组织亦表达CSTB,两者间的表达率无统计学差异(P>0.05)。

表1 Cystatin B在不同肿瘤组织内的表达[n(%)]
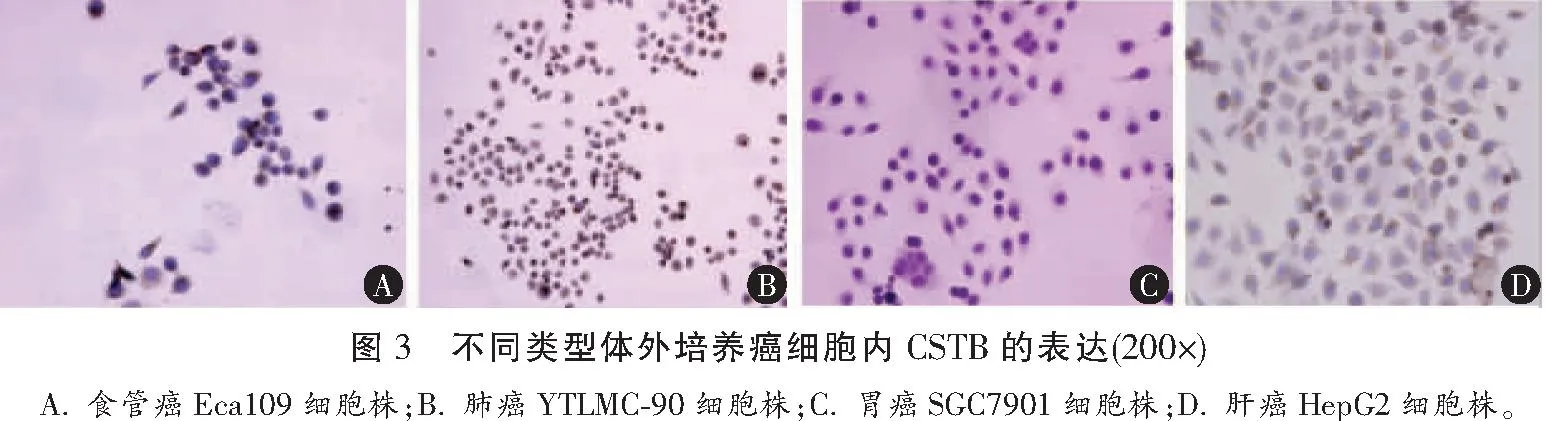
2.3 不同类型体外培养癌细胞内CSTB的表达
不同种类的体外培养癌细胞株经抗CSTB单克隆抗体免疫组化染色和铁苏木素复染,结果显示食管鳞状细胞癌Eca109细胞株、肺鳞状细胞癌细胞株YTLMC-90及肝细胞癌HepG2细胞株均大量表达CSTB(图3A,图3B,图3D),而胃腺癌SGC7901细胞株则低表达CSTB(图3C)。
3 讨论
人体内组织蛋白酶抑制剂通过对组织蛋白酶的抑制,密切影响机体内蛋白质降解、免疫等系列生理过程,对维护机体健康和生命至关重要。若组织蛋白酶抑制剂表达失调不仅影响机体正常生长发育,而且参与风湿病、肿瘤及坏死性炎症等的发生发展[5]。组织蛋白酶抑制剂家族中的CSTB可抑制木瓜蛋白酶、组织蛋白酶B,H,L,S的生物活性。本研究发现,在多种组织中,CSTB广泛地分布于细胞浆和细胞核,及分泌到细胞外,预示它的作用不仅发生在细胞内,也可发生在细胞外。在细胞浆中,CSTB通过增强线粒体膜稳定性,避免蛋白酶泄漏[6],减少氧化应激反应,抑制凋亡、铁死亡[7];减少炎性细胞因子产生[8],炎性小体形成,抑制焦亡发生[9-10];增强细胞自噬功能,清除错误蛋白[11-12],维护细胞的正常生命代谢活性。在细胞核中,CSTB 通过抑制组织蛋白酶对组蛋白、转录因子CUX1等的降解,调节细胞周期和细胞寿命[13-14]。在细胞外,CSTB可抑制相关组织蛋白酶对细胞间质中弹力蛋白等的降解[3],有利于细胞增殖、组织形成。说明CSTB从多个方面影响人细胞的生物学行为[15]。
本研究证实,在成人阶段,CSTB的表达具有组织特异性。正常成人喉、食道中上段粘膜及胃底腺可表达CSTB,其它如结肠粘膜、膀胱粘膜、肝及肺组织中低表达或不表达。说明CSTB属人体正常分化表达蛋白,在不同性质的正常细胞内的表达存在差异。并且,先前Räsänen等[16]发现在人胚胎粘膜组织发育过程中,第9周时鳞状上皮细胞层内基底细胞等开始表达CSTB,16周时达到最高水平,并一直存在于成熟的胎儿、婴儿和成人鳞状上皮组织内。而在皮肤发育过程中,11周时开始表达CSTB,17周以上时表达减少,超过26周时皮肤内完全消失。Lu等[17]证实在雌激素诱导的子宫蜕膜化过程中,当成纤维细胞分化为成熟的蜕膜上皮细胞后开始表达CSTB,并刺激血管生成,Abdulkhalikova等[18]研究证实肥胖妇女减肥后可引起子宫内膜退化,CSTB表达增高,本研究亦证实在成人食管和喉粘膜中仅分化中晚期细胞表达CSTB。说明在机体相关组织或细胞中CSTB的表达受分化发育压力的调节。本研究证实癌旁肝组织中,存在炎症促进CSTB表达现象。同时,发现人食管鳞状细胞癌组织等不表达或低表达CSTB,但体外人工培养的食管鳞状细胞癌Eca109细胞株等则大量表达CSTB,预示特定肿瘤细胞内CSTB的表达受炎症或营养等因素影响会发生变化。致体外培养的相关癌细胞株与患者体内癌细胞的生物学行为有可能不一致,相关体外实验结果难以反映体内真实情况。
本研究证实人体实体癌组织表达CSTB存在失调现象。癌喉鳞状细胞癌、食管鳞状细胞癌及胃腺癌组织CSTB的表达显著下调,预示相关癌细胞发生在分化发育早期,肿瘤微环境中的相关组织蛋白酶缺乏CSTB抑制,相关细胞分裂速度较快[19],易向周边侵袭,并经淋巴结转移[20-21],部分癌组织表达CSTB,可能与局部炎症,或细胞密度过大,营养匮乏致相关癌细胞衰退有关;胃腺癌旁粘膜固有层中胃底腺细胞可大量表达CSTB,胃癌组织中随胃底腺细胞减少,致胃癌组织表达CSTB下调,体外培养的相关胃癌细胞株也仅表达的低水平的CSTB,说明胃腺癌主要发生在胃底腺细胞未成熟阶段;肺鳞状细胞癌、膀胱移行细胞癌及结肠腺癌组织CSTB的表达显著上调,可能与癌组织局部炎症等有关;肝癌旁炎性灶、肝癌组织及体外培养肝癌细胞株均高表达CSTB,可能与炎症相关。由于CSTB为多功能分子,既具有抗炎作用,但又可增强癌细胞活性和寿命[22],促进组织血管生成[17],预示可增强相关癌细胞耐药性[23]。若通过CSTB作用的添加或拮抗方式来研发相关肿瘤治疗方法,必须依据特定肿瘤CSTB的表达特征、对相关肿瘤发生发展的具体影响等进行综合考虑。
