芒柄花素调节Nrf2/HO-1信号通路对急性肺栓塞大鼠肺组织损伤的影响
2024-01-02赵博韬毛宏宇姚春霞吴清华
赵博韬,毛宏宇,姚春霞,吴清华
(1.沧州市中心医院心内科,河北 沧州 062450;2.河北工程大学医学院,河北 邯郸 056000)
急性肺栓塞(acute pulmonary embolism,APE)是以各种栓子堵塞肺动脉从而引起呼吸功能和肺循环功能障碍,其病情凶险且病死率高[1]。栓子堵塞肺动脉可阻碍血液引起氧化应激损伤,导致肺动脉高压;并且栓子可刺激血管内皮,引起炎症反应进一步加重疾病[2-3]。目前,APE的治疗以抗凝、溶栓等为主,但会增加出血风险,因此仍需探索新型有效的治疗药物。
芒柄花素(formononetin,FN)是一种在黄芪、鸡血藤及红车轴草中普遍存在的异黄酮类化合物,具有抗炎、抗菌和抗氧化特性[4]。芒柄花素对急性肺损伤具有保护作用[5];还可通过抑制大鼠肺血管重构减轻肺动脉高压[6]。然而,FN对APE的治疗作用及其可能的机制尚不清楚。核因子E2相关因子2(nudear factor E2-related factor 2,Nrf2)/血红素加氧酶1(heme oxygenase-1,HO-l)通路是抗氧化应激的关键信号通路,并且能够调控核因子κB(NF-κB)表达与活化参与炎症反应过程[7-8]。研究[9]发现,Nrf2是FN诱导HO-1表达的上游信号调节因子,当Nrf2沉默时,FN诱导的HO-1水平提升被显著抑制,FN通过激活Nrf2/HO-1途径发挥其抗炎和抗氧化作用,从而减轻小鼠高氧性急性肺损伤。但FN调控Nrf2/HO-1信号通路对APE大鼠肺组织损伤影响及作用机制尚未明确。因此,本实验通过构建APE大鼠模型,探究FN调控Nrf2/HO-1信号通路对APE大鼠肺组织损伤的影响。
1 材料与方法
1.1 实验动物
从广东维通利华实验动物技术有限公司购入100只SD大鼠(SYXK(粤)2022-00683),雄性,体质量为(280±10)g,大鼠适应性饲喂1周。
1.2 试剂
芒柄花素(纯度≥99.0%, 47752)、Nrf2抑制剂Brusatol(纯度≥95.0%, SML1868)购自美国Sigma-Aldrich公司;低分子肝素钙注射液购自深圳赛保尔生物药业有限公司;B型脑钠肽(BNP)(ml028489)、肌钙蛋白Ⅰ(TnⅠ)(ml092662)、缺血修饰性白蛋白(IMA)(ml001923)检测试剂盒均购自上海酶联生物科技有限公司;白细胞介素6(IL-6)(PI328)、肿瘤坏死因子α(TNF-α)(PT516)检测酶联免疫吸附(ELISA)试剂盒均购自上海碧云天生物技术有限公司;超氧化物歧化酶(SOD)(799594)、丙二醛(MDA)(D799762)检测试剂盒均购自生工生物工程(上海)股份有限公司;兔源一抗Nrf2抗体(ab31163)、HO-1抗体(ab68477)、NF-κB抗体(ab16502)、p-NF-κB抗体(ab76302)均购自英国Abcam公司。
1.3 主要仪器
ABL90血气分析仪(丹麦雷度米特医疗设备有限公司);ELx808酶标仪(美国Lonza公司);BX51电动显微镜(日本Olympus公司)。
1.4 方法
1.4.1 模型建立 大鼠采用颈静脉回输自体血栓栓子建立APE模型[10]。经大鼠自身眼眶静脉取血0.5 mL,待凝血后将凝块分割成0.5×2 mm2大小的血栓栓子20个左右,吸入2 mL无菌注射器内,生理盐水补足至2 mL制成血栓悬液备用。50 mg/kg戊巴比妥钠腹腔注射麻醉大鼠,于颈部右侧做一约1 cm的纵行切口,游离颈静脉后,经右侧颈总静脉迅速注入血栓悬液(约20个栓子),消毒并缝合。术后2 h内大鼠有发绀,呼吸加快、加深的症状出现表示成功建立APE模型。
1.4.2 实验分组与给药 88只大鼠建立APE模型,共造模成功72只,随机分为APE组、低分子肝素钙组(LMWH组)、低剂量FN组(L-FN组)、高剂量FN组(H-FN组)、Nrf2抑制剂Brusatol组(BR组)、高剂量FN+Brusatol组(H-FN+BR组),每组各12只;另取12只大鼠作为对照组(Control组),仅分离颈静脉,不注射血栓悬液。造模后,L-FN组和H-FN组大鼠分别以30 mg/kg、60 mg/kg剂量腹腔注射FN溶液,LMWH组造模后立即腹腔注射低分子肝素钙注射液(0.01 mL/kg)[9],BR组大鼠腹腔注射2 mg/kg剂量[11]Brusatol,H-FN+BR组大鼠腹腔注射60 mg/kg FN溶液和2 mg/kg Brusatol,Control组和APE组大鼠腹腔注射同量生理盐水;1次/d,连续给药7 d。
1.5 观察指标
1.5.1 动脉血氧分压(PaO2)、氧合指数(OI)检测 末次给药16 h后,将大鼠麻醉,剪开腹腔,暴露腹主动脉,采用普通负压管取血2 mL用于分离血清,并采用抗凝负压管经腹主动脉取大鼠血液2 mL,血气分析仪测量动脉血氧分压(PaO2),计算氧合指数(OI)。OI=PaO2/吸入氧浓度(氧浓度为0.21)。
1.5.2 BNP、TnⅠ、IMA水平检测 将普通负压管中的血液离心(3 000 r/min,10 min),取上层血清。采用ELISA法测定BNP、TnⅠ、IMA水平,按试剂盒操作步骤进行。
1.5.3 肺组织病理检查 取多聚甲醛固定的肺组织经脱水、透明、浸蜡、包埋及切片制作石蜡切片,切片厚度在4~6 μm,制作好的切片再经脱蜡、水化、浸染、分化、返蓝等步骤进行HE染色,再分别浸泡于70%、80%、90%以及100%梯度酒精1 min,二甲苯浸泡5 min,中性树胶封片,在光学显微镜下进行观察。
1.5.4 血清中炎症因子检测 采用ELISA法测定血清IL-6、TNF-α水平,按说明书严格操作。制备标准品并绘制标准曲线,取血清置于冰上备用,每孔加入样品100 μL,37 ℃孵育2 h,加入炎性抗体于检测孔中,孵育、洗板、显色,于450 nm处使用酶标仪测定吸光度值,计算各组大鼠IL-6、TNF-α水平。
1.5.5 肺组织氧化应激指标检测 肺组织匀浆后,3 000 r/min离心10 min,吸取上清液于96孔板中,酶标仪中测定吸光度值(检测波长450 nm),计算各组大鼠SOD、MDA水平,操作步骤严格按照说明书进行。
1.5.6 Westernblot法检测Nrf2/HO-1信号通路相关蛋白水平 Western blot检测Nrf2、HO-1、NF-κB、p-NF-κB蛋白水平,肺组织匀浆后,提取总蛋白。按照试剂盒操作步骤通过Tris-甘氨酸SDS-PAGE分离蛋白质并转移到硝酸纤维素膜上,经4 ℃封闭过夜,然后将硝酸纤维素膜有蛋白一面置于一抗Nrf2、HO-1、NF-κB、p-NF-κB稀释液(稀释比例1∶1 000)中孵育过夜,取硝酸纤维膜洗净一抗后常温下二抗孵育1 h,TBST洗脱4次。滴加ECT显影液检测蛋白质印迹,分析目标蛋白灰度值。
1.6 统计学分析
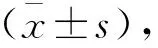
2 结果
2.1 各组大鼠动脉血PaO2、OI比较
与Control组比较,APE组大鼠动脉血PaO2、OI降低(P<0.05)。与APE组比较,LMWH组、L-FN组和H-FN组大鼠动脉血PaO2、OI升高(P<0.05),BR组大鼠动脉血PaO2、OI降低(P<0.05);与L-FN组比较,LMWH组和H-FN组大鼠动脉血PaO2、OI升高(P<0.05);与H-FN组比较,H-FN+BR组大鼠动脉血PaO2、OI降低(P<0.05)。见表1。
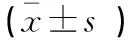
表1 各组大鼠动脉血PaO2、OI比较
2.2 各组大鼠BNP、TnⅠ、IMA水平比较
与Control组比较,APE组大鼠BNP、TnⅠ、IMA水平升高(P<0.05);与APE组比较,LMWH组、L-FN组和H-FN组大鼠BNP、TnⅠ、IMA水平降低(P<0.05),BR组BNP、TnⅠ、IMA水平升高(P<0.05);与L-FN组比较,LMWH组和H-FN组大鼠BNP、TnⅠ、IMA水平降低(P<0.05);与H-FN组比较,H-FN+BR组大鼠BNP、TnⅠ、IMA水平升高(P<0.05)。见表2。

表2 各组大鼠BNP、TnⅠ、IMA水平比较
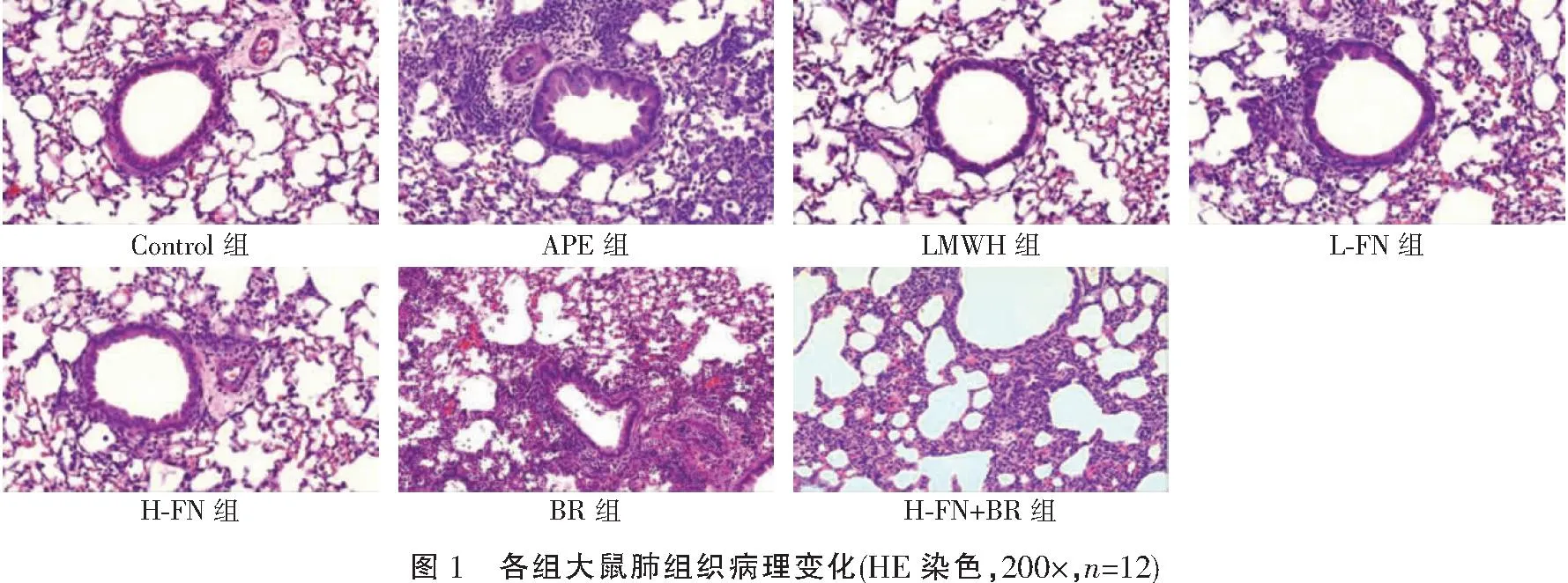
2.3 各组大鼠肺组织病理变化比较
Control组大鼠肺组织结构清晰完整;APE组大鼠肺组织可观察到肺泡破裂,有渗液,间质水肿,并伴有大量炎性细胞浸润;LMWH组、L-FN组和H-FN组肺组织病变减轻,LMWH组和H-FN组病理变化改善更为明显;BR组大鼠肺组织病变较APE组加重,肺泡壁增厚进一步增厚,肺泡腔内可见大量炎症细胞浸润;H-FN+BR组大鼠肺组织病变较H-FN组加重,炎性细胞增多。见图1。
2.4 各组大鼠血清炎性因子IL-6、TNF-α水平比较
与Control组比较,APE组大鼠血清炎性因子IL-6、TNF-α水平升高(P<0.05);与APE组比较,LMWH组、L-FN组和H-FN组大鼠血清炎性因子IL-6、TNF-α水平降低(P<0.05),BR组大鼠血清炎性因子IL-6、TNF-α水平升高(P<0.05);与L-FN组比较,LMWH组和H-FN组大鼠血清炎性因子IL-6、TNF-α水平降低(P<0.05);与H-FN组比较,H-FN+BR组大鼠血清炎性因子IL-6、TNF-α水平升高(P<0.05)。见表3。
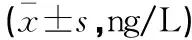
表3 各组大鼠血清炎性因子IL-6、TNF-α水平比较
2.5 各组大鼠肺组织SOD、MDA水平比较
与Control组比较,APE组大鼠肺组织SOD水平降低,MDA水平升高(P<0.05);与APE组比较,LMWH组、L-FN组和H-FN组大鼠肺组织SOD水平升高,MDA水平降低(P<0.05),BR组大鼠肺组织SOD水平降低,MDA水平升高(P<0.05);与L-FN组比较,LMWH组和H-FN组大鼠肺组织SOD水平升高,MDA水平降低(P<0.05);与H-FN组比较,H-FN+BR组大鼠肺组织SOD水平降低,MDA水平升高(P<0.05)。见表4。

表4 各组大鼠肺组织SOD、MDA水平比较
2.6 各组大鼠肺组织Nrf2、HO-1、NF-κB、p-NF-κB蛋白水平比较
与Control组比较,APE组大鼠Nrf2、HO-1水平降低,p-NF-κB/NF-κB升高(P<0.05);与APE组比较,LMWH组、L-FN组和H-FN组大鼠Nrf2、HO-1水平升高,p-NF-κB/NF-κB降低(P<0.05),BR组大鼠Nrf2、HO-1水平降低,p-NF-κB/NF-κB升高(P<0.05);与L-FN组比较,LMWH组和H-FN组大鼠Nrf2、HO-1水平升高,p-NF-κB/NF-κB降低(P<0.05);与H-FN组比较,H-FN+BR组大鼠Nrf2、HO-1水平降低,p-NF-κB/NF-κB升高(P<0.05)。见图2及表5。


表5 各组大鼠肺组织Nrf2、HO-1、p-NF-κB蛋白水平比较
3 讨论
APE常引起肺梗塞,导致肺实质缺血、出血和最终坏死[12]。BNP和TnⅠ是临床上APE常用的诊断指标,能够有效预测肺血栓短期预后状况[13]。此外APE的发生发展与IMA水平升高密切相关[14]。对高危APE患者来说,体内低氧血症会更加明显,肺动脉压急剧增高,血清中BNP的水平显著升高[15]。IMA可用作评估APE严重程度的临床标志物。崔波等[16]研究发现,在APE患者中IMA水平呈高水平表达。在本研究中,APE大鼠肺组织可见肺泡破裂融合,有渗液,间质区水肿且大量炎性细胞浸润,PaO2、OI、SOD水平降低,BNP、TnⅠ、IMA、IL-6、TNF-α、MDA水平升高。由此可知,APE不仅会引起机体BNP、TnⅠ、IMA升高,还有诱导炎症反应和氧化应激,损伤肺组织。
研究[17]表明,FN能够通过激活Nrf2/HO-1信号传导,抑制氧化应激以及炎症反应,对甲氨蝶呤肾毒性大鼠发挥保护作用。Zhou等[18]发现,在深静脉血栓大鼠模型中,FN可减少血栓形成并抑制促炎介质IL-1β和IL-18的分泌,改善静脉血栓。此外,胡志平等[19]研究显示,FN可通过促进Nrf2/HO-1通路激活,抑制氧化应激反应,减轻脑外伤小鼠脑水肿并改善其行为障碍。以上研究表明FN具有显著的抗炎和抗氧化作用。在本研究中,低、高剂量FN可降低BNP、TnⅠ、IMA、IL-6、TNF-α、MDA水平,升高SOD水平,减轻APE大鼠肺组织病变。这与既往的研究结果一致,进一步证实了FN具有抗炎、抗氧化能力;提示FN可抑制炎症和氧化应激,改善APE大鼠肺组织损伤。
Nrf2和Kelch样ECH相关蛋白(Keap1)在细胞质中以二聚体的形式结合,当受到刺激时,Nrf2会从Keap1上解离并转移到细胞核中,从而诱导编码的相关酶HO-1的表达[20]。HO-1是Nrf2的下游信号蛋白,具有催化血红素降解作用,其降解产物胆绿素具有较强的抗氧化活性,因而Nrf2/HO-1信号通路表现出抗氧化能力[21]。Huang等[22]的研究发现,在IL-13刺激的人鼻上皮JME/CF15细胞中,FN预处理可促进Nrf2的核移位,抑制IL-13诱导的JME/CF15细胞中促炎性细胞因子的分泌。NF-κB是一种由p50/p65二聚体形成的核转录因子,研究发现在机体病理状态下能够诱导NF-κB磷酸化为p-NF-κB p65,其具有诱导炎性因子转录表达能力,加重炎症反应。Hao等[23]研究表明,FN通过激活Nrf2/HO-1信号通路,抑制炎症和氧化应激,防止顺铂诱导的急性肾损伤。在本研究中,APE大鼠肺组织Nrf2、HO-1水平降低,p-NF-κB/NF-κB升高,提示Nrf2/HO-1信号通路表达受到抑制,NF-κB通路激活;且Nrf2抑制剂Brusatol可进一步抑制Nrf2/HO-1信号通路,加重APE大鼠肺组织损伤,表明APE大鼠肺损伤与Nrf2/HO-1信号通路的活化被抑制有关。给予FN处理后,APE大鼠肺组织Nrf2、HO-1水平升高,p-NF-κB/NF-κB降低,提示FN可诱导Nrf2/HO-1信号通路激活,抑制NF-κB磷酸化。为了进一步验证FN对APE大鼠肺损伤的保护机制,本研究在FN处理的基础上采用Nrf2抑制剂Brusatol进行干预,发现Brusatol可降低APE大鼠肺组织Nrf2、HO-1水平,升高NF-κB磷酸化水平,减弱FN对APE大鼠肺损伤的保护作用。由此可见,FN可能通过激活Nrf2/HO-1信号通路,抑制NF-κB磷酸化,保护APE大鼠肺组织损伤。
综上,FN可通过抑制氧化应激和炎症反应减轻APE大鼠肺损伤,改善大鼠肺功能,其可能是通过激活Nrf2/HO-1信号通路实现的。本研究表明FN可能是一种有前途的治疗APE的药物,可能为APE的治疗提供新的选择和研究方向。在未来的研究中,将采用体外细胞实验,深入验证FN对APE发挥保护作用的分子机制。此外,APE的机制复杂,FN是否能通过其他途经发挥保护作用仍需进一步研究。
