蔓荆子黄素通过调控糖代谢重编程抑制肝癌细胞增殖
2024-01-02董佳琪房涛偶勇危靖怡胡龙泉李媛媛晁旭
董佳琪 房涛 偶勇 危靖怡 胡龙泉 李媛媛 晁旭,6
作者单位:712046 咸阳1陕西中医药大学第二临床医学院;727031 铜川2铜川职业技术学院孙思邈医学院;
712046 咸阳3陕西中医药大学第一临床医学院;710038 西安4空军军医大学唐都医院介入疼痛科;
712046 咸阳 陕西中医药大学5第二附属医院科研科,6基础医学院
肝癌是世界范围内常见的恶性肿瘤之一,具有恶性程度高、死亡率高、预后不良、缺乏早期诊断的生物标志物等特点,其主要的病理类型是肝细胞癌,占肝癌患者的75%~85%,其次是肝内胆管癌(10%~15%)以及其他罕见类型[1]。肝癌的治疗策略主要包括手术切除、介入治疗和放疗等,然而大多数肝癌患者诊断时通常已为中晚期,因此错过手术切除的最佳时间[2]。近年来,分子靶向药物虽然大幅度提高了肝癌患者的生存率,但是依旧无法避免耐药性[3]。因此,迫切需要探索新的肝癌治疗策略。
在20 世纪20 年代,奥托·沃伯格首次观察到“Warburg效应”,其发现即使在氧气供应充足的条件下,肿瘤细胞也倾向于将葡萄糖转化为乳酸,同时指出肿瘤细胞中糖酵解增强是由于肿瘤细胞线粒体功能损伤所导致[4]。目前,通过有氧糖酵解的高水平碳通量已被确定为肿瘤疾病的新特征,而有氧糖酵解的典型特征是增强葡萄糖摄取和乳酸的产生[5]。研究表明,肝癌的有氧糖酵解功能增强会促进癌细胞生长和侵袭[6]。近年来,有研究发现,部分天然中草药及其活性成分可能通过作用于糖酵解而抑制肿瘤细胞生长,从而发挥抗肿瘤作用[7]。蔓荆子黄素(Vitexicarpin)是从单叶蔓荆果实中分离出的类黄酮[8],具有抗炎[9]、护肝[10]和抗癌[11-12]的活性。在肝癌中,已有研究报道蔓荆子黄素可通过诱导肝癌细胞凋亡抑制肝癌细胞生长[13]。然而,目前还没有报道显示蔓荆子黄素对肝癌细胞生长的抑制是否与糖代谢重编程有关。本研究旨在探讨蔓荆子黄素对肝癌细胞增殖及细胞糖代谢重编程的影响。
1 材料与方法
1.1 主要材料
人肝癌细胞SNU-368(CBP60213)和SNU-739(CBP60219)购自南京科佰生物科技有限公司,人肝永生化细胞THLE-2 购自美国ATCC 细胞库(CRL-2706TM)。蔓荆子黄素(纯度>98%)购自成都普瑞法科技开发有限公司;RPMI-1640 和DMEM 培养基购自美国Hyclone 公司;胎牛血清购自生工生物工程(上海)股份有限公司;过表达HIF-1α 慢病毒及其阴性对照慢病毒均购自上海吉凯基因医学科技股份有限公司;MTS 试剂(G3581)购自美国Promega 公司;RNA 提取试剂盒(9112)、反转录试剂盒(RR036A)、qPCR 定量试剂盒(RR820A)购自宝日医生物技术(北京)有限公司;葡萄糖检测试剂盒购自美国Molecular Probes公司;乳酸检测试剂盒购自美国BioVision公司;细胞氧耗仪(782 Oxygen Meter 氧电极)购自美国Strathkelvin 公司;pH 计(PB-11 Basic Meter)购自德国Sartorius公司;蛋白定量检测试剂盒购自美国Thermo Fisher 公司;5-氟尿嘧啶(5-FU)、嘌呤霉素(P8230)购自北京索莱宝科技有限公司;聚偏二氟乙烯膜、鼠单抗C-MYC 抗体购自美国Invitrogen 公司;鼠单抗P53 抗体购自美国Dako公司;兔单抗HIF-1α抗体购自英国Abcam 公司;兔多抗β-actin 抗体购自天德悦(北京)生物科技有限责任公司;羊抗兔二抗、超敏电化学发光法(ECL)试剂盒购自上海碧云天生物技术有限公司。PCR 引物由生工生物工程(上海)股份有限公司合成。
1.2 细胞培养及慢病毒感染
肝癌细胞SNU-368、SNU-739 应用含10%胎牛血清的1640 培养基,人肝永生化细胞THLE-2 应用含10%胎牛血清的DMEM 培养基,于37 ℃、5% CO2条件下培养。
将对数生长期的肝癌细胞SNU-368、SNU-739 分别铺种于6 孔板,每孔约为5×105个细胞。待细胞培养24 h,细胞密度达到50%~60%时,弃去上清液,用过表达HIF-1α 慢病毒液和阴性对照慢病毒液分别感染SNU-368 和SNU-739 细胞。各组细胞培养24 h 后,在培养基中加入0.5 µg/mL 的嘌呤霉素,每2 d 更换1次培养基。用0.5µg/mL嘌呤霉素筛选14 d后,通过qRT-PCR 和Western blot 实验检测慢病毒感染效果,收集慢病毒感染成功的细胞进行后续实验。
1.3 MTS实验测定细胞活力
1.3.1 不同浓度蔓荆子黄素对肝癌细胞活力的影响将对数生长期的SNU-368、SNU-739和THLE-2细胞分别接种于96 孔板中,每孔约1×104个细胞,向每孔加入100µL培养基培养12 h,每个样品设3个复孔。预先用RPMI-1640 和DMEM 培养基将DMSO 溶解的蔓荆子黄素母液分别稀释到0.5、1.0、2.0µmol/L。待细胞贴壁后,分别加入100 µL 不同浓度(0.5、1.0、2.0µmol/L)的蔓荆子黄素溶液;另以0 h不加蔓荆子黄素溶液的细胞为对照,以不含细胞的培养基为空白对照。各组分别于培养0、12、24、48、72 h 时,向每孔添加20 µL MTS-PMS 溶液,于37 ℃继续孵育2 h 后,用酶标仪测定490 nm波长处的光密度(OD)值。相对细胞活力=(加药细胞组OD 值-空白对照组OD 值)/(对照组OD值-空白对照组OD值)。
1.3.2 蔓荆子黄素对过表达HIF-1α 肝癌细胞活力的影响 将HIF-1α过表达慢病毒感染前后的SNU-368、SNU-739 细胞分别接种于96 孔板中,每孔约1×104个细胞,向每孔加入100 µL 培养基培养12 h,每个样品设3 个复孔。待细胞贴壁后,按照Control 组、Vitexicarpin组、LV-Control组、HIF-1α组和LV-HIF-1α+Vitexicarpin 组的分组每孔分别加入共100µL 的加药(1.0µmol/L 蔓荆子黄素)或不加药培养基,继续培养48 h后,按照“1.3.1”的操作步骤用酶标仪测定OD 值,并计算相对细胞活力。
1.4 克隆形成实验检测细胞克隆形成能力
1.4.1 不同浓度蔓荆子黄素对肝癌细胞克隆形成能力的影响 将SNU-368、SNU-739、THLE-2 细胞分别按每孔1×103个细胞的密度接种到6 孔平板上培养24 h,每个样品设3个复孔。待细胞贴壁后,分别加入3 mL 含相应种类及浓度药物(0.5、1.0、2.0 µmol/L 蔓荆子黄素或10 µmol/L 5-FU)的培养基,并以只加等量培养基的细胞为对照;继续培养各组细胞,3 d 换一次培养基,培养10 d 后,用4%多聚甲醛固定及结晶紫染色后,使用Image J 软件计算每孔的菌落数。
1.4.2 蔓荆子黄素对过表达HIF-1α 的肝癌细胞克隆形成能力的影响 将HIF-1α 过表达慢病毒感染前后的SNU-368、SNU-739细胞分别按每孔1×103个细胞的密度接种到6 孔平板上培养24 h,每个样品设3 个复孔。待细胞贴壁后,按照Control 组、Vitexicarpin 组、LV-Control组、HIF-1α组和LV-HIF-1α+Vitexicarpin 组的分组每孔分别加入共3 mL 的加药(1.0 µmol/L 蔓荆子黄素)或不加药培养基,然后按照“1.4.1”的操作步骤处理各组细胞后,用Image J 软件计算每孔的菌落数。
1.5 葡萄糖摄取水平、细胞外乳酸含量及pH、细胞氧耗的检测
将对数生长期的各组肝癌细胞分别接种至6 孔板,用含4 500 mg/L 葡萄糖的DMEM 培养基100 μL培养12 h,分别加入含有蔓荆子黄素(1.0 μmol/L)和不含蔓荆子黄素(control)的培养基100 μL,继续培养48 h 后,收集细胞培养液,待用。以不含细胞的培养基孔为空白对照。在细胞培养液收集后的2 min内检测细胞外pH;应用葡萄糖检测试剂盒、乳酸试剂盒及GENiosPlus 多功能酶标仪检测OD 值,计算葡萄糖摄取水平和细胞培养基中的乳酸含量。相对葡萄糖摄取量=(加药细胞组OD 值-空白对照组OD 值)/(对照组OD 值-空白对照组OD 值),相对乳酸生成量=(加药细胞组OD 值-空白对照组OD 值)/(对照组OD 值-空白对照组OD值)。葡萄糖摄取水平、细胞外乳酸含量和pH 的检测结果均先采用细胞蛋白总量(BCA 法测定)进行标准化校正后,再进行各组之间的比较。应用细胞氧耗仪检测细胞氧耗。待细胞氧耗检测实验完成后,选取一段约3~5 min 较平直稳定的线段计算细胞氧耗率(OCR)。OCR 的计算公式:OCR=选定线段的斜率/细胞数。
1.6 Western blot 检测HIF-1α、P53 和C-MYC 蛋白的表达
各组肝癌细胞经胰酶常规消化并离心后,用含蛋白酶抑制剂的RIPA 裂解液裂解,提取细胞中的总蛋白并利用BCA 蛋白定量测定细胞蛋白浓度。使用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白后,在恒定电压100 V 下转膜,室温下用5%脱脂奶粉封闭1 h,加入一抗,于4 ℃下孵育过夜;用TBST 缓冲液洗膜后,加入二抗,于37 ℃下孵育1 h,再用TBST缓冲液洗膜。采用ECL 检测试剂盒检测蛋白的表达水平。实验重复3次。
1.7 qRT-PCR 检测HIF-1α、P53、C-MYC mRNA 的表达水平
各组肝癌细胞经胰酶常规消化后,用RNA 提取试剂盒提取细胞内的总RNA,并用反转录试剂盒逆转录成cDNA 后,通过qPCR 定量试剂盒进行qRT-PCR 检测。PCR反应条件:95 ℃30 s,95 ℃10 s,55 ℃30 s,72 ℃30 s,35 个循环;72 ℃5 min。PCR 引物序列:HIF-1α 的正向引物为5'-GTCGGACAGCCTCACCAAACAGAGC-3',反向引物为5'-GTTAACTTGATCCAAAGCTCTGAG-3';P53 的正向引物为5'-GAGGATTCACAGTCGGATA-3' ,反向引物为5'-ATCATCTGGAGGAAGAAGTT-3';C-MYC 的正向引物为5'-GTTTGCTGTGGCCTCCAGCAGAAG-3',反向引物为5'-CTTCCCCTACCCTCTCAACGACAG-3';β-actin的正向引物为5'-CCCA-GB-CCATGTACGTTGCAT-3',反向引物为5'-TCACC-GGAGTCCATCACGAT-3'。每个样品均设置3 个复孔。选择β-actin 作为内参,采用2-ΔΔCt法计算HIF-1α、P53 和C-MYC mRNA的相对表达水平。
1.8 统计学方法
采用SPSS 20.0统计软件进行数据处理和统计分析。实验数据用均数±标准差表示,先进行正态性和方差齐性检验,满足正态分布和方差齐性后,多组间采用单因素方差分析,若组间差异有统计学意义,采用Bonferroni 检验等进行多重比较,两组之间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 蔓荆子黄素抑制肝癌细胞增殖
MTS 实验结果(图1A)显示,肝癌细胞SNU-368、SNU-739 和人肝永生化细胞THLE-2 经不同浓度蔓荆子黄素(0.5、1.0、2.0 µmol/L)分别处理12、24、48、72 h 后,同一浓度组SNU-368 和SNU-739 细胞的活力均随时间的增加而降低,而THLE-2细胞在2.0µmol/L蔓荆子黄素处理48 h 时才被明显抑制(P<0.05)。进一步比较48 h时蔓荆子黄素各浓度组间的细胞活力,MTS 实验结果(图1B)显示,SNU-368 和SNU-739 细胞活力随蔓荆子黄素浓度增加而降低;而THLE-2 细胞各浓度组与对照组相比,仅2.0µmol/L蔓荆子黄素组细胞活力显著降低(P<0.05)。克隆形成实验结果(图1C)显示,与相应Control组比较,0.5µmol/L蔓荆子黄素能显著抑制SNU-739 细胞的集落形成能力(P<0.05),但不能显著抑制SNU-368细胞的集落形成能力(P>0.05);10µmol/L 5-FU 和1.0µmol/L、2.0µmol/L 蔓荆子黄素均可明显抑制SNU-368和SNU-739细胞的集落形成能力(均P<0.01),且2.0 µmol/L 蔓荆子黄素还可抑制THLE-2 细胞的集落形成能力(P<0.05)。以上研究结果表明蔓荆子黄素呈时间及剂量依赖性抑制SNU-368和SNU-739细胞的增殖。
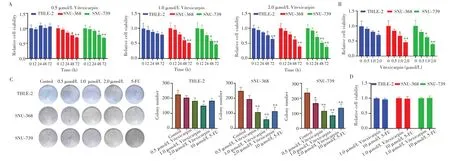
图1 蔓荆子黄素对肝癌细胞SNU-368和SNU-739增殖的影响Fig.1 Effects of Vitexicarpin on the proliferation of liver cancer cells SNU-368 and SNU-739 cells
本研究进一步选择1.0 µmol/L 蔓荆子黄素处理SNU-368、SNU-739 和THLE-2 细胞,并以10 µmol/L 5-FU 作为阳性对照,比较各组细胞的集落形成能力,MTS 实验结果(图1D)显示,1.0µmol/L 蔓荆子黄素组和10 µmol/L 5-FU 组细胞的集落形成能力差异均无统计学意义(均P>0.05)。综上,蔓荆子黄素处理肝癌细胞的最适浓度为1.0µmol/L,故选择该浓度进行后续实验。
2.2 蔓荆子黄素对肝癌细胞糖代谢的影响
1.0µmol/L 的蔓荆子黄素分别作用于SNU-739 和SNU-368 细胞48 h 后,检测各组细胞的葡萄糖摄取水平、乳酸生成水平、细胞外培养液pH值和氧耗率,结果(图2)显示,与Control组相比,蔓荆子黄素组SNU-739和SNU-368 细胞的葡萄糖摄取水平和乳酸生成水平均明显降低(均P<0.01),细胞外培养液的pH 值明显升高(均P<0.01),细胞氧耗率也明显增加(均P<0.01)。

图2 蔓荆子黄素对肝癌细胞SNU-368和SNU-739糖代谢的影响Fig.2 Effects of Vitexicarpin on glucose metabolism in liver cancer cells SNU-368 and SNU-739
2.3 蔓荆子黄素抑制转录因子HIF-1α的表达
qRT-PCR(图3A)和Western blot 检测结果(图3B)显示,与Control 组比较,蔓荆子黄素组SNU-368 和SNU-739细胞中HIF-1α的表达均降低(均P<0.05),而P53和C-MYC的表达差异无统计学意义(均P>0.05)。
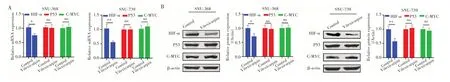
图3 蔓荆子黄素对HIF-1α、p53 和C-MYC 表达的影响Fig.3 Effects of Vitexicarpin on the expression of HIF-1α, p53 and C-MYC
2.4 蔓荆子黄素通过HIF-1α调控糖代谢重编程而减弱肝癌细胞的生长能力
qRT-PCR(图4A)和Western blot(图4B)检测结果显示,与LV-Control组相比,HIF-1α 组肝癌细胞SNU-739 和SNU-368 中HIF-1α 的表达均明显升高(均P<0.05);与Control 组相比,Vitexicarpin 组肝癌细胞中HIF-1α 的表达明显降低(均P<0.05),而LV-Control 组则无明显变化(均P>0.05);过表达HIF-1α 的肝癌细胞进一步加入蔓荆子黄素治疗后,肝癌细胞中HIF-1α 的表达较HIF-1α 组明显降低(均P<0.05),表明蔓荆子黄素可负向调控HIF-1α的表达。
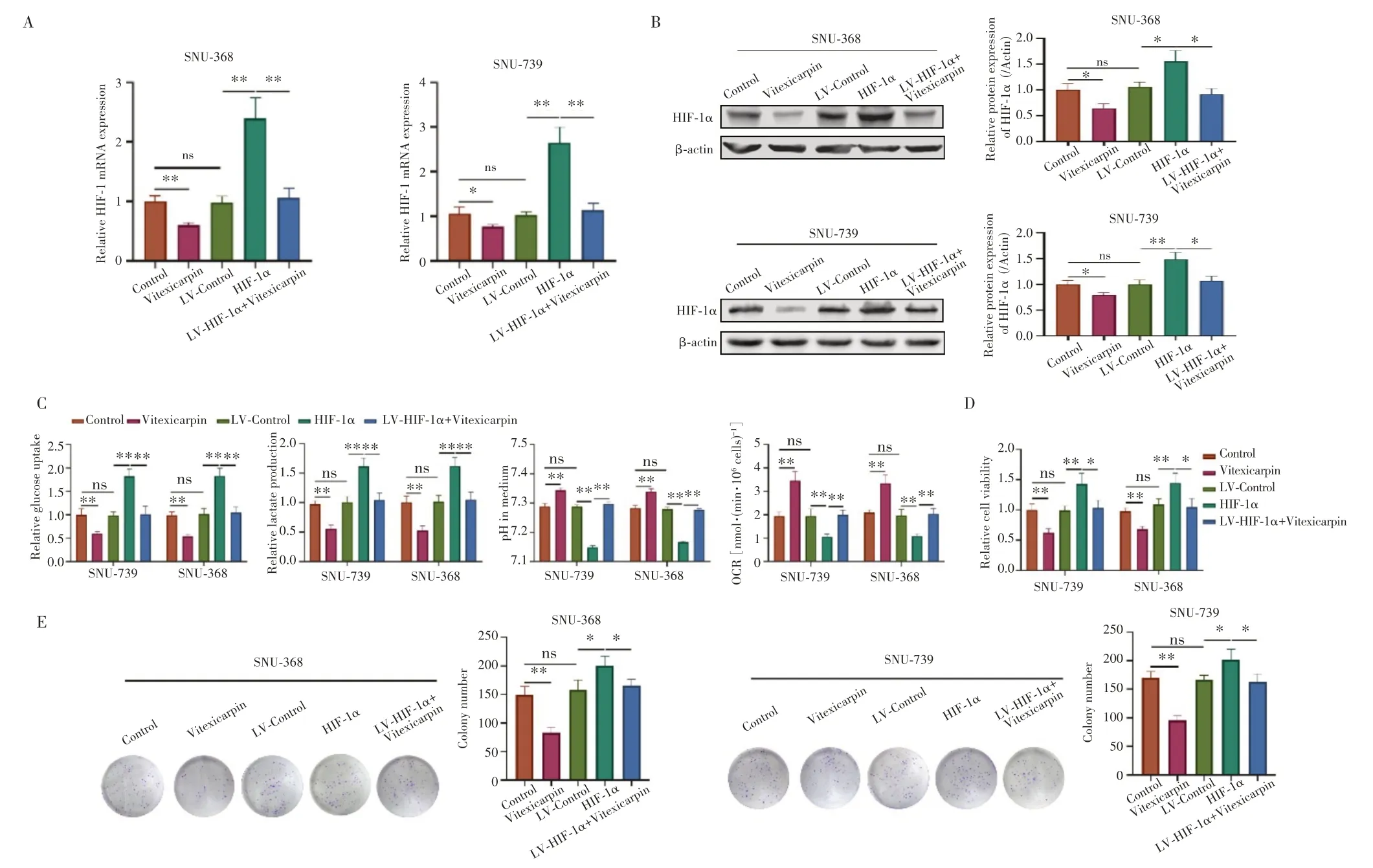
图4 蔓荆子黄素通过HIF-1α调控糖代谢重编程而减弱肝癌细胞的生长能力Fig.4 Vitexicarpin weaked the growth ability of liver cancer cells by regulating glucose metabolism reprogramming through HIF-1α
本研究进一步比较各组细胞的葡萄糖摄取水平、乳酸生成水平、细胞外培养液pH 值及氧耗率,结果(图4C)显示,LV-Control 组与Control 组差异均无统计学意义(均P>0.05);与Control 组相比,Vitexicarpin 组的葡萄糖摄取水平和乳酸生成水平减少(均P<0.01),细胞外培养液的pH 值升高(均P<0.01),细胞氧耗率增加(均P<0.01);与LV-Control 组相比,HIF-1α 组的葡萄糖摄取水平和乳酸生成水平增加(均P<0.01),细胞外培养液的pH值降低(均P<0.01),细胞氧耗率降低(均P<0.01);与HIF-1α组相比,LV-HIF-1α+Vitexicarpin组葡萄糖摄取水平和乳酸生成水平减少(均P<0.01),细胞外培养液的pH 值升高(均P<0.01),细胞氧耗率增加(均P<0.01)。
MTS实验结果(图4D)和克隆形成实验结果(图4E)显示,LV-Control 组肝癌细胞的活力和集落形成能力与Control 组比较差异均无统计学意义(均P>0.05);与Control组相比,Vitexicarpin组肝癌细胞的活力和集落形成能力明显降低(均P<0.01);与LV-Control 比较,HIF-1α 组肝癌细胞的活力和集落形成能力均明显增强(均P<0.05);与HIF-1α 组相比,LV-HIF-1α+Vitexicarpin 组肝癌细胞的活力和集落形成能力均明显降低(均P<0.05)。以上研究结果表明,蔓荆子黄素可通过HIF-1α 调控糖代谢重编程而减弱肝癌细胞的生长能力。
3 讨论
大量研究表明,来自天然产物的化合物可在体内外降低多种人类癌细胞的活力[14-15]。蔓荆子黄素作为蔓荆子的主要化学成分,已有大量研究表明其可抑制肝癌[16]、黑色素瘤[17]、口腔鳞状细胞癌[18]等肿瘤细胞增殖,并呈一定的时间及剂量依赖性;还可诱导子宫颈癌[19]、肝癌[13]及胃癌[20]等肿瘤细胞的细胞周期阻滞和凋亡进而降低癌细胞的生存能力。本研究采用不同浓度蔓荆子黄素处理肝癌细胞SNU-368 和SNU-739,结果也发现蔓荆子黄素可呈时间及剂量依赖性抑制肝癌细胞的增殖,并且在适宜浓度(1.0 μmol/L)及合适时间(48 h)下不会对正常肝细胞的增殖造成影响。
代谢重编程是肿瘤的十大特征之一,在促进肿瘤的发生发展中起着关键作用,其中糖代谢异常是多种类型癌症最具代表性的代谢特征[5]。研究[21]表明,肝癌的糖代谢变化主要包括以下方面:⑴有氧糖酵解增强,从而导致葡萄糖生成乳酸和核苷酸;⑵增强氨基酸和脂类的合成代谢,破坏三羧酸(TCA)循环和增加使用谷氨酰胺作为碳源;⑶肿瘤诱导的磷酸戊糖途径上调,增加减少辅酶Ⅱ循环,保护细胞免受氧化应激损伤;⑷增加葡萄糖摄取和消耗。与正常细胞不同,肿瘤细胞在有氧糖酵解增强的同时,线粒体氧化磷酸化功能显著降低。考虑到线粒体氧化磷酸化功能抑制与糖酵解速率异常升高同为“Warburg效应”的重要组成部分,因此本研究同时探讨了蔓荆子黄素对肝癌细胞中有氧糖酵解(葡萄糖摄取水平、乳酸生成水平、细胞外培养液pH 值)和氧化磷酸化(细胞氧耗率[22])的影响,结果发现蔓荆子黄素处理肝癌细胞SNU-368 和SNU-739 后,细胞葡萄糖摄取水平和乳酸生成水平显著降低,同时细胞外培养液pH 值和细胞氧耗率也显著提高,提示蔓荆子黄素可抑制肝癌细胞糖代谢重编程、促进有氧磷酸化。
有研究表明,代谢重编程可由癌基因和肿瘤抑制因子对关键代谢酶效应物的调节而实现[23],其中有氧糖酵解中的关键限速酶,如HK、PFK 和PKs等已被报道在肝癌的进展过程中增加[24]。糖酵解的第一步是葡萄糖转运蛋白介导葡萄糖在质膜上的转运,而葡萄糖转运蛋白1(GLUT1)可被癌基因C-MYC、KRas和HIF-1α激活而被肿瘤抑制因子P53 抑制。还有研究表明,转录因子HIF-1α、C-MYC 和P53 在有氧糖酵解和氧化磷酸化的调控中发挥着关键作用[3,25]。其中,HIF-1α 作为关键转录因子之一,可通过激活大量参与糖酵解的基因转录,从而在肿瘤有氧糖酵解中发挥重要作用[26-28]。近年来,还有研究发现,肿瘤细胞的代谢重编程受缺氧和肿瘤微环境等多种不同因素的调控,在缺氧或炎症微环境下,HIF-1α诱导肿瘤细胞显著增加其葡萄糖摄取和乳酸产生水平[3,29]。此外,HIF-1α还可通过转录激活丙酮酸脱氢酶激酶1(PHK1)的表达而抑制丙酮酸脱氢酶(PDH)的活性,进而抑制肿瘤细胞的氧化磷酸化[30]。目前已有大量研究证明HIF-1α 的激活是包括肝细胞癌在内的多种癌症的共同特征[27-28,31]。本研究检测蔓荆子黄素对肝癌细胞中转录因子HIF-1α、C-MYC 和P53表达的影响,结果发现蔓荆子黄素对C-MYC和P53表达无明显影响,但可显著抑制HIF-1α 的表达,提示蔓荆子黄素可能通过HIF-1α 调控肝癌细胞糖代谢重编程。进一步构建HIF-1α 过表达的肝癌细胞SNU-368和SNU-739 的稳定细胞株,结果发现HIF-1α 过表达后肝癌细胞中HIF-1α 表达上调,葡萄糖摄取水平和细胞外乳酸含量增加,细胞外培养液的pH 值和氧耗率增加,细胞增殖能力也增强,而进一步用蔓荆子黄素处理后,上述增强作用均被逆转,说明蔓荆子黄素可能通过HIF-1α 调控肝癌细胞糖代谢重编程而减弱肝癌细胞的生长能力。
综上所述,本研究结果表明蔓荆子黄素可抑制肝癌细胞的生长,而这种作用可能是通过调控HIF-1α而抑制细胞糖酵解实现的。该研究结果为蔓荆子黄素在肝癌防治中的应用提供了科学依据。然而,蔓荆子黄素在体内对肝癌的活性以及蔓荆子黄素调控HIF-1α 及糖代谢重编程的具体分子机制仍有待进一步研究。
