不同色泽核桃内种皮多酚和核桃仁分离蛋白理化性质的差异
2024-01-02马家辉任丽秋李晓芹朱建津成向荣
张 燕,马家辉,王 伟,任丽秋,李晓芹,朱建津,成向荣,*
(1.江南大学 食品学院,江苏 无锡 214122; 2.苏州市食品检验检测中心,江苏 苏州 215104)
核桃(JuglansregiaL.)是一种可食用的核果类坚果,因其营养丰富和有益健康的特性而享誉全球。我国的核桃种植历史悠久,种植面积和产量均居世界第一[1]。核桃仁是核桃的主要可食用部位,含有较高的生物活性分子和植物化学物质,如必需脂肪酸、蛋白质、纤维、植物甾醇、维生素E和酚类物质等[2]。核桃仁表面包裹着一层薄膜,即核桃内种皮,其所含的酚类物质含量远高于内部核桃仁[3]。
核桃内种皮颜色是决定消费者偏好的关键参数。《核桃仁》(LY/T 1922-2010)[4]规定,核桃仁按照内种皮色泽可分为淡黄、浅琥珀和琥珀等不同等级。核桃常作为干果进行销售,内种皮色泽直接影响到核桃的交易价格[5]。内种皮颜色变深还会导致核桃仁风味变差;且以颜色较深的核桃仁为原料生产的核桃油和核桃奶等产品颜色往往发褐,口感苦涩[6]。此外,核桃内种皮颜色与核桃仁中油脂组成、内种皮酚类化合物含量息息相关。Pakrah等[7]研究表明,核桃内种皮颜色与多不饱和脂肪酸含量呈正相关,而与油脂过氧化值呈负相关,即颜色浅的核桃仁具有更高的营养价值和更低的酸败度。据报道,浅色核桃内种皮中的酚类化合物含量和抗氧化能力均高于深色核桃内种皮[8]。总之,目前仅有依据核桃仁外观的分级,并没有深入研究不同分级组分中核桃蛋白的差异。
内种皮中的酚类物质能和蛋白质相互作用,影响核桃蛋白的提取率、稳定性和色泽等品质。研究表明,核桃内种皮中的酚类物质会导致蛋白质沉淀;虽然酚类物质和蛋白质之间相互作用可以提高抗氧化性,但高浓度的酚类物质与苦味和深棕色有关,会极大地影响食物中蛋白质的品质[9]。黄子林等[10]的研究结果表明,核桃衣多酚能够改善植物蛋白溶解性。张雪春等[11]发现,在多酚作用下,核桃蛋白溶解性与持水性降低,吸油性增加,且不同多酚对核桃蛋白加工性质影响程度不同。因此,推测不同色泽核桃仁中酚类物质组成不同,进而导致提取的蛋白质在氧化水平和理化性质上存在差异。
本研究根据核桃内种皮色泽对核桃仁进行分级,并通过去皮处理得到相应色泽的内种皮和去皮核桃仁。分析色泽对内种皮中酚类化合物含量、抗氧化活性和物质组成的影响;并通过碱溶酸沉法提取相应色泽核桃仁中的核桃分离蛋白,评价不同色泽核桃仁中核桃蛋白氧化水平与理化性质的差异,为合理开发和利用核桃内种皮和核桃蛋白提供科学依据。
1 材料与方法
1.1 仪器
5430R台式高速冷冻离心机,德国艾本德公司;Synergy H4多功能酶标仪,美国伯腾仪器有限公司;UV-1800紫外可见分光光度计,日本岛津公司;超高效液相色谱仪和高分辨质谱仪,美国安捷伦科技有限公司;TS-8转移脱色摇床,碧云天生物技术有限公司;KJ-300超声波发生器,无锡市科洁超声电子设备有限公司;ME204E/02电子天平,梅特勒-托利多仪器(上海)有限公司产品。
1.2 材料与试剂
本实验所用核桃品种为温185,购于新疆维吾尔自治区温宿县。Bradford蛋白质浓度测定试剂盒购自上海碧云天生物技术有限公司。5,5-二硫代-双-(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid), DTNB]、2,4-二硝基苯肼(dinitrophenylhydrazine, DNPH)、十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、乙酸乙酯、三氯乙酸、三羟甲基氨基甲烷(Tris)为分析纯,购自上海阿拉丁生化科技股份有限公司。其他试剂,如盐酸胍、丙酮、甲醇、正己烷、福林酚、氢氧化钠、氯化钠、过硫酸钾、没食子酸、水溶性维生素E(Trolox)等均为分析纯,购自国药集团化学试剂有限公司。
1.3 核桃仁分级
去除核桃外壳,参考《核桃仁》(LY/T 1922-2010)[4]的分级标准,按照内种皮色泽,将核桃仁分为淡黄、浅琥珀和琥珀3个等级。使用液氮急冻分离核桃内种皮与核桃仁[12],-20 ℃储存备用。
1.4 脱脂核桃粉与脱脂内种皮粉的制备
称取去皮核桃仁500.00 g,45 ℃烘干12 h后粉碎为核桃浆。使用正己烷进行脱脂,设定料液比为1∶5(质量体积比,g·mL-1),搅拌2 h后抽滤,重复提取3次。最后将抽滤后的脱脂粉置于通风橱中,待溶剂挥干即得脱脂核桃粉,保存于-20 ℃冰箱备用。
称取10.00 g内种皮用粉碎机粉碎,冷冻干燥24 h,去除内种皮水分。其余步骤同上。将得到的脱脂内种皮粉保存于-20 ℃冰箱备用。
1.5 核桃内种皮多酚的提取
称取1.00 g脱脂内种皮粉,按料液比1∶20(质量体积比,g·mL-1)加入体积分数80%的丙酮溶液,冰浴条件下超声处理20 min,4 ℃、3 186×g离心15 min,分离上清液,重复操作2次。收集上清液在30 ℃下减压旋转蒸发至干,10 mL甲醇复溶后经0.22 μm微孔膜过滤,保存于-20 ℃冰箱中备用。
1.6 核桃内种皮多酚提取物游离酚含量的测定
采用Folin-Ciocalteu法测定样品中的总酚含量[13]。取0.5 mL稀释后的样品,加入2.5 mL福林酚溶液(10倍去离子水稀释),旋涡混匀后避光反应5 min,再加入2 mL质量分数7.5%的Na2CO3溶液,混匀后避光静置反应60 min,然后765 nm波长下测吸光度。以0.5 mL甲醇为空白对照,以没食子酸制定标准曲线(y=7.529 32x-0.002 35,R2=0.966 9)。总酚含量以单位质量内种皮干重所含的没食子酸当量(gallic acid equivalents, GAE)表示,单位为mg·g-1。
1.7 核桃内种皮多酚提取物抗氧化活性测定
DPPH自由基清除活性的测定参考Brand-Williams等[14]的方法。0.1 mL稀释后的样品加入2.9 mL DPPH溶液(0.06 mmol·L-1,甲醇溶解),混匀后避光反应60 min,在517 nm波长下检测吸光度。以甲醇作为对照,以Trolox为标样制定标准曲线(y=3.082 65x+0.017 76,R2=0.995 0),抗氧化能力以Trolox等价抗氧化能力(Trolox equivalent antioxidant capacity, TEAC)表示,即以单位质量内种皮干重所含Trolox当量(Trolox equivalents,TE)表示,单位为mmol·g-1。
ABTS自由基阳离子清除活性的测定参考Re等[15]的方法。7 mmol·L-1ABTS和2.45 mmol·L-1K2S2O8水溶液避光放置16 h后,以去离子水为对照,用去离子水稀释至734 nm吸光度为0.70±0.02。取70 μL稀释后的样品,加入2.93 mL ABTS溶液,混匀后避光反应6 min,在734 nm测定吸光度。以去离子水作为对照,以Trolox为标样制定标准曲线(y=1.299 82x-0.024 63,R2=0.985 6),抗氧化能力以TEAC表示,单位为mmol·g-1。
1.8 核桃内种皮多酚提取物的UPLC-MS/MS分析
取1.5 mL核桃内种皮多酚提取物加入2 mL离心管,真空浓缩后用甲醇配制成1 mg·mL-1的溶液,过0.22 μm微孔膜后进样分析。
色谱条件:Agilent Zorbax Eclipse Plus C18色谱柱(2.1 mm×150 mm,1.8 μm)。柱温为35 ℃。流动相(A)为体积分数0.1%甲酸水溶液,流动相(B)为乙腈,流速设定为0.3 mL·min-1,优化后的梯度洗脱程序如下:0~25 min,5% B~100% B;25~30 min,100% B;30~30.01 min,100% B~5% B;30.01~35 min,5% B。
质谱条件:采用电喷雾离子源正离子模式进行离子化。干燥气流量800 L·h-1;干燥气温度400 ℃;离子源温度120 ℃;碰撞能量:10~40 V,40~120 V;锥孔气流量50 L·h-1。
1.9 多维变量统计分析
通过ProteoWizard将原始数据转换为mzXML格式,利用MZmine 2.39软件构建色谱图、进行解卷积、同位素峰聚集、色谱峰匹配,最终导出csv格式文件。通过MetaboAnalyst(https://www.metaboanalyst.ca)进行主成分分析(principal component analysis, PCA)、偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)和聚类热图分析[16]。
1.10 核桃仁分离蛋白的制备
根据王丰俊等[17]的方法,采用碱溶酸沉法提取核桃仁分离蛋白,并进行相应调整。具体方法为准确称量140.00 g脱脂核桃粉,将脱脂核桃粉与去离子水以1∶10(质量体积比,g·mL-1)的比例混合,调节pH值为9.0,在37 ℃搅拌3 h后,离心(4 ℃,2 039×g,20 min)获得上清液。将上清液pH值调节至5.5,室温放置2 h后离心(4 ℃,3 186×g,10 min),获取沉淀。用去离子水洗涤沉淀物呈中性,沉淀物冷冻干燥即得核桃仁分离蛋白,将淡黄色内种皮核桃仁制备的核桃仁分离蛋白标记为Z1,相应地,浅琥珀色标记为Z2,琥珀色标记为Z3,储存于-20 ℃备用。
1.11 蛋白质含量测定
采用Bradford蛋白质浓度测定试剂盒测定样品的蛋白质浓度[18]。取0.25 g样品,加入25 mL去离子水,调pH值至8.5,室温搅拌30 min后离心(4 ℃,12 745×g,10 min)。取5 μL上清液于96孔板中,加入250 μL考马斯亮蓝染色液后,立即于595 nm测定吸光度。以标准牛血清蛋白为标样制定标准曲线(y=0.607 47x+0.048 2,R2=0.992 0)。蛋白质含量以单位质量样品中所含的蛋白质质量表示,单位为mg·g-1。
1.12 核桃仁分离蛋白游离巯基含量测定
参考邓欣伦等[19]的方法并进行适当修改。以含86 mmol·L-1Tris、90 mmol·L-1甘氨酸、4 mmol·L-1EDTA,pH值为8.0的缓冲液为溶剂,分别配制4 mg·mL-1的DTNB溶液、2 mg·mL-1的核桃仁分离蛋白溶液。往2.5 mL核桃仁分离蛋白溶液中加入50 μL DTNB溶液,25 ℃恒温振荡1 h后离心(4 ℃,12 745×g)。取上清液,于412 nm测定吸光度。核桃仁分离蛋白中游离巯基含量计算方法见式(1)。
c0=75.53×D412×D/C。
(1)
式(1)中:c0为巯基含量(μmol·g-1);D412为样品吸光度;C为离心后上清液蛋白质质量浓度(mg·mL-1);D为稀释因子(1.02)。
1.13 核桃仁分离蛋白的羰基含量测定
参考裴昊铭[20]的方法并进行适当修改。配制6 mg·mL-1的核桃仁分离蛋白水溶液,调pH值至9.0,室温振荡1 h至完全溶解。用2 mol·L-1HCl溶液为溶剂配制10 mmol·L-1的DNPH溶液。取0.35 mL核桃仁分离蛋白溶液,加入1 mL DNPH盐酸溶液,30 ℃保温1 h后,加入450 μL体积分数40%的三氯乙酸,充分振荡,静置20 min后于4 ℃离心(5 533×g,30 min),去除上清液,保留沉淀。取1.5 mL乙醇-乙酸乙酯溶液(体积比1∶1)洗涤沉淀,重复3次。洗涤完毕后,加入1.5 mL 6 mol·L-1的盐酸胍溶液,37 ℃保温0.5 h,使沉淀物溶解。最终在370 nm测量吸光度。可溶性核桃仁分离蛋白的羰基含量计算方法见式(2)。
(2)
式(2)中:c1为羰基含量(μmol·g-1);D370为样品吸光度;ε为摩尔消光系数,22 mL·μmol-1·cm-1;B为比色光径,1 cm;C为上清液中蛋白质质量浓度(mg·mL-1)。
1.14 核桃仁分离蛋白的溶解性测定
称取0.25 g核桃仁分离蛋白,加入25 mL去离子水,调节溶液pH值至8.5,将摇床调至适当振幅,振荡1 h。将该溶液放置于4 ℃静置16 h,使之充分水合。在4 ℃条件下10 324×g离心30 min。采用Bradford蛋白质浓度测定试剂盒测定上清液中蛋白质的质量浓度。
1.15 核桃仁分离蛋白的持水性与持油性测定
在50 mL离心管中准确称0.75 g核桃仁分离蛋白,并记录此时的离心管质量m1与样品质量m2。将20 mL去离子水添加到离心管中,充分混合样品。将离心管放在40 ℃恒温水中30 min,充分吸收水分后,于4 ℃离心(3 186×g,20 min)。使用滴管吸弃上清液,记录此时离心管质量m3,按式(3)计算蛋白质持水性。
准确称取0.75 g核桃仁分离蛋白,与6 mL大豆油混匀,记录样品质量m4与加入样品后的离心管质量m5。40 ℃恒温水浴锅静置30 min,4 ℃离心(3 186×g,20 min),使用滴管吸弃上清液,称重记录此时离心管质量m6,按式(4)计算蛋白质持油性。
(3)
(4)
式(3)、(4)中:Chw为持水性(g·g-1);Cho为持油性(g·g-1)。
1.16 核桃仁分离蛋白的起泡能力、泡沫稳定性测定
取20 mL 0.01 g·mL-1核桃仁分离蛋白溶液于50 mL离心管中,初始高度为H0。把超速分散器调节到适当的档位,对蛋白质进行1 min的切割,测量泡沫高度H1。放置30 min,记录泡沫高度H2。蛋白质溶液起泡能力和泡沫稳定性计算方法分别见式(5)和(6)。
(5)
(6)
式(5)和(6)中:Cf为起泡能力;Sf为泡沫稳定性。
1.17 核桃仁分离蛋白的乳化性、乳化稳定性测定
参考孙敬敬[21]的方法并进行适当修改。取10 mL 0.01 g·mL-1核桃仁分离蛋白溶液,加入5 mL大豆油,混合均匀,使用高速搅打机搅打1 min。将50 μL搅打后的溶液分散于5 mL质量分数0.1%的SDS溶液,充分混匀。于500 nm测定吸光度D0,30 min后再次测定吸光度D1。乳化活性(EAI)和乳化稳定性(ESI)的计算公式分别为式(7)和式(8)。
(7)
(8)
式(7)与式(8)中:EAI为乳化活性(m2·g-1);ESI为乳化稳定性(%);D0为0 min时吸光度;D1为30 min时的吸光度;N为稀释倍数(100);c为核桃仁分离蛋白溶液的质量浓度,g·mL-1;L为0.01 m光路;φ为分散系数(0.25)。
1.18 数据处理
所有实验均设置3组平行实验,实验所得结果用平均值±标准差表示,数据通过GraphPad Prism 8.0软件进行分析和绘图,同时使用SPSS 23.0软件对实验数据进行单因素方差分析(one-way ANOVA),采用Duncan检验进行显著性分析,显著性水平为α=0.05。
2 结果与分析
2.1 不同色泽核桃仁的筛选
依据《核桃仁》(LY/T 1922-2010)规定,将核桃仁按照内种皮色泽分为淡黄色、浅琥珀色和琥珀色3组。然后去除干瘪霉变的核桃仁,选择完整的核桃仁进行液氮急冻分离得到内种皮和去皮核桃仁。将内种皮冷冻干燥后进行脱脂处理得到脱脂内种皮粉,将去皮核桃仁磨浆、脱脂,采用碱溶酸沉法提取核桃仁分离蛋白。成品如图1所示。
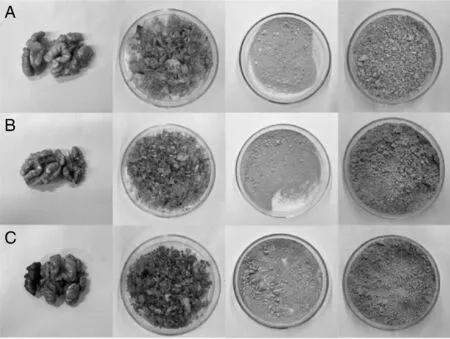
A,淡黄色内种皮组;B,浅琥珀色内种皮组;C,琥珀色内种皮组。纵行从左到右依次为核桃仁、核桃内种皮、脱脂内种皮粉、核桃仁分离蛋白。A, The light walnut pellicle group; B, The light amber walnut pellicle group; C, The amber walnut pellicle group. The longitudinal row from left to right are walnut kernel, walnut pellicle, defatted walnut pellicle powder, walnut kernel protein isolate.图1 样品的外观形态Fig.1 Appearance of samples
2.2 核桃内种皮酚类化合物含量与抗氧化能力
2.2.1 不同色泽内种皮的多酚含量
采用溶剂浸提法提取内种皮中总酚类化合物,结果如图2所示,淡黄色内种皮多酚含量为(308.49±13.43)mg·g-1,浅琥珀色内种皮多酚含量为(296.86±4.95)mg·g-1,仅次于淡黄色内种皮,琥珀色内种皮多酚含量最低,为(271.19±16.32)mg·g-1。淡黄色内种皮、浅琥珀色内种皮多酚含量显著(P<0.05)高于琥珀色内种皮。这可能是因为随着内种皮颜色的加深,酚类物质的氧化程度增加,从而导致内种皮多酚含量降低,这与梁蓉等[22]的研究结果相符。此外,孙鹏程等[5]的研究也表明,内种皮颜色越深,其种皮中多酚含量越少。
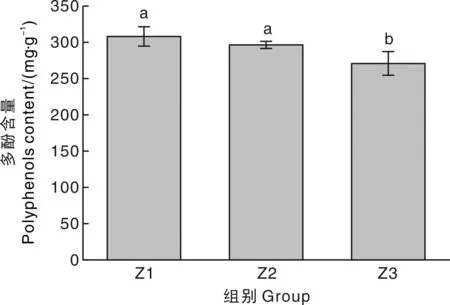
Z1、Z2、Z3分别为淡黄色内种皮组、浅琥珀色内种皮组、琥珀色内种皮组。柱状图上方无相同小写字母代表差异显著(P<0.05)。下同。Z1, Z2, and Z3 are the light walnut pellicle group, the light amber walnut pellicle group, the amber walnut pellicle group, respectively. Different lowercase letters above the columns represent significantly different (P<0.05). The same as below.图2 不同色泽核桃内种皮的多酚含量Fig.2 Polyphenols content in walnut pellicle with different colors
2.2.2 不同色泽内种皮多酚抗氧化能力
淡黄色内种皮的DPPH自由基清除活性的TEAC值为(5.53±0.38)mmol·g-1,显著(P<0.05)高于浅琥珀色与琥珀色内种皮(图3)。ABTS自由基清除能力测定的结果趋势与DPPH自由基清除活性相同,也是淡黄色内种皮>浅琥珀色内种皮>琥珀色内种皮,且组间差异显著(P<0.05)(图3)。可见,随着核桃内种皮颜色加深,核桃内种皮多酚提取物的抗氧化活性显著(P<0.05)下降,其原因可能是内种皮多酚被氧化,导致多酚含量下降,从而影响其抗氧化活性。
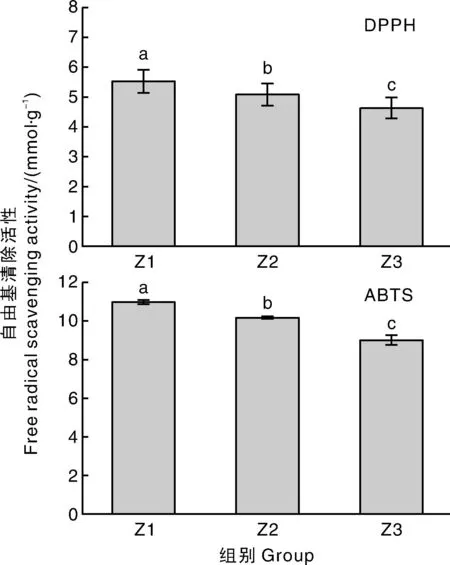
图3 不同色泽核桃内种皮的DPPH自由基清除活性和ABTS自由基清除活性Fig.3 DPPH free radical scavenging activity and ABTS free radical scavenging activity of walnut pellicle with different colors
2.2.3 内种皮多酚组成
核桃内种皮多酚总离子流图(total ion chromatogram,TIC)如图4所示。淡黄色、浅琥珀色、琥珀色核桃内种皮多酚的峰形基本一致,但部分质谱信号所对应离子峰的相对丰度存在差异,表明3组内种皮多酚的物质组成有差异。

图4 不同色泽核桃内种皮多酚的总离子流图Fig.4 Total ion chromatogram spectra of polyphenols from walnut pellicles with different colors
通过主成分分析(PCA)与偏最小二乘判别分析(PLS-DA)进一步分析淡黄色、浅琥珀色、琥珀色3组核桃内种皮多酚提取物中化合物的差异。由图5-B与图5-C可知,淡黄色内种皮多酚的3个平行样品与浅琥珀色内种皮多酚的3个平行样品聚集在一起,而与琥珀色内种皮多酚的3个平行样品明显分开。这说明淡黄色与浅琥珀色内种皮多酚物质组成与琥珀色内种皮多酚物质组成存在差异。聚类热图是一种可视化的分析质谱数据分布的方法[16],能够用颜色深浅表示各成分的丰度。制作聚类热图,分析核桃内种皮多酚的组间差异,如图5-A所示。9个样品被分为3大类,且各成分在3组不同色泽内种皮提取物中丰度存在差异,这表明淡黄色、浅琥珀色、琥珀色3组内种皮多酚在物质组成上存在差别。这与TIC、PCA和PLS-DA的结果相吻合。

A,聚类热图分析;B,PCA分析;C,PLS-DA分析;D,Z1组和Z2组火山图;E,Z2组和Z3组火山图;F,3种物质的峰面积。A, Cluster heat map; B, PCA analysis; C, PLS-DA analysis; D, Volcano plot of group Z1 and group Z2; E, Volcano plot of group Z2 and group Z3; F, Peak area of 3 substances.图5 不同色泽内种皮多酚分析Fig.5 Analysis of polyphenols from walnut pellicles with different colors
火山图可以用于展示组间显著差异数据,本研究通过将淡黄色与浅琥珀色、浅琥珀色与琥珀色进行两两比对,以P<0.05为条件筛选出3种显著差异的化合物(图5-D和图5-E)。如图5-F所示,这3种化合物的质荷比(m:z)分别为792.597 5、147.075 6、127.039 0,推测这3种物质分子式分别为C42H79N7O8、C5H10N2O3、C6H6O3。
2.3 不同色泽核桃仁分离蛋白氧化水平与理化性质的差异
2.3.1 蛋白质含量与氧化水平
为探究不同色泽核桃仁所提取的核桃仁分离蛋白纯度的差异,分别测定脱脂核桃粉与核桃仁分离蛋白的蛋白质含量,结果如图6所示。不同色泽核桃仁提取出的脱脂核桃粉的蛋白质含量并无显著差异(P>0.05),但核桃仁分离蛋白的蛋白质含量有显著差异(P<0.05)。淡黄色组核桃仁分离蛋白的蛋白质含量为(974.20±66.35) mg·g-1,显著(P<0.05)高于琥珀色组(图6-B)。可见,虽然不同色泽内种皮核桃仁的脱脂蛋白粉蛋白质含量差异不大,但相应提取的核桃仁分离蛋白的纯度有显著性差异。这可能是由于随着核桃内种皮色泽加深,核桃蛋白氧化程度加深,溶解性下降,从而导致所提取的核桃仁分离蛋白含量下降。

图6 脱脂核桃粉(A)和核桃仁分离蛋白(B)的蛋白质含量Fig.6 Protein content of defatted walnut powder (A) and protein isolates of walnut kernel (B)
半胱氨酸残基对氧化敏感,易发生相应的修饰,因此,蛋白质氧化的程度可以通过巯基含量来反映[23]。由图7-A可知,琥珀色组核桃仁分离蛋白游离巯基含量为(11.28±1.51)μmol·g-1,显著(P<0.05)低于淡黄色和浅琥珀色组。这可能是因为随着内种皮色泽增加,相应蛋白质氧化程度升高,导致其结构展开,巯基被氧化成二硫键和不可逆的磺酸基,从而导致游离巯基含量降低[24]。在蛋白质氧化损伤的研究中,羰基含量也经常被用作蛋白质氧化损伤的关键指标[25]。由图7-B可知,淡黄色和浅琥珀色组核桃仁分离蛋白的羰基含量没有显著差异(P>0.05),而琥珀色组核桃仁分离蛋白羰基含量为(4.61±0.13)μmol·g-1,显著(P<0.05)高于淡黄色和浅琥珀色组,这与游离巯基的结果相符合。巯基和羰基含量的变化表明不同色泽内种皮核桃仁提取的核桃仁分离蛋白的氧化程度存在差异,内种皮色泽浅的核桃仁分离蛋白的氧化程度较低。

图7 核桃仁分离蛋白的游离巯基含量和羰基含量Fig.7 Content of free sulfhydryl groups and carbonyl groups in protein isolates of walnut kernel
2.3.2 核桃仁分离蛋白的溶解性
核桃仁分离蛋白的溶解性是蛋白质亲水能力的重要指标,是蛋白质持水性、乳化性和起泡能力等重要功能特性的基础[26]。3组核桃仁分离蛋白溶液的蛋白质质量浓度分别如图8所示,蛋白质质量浓度越高,说明核桃仁分离蛋白的溶解性越好。琥珀色组核桃仁分离蛋白溶液的蛋白质质量浓度为(7.23±1.15)mg·mL-1,显著低于淡黄色组[(10.31±0.60)mg·mL-1]与浅琥珀色组[(9.78±0.53)mg·mL-1](P<0.05)。虽然核桃经过了去皮处理,但核桃仁中仍有部分酚类物质。这些酚类物质有的来自核桃仁本身,有的则是因为核桃仁的特殊构造,难以完全将内种皮剥脱干净,而有极少量残留引入[9]。推测在碱溶酸沉提取核桃仁分离蛋白的过程中,琥珀色组核桃仁中的酚类物质在有氧碱性条件下氧化成醌类物质,与核桃仁分离蛋白发生共价相互作用,从而形成了颗粒较大、不溶解的复合物,而导致核桃仁分离蛋白的溶解性较差[10]。此外,不同内种皮色泽核桃仁提取的核桃仁分离蛋白的氧化程度不同,其蛋白质的构象也不相同,这也会对溶解性造成影响。
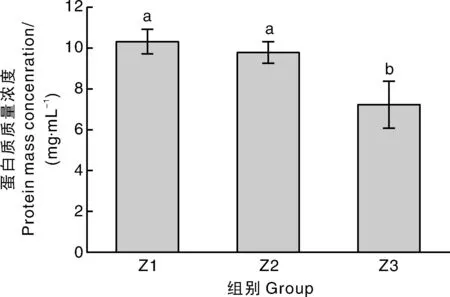
图8 核桃仁分离蛋白的溶解性Fig.8 Solubility of protein isolates of walnut kernel
2.3.3 核桃仁分离蛋白的持水性与持油性
持水性、持油性是评价核桃仁分离蛋白功能特性的重要指标。如图9-A所示,淡黄色和浅琥珀色组核桃仁分离蛋白的持水力分别为(3.07±0.19)、(2.98±0.11)g·g-1,均显著(P<0.05)高于琥珀色组。核桃仁分离蛋白与核桃仁中多酚相互作用形成不溶性聚集体,减弱蛋白质与水的相互作用,导致持水性降低,这也与溶解度的结果相符合[27]。如图9-B所示,淡黄色组核桃仁分离蛋白的持油力为(5.67±4.65)g·g-1,显著(P<0.05)高于浅琥珀色组和琥珀色组。这可能是因为不同色泽核桃仁提取的核桃仁分离蛋白溶解性存在差异,进而导致其持油性降低。这与岳鑫[28]的研究结果相似。当红松种鳞多酚的添加量增加时,蛋白质的溶解性降低,从而导致其与脂质结合的能力也下降,进而导致乳清蛋白持油性降低。

图9 核桃仁分离蛋白的持水性(A)和持油性(B)Fig.9 Water holding capacity (A) and oil holding capacity (B) of protein isolates of walnut kernel
2.3.4 核桃仁分离蛋白的起泡能力与泡沫稳定性
核桃仁分离蛋白起泡能力与泡沫稳定性如图10所示。由图10-A可知,淡黄色组核桃仁分离蛋白的起泡能力显著(P<0.05)高于浅琥珀色组和琥珀色组。这可能是因为核桃仁分离蛋白与核桃仁中多酚相互作用形成不溶性聚集体,导致溶液的液相界面张力变大,从而使核桃仁分离蛋白起泡能力下降。此外,因为淡黄色内种皮中多酚氧化程度低,核桃仁分离蛋白中酚类物质含量相对较高,这些酚类物质在一定程度上可能提高核桃仁分离蛋白的起泡能力[27]。由图10-B可知,3组不同蛋白的泡沫稳定性并无显著性差异(P>0.05)。这可能是因为尽管3种核桃仁分离蛋白溶液经过搅打,但其形成的泡沫表面强度和刚性较为相似。
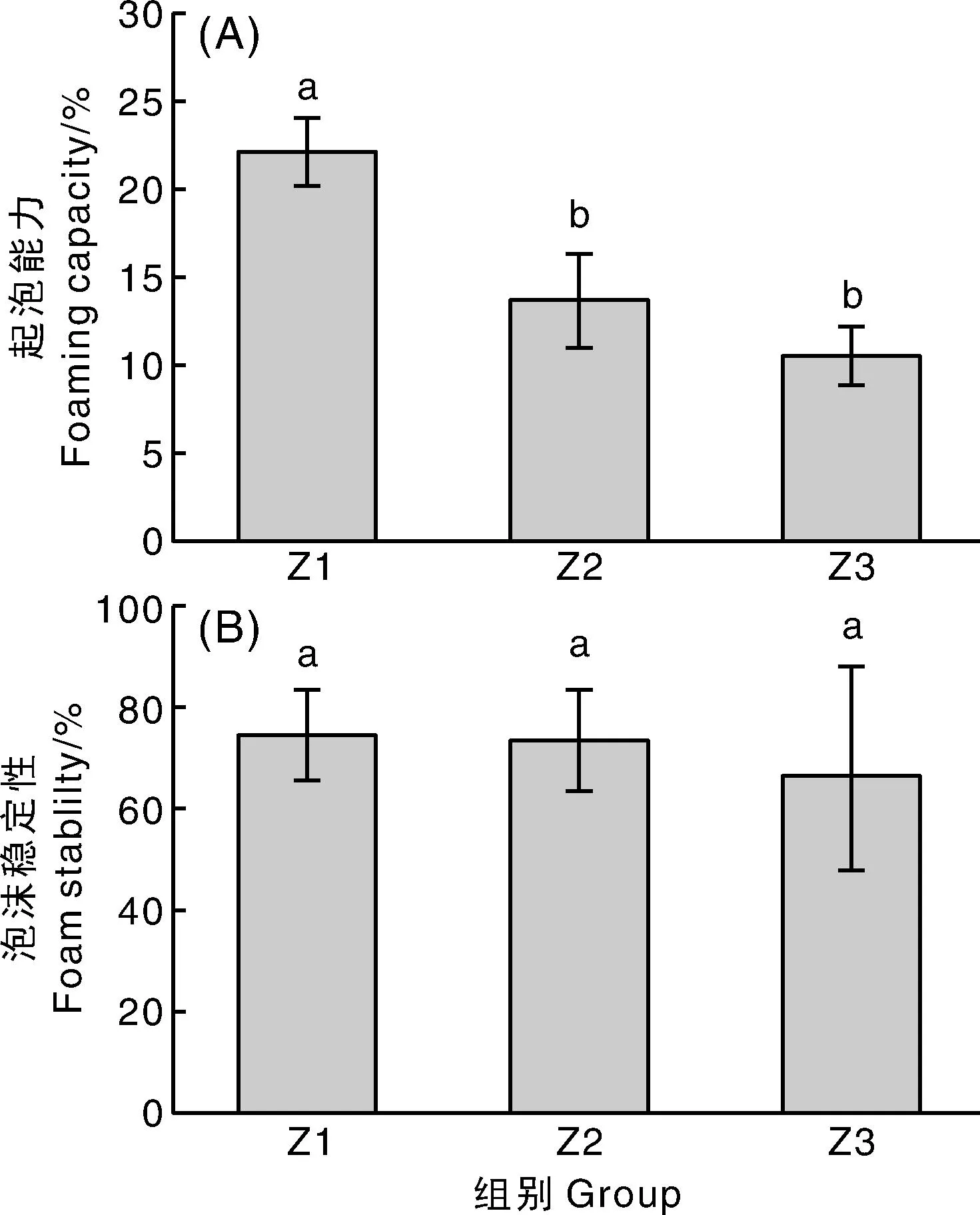
图10 核桃仁分离蛋白的起泡能力和泡沫稳定性Fig.10 Foaming property and foam stability of protein isolates of walnut kernel
2.3.5 核桃仁分离蛋白的乳化活性与乳化稳定性
不同核桃仁分离蛋白的乳化能力如图11-A所示。琥珀色组核桃仁分离蛋白具有较好的乳化能力,为(27.99±2.12)m2·g-1,显著高于浅琥珀色组(P<0.05)。虽然核桃仁分离蛋白乳化活性与其溶解度密切相关,溶解度高的蛋白乳化活性应该更好,但蛋白质粒径、温度、分子柔性等方面均可能对核桃仁分离蛋白乳化活性产生影响[29]。琥珀色组蛋白乳化活性较高,可能是因为其核桃仁分离蛋白氧化程度高,由于巯基氧化形成的二硫键导致蛋白质分子共价交联而形成大分子聚集体,更易结合到油-水界面形成稳定的蛋白膜[30]。核桃仁分离蛋白乳化稳定性如图11-B所示,3组核桃仁分离蛋白的乳化稳定性有显著性差异(P<0.05),且琥珀色组>浅琥珀色组>淡黄色组。其原因可能在于琥珀色组核桃仁分离蛋白中有更多的大分子聚集体,能够有效地阻止油脂聚集,提高了蛋白质的乳化稳定性[30]。
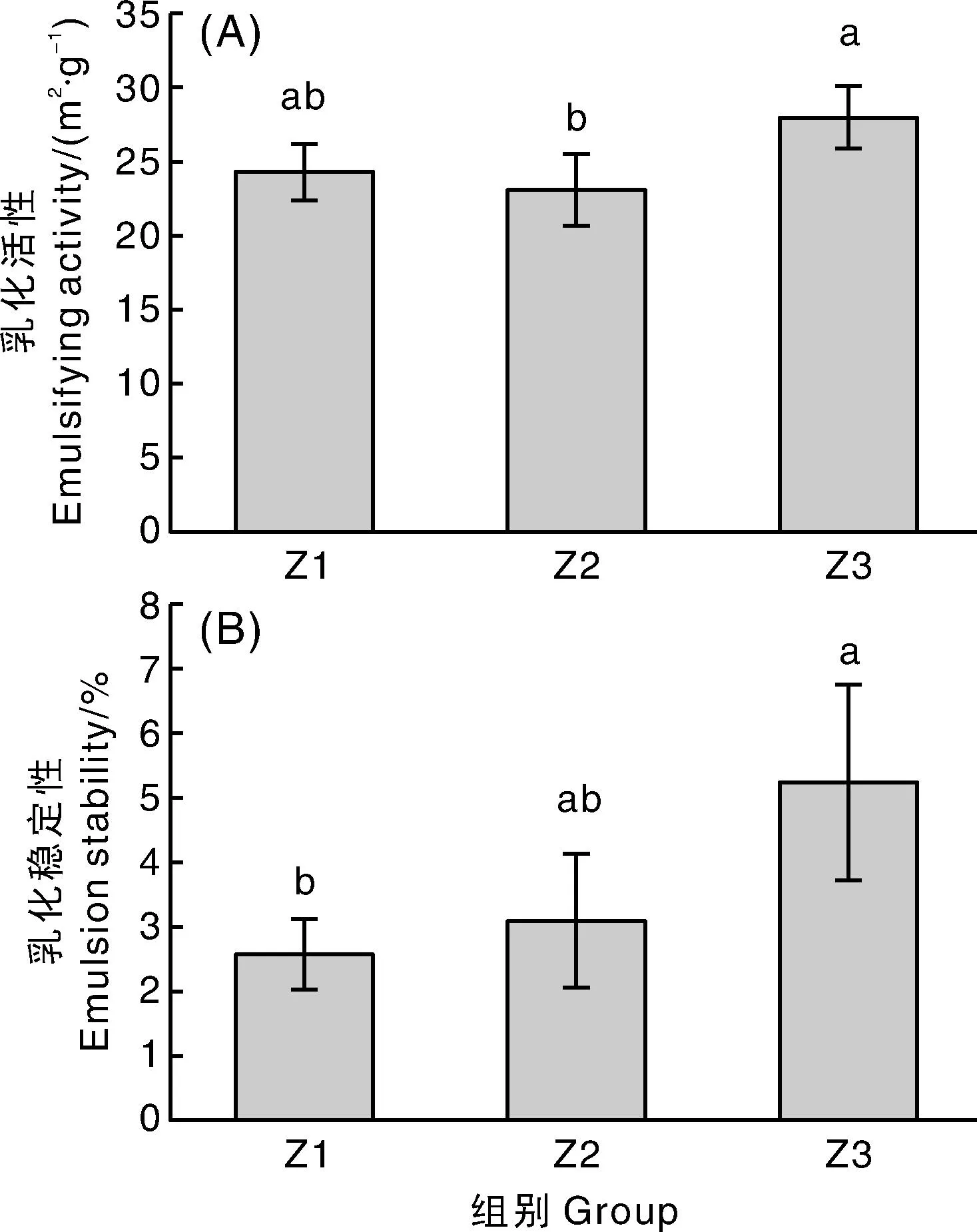
图11 核桃仁分离蛋白的乳化活性和乳化稳定性Fig.11 Emulsification and emulsification stability of protein isolates of walnut kernel
3 结论
不同色泽核桃仁的内种皮酚类化合物含量、组成与抗氧化活性存在差异。随着核桃仁内种皮色泽的加深,内种皮提取物中总酚含量、DPPH和ABTS自由基清除能力都显著降低,其原因可能是因为随着内种皮颜色的加深,酚类物质的氧化程度增加,从而导致物质组成发生改变,多酚含量和抗氧化能力降低。此外,不同色泽核桃仁分离蛋白的氧化程度与理化性质存在差异。淡黄色和浅琥珀色核桃仁提取出的蛋白质氧化程度较琥珀色低,淡黄色内种皮核桃仁分离蛋白的溶解性、持水性、持油性、起泡性与泡沫稳定性显著优于琥珀色,而琥珀色内种皮核桃仁分离蛋白的乳化性与乳化稳定性显著优于淡黄色与浅琥珀色。总之,不同色泽内种皮核桃仁中营养物质的组成和性质存在差异,这对科学分级核桃仁和合理开发利用不同色泽核桃仁提供了理论基础。但本研究只关注了单一品种的核桃,后续研究需要增加核桃品种,进一步明确核桃仁内种皮色泽与核桃仁中的油脂、多糖、维生素等更多营养物质的相关性,这对不同等级核桃仁的差异化开发利用具有指导意义。
