稻虾种养系统水稻根际土壤活性有机碳、微生物群落结构及其相互关系
2024-01-02郝柳柳代梨梨陈思媛
郝柳柳,代梨梨,彭 亮,陈思媛,陶 玲,李 谷,张 辉,*
(1.湖州师范学院 生命科学学院,浙江 湖州 313000; 2.中国水产科学研究院 长江水产研究所,湖北 武汉 420322)
水稻(Oryzasativa)-克氏原螯虾(Procambarusclarkii)种养(简称稻虾种养)模式是我国应用面积最广的一种稻田复合生态种养模式。据统计,2020年全国稻田养殖面积达到2 562 686 hm2,其中稻虾种养模式占主要部分[1]。在稻虾种养模式中,水稻和克氏原螯虾共同种养在同一稻田中,二者共享同一生态环境(水、土壤)。越来越多的研究表明,稻虾种养模式提高了土壤肥力,减少了氮肥、磷肥的使用量[2-3]。但也有研究表明,随着养殖密度的增加,土壤中的营养物质出现累积,其环境释放风险也相应增加[3-4]。研究稻虾种养模式的营养物质循环规律,特别是水稻土的营养物质吸收利用规律,对于水稻增产和农业面源污染控制都有积极意义。
土壤活性有机碳作为土壤有机碳库的重要组成部分,是土壤中迁移快、稳定性较差、容易氧化、容易矿化,且极易被植物和土壤微生物利用的有机碳,是土壤养分矿化、循环和能量释放的重要参与者[5]。土壤活性有机碳常通过溶解性有机碳(DOC)、微生物量碳(MBC)、易氧化有机碳(LOC)和颗粒有机碳(POC)等来进行表征。DOC和MBC可以表征土壤有机碳的降解能力和降解潜力,是反映土壤有机碳有效性和土壤质量演变的敏感性指标[6-7];LOC和POC可以表征新增加的有机碳组分[8-9]。目前,关于稻虾种养的研究主要集中在土壤肥力、水体环境、温室气体等方面[10-12],关于稻虾种养中根际土壤活性有机碳的研究还相对较少。
根际是受植物根部直接影响的土壤范围,是植物、土壤和微生物及其环境相互作用的中心,也是植物和土壤环境之间物质、能量交换最为剧烈的区域[13]。本研究从水稻根际的角度研究稻虾种养系统根际土壤活性有机碳及其微生物的动态变化,旨在为水稻土的固碳减排和稻虾种养模式的健康发展提供进一步的依据。
1 材料与方法
1.1 试验区概况与试验设计
试验在湖北省荆州市江陵县三湖农场(30°19′N,112°54′E)进行。试验区域属于典型的北亚热带季风气候,年均气温16 ℃,年均降水量1 100 mm,年无霜期246~262 d,年日照时数1 827~1 897 h。该区域于2017年开始采用稻虾种养模式。
试验于2021年3-10月进行,分别设置稻虾种养系统(CR)和水稻单作系统(MR)两种模式的处理,每种处理分别设置3块稻田,每块稻田的面积为667 m2。在CR系统中,采用标准的环沟模式,每年主要养虾期为3-5月,期间每块稻田(667 m2,下同)的虾苗投放量为25 kg,饲料投放量为125 kg,6月前完成捕捞,然后进行排水整地、插秧。供试水稻品种为深两优3117,株行距为16 cm×30 cm。水稻种植前施底肥(每块稻田包括尿素10 kg、磷酸二铵15 kg),另于返青期和分蘖期各追肥1次(每次每块稻田施尿素5 kg)。供试尿素(N质量分数≥46.4%),磷酸二铵(N质量分数≥18%,P2O5质量分数≥46%),均产自湖北宜化化工股份有限公司。10月水稻收割后灌水养虾,稻草全量还田。除小龙虾养殖外,MR与CR的稻田管理方式基本相同。
将试验开始前CR和MR系统耕层土壤(0~20 cm)的部分基本性质整理于表1。
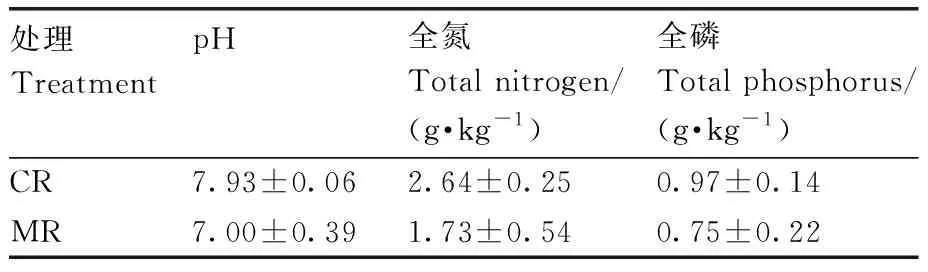
表1 试验开始前耕层土壤(0~20 cm)的部分基本理化性质Table 1 Physiochemical properties of the surface soil (0-20 cm) before the experiment
1.2 样品采集与测定
2021年,分别在水稻分蘖期(7月)、抽穗期(9月)、成熟期(10月)采集根际土壤样品,每种模式下分别采集3块稻田土壤,在每块稻田按照“S”形采集5份以上带根的水稻,混合后带回实验室进行处理。根际土壤的采集采用抖落分离法[14-15],先抖落掉松散的土壤,然后轻轻刮取紧贴于根系(0~4 mm)的土样。土样去除侧根、碎石等杂物后混匀,分为3份:一份土样过2 mm筛后保存于4 ℃[16-17],尽快用于MBC、DOC测定;一份土样自然风干并研磨过筛后,用于总有机碳(TOC)、POC、LOC的测定;剩下一份于-20 ℃冷冻保存,用于微生物测序分析。
TOC采用浓硫酸-重铬酸钾外加热法测定[18];MBC采用氯仿熏蒸法测定[19],熏蒸土样与未熏蒸土样提取的有机碳的差值取转换系数0.38;DOC采用1∶2.5的水土质量比提取测定[20];POC采用六偏磷酸钠溶液提取测定[21];LOC采用333 mmol·L-1KMnO4氧化法测定[22]。
土壤pH值采用1∶5的土水质量体积比浸提,用酸度计法测定;全氮含量采用凯氏定氮法测定;全磷含量采用碱熔-钼锑抗分光光度法测定。
1.3 微生物测序与分析
利用DNeasy PowerSoil Pro Kit(强力土壤DNA提取试剂盒,德国QIAGEN),按照操作说明书提取土壤总DNA。DNA样品经检验合格后,利用Illumina Miseq高通量测序技术平台进行测序和分析。测序采用2×250 bp双端测序(PE)方式,由百迈克云科技(武汉)有限公司进行,测序区段为16S rDNA的V3和V4区,引物及其序列分别为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。
将双端测序得到的序列用于拼接、过滤,经过处理后,最终得到的序列用于运算分类单位(OUT)分析(97%相似性水平)。利用Ribosomal Database Project平台提供的RDP classifier工具中的贝叶斯算法进行物种分类。采用样本序列随机抽样的方法,分别计算Chao1指数、ACE指数、Shannon指数(香农指数)和Simpson指数(辛普森指数)等α多样性指标。利用Excel 2016软件绘制物种组成堆砌条图。利用R软件(version 3.4.3)进行主成分分析(PCA)。利用Vegan(2.6-4)程序包进行冗余分析(RDA)。
1.4 统计分析
采用SPSS 21.0软件进行单因素方差分析(one-way ANOVA)和Pearson(皮尔逊)相关性分析。显著性水平分别选定为α=0.05和α=0.01,P<0.05表示差异显著或显著相关,P<0.01表示极显著相关。
2 结果与分析
2.1 根际土壤活性有机碳分析
CR处理水稻分蘖期、抽穗期、成熟期的根际土壤TOC含量分别为104.10~132.73、97.68~108.49、86.08~93.97 g·kg-1(图1),MR处理分别为47.71~77.76、49.07~88.69、48.23~81.91 g·kg-1。单因素方差分析发现,CR处理在上述3个生育期的水稻根际土壤TOC含量均显著高于MR处理,分蘖期、抽穗期和成熟期的增幅分别为78%、66%、49%。
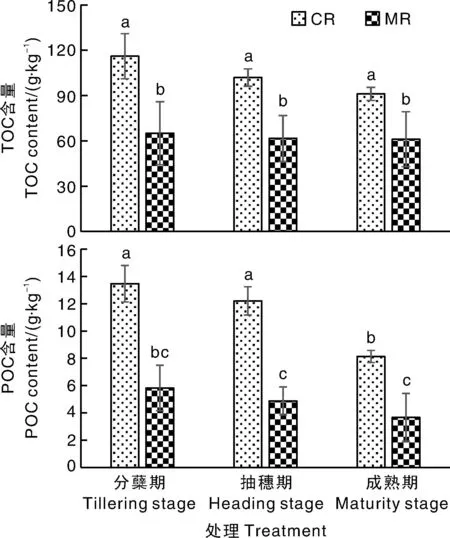
柱上无相同字母的表示差异显著(P<0.05)。下同。Bars marked without the same letters indicate significant difference at P<0.05. The same as below.图1 不同处理各生育期的根际土壤总有机碳(TOC)和颗粒有机碳(POC)含量Fig.1 Total organic carbon (TOC) and particulate organic carbon (POC) contents in rhizosphere soil under treatments at varied growth stages
CR处理水稻分蘖期、抽穗期、成熟期的根际土壤POC含量分别为12.11~14.78、11.14~13.21、7.67~8.55 g·kg-1,MR处理分别为4.26~7.58、4.02~6.01、2.52~5.69 g·kg-1。CR处理在上述3个生育期的水稻根际土壤POC含量均显著高于MR处理,分蘖期、抽穗期和成熟期的增幅分别为131%、150%和121%。CR处理下水稻根际土壤的POC含量随生育周期呈下降趋势,成熟期的根际POC含量显著低于分蘖期和抽穗期;但MR处理下水稻根际土壤的POC含量在3个生育期间无显著差异。
CR处理水稻分蘖期、抽穗期、成熟期的根际土壤LOC含量分别为3.42~5.43、4.07~5.38、4.40~5.85 g·kg-1(图2),MR处理分别为2.08~4.44、1.96~3.04、2.49~2.97 g·kg-1。在分蘖期,CR与MR处理的水稻根际土壤LOC含量无显著差异;但在抽穗期和成熟期,CR处理的水稻根际土壤LOC含量均显著高于MR处理,增幅分别为70%和87%。
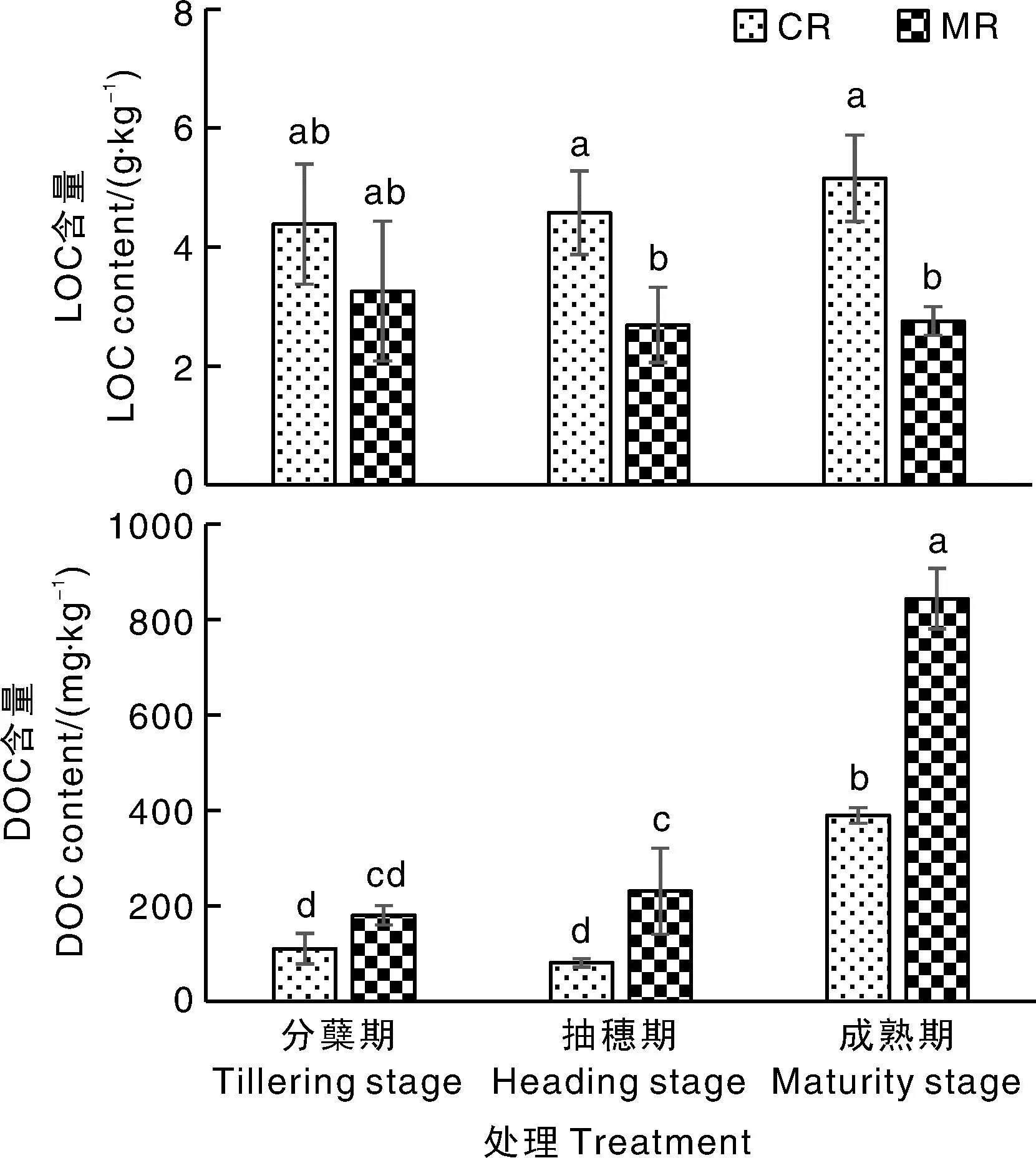
图2 不同处理各生育期的根际土壤易氧化有机碳(LOC)和溶解性有机碳(DOC)含量Fig.2 Labile organic carbon (LOC) and dissolved organic carbon (DOC) contents in rhizosphere soil under treatments at varied growth stages
CR处理水稻分蘖期、抽穗期、成熟期的根际土壤DOC含量分别为85.29~146.70、74.30~91.11、376.16~407.84 mg·kg-1,MR处理分别为160.30~200.31、127.95~294.98、771.72~888.82 mg·kg-1。CR和MR处理水稻成熟期的根际土壤DOC含量均显著高于分蘖期、抽穗期。在分蘖期,CR与MR处理的水稻根际土壤DOC含量无显著差异;但在抽穗期和成熟期,CR处理的水稻根际土壤LOC含量均显著低于MR处理,降幅分别为65%和54%。
CR处理水稻分蘖期、抽穗期、成熟期的根际土壤MBC含量分别为237.33~274.34、143.70~189.43、120.84~161.12 mg·kg-1(图3),MR处理下分别为137.17~215.55、106.69~169.83、93.62~167.65 mg·kg-1。CR处理下,水稻抽穗期和成熟期的根际土壤MBC含量较分蘖期显著(P<0.05)降低,但MR处理下水稻根际土壤的MBC含量在3个生育期间无显著差异。在分蘖期,CR处理的水稻根际土壤MBC含量显著高于MR处理,增幅为56%;在抽穗期和成熟期,CR与MR处理的水稻根际土壤MBC含量无显著差异。
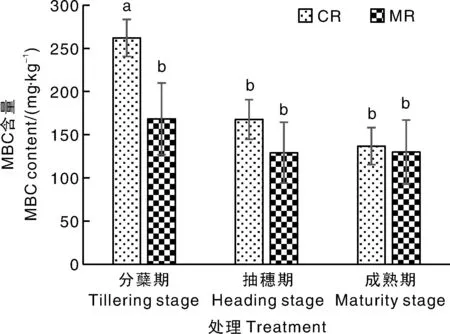
图3 不同处理各生育期的根际土壤微生物量碳(MBC)含量Fig.3 Microbial biomass carbon (MBC) contents in rhizosphere soil under treatments at varied growth stages
2.2 根际土壤微生物群落组成分析
本研究共获得1 438 173对reads,对双端reads质控、拼接后,共产生1 433 928条clean reads。对clean reads在97.0%的相似度水平下进行聚类,共获得2 030个OTU。对稀释曲线进行分析发现,各样品曲线在相应的测序深度下均趋于平缓,说明所用的测序深度可满足分析需求。对韦恩图进行分析发现,CR与MR处理下的OTU数分别为2 373和2 443,特异性OTU数分别为12和82,但不同时期的样品间无特异性OTU,说明各OTU在不同时期样品间均有分布。
2.2.1 根际土壤微生物的多样性
在水稻的分蘖期、抽穗期和成熟期,两种模式的OTU数量,及微生物多样性指标(Chao1指数、Ace指数、Shannon指数和Simpson指数)均无显著差异(表2)。
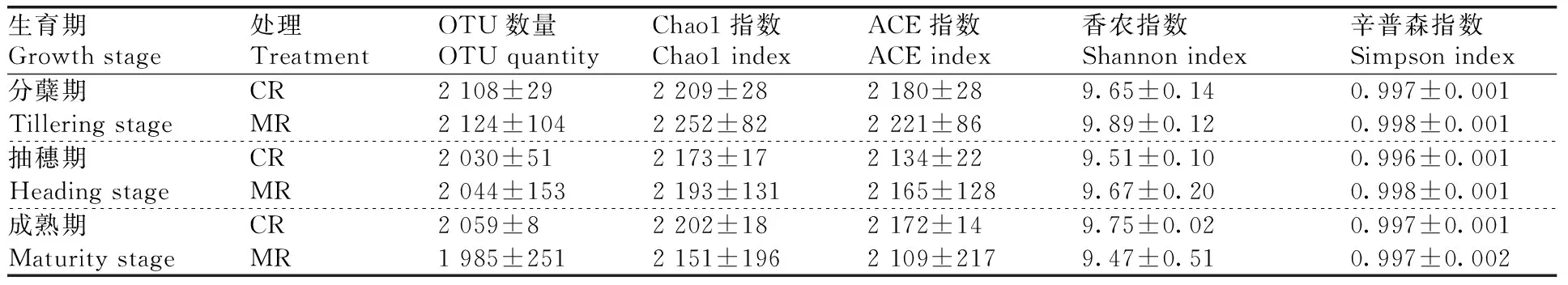
表2 不同处理各生育期的根际土壤微生物多样性指标Table 2 Rhizosphere microbial diversity indexes under treatments at varied growth stages
2.2.2 根际土壤微生物的群落结构
在门水平上:水稻分蘖期MR处理下的优势类群(相对丰度>10%)包括变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、unclassified_Bacteria(未分类)和拟杆菌门(Bacteroidetes),而CR处理下的优势类群为变形菌门、酸杆菌门、绿弯菌门和unclassified_Bacteria(图4)。在水稻抽穗期和成熟期,两种模式下的优势类群无明显变化。进一步的分析发现:在水稻抽穗期,CR处理疣微菌门(Verrucomicrobia)和厚壁菌门(Firmicutes)的相对丰度显著低于MR;在分蘖期,CR处理Bdellovibrionota和浮霉菌门(Planctomycetes)的相对丰度显著低于MR。成熟期时,不同处理各菌门的相对丰度无显著差异。
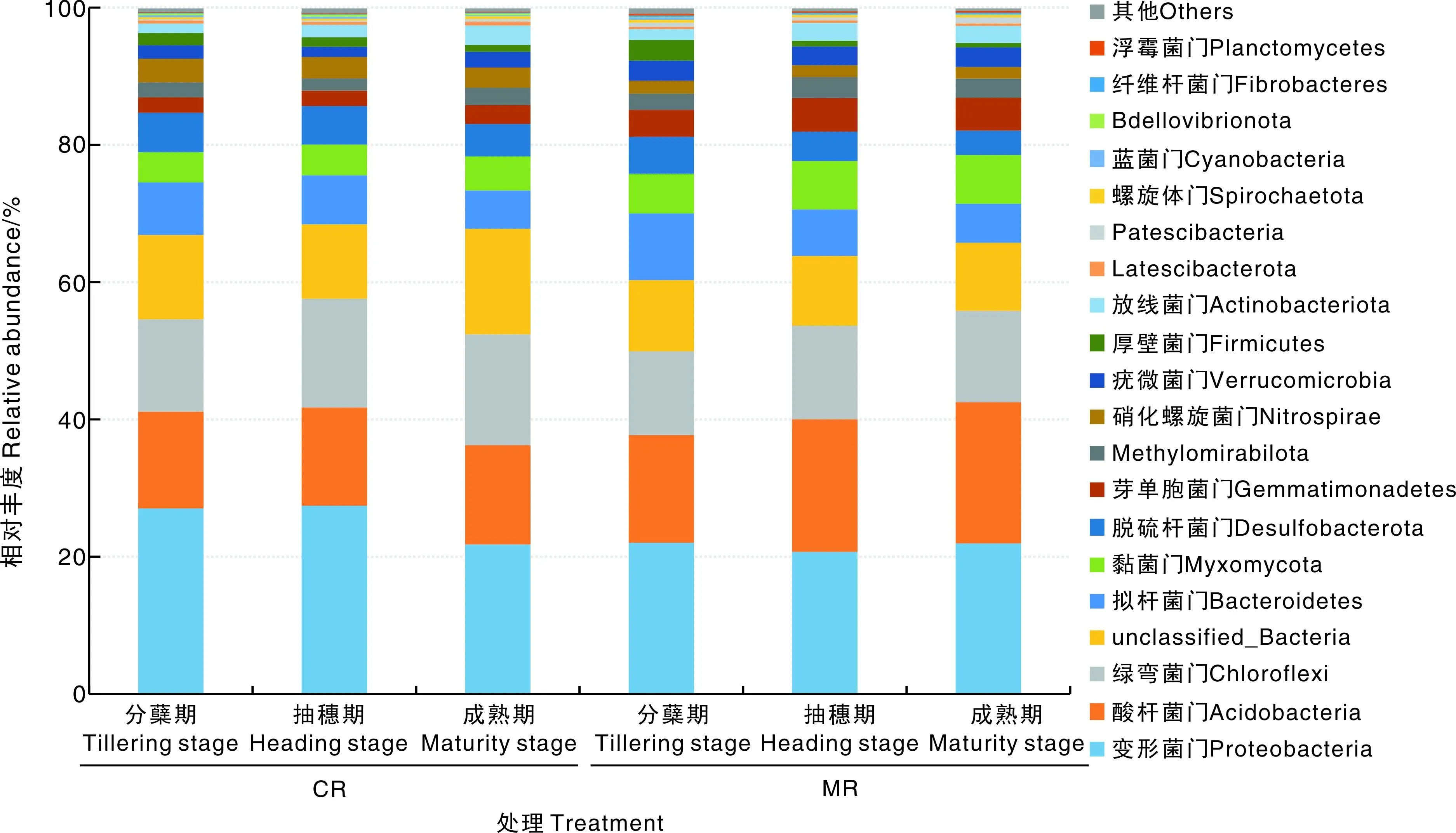
图4 不同处理各生育期门水平上根际土壤微生物的相对丰度Fig.4 Relative abundances of microorganisms in rhizosphere soil at phylum level under treatments at varied growth stages
在属水平上,对相对丰度排名前20的微生物OTU进行分析(图5),结果发现,CR处理下unclassified_Anaerolineaceae在水稻抽穗期的相对丰度显著高于MR,增幅为935.53%,但在分蘖期和成熟期无显著性差异。CR处理下unclassified_Steroidobacteraceae在分蘖期和抽穗期的相对丰度均显著高于MR模式,增幅分别为120.85%和389.79%,但在成熟期与MR无显著差异。CR处理显著提高了抽穗期unclassified_Subgroup_17的相对丰度,显著降低了抽穗期unclassified_Geobacteraceae的相对丰度。
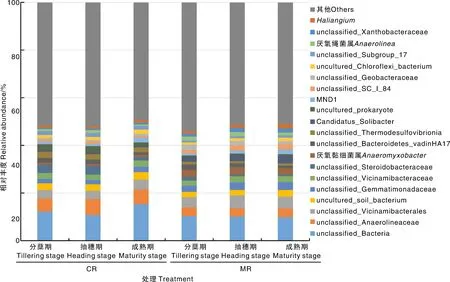
图5 不同处理各生育期属水平上根际土壤微生物的相对丰度Fig.5 Relative abundances of microorganisms in rhizosphere soil at genus level under treatments at varied growth stages
利用PCA探讨不同处理各生育期水稻根际微生物群落的结构差异,其中PC1(主成分1)的解释度为52.14%,PC2(主成分2)的解释度为15.03%,二者合计的总解释度为67.17%(图6)。CR与MR处理的根际土壤微生物群落结构有着明显的差异:CR处理的样品分布在第二、第三象限,而MR处理的样品分布在第一、第四象限。CR处理下,不同生育期的微生物在PC1和PC2上存在较明显的聚集,说明CR处理下的微生物群落结构随时间变化较大;MR处理下,不同生育期的微生物在PC1和PC2上无明显聚集,说明MR处理下的微生物群落结构随时间变化不明显。
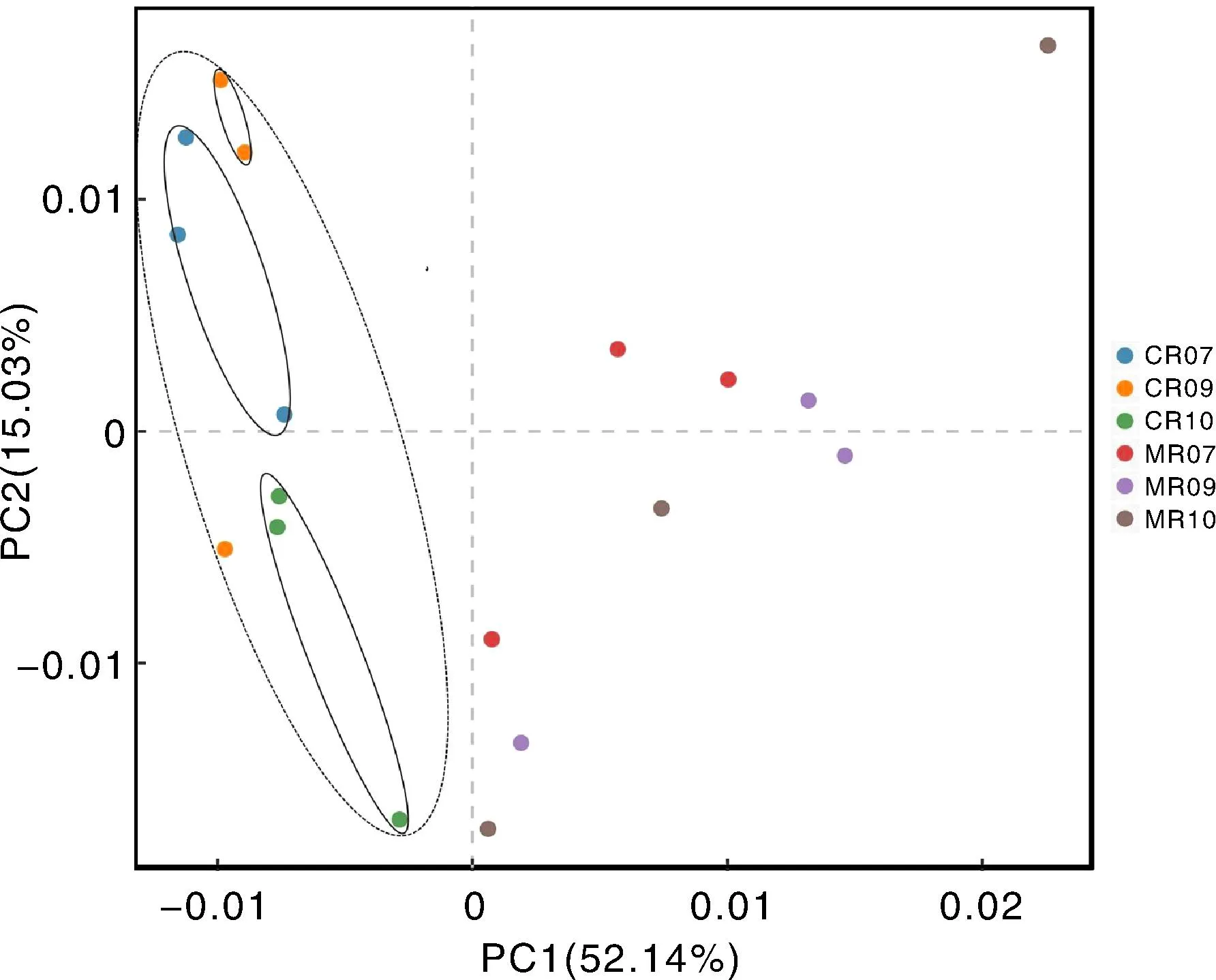
PC1,主成分1;PC2,主成分2。CR07、CR09、CR10分别代表CR处理分蘖期、抽穗期、成熟期的样品,MR07、MR09、MR10分别代表MR处理分蘖期、抽穗期、成熟期的样品。下同。PC1, Principle component 1; PC2, Principle component 2. CR07, CR09, CR10 represent samples collected at tillering stage, heading stage and maturity stage under CR treatment, respectively. MR07, MR09, MR10 represent samples collected at tillering stage, heading stage and maturity stage under MR treatment, respectively.The same as below.图6 不同处理各生育期根际土壤微生物群落的主成分分析Fig.6 Principle component analysis (PCA) of microorganisms in rhizosphere soil under treatments at varied growth stages
2.2.3 根际土壤微生物的功能预测
基于KEGG数据库,对根际土壤微生物中最主要的20种代谢通路进行分析(表3)。在水稻分蘖期,CR处理在原核生物的碳固定途径、丙酮酸代谢、甲烷代谢、泛酸和辅酶A生物合成等通路上的相对丰度显著高于MR处理,但在磷酸戊糖途径通路上的相对丰度却显著低于MR处理;在抽穗期,CR处理在磷酸戊糖途径通路上的相对丰度显著低于MR处理;在成熟期,CR处理在丙酸代谢通路上的相对丰度显著低于MR处理。
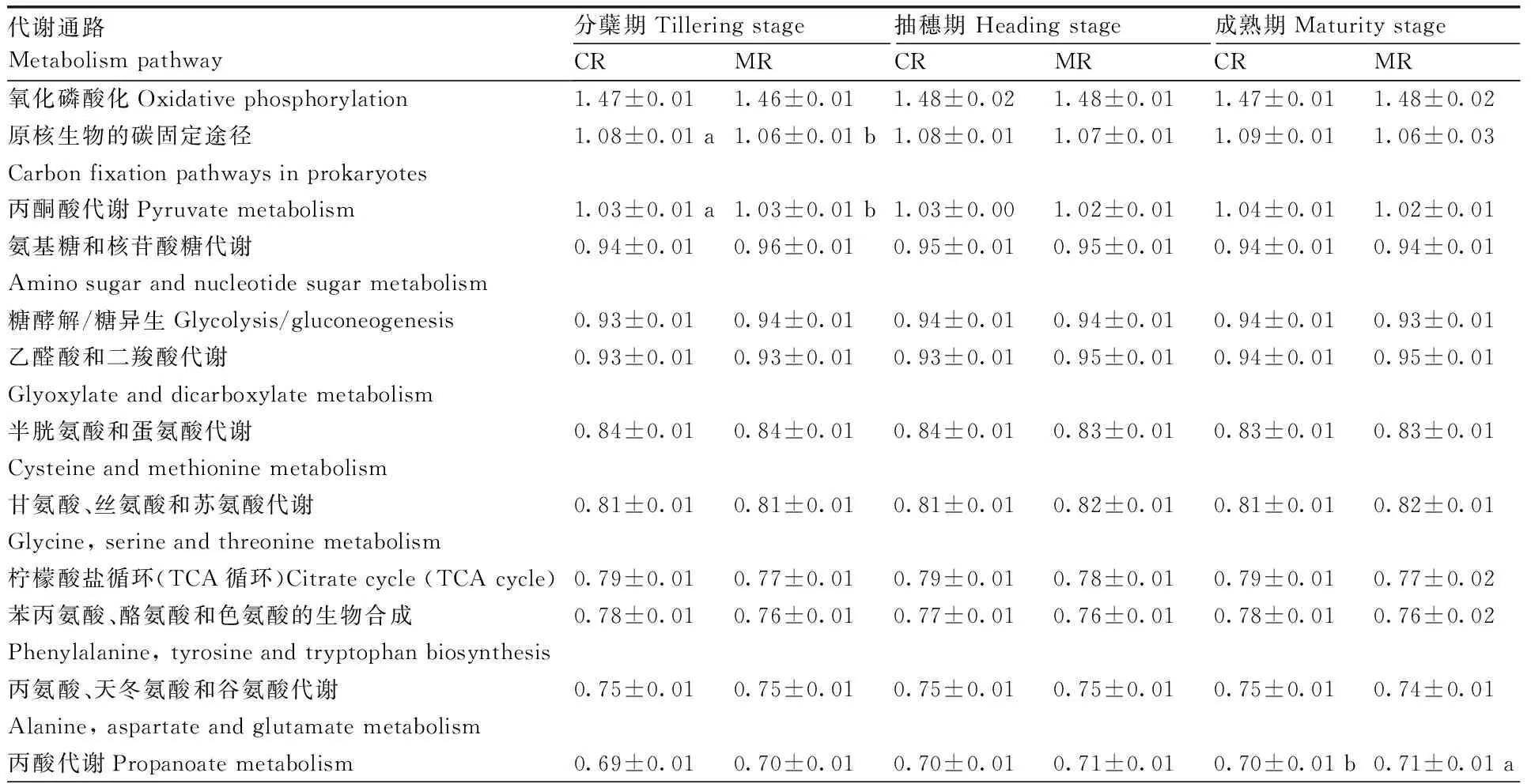
表3 不同处理各生育期根际土壤微生物的KEGG代谢通路丰度Table 3 Abundance of KEGG metabolism pathways of rhizosphere microbes under treatments at varied growth stages %
2.3 根际土壤活性有机碳与微生物群落结构的关系
在属水平上分析不同类群微生物与活性有机碳的相关性(图7),结果显示:根际土壤TOC含量与unclassified_Anaerolineaceae呈显著正相关,与Candidatus_Solibacter、厌氧绳菌属(Anaerolinea)、unclassified_Xanthobacteraceae、unclassified_Geobacteraceae呈显著负相关;POC与unclassified_Anaerolineaceae呈极显著正相关,与Haliangium、unclassified_Geobacteraceae呈显著负相关,与Candidatus_Solibacter、unclassified_Xanthobacteraceae呈极显著负相关。此外,两者都与unclassified_Steroidobacteraceae、unclassified_Thermodesulfovibrionia、uncultured_prokaryote和unclassified_Subgroup_17呈极显著正相关,与unclassified_Vicinamibacterales、unclassified_Gemmatimonadaceae、厌氧黏细菌属(Anaeromyxobacter)呈极显著负相关。LOC与unclassified_Anaerolineaceae、unclassified_Thermodesulfovibrionia、uncultured_prokaryote呈显著正相关,与unclassified_Subgroup_17呈极显著正相关,与unclassified_Vicinamibacterales、unclassified_Gemmatimonadaceae呈显著负相关。DOC与unclassified_Gemmatimonadaceae呈显著正相关,与MND1、Haliangium呈极显著正相关,与unclassified_Steroidobacteraceae、unclassified_Bacteroidetes_vadinHA17和uncultured_prokaryote呈显著负相关。MBC与unclassified_Steroidobacteraceae呈极显著正相关,与uncultured_prokaryote呈显著正相关,与unclassified_Vicinamibacterales、unclassified_Gemmatimonadaceae、MND1呈显著负相关。
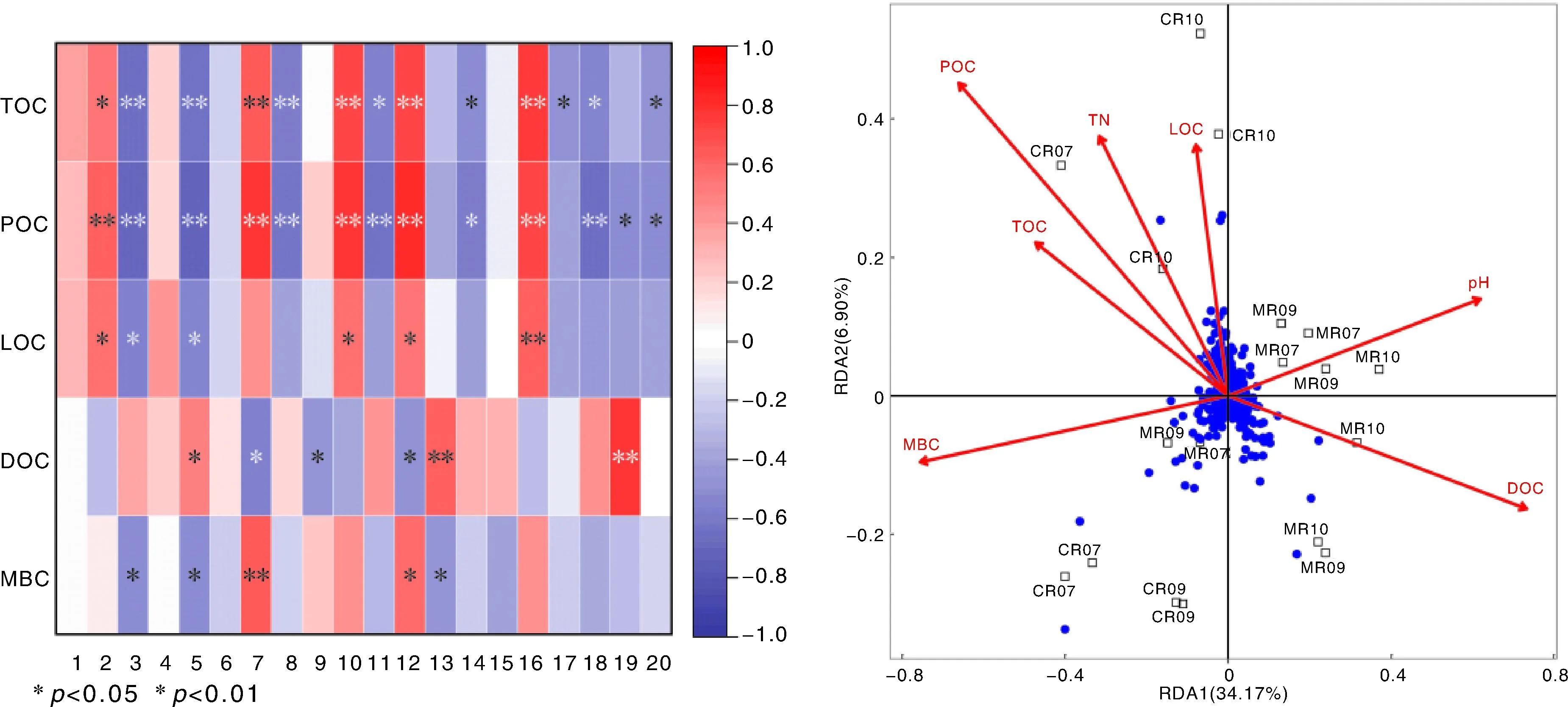
1, Unclassified_Bacteria;2, Unclassified_Anaerolineaceae;3, Unclassified_Vicinamibacterales;4, Uncultured_soil_bacterium;5, Unclassified_Gemmatimonadaceae;6, Unclassified_Vicinamibacteraceae;7, Unclassified_Steroidobacteraceae;8, 厌氧黏细菌属(Anaeromyxobacter);9, Unclassified_Bacteroidetes_vadinHA17;10, Unclassified_Thermodesulfovibrionia;11, Candidatus_Solibacter;12, Uncultured_prokaryote;13, MND1;14, Unclassified_SC_I_84;15, Uncultured_Chloroflexi_bacterium;16, Unclassified_Subgroup_17;17, 厌氧绳菌属(Anaerolinea);18, Unclassified_Xanthobacteraceae;19, Haliangium;20, Unclassified_Geobacteraceae。TOC,总有机碳;POC,颗粒有机碳;LOC,易氧化有机碳;DOC,溶解性有机碳;MBC,微生物量碳;TN,全氮。“*”和“**”分别表示显著(P<0.05)相关和极显著(P<0.01)相关。1, Unclassified_Bacteria;2, Unclassified_Anaerolineaceae;3, Unclassified_Vicinamibacterales;4, Uncultured_soil_bacterium;5, Unclassified_Gemmatimonadaceae;6, Unclassified_Vicinamibacteraceae;7, Unclassified_Steroidobacteraceae;8, Anaeromyxobacter;9, Unclassified_Bacteroidetes_vadinHA17;10, Unclassified_Thermodesulfovibrionia;11, Candidatus_Solibacter;12, Uncultured_prokaryote;13, MND1;14, Unclassified_SC_I_84;15, Uncultured_Chloroflexi_bacterium;16, Unclassified_Subgroup_17;17, Anaerolinea;18, Unclassified_Xanthobacteraceae;19, Haliangium;20, Unclassified_Geobacteraceae。TOC, Total orgaic carbon; POC, Particulate organic carbon; LOC, Labile organic carbon; DOC, Dissoloved organic carbon; MBC, Microbial biomass carbon; TN, Total nitrogen. “*” and “**” represent significant correlation at P<0.05 and P<0.01 level, respectively.图7 根际土壤微生物群落(属水平)与有机碳组分的相关性分析与冗余分析(RDA)Fig.7 Correlation and redundancy analysis (RDA) of rhizosphere microbial community (at genus level) and organic carbon components
RDA有助于进一步揭示根际土壤微生物群落与活性有机碳之间的关系,环境因子前两轴的解释率分别为34.17%和6.90%,总解释率为4.07%。不同有机碳组分的含量与根际微生物群落的相对丰度间存在显著相关性,土壤POC、MBC、DOC含量是最主要的环境驱动因子。同时,土壤pH值、全氮含量也对根际土壤微生物群落有重要影响。
3 讨论
3.1 稻虾种养系统水稻根际土壤活性有机碳的变化特征
近年来,稻虾种养模式受到了广泛的关注和研究,大量研究表明,稻虾种养模式能够增加土壤有机质含量,并提高土壤肥力[23-25]。然而,大多数研究只关注稻虾种养模式对稻田土壤的影响,较少关注这一模式下土壤碳的转化动态。水稻作为这一系统的重要组成部分,无疑对系统内的营养物质转化具有重要影响。本研究通过与常规稻田的对比,分析了稻虾种养系统水稻根际土壤活性有机碳与微生物的动态变化,有利于揭示这一系统土壤碳的转化和利用规律。
之前有大量的研究都表明,CR处理能增加不同土层的土壤有机碳含量[10,25-26]。本研究也同样发现,CR处理较MR处理更能促进根际土壤TOC的积累。土壤中的有机碳含量是由有机质的输入和矿化共同决定的[27]。在稻虾种养系统中,一方面,小龙虾投饵和粪便残留使得稻田土壤有机质含量升高;另一方面,淹水养虾的环境也有助于减缓土壤有机碳的分解[28]。
POC主要由未完全分解的有机物残体组成[29]。本研究表明,在水稻各生育期,CR处理的根际土壤POC含量均显著高于MR处理。有研究指出,小龙虾对秸秆、树叶等植物凋落物的粉碎、摄食等行为会增加细颗粒有机质的含量[30]。另外,在CR处理下,根际土壤的POC含量在水稻成熟期显著低于分蘖期和抽穗期,此结果与符卓旺[13]的研究类似。这可能是由于CR处理下微生物群落的改变,加快了POC的分解。
土壤LOC含量越高,表明土壤碳的活性越高,稳定性越差,养分循环越快[31]。本研究中,在抽穗期和成熟期,CR处理根际土壤的LOC含量显著高于MR。这与之前的研究结果类似,即小龙虾的引入提高了根际土壤有机碳的质量和生物有效性[32-33]。这与前面对CR处理下有机质分解活性升高的分析一致。
土壤DOC是指土壤有机碳库中具有一定溶解性、较易矿化分解的那部分土壤有机碳,是土壤活性炭的重要组成部分[34],也是土壤微生物可直接利用的有机碳源[35]。本研究发现,CR处理在抽穗期和成熟期的根际土壤DOC含量显著低于MR。CR处理的长期淹水环境可能使土壤DOC更容易进入水体流失[36],从而导致根际土壤DOC含量降低,这与曹凑贵等[2]的研究结果类似。先前有研究发现,随着根际衰老,根际微生物的富集效应减少[37]。对MBC含量的分析发现,在水稻分蘖期,CR处理根际土壤的MBC含量显著高于MR,这进一步说明CR处理存在较高的微生物量,但也可能会引起根际土壤DOC含量的降低。
3.2 稻虾种养系统水稻根际土壤微生物的变化特征
根际是植物-微生物-土壤生态系统物质交换的活跃场所[38],对维系稻田系统平衡发挥着重要的作用。相比周边土壤,根际土壤的微生物活性往往更高,有机质分解转化的活性也更强[13]。因此,评价稻虾系统根际微生物的影响对了解稻虾种养的生态学效应具有重要意义。本研究以水稻单作为对照,发现稻虾种养系统与水稻单作系统根际土壤微生物群落多样性并无显著差异。但陶先法等[39]的研究发现,稻虾种养能够提高水稻结实期根际土壤微生物的多样性。较高的微生物多样性往往意味着较高的生态系统稳定性[40],因此,稻虾种养模式可能更有利于根际微环境的稳定。本研究还发现,CR处理的微生物群落结构在水稻的不同生育期存在着较明显的差异,而MR处理下的微生物群落结构组成在不同生育期间变化较小。在稻虾种养模式下,水稻种植前的冬闲田养虾可能会对水稻种植后的根际微生物群落造成影响;但随着水稻生长,根际微生物多样性得到快速恢复。对微生物群落功能的分析发现,在水稻分蘖期,CR处理的原核生物的碳固定途径、丙酮酸代谢、甲烷代谢、泛酸和辅酶A生物合成等通路的相对丰度显著高于MR处理,说明CR处理下微生物的碳固定能力更强,微生物群落组成上的差异可能是造成两处理间差异的主要原因。
在门水平上,虽然CR和MR处理在水稻抽穗期和成熟期的微生物优势种群无显著差异,但在丰度较小的群落中,CR与MR处理在疣微菌门、厚壁菌门、浮霉菌门、Bdellovibrionota的相对丰度上存在显著差异,说明CR与MR处理的根际微生物组成发生了显著变化。PCA分析的结果也进一步证实了CR和MR处理下根际微生物群落结构上的差异。在属水平上,对最主要的20种微生物进行分析也发现,相较于MR,CR处理下unclassified_Anaerolineaceae在水稻抽穗期的相对丰度,unclassified_Steroidobacteraceae在分蘖期和抽穗期的相对丰度,以及unclassified_Subgroup_17在抽穗期的相对丰度均显著升高。微生物作为有机质分解转化的主要类群,推测其群落变化可能与不同处理下土壤有机碳的差异有重要关系。
3.3 稻虾种养系统水稻根际土壤活性有机碳与微生物的关系
unclassified_Anaerolineaceae属于绿弯菌门厌氧绳菌科,相关类群被发现广泛分布于沉积物和湿地土壤中[41-43],其成员普遍在厌氧环境下生长[44],提示CR处理下水稻根际可能保持厌氧环境,因而有利于unclassified_Anaerolineaceae的生存。相关性分析发现,unclassified_Anaerolineaceae与POC呈极显著正相关。在底泥中,绿弯菌主要附着在胶体和颗粒上[45],CR处理下较高的POC含量可能为unclassified_Anaerolineaceae提供了生长条件。有研究认为,unclassified_Anaerolineaceae可能是将新鲜的碳转变为土壤有机碳并封存在土壤中的主要贡献者[46]。石琪晗等[47]的研究也认为,Anaerolineaceae可能是促进土壤有机碳转化的主要因素。因此,CR处理下unclassified_Anaerolineaceae相对丰度的增加可能会对根际土壤POC、TOC的积累有正反馈作用,并可能增加根际土壤LOC的含量。
unclassified_Steroidobacteraceae属于类固醇杆菌科。目前,对类固醇杆菌科与碳循环关系的研究还很少。Ikenaga等[48]发现,从根际分离的Steroidobacter可以降解琼脂糖,多存在于纤维多糖中。先前的研究已经发现,CR处理可以提高根际有机酸的分泌[39],这可能有利于unclassified_Steroidobacteraceae的生长。本研究发现,相较于MR,CR处理水稻分蘖期和抽穗期unclassified_Steroidobacteraceae的相对丰度显著增加。这可能是由于CR处理下根际土壤分泌物的增加引起了更多的unclassified_Steroidobacteraceae聚集。相关性分析结果显示,unclassified_Steroidobacteraceae的相对丰度与TOC、POC、MBC含量呈正相关,与DOC含量呈负相关,推测CR处理较高的有机碳含量可能更利于其生长,但其生长消耗可能会引起DOC含量的降低。
相关性分析与RDA的结果均发现,POC是影响根际微生物的重要因素。目前,已有研究发现微生物群落组成与POC存在着密切的关系。例如,在海洋中,自养细菌能够通过光能或化能合成POC,而POC又能被异养细菌分解和转化[49]。Wang等[50]发现,POC是显著影响土壤微生物群落组成的关键因子之一。Uncles等[51]的研究认为,细菌对于悬浮物POC的转化具有重要贡献。然而,目前在稻虾种养系统中还很少有研究发现POC对土壤微生物的影响。相较于单纯的稻作系统,稻虾种养系统中小龙虾的养殖引起了根际土壤中POC含量的显著升高,并可能最终引起根际土壤微生物群落组成的变化。本研究的结果可为深入揭示这一系统的物质转化机制提供基础支撑。此外,本研究还发现,TOC、LOC、DOC、MBC含量对根际微生物群落具有明显影响,不同有机碳形态可在微生物的作用下相互转化,水稻根际土壤微生物的大量繁殖会消耗大量碳源,引起根际DOC含量的降低。已有研究表明,土壤TOC含量是影响土壤微生物量的重要因子[52],TOC含量升高会引起土壤MBC含量上升,进而促进土壤有机质的更新与活化[53],并可能引起其他有机碳形式的变化。本研究也发现,MBC含量的变化趋势与DOC相反。CR处理下TOC输入量的增加,可能为微生物提供了有效的碳源,并在微生物作用下引起了其他有机碳形式的变化。同时,其他土壤形状指标,如pH值、全氮等,也对微生物群落具有影响。综上,本研究发现,相比单纯的稻作系统,在稻虾种养系统中,小龙虾的引入引起了水稻根际土壤活性有机碳的显著变化,缘于土壤活性有机碳与微生物之间的显著关联,稻虾种养系统根际微生物的群落也发生了显著改变,并可能反过来对土壤有机碳产生影响。
