宽体金线蛭提取物对HEK293细胞维甲酸诱导基因蛋白样受体(RLRs)通路的影响
2024-01-02陈姿亦何盛盛闫晶男吴怡蓉张雨婷高有领
陈姿亦,何盛盛,闫晶男,吴怡蓉,张雨婷,高有领
(浙江万里学院 生物与环境学院,浙江 宁波 315100)
细胞的模式识别受体(pattern recognition receptors, PRRs)具有识别入侵病毒的作用,其中维甲酸诱导基因蛋白样受体(RIG-I-like receptors, RLRs)是细胞质中的一类RNA解旋酶,主要识别细胞质中病毒感染过程中产生的双链RNA(dsRNA)。研究发现,哺乳动物RLRs包括3种细胞质受体:维甲酸诱导基因Ⅰ(RIG-Ⅰ)、黑色素瘤分化相关基因5(MDA5)、遗传学和生理实验室蛋白2(LGP2)[1],它们几乎在所有组织的细胞中表达,病毒入侵时在免疫组织中被激活[2]。其中,RIG-Ⅰ是这个家族发现最早且最具有结构特性的蛋白[3]。RIG-Ⅰ又称DDX58,由925个氨基酸残基组成[1]。静息状态下,RIG-Ⅰ处于自身抑制状态,不与下游因子发生信号级联;病毒感染宿主细胞时,RIG-Ⅰ和MDA5都可以识别病毒dsRNA并发生构象上的改变,其中RIG-Ⅰ识别5’-三磷酸dsRNA(5’-ppp-dsRNA)和短链dsRNA(<1kp),MDA5识别长链dsRNA(>2 kb)[4]。RIG-Ⅰ和MDA5识别dsRNA激活后,由细胞质转移到一个线粒体相关膜上,与线粒体抗病毒信号蛋白(MAVS)相互作用,引起MAVS的活化。MAVS招募肿瘤坏死因子受体相关因子3(TRAF3)进而激活蛋白激酶TBK-1和IKKε,磷酸化并激活干扰素调节因子3/7(IRF3/7)。活化的 IRF3/7从细胞质转移到细胞核中,从而诱导具有抗病毒作用的Ⅰ型干扰素的生成[5],Ⅰ型干扰素主要包括α干扰素(IFN-α)和β干扰素(IFN-β)[6]。此外,活化的MAVS通过肿瘤坏死因子受体相关因子2/6(TRAF2/6)等将信号传导给κB抑制因子激酶(IKK)复合物,进而活化核转录因子(NF-κB),形成二聚体并进入细胞核调节促炎因子和趋化因子的产生[7]。因此,由RLRs介导的Ⅰ型干扰素生成通路发挥着重要的抗病毒效应。目前,有研究证实一些活性物质对RLRs信号通路有调节作用,例如锌具有下调干扰素调节因子mRNA转录的作用[8],皮质醇具有抑制巨噬细胞IRF3活化,从而调节干扰素的作用[9]。芒果苷具有下调干扰素调节因子5(IRF5)的作用[10]。维生素C在HEK293T、U937等细胞系中对干扰素通路有抑制作用[11]。与上述物质的抑制作用相反,紫草素可以通过激活IRF3上调Ⅰ型干扰素的产生[12],人参提取物可通过Toll样受体途径诱导单核细胞分泌IFN-α[13]。限于作者知识水平,目前仅查到上述研究涉及活性物质对RLRs信号通路的影响,鉴于RLRs信号通路在机体免疫中的重要作用,有必要挖掘更多的活性物质来调节Ⅰ型干扰素的生成。
宽体金线蛭(Whitmaniapigra)属于环节动物门蛭纲颚蛭目,是一种水产经济动物,也是一种重要的中药材,体内含有抗凝血和抗血栓的生物活性物质,其提取物广泛用于治疗淤血症和蓄血有关的各种疾病,同时也可用于心脑血管疾病的治疗,此外还具有降脂、抗肿瘤和抗炎作用[14]。但是宽体金线蛭作为一种中药材,除了上述的药理作用以外,是否会对机体的RLRs信号通路产生影响,目前未有任何研究涉及。聚肌苷酸-聚胞苷酸(poly I∶C)是双链RNA的类似物,一条链是ploy(Ⅰ),另一条链是poly(C),是一种高效干扰素诱导剂,可作用于正常细胞激活RLRs信号通路并产生干扰素,已用于许多细胞类型,并成功地激活了RLRs信号通路[15-17]。本研究尝试采用poly I∶C对细胞进行刺激,以建立RLRs信号通路激活模型。此外,HEK293细胞为人胚胎肾上皮细胞系,是生命科学研究中常用的细胞系,广泛用于生产蛋白、疫苗、抗癌试剂和重组腺病毒包被等领域[18],本试验采用该细胞进行RLRs信号通路的研究。本试验的目的是:1)采用Poly I∶C转染HEK293细胞以建立RLRs信号通路激活模型;2)揭示宽体金线蛭提取物对HEK293细胞活力和RLRs信号通路的影响。
1 材料与方法
1.1 细胞培养和传代
HEK293细胞购于中国科学院上海生命科学研究院细胞资源中心(目录号GNHu43)。细胞培养所需的高糖培养基DMEM(批号11995)和D-Hanks缓冲液(批号H1040)购于索莱宝公司,0.25%胰蛋白消化酶(批号25200072)和Opti-MEMTMI培养基(批号1058021)购于美国Gibco公司,胎牛血清(FBS,批号1809B)购于澳大利亚Bovogen公司。DMEM和FBS按质量比9∶1配成完全培养基。在T75细胞瓶中培养HEK293细胞,培养3 d传代1次,传代时,吸出旧培养基,用10 mL D-Hanks缓冲液清洗一次,吸出后加入1.5 mL 0.25%胰蛋白酶于37℃培养箱中消化2 min,之后加入完全培养基8.5 mL重悬细胞,留1 mL的细胞悬液在细胞瓶中,再加入10 mL完全培养基混匀,置于37 ℃培养箱培养。后续传代均按体积比1∶10进行。
1.2 宽体金线蛭提取物(LE)制备
宽体金线蛭提取物的制备参考李濯冰等[19]和单宇等[20]的方法并进行改进。取样品粗粉1.0 g,加入20 mL去离子水,于室温磁力搅拌5 h,以8 000×g离心20 min,取上清液,经过抽滤、冻干得到水提物,保存备用。
1.3 Poly I∶C激活HEK293细胞RLRs信号通路
试验采用24孔板进行,每孔铺平板细胞数为3.69×105。37 ℃培养24 h后,采用lipofectamine3000(Invitrogen公司,批号L3000008)转染3个不同质量浓度的poly I∶C(Sigma公司,批号P1530),分别为1.0、2.0、4.0 μg·mL-1,另设1个对照组(Control)。每个处理设3个重复。转染操作按试剂说明书进行,在对照组中加入相同量的空白Opti-MEMTMI培养基,之后分别在12、24、48 h收样,收集细胞时吸干培养基,加入100 μL RIPA裂解液(索莱宝公司,批号R0010),放置于冰上,在摇床上裂解处理30 min,转移裂解液至EP(Eppendorf)管中并加入20 μL 5×SDS-PAGE(SDS聚丙烯酰胺凝胶电泳)上样缓冲液,100 ℃金属浴处理10 min后,12 000×g4 ℃离心5 min,最后吸取上清液用于Western blot检测。若收集细胞用于荧光定量PCR,每孔添加100 μL RNA提取裂解液,之后按试剂盒说明书提取总RNA。
1.4 宽体金线蛭提取物对细胞活力的影响
采用CCK-8细胞增殖及毒性检测试剂盒(索莱宝公司,批号CA1210)测定细胞活力,操作和计算按说明书进行,采用96孔板,每孔铺平板细胞数为3.03×104。为检测Poly I∶C对细胞活力的影响,转染3个不同质量浓度的Poly I∶C,分别为1.0、2.0、4.0 μg·mL-1,每个处理设6个重复,培养时间分别为12、24、48 h。为检测水蛭提取物单独处理,以及poly I∶C转染和水蛭提取物共同处理对细胞活力的影响,设置6组,每组设6个重复。分别为对照组、150 μg·mL-1水蛭提取物处理组(LE150)、300 μg·mL-1水蛭提取物处理组(LE300)、2.0 μg·mL-1poly I∶C转染组(poly I∶C)、150 μg·mL-1水蛭提取物处理24 h后进行poly I∶C转染组(poly I∶C+LE150),以及300 μg·mL-1水蛭提取物处理24 h后进行poly I∶C转染组(poly I∶C+LE300)。继续培养24 h,之后添加CCK-8溶液,在培养箱内继续孵育4 h后,用酶标仪测定在450 nm处的吸光度,最后计算细胞活力。
1.5 宽体金线蛭提取物对细胞RIG-Ⅰ信号通路的影响
采用24孔板进行试验,每孔铺平板细胞数为3.28×105,待细胞长到80%时添加水蛭提取物,24 h后再进行Poly I∶C转染(2 μg·mL-1)。试验设置4组,每组3个重复,分别为对照、2.0 μg·mL-1Poly I∶C转染组(Poly I∶C)、150 μg·mL-1水蛭提取物处理24 h后进行Poly I∶C转染组(Poly I∶C+LE150),300 μg·mL-1水蛭提取物处理24 h后进行Poly I∶C转染组(Poly I∶C+LE300),处理时长分别为24、48 h,之后收细胞样(方法同1.3节)用于Western blot和荧光定量PCR检测,收集培养基用于β干扰素的测定。
1.6 实时荧光定量PCR(qRT-PCR)
采用FastPure Cell/Tissue Total RNA Isolation Kit V2试剂盒(Vazyme公司,批号RC112-01)提取RNA,按说明书进行操作。提取的总RNA直接用于下游实验或保存于-80 ℃。使用Thermo公司RevertAid First Strand cDNA Synthesis Kit试剂盒(批号K1622)合成cDNA第一链,各组反转录的总RNA量为4 μL。用UltraSYBR Mixture试剂(康为世纪,批号CW0957M),以GAPDH为内参基因,使用MyiQ2 Two Color实时荧光定量PCR(Bio-Rad)测定RIG-Ⅰ、MAVS、MDA5、TRAF3、IRF3、IFN-β1、TRAF2和NF-κB的相对表达量。引物序列见表1,qRT-PCR反应体系为12.5 μL(2×UltraSYBR Mixture 6.25 μL、上游引物和下游引物各0.25 μL、模板cDNA 0.75 μL、ddH2O 5.00 μL);反应程序为95 ℃ 10 min;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,39个循环;65 ℃ 5 s,95 ℃ 5 s。
1.7 Western blot检测
试验采用的RIG-Ⅰ抗体购自Solarbio公司(批号K001699P),GAPDH购于Abclonal公司(批号AC001),二抗为HRP标记的山羊抗兔IgG(批号D110058),购于生工生物工程(上海)股份有限公司。SDS-PAGE凝胶快速配制试剂盒购自碧云天生物科技有限公司(批号P0012AC)。配制10%的聚丙烯酰胺凝胶,电泳时先设置电压80 V,20 min后把电压提高到100 V,继续电泳约70 min。准备聚偏二氟乙烯(polyvinylidene fluoride, PVDF)滤膜1张(6 cm×9 cm)、滤纸6张,PVDF滤膜先在甲醇中浸泡5 min,再放入转膜缓冲液中,滤纸直接浸泡于转膜缓冲液中,3张滤纸置于胶的下面,把膜放于胶的上面,再在膜上贴3层滤纸,之后90 V转膜90 min(冰盒中进行)。转膜完成后用含体积分数5%脱脂牛奶的TBST(TBS with Tween-20)缓冲液封闭1 h,再加入一抗在4 ℃下孵育过夜,之后用TBST洗膜3次,每次10 min,再加入二抗室温下孵育1 h,TBST洗膜3次,每次10 min,最后加入化学发光试剂ECL(碧云天公司,批号P0018A-2)显色,采用Amershan公司的Imager 680系统成像。
1.8 人β干扰素(IFN-β)测定
采用生工生物工程(上海)股份有限公司的人β干扰素酶联免疫吸附(ELISA)测定试剂盒(批号D711042)测定IFN-β,操作按试剂盒说明书进行,取100 μL样品加入反应孔,之后按步骤分别添加生物素标记IFN-β抗体工作液、辣根过氧化物酶(HRP)标记链霉亲和素工作液、显色剂和终止液,最后用酶标仪在450 nm波长测定吸光度,样品检测时需同时检测标准溶液以制备标准曲线,最后经标准曲线计算得到样品的IFN-β含量。
1.9 数据统计分析
qRT-PCR的数据采用2-ΔΔCT法计算[21]。采用Image-J(V1.8)量化Western blot图像条带灰度值,获得的数据采用GraphPad Prism(V8.0.2)软件进行方差分析和作图,用Tukey方法进行多重比较。显著水平为P<0.05,图中的统计结果用平均值±标准误表示。
2 结果与分析
2.1 Poly I∶C对HEK293细胞形态、活性和RIG-Ⅰ的影响
3个剂量的Poly I∶C转染细胞12、24、48 h后,均会引起细胞的减少,4 μg·mL-1的Poly I∶C转染细胞48 h后,细胞减少程度最为明显(图1)。细胞活力结果说明,转染的Poly I∶C质量浓度越高,细胞活力越低(图2)。
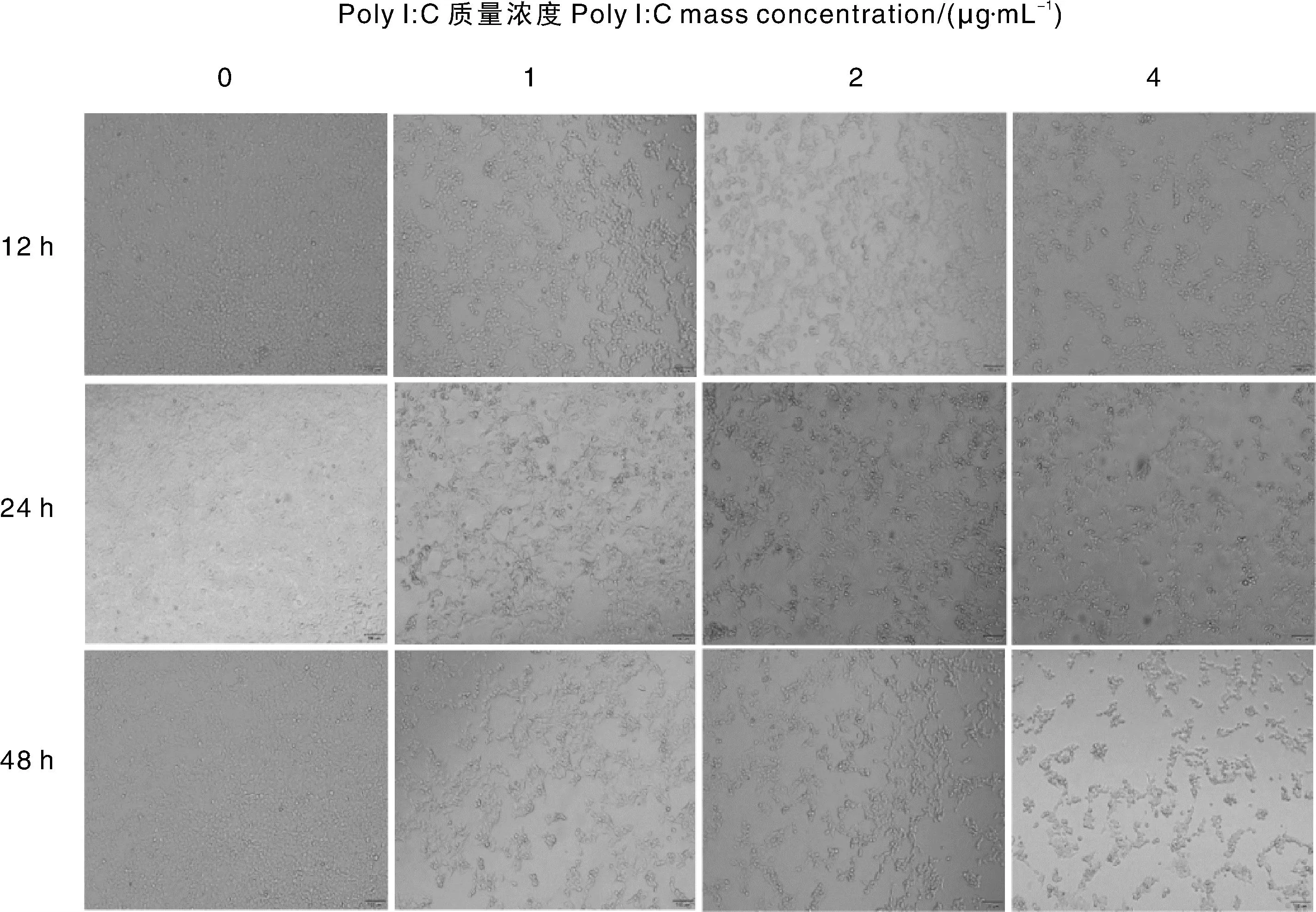
图1 Poly I∶C转染HEK293细胞后细胞形态变化Fig.1 Morphology change of HEK293 cell transfected with Poly I∶C
Poly I∶C转染HEK293细胞12、24、48 h后均提高了RIG-Ⅰ蛋白的表达量(图3),12 h时,2 μg·mL-1Poly I∶C处理组的RIG-Ⅰ蛋白表达量显著高于对照组和1 μg·mL-1Poly I∶C处理组,且4 μg·mL-1Poly I∶C处理组的RIG-Ⅰ蛋白表达量也显著高于对照组,RIG-Ⅰ表达量最高的2 μg·mL-1Poly I∶C处理组是对照组的2.84倍。处理24 h和48 h时,3个质量浓度Poly I∶C处理组的RIG-Ⅰ蛋白表达量均显著高于对照组,且3个质量浓度Poly I∶C处理组之间无显著差异。此外,处理24 h和48 h时,RIG-Ⅰ蛋白表达量最高的2 μg·mL-1Poly I∶C处理组分别是对照组的11.26倍和24.52倍。不同剂量的Poly I∶C转染显著提高了RIG-Ⅰ的mRNA转录水平,其中4 μg·mL-1Poly I∶C处理组mRNA转录水平最高,但是在12 h,Poly I∶C的剂量效应不明显(图4)。根据上述Poly I∶C转染试验结果,选择2 μg·mL-1剂量和处理时间24、48 h作为后续的试验条件。
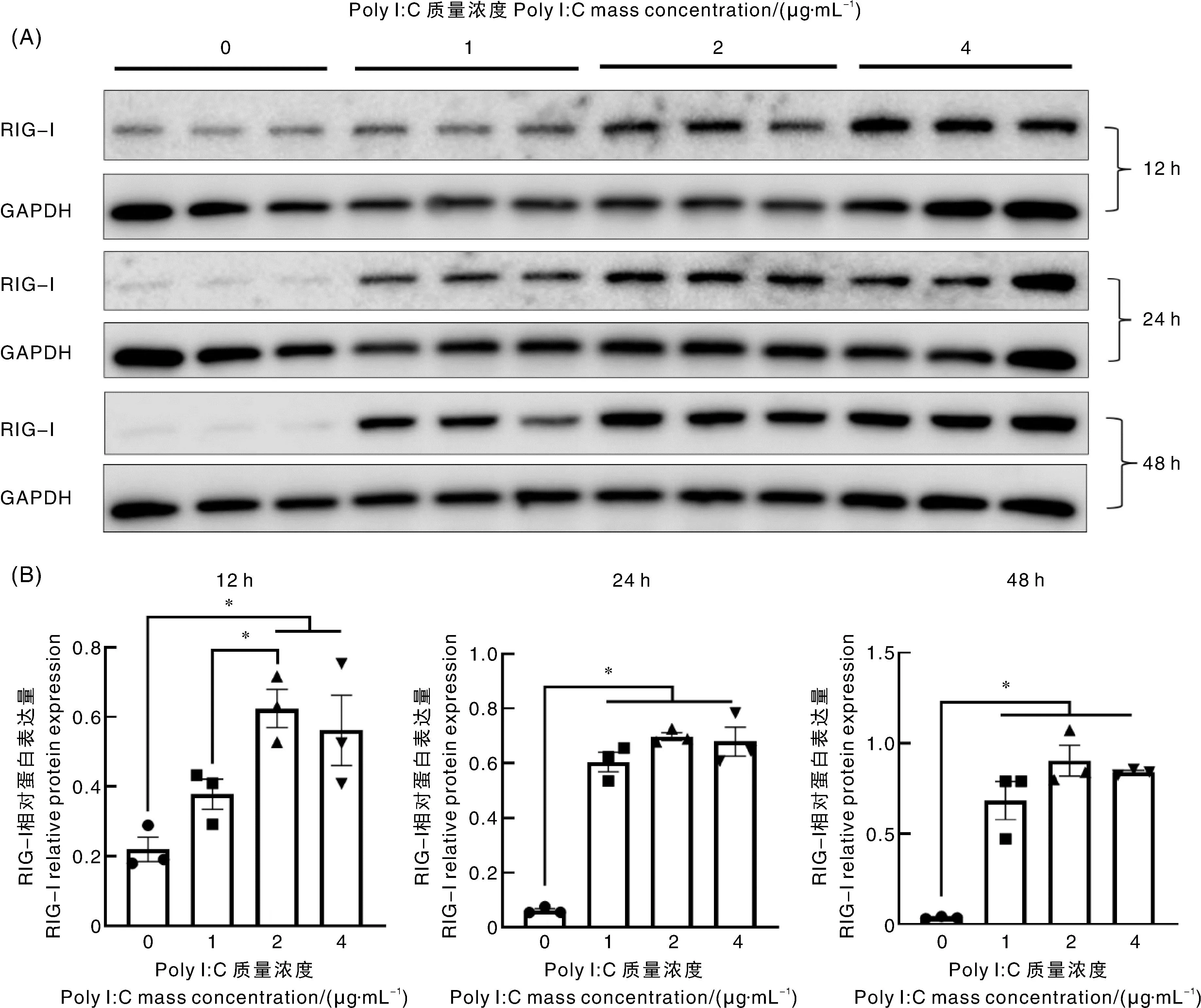
A,Western blot;B,条带灰度值;*,P<0.05。A, Western blot; B, Gray density of bands; *, P<0.05.图3 poly I∶C转染后HEK293细胞中RIG-Ⅰ蛋白的表达量Fig.3 RIG-Ⅰ protein expression in HEK293 cell transfected with poly I∶C
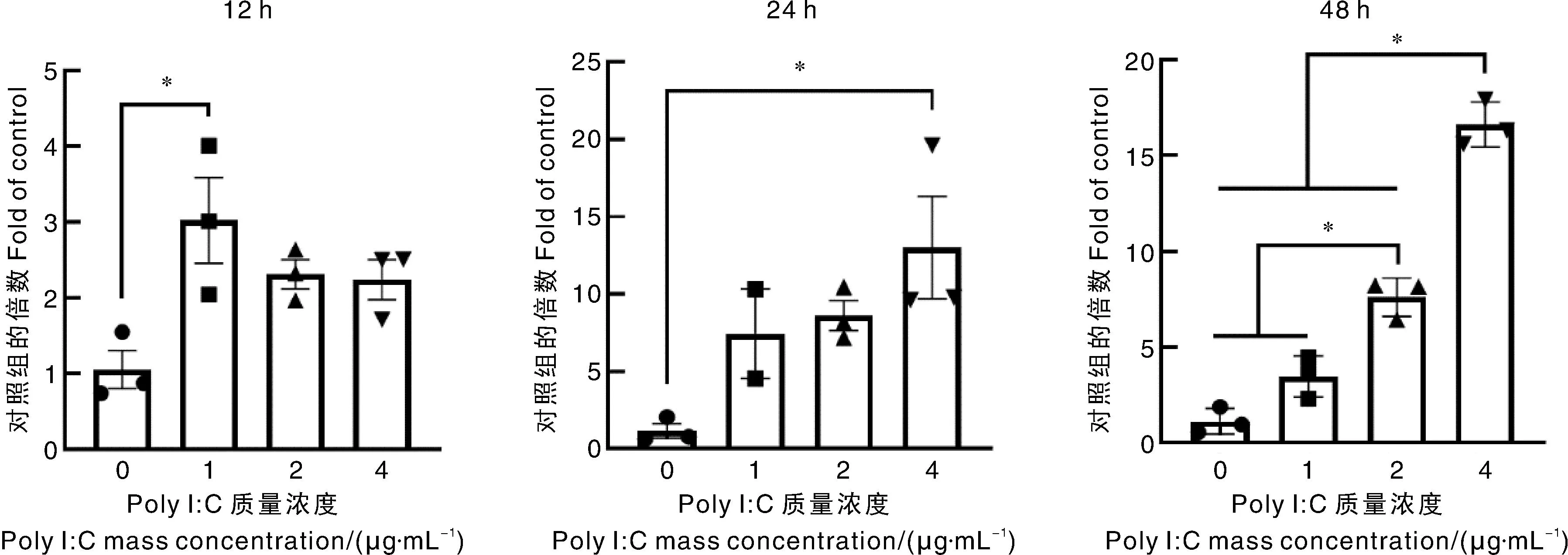
图4 poly I∶C转染后HEK293细胞中RIG-Ⅰ基因的转录水平Fig.4 mRNA transcription level of RIG-Ⅰ in HEK293 cell transfected with poly I∶C
2.2 宽体金线蛭提取物对HEK293细胞形态和RLRs信号通路的影响
尽管图5不能明显呈现水蛭提取物对于Poly I∶C转染24 h和48 h引起的细胞数量减少有抑制作用,但是细胞活力结果表明,单独用150 μg·mL-1水蛭提取物处理HEK293细胞24 h和48 h,均显著提高了细胞活力,而且300 μg·mL-1水蛭提取物处理48 h也会显著提高细胞活力。细胞活力结果也表明,在Poly I∶C转染24 h和48 h时,150 μg·mL-1水蛭提取物具有抑制细胞活力降低的作用(图6)。
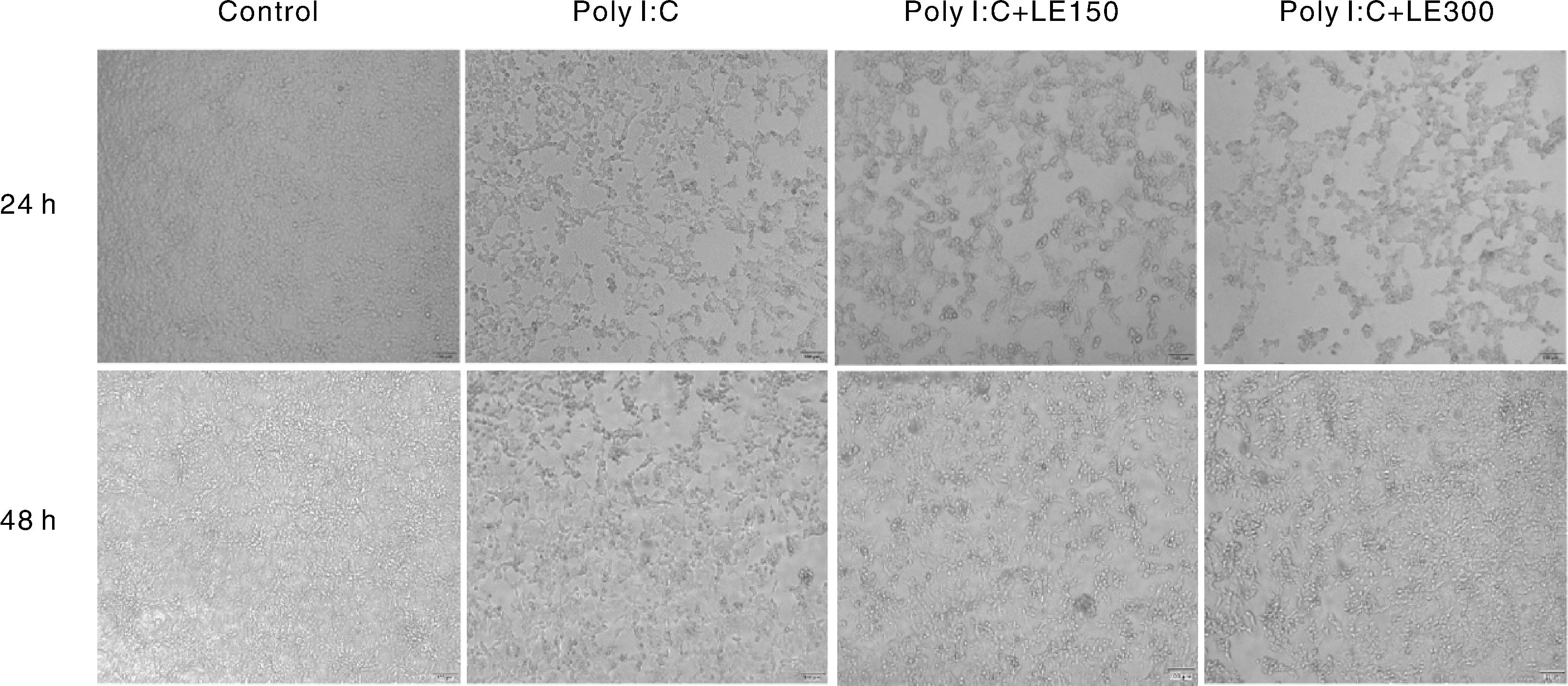
图5 宽体金线蛭提取物处理HEK293细胞后细胞形态的变化Fig.5 Morphology change of HEK293 cell treated with Whitmania pigra extract
Poly I∶C转染HEK293细胞24 h时,水蛭提取物并没有显著降低RIG-Ⅰ的蛋白表达水平和mRNA转录水平(图7、图8),但是300 μg·mL-1水蛭提取物处理组的RIG-Ⅰ蛋白水平显著低于150 μg·mL-1水蛭提取物处理组(图7)。poly I∶C转染HEK293细胞48 h时,300 μg·mL-1水蛭提取物处理组的RIG-Ⅰ蛋白水平显著低于poly I∶C对照组(图7),但是RIG-Ⅰ的mRNA转录水平在这两组之间无显著差异,且2个剂量水蛭提取物处理组之间无显著差异(图8)。
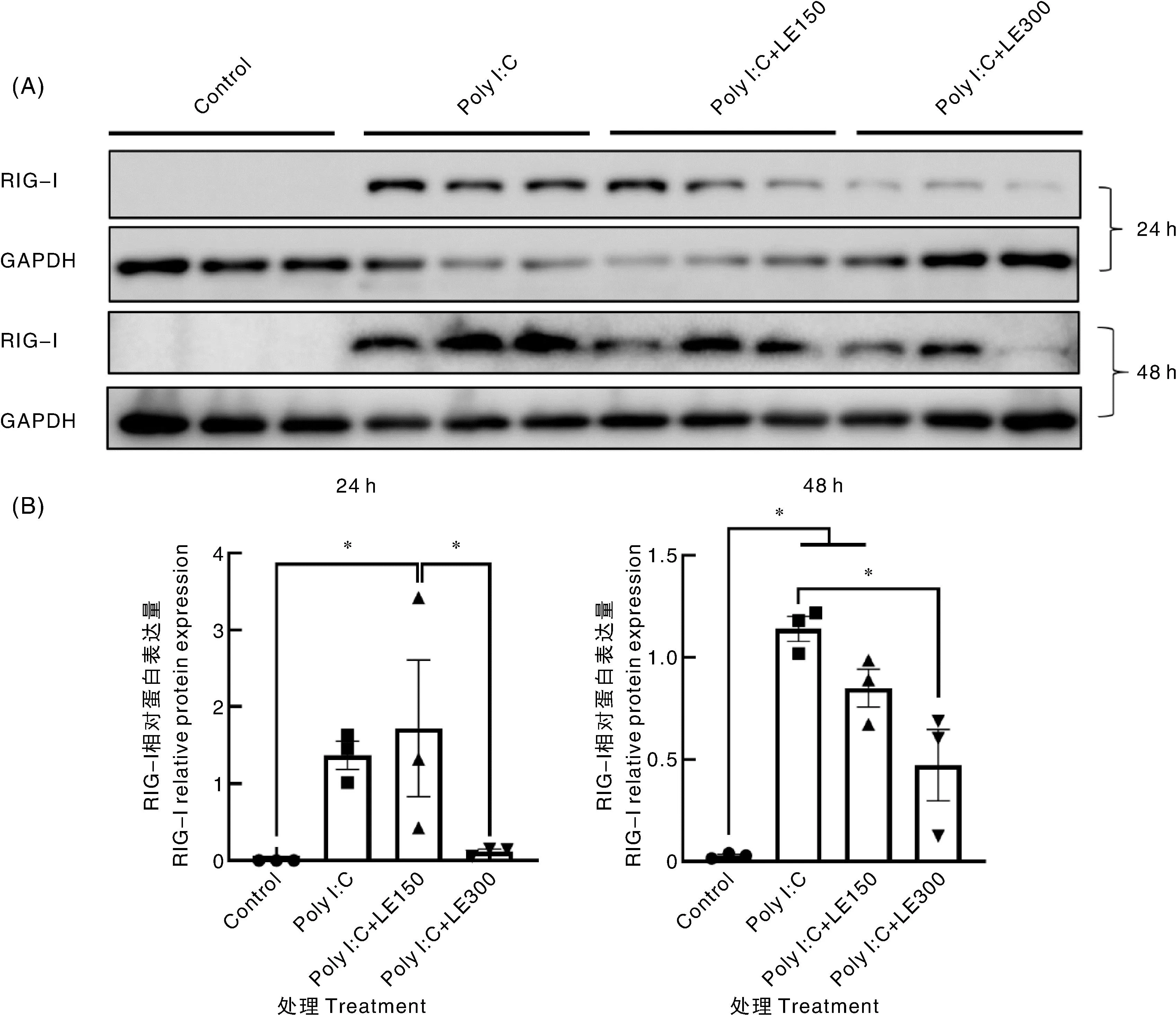
A,Western blot;B,条带灰度值。A, Western blot; B, Gray density of bands.图7 宽体金线蛭提取物处理后HEK293细胞中RIG-Ⅰ蛋白的表达量Fig.7 RIG-Ⅰ protein expression in HEK293 cell treated with Whitmania pigra extract
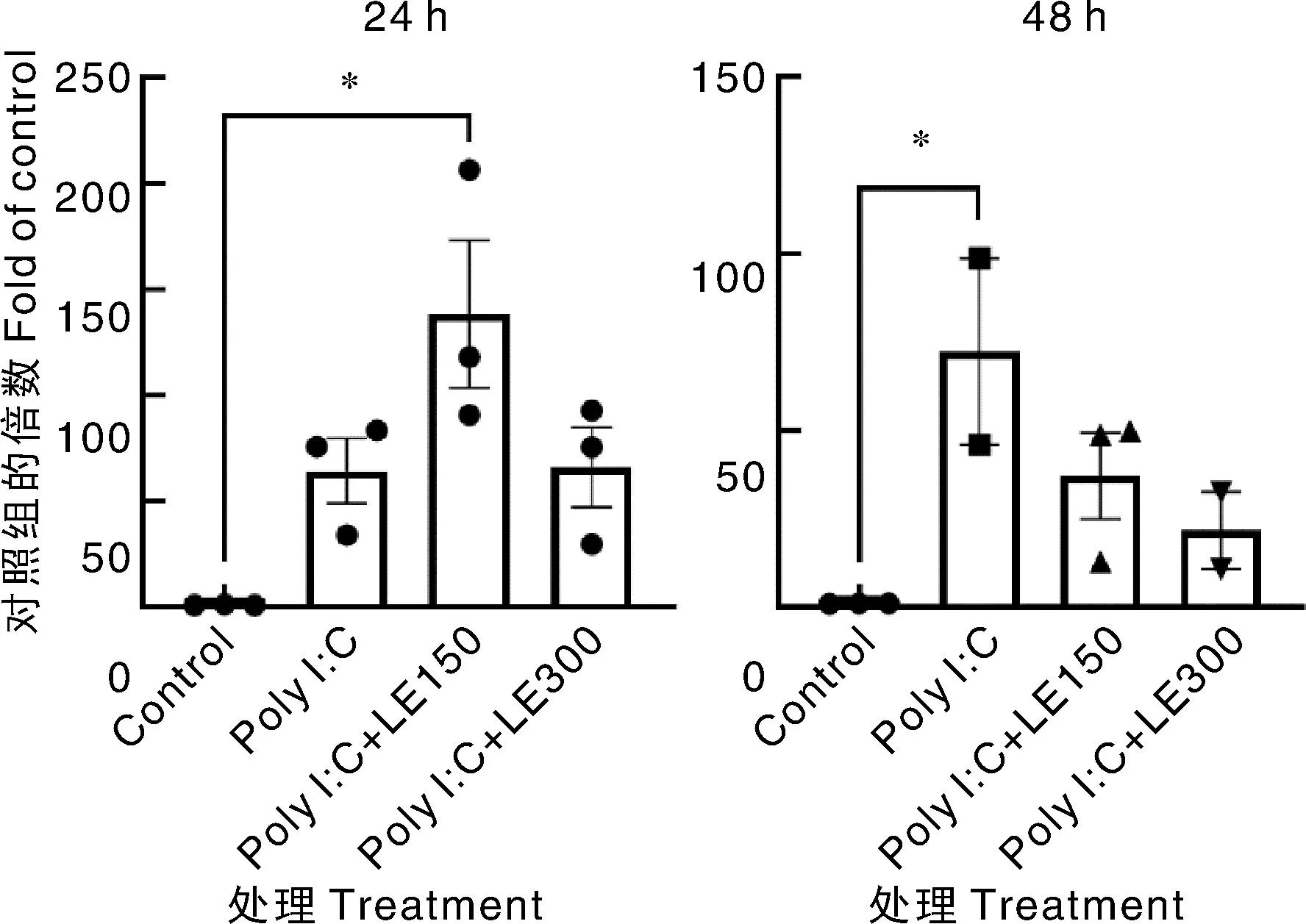
图8 宽体金线蛭提取物处理后HEK293细胞中RIG-Ⅰ mRNA的转录水平Fig.8 mRNA transcription level of RIG-Ⅰ in HEK293 cell treated with Whitmania pigra extract
与poly I∶C处理相比,150 μg·mL-1和300 μg·mL-1水蛭提取物在24 h和48 h均显著抑制了IFN-β的mRNA转录水平(图9-A和图9-B);与此相对应的是,24 h和48 h的IFN-β的生成量也受到2个质量浓度水蛭提取物的显著抑制(图9-C和图9-D)。
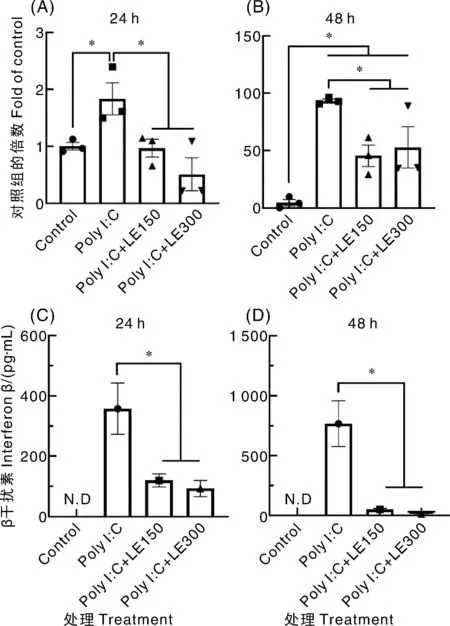
*,P<0.05;N.D表示未检出。*P<0.05; N.D represents non-detected.图9 宽体金线蛭提取物处理后HEK293细胞中IFN-β的mRNA转录水平和IFN-β生成量Fig.9 mRNA transcription level and production of IFN-β in HEK293 cell treated with Whitmania pigra extract
Poly I∶C处理HEK293细胞48 h,显著提高了干扰素通路中MDA5基因的mRNA转录水平(图10-A),但是对于MAVS(图10-B)、TRAF3(图10-C)、IRF3(图10-D)、TRAF2(图10-E)和NF-κB(图10-F)的mRNA转录水平无显著影响。与Poly I∶C处理相比,除MDA5基因外,添加150、300 μg·mL-1水蛭提取物对其他5个基因的mRNA转录水平均无显著影响。
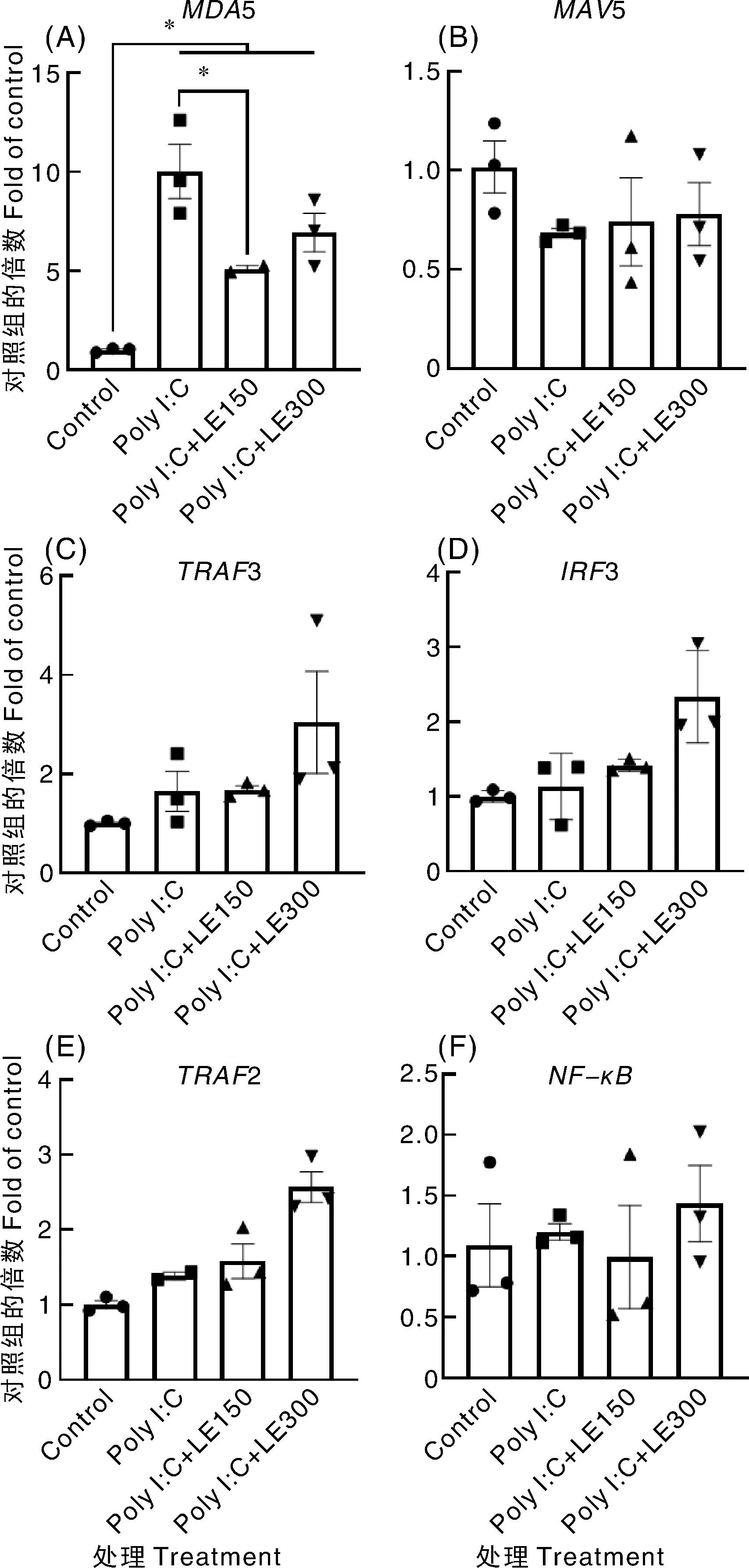
图10 宽体金线蛭提取物处理48 h后HEK293细胞中RLRs信号通路因子的mRNA转录水平Fig.10 mRNA transcription level of the factors involved in RLRs signaling pathway in HEK293 cell treated with Whitmania pigra extract for 48 h
3 讨论
病毒进入细胞质并进行复制的过程中会产生dsRNA,受感染的宿主细胞质中的RLRs家族可以专门监测细胞质中的异源性dsRNA,从而激活内在的抗病毒信号通路。目前已知RLRs由3种组分构成,分别是RIG-Ⅰ、MDA5和LGP2。Poly I∶C是dsRNA的类似物,RLRs因子会将其当作病毒产生的dsRNA,从而激活该通路。本试验中,Poly I∶C成功地激活了HEK293细胞的RIG-Ⅰ并产生干扰素,表明HEK293细胞具有完整的抗病毒信号通路。目前已知,Poly I∶C可激活多个物种的多个细胞类型的抗病毒信号通路,包括人、哺乳动物和水生动物的免疫细胞、体细胞和癌细胞等[15,22-26],本试验首次尝试对HEK293细胞的抗病毒信号通路进行激活。
1、2、4 μg·mL-1poly I∶C处理HEK293细胞12、24、48 h后,均会引起细胞数量的减少。细胞活力结果证实,Poly I∶C质量浓度越高,处理时间越长,细胞活力越低,提示在试验设置条件范围内,Poly I∶C诱导细胞数量减少呈剂量依赖性和时间依赖性,这一趋势与申鹏等[27]在人肝癌细胞(SMMC-7721)上的研究结果相一致。此外,细胞类型不同、转染方法不同也会导致Poly I∶C对细胞数量减少作用的差异。Sales Conniff等[22]用电穿孔的方法进行转染,结果显示,0.4 mg·mL-1Poly I∶C处理24 h后显著降低了乳房癌细胞(CAL2539)和纤维肉瘤细胞(CAL-1751)的细胞活力。Poly I∶C转染后引起细胞数量减少的原因较为复杂,目前研究较多的是癌细胞的凋亡机制,已经证实Poly I∶C转染引起的癌细胞凋亡的原因之一是多个因子综合作用激活NF-κB并产生Ⅰ型干扰素,这些因子中最为重要的是Toll样受体3(TLR3)[28]和RLRs家庭成员[29]。此外,最新的研究证实,Poly I∶C处理也会激活p38信号通路,促进活性氧自由基(ROS)的生成,并促进Caspase-8和Caspase-9的激活,这一机制与宫颈癌细胞的凋亡有关[16]。本试验中,2、4 μg·mL-1Poly I∶C转染HEK293细胞24 h和48 h,引起RIG-Ⅰ的蛋白表达水平显著提高,4 μg·mL-1Poly I∶C转染HEK293细胞24 h和48 h,引起RIG-Ⅰ mRNA转录水平显著提高,同时也出现了细胞数量减少,这一结果符合RIG-Ⅰ的激活与细胞凋亡具有相关性的理论。当然,细胞类型不同,激活RIG-Ⅰ所需的Poly I∶C剂量和时长也会存在着差异,例如,Zhou等[30]采用10 μg·mL-1Poly I∶C转染人肝癌细胞(Huh7)16 h后,显著提高了RIG-Ⅰ、MDA5和TLR-3的mRNA转录水平。Qin等[24]采用0.3 μg Poly I∶C转染间质细胞6 h,观察到RIG-Ⅰ和TLR-3的mRNA转录水平显著提高。另有研究采用10 μg·mL-1Poly I∶C转染猪骨骼肌卫星细胞,在12 h时检测到RIG-Ⅰ mRNA转录水平显著提高,但是在24 h和48 h,RIG-Ⅰ mRNA转录水平并没有显著变化[31]。本试验的HEK293细胞在Poly I∶C转染12 h时开始检测到RIG-Ⅰ蛋白表达水平和mRNA转录水平的提高,由于12 h是本试验设置的最短处理时间,不排除处理时长短于12 h时,HEK293细胞RIG-Ⅰ蛋白表达水平和mRNA转录水平也会提高。
基于前述的试验结果,本试验采用2 μg·mL-1Poly I∶C对HEK293细胞进行后续试验,并揭示了2 μg·mL-1Poly I∶C转染HEK293细胞24 h和48 h后,不仅RIG-Ⅰ、MDA5和IFN-β1的表达水平受到显著影响,同时生成了β干扰素。这进一步证实了Poly I∶C作为一种病毒模拟物对HEK293细胞的有效性。本研究中,单独用150 μg·mL-1水蛭提取物处理24 h和48 h,均会显著提高细胞活力,而且300 μg·mL-1的水蛭提取物处理48 h,也会显著提高细胞活力,150 μg·mL-1水蛭提取物对于Poly I∶C转染处理24 h和48 h引起的细胞活力降低具有显著的抑制作用,但是300 μg·mL-1的水蛭提取物却没有同样的效果。该结果说明适宜质量浓度的水蛭提取物具有促进细胞活力的作用,但是过高的质量浓度可能会抑制细胞活力。肖移生等[32]证实1 400 μg·mL-1水蛭提取物处理HL-60细胞48 h以后,对于细胞增殖的抑制度达到了55.46%,抑制的机制之一是诱导HL-60细胞向成熟粒系方向分化,进而抑制细胞增殖。另有研究证实,3 000 μg·mL-1水蛭提取物具有诱导人肝癌HepG2细胞凋亡的作用,且分子机制与下调多药耐药基因1(MDR1)表达和上调半胱天冬酶3基因(Caspase3)表达有关[32];2 000 μg·mL-1和4 000 μg·mL-1水蛭提取物处理肺泡上皮细胞48 h后,也出现了凋亡现象[33]。上述研究采用的水蛭提取物的质量浓度是本研究的10~20倍,过高的剂量或是引起细胞凋亡的主要原因之一,但是也有可能是细胞类型不一样引起的差异。本研究中150 μg·mL-1水蛭提取物具有最佳的促进HEK293细胞活力的效果,该机制尚不明确。但有研究证实,水蛭提取物具有抗炎作用[34],能减少炎病因子的产生[35],提高血清超氧化物歧化酶(SOD)的活性[36],这些指标说明水蛭提取物对机体细胞具有保护作用,最终可能引起细胞活力的增强。有关水蛭提取物促进HEK293细胞活力的机制需要在后续的研究中进一步探索。
Poly I∶C处理HEK293细胞24 h时,300 μg·mL-1水蛭提取物具有抑制poly I∶C引起的RIG-Ⅰ蛋白和基因表达量上升的作用,且该处理组的RIG-Ⅰ蛋白水平显著低于150 μg·mL-1水蛭提取物处理组。延长处理时间至48 h时,300 μg·mL-1水蛭提取物处理组的RIG-Ⅰ蛋白水平显著低于Poly I∶C对照组,表明该剂量的水蛭提取物在该处理时长下,具有显著抑制RIG-Ⅰ的作用。
前言中已经介绍过病毒感染宿主细胞时,干扰素生成通路中重要因子激活后的变化规律。本试验中,在干扰素通路激活的基础上,150 μg·mL-1和300 μg·mL-1水蛭提取物在24 h和48 h均抑制了IFN-β的mRNA转录和β干扰素的生成,表明该通路的上游节点RIG-Ⅰ和下游节点IFN-β均受到Poly I∶C的激活,且受到水蛭提取物的抑制,但是该通路中其他节点,除了MDA5的表达量受Poly I∶C诱导上调以外,其他基因(MAVS、TRAF3、TRAF2、IRF3、NF-κB)的表达量不受Poly I∶C和水蛭提取物的影响。这些因子的mRNA转录水平变化不显著不足以说明该因子不起调控作用,原因是因子激活的方式也包括构象的变化和翻译后的修饰,如,MAVS与RIG-Ⅰ等基因不同,其不属于干扰素刺激基因,转录水平不直接受干扰素调控,MAVS的表达和功能更多受到转录、转录后和翻译后的调控[37],RIG-Ⅰ活化以后,从细胞质转运至细胞内膜,例如线粒体相关膜(MAM),RIG-Ⅰ的2CARD结构域与MAVS的N端CARD域结合,促进MAVS发生寡聚化,从而激活MAVS[7]。MAVS翻译后的调控,对于干扰素的生成起着重要的作用,其中一个负调控机制是对MAVS的赖氨酸位点进行K48泛素化修饰;正调控机制是对MAVS的赖氨酸位点进行K63泛素化修饰,活化MAVS,也包括磷酸化修饰[38]。TRAF3与寡聚化的MAVS结合,发生K63泛素化并被激活,继而招募NEMO、TBK1/IKKε激酶复合体,活化IRF3[39-40]。IRF3激活时,其C端受2个同源蛋白激酶TBK1/IKKε的作用磷酸化;此外,泛素化是负调控IRF3转录活力的重要机制,其他影响IRF3活力的翻译后修饰机制还包括苏木化、谷胱甘肽化和干扰素刺激基因(interferon-stimulated gene, ISG)化[41]。研究表明,磷酸化对于干扰素的生成不一定是正向调控。Cheng等[42]揭示了IRF3的Ser82磷酸化抑制了β干扰素生成通路的活化。NF-κB的激活过程中TRAF2起着重要的作用[43],且TRAF2与肿瘤坏死因子受体1(TNFR1)和肿瘤坏死因子受体2(TNFR2)相结合,对典型的NF-κB激活起着正调节作用,对非典型的NF-κB激活起着负调节作用[44]。NF-κB激活方式包括p65磷酸化[45]和p50的磷酸化[46]。水蛭提取物处理HEK293细胞时,分析干扰素生成通路中各个因子的mRNA转录情况只能揭示部分机制,要完全理解,则需要进行翻译后的修饰与结构变化分析。
水蛭提取物的许多成分与抗凝血作用有关,如水蛭素、溶纤素、失稳酶等,除此以外,水蛭提取物中还含有eglin-C、ghilantens和antistasin等具有抗炎作用的物质[47]。β干扰素生成通路与炎症通路具有相关性,NF-κB在这2个通路中起着节点的作用,MAVS活化以后,通过TRAF2/6等因子将信号传给kappa B激酶抑制因子(inhibitor of kappa B kinase, IKK)复合物,之后活化NF-κB并形成二聚体进入细胞核调节促炎因子和趋化因子的产生[7];因此,在炎症反应受到抑制的同时,β干扰素生成通路可能也会受到影响。在其他蛭类物种中,已经证实森林山蛭的唾液腺能够分泌一种神经肽Y-HS,该成分具有抑制炎症因子的产生,如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和单细胞趋化蛋白1(MCP-1),更为重要的是,该成分也能抑制干扰素γ(IFN-γ)的生成[48]。推测宽体金线蛭可能也存在类似的肽类物质,并具有抑制干扰素生成的作用。
本试验据此得出如下结论:1、2、4 μg·mL-1Poly I∶C转染HEK293细胞24 h和48 h后,成功地激活了RLRs信号通路;150 μg·mL-1和300 μg·mL-1水蛭提取物均具有促进HEK293细胞活力的作用,且150 μg·mL-1效果更显著;150 μg·mL-1和300 μg·mL-1水蛭提取物均有显著抑制β干扰素生成的作用,特别是300 μg·mL-1水蛭提取物处理48 h显著降低了RIG-Ⅰ的蛋白表达水平。
