大豆根际促生菌的筛选鉴定与促生效应
2024-01-02徐伟慧王志刚
刘 悦,徐伟慧,王志刚
(齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006)
大豆作为我国重要的农产品,国内供给率仅15%左右。由于耕地面积有限,大豆高度的单一性种植,以及农药和化肥的大量施用,降低了农田微生物的多样性,妨碍了植物与微生物之间的互作[1-3]。随着微生物研究技术的进步和对根际微生物了解的深入,各种微生物菌剂成为提高大豆产量和品质的方法,同时也能够满足绿色环保可持续的理念,有助于农药化肥的减施减用[4]。

从大豆根际筛选优良PGPR,以丰富田间大豆生产的优异菌种资源,对生产高效生物菌剂具有重要意义。本研究从大豆根际土壤中分离具有解磷、溶磷、解钾和固氮功能的PGPR,鉴定其菌属分类,并测定其分泌IAA和赤霉素(GA)的能力,筛选促生特性优良的PGPR,最后探究PGPR对大豆植株的促生作用,进而为大豆专用微生物肥料的研制提供候选菌剂。
1 材料与方法
1.1 材料
研究地位于黑龙江省齐齐哈尔市的梅里斯区(123°74′90.67″E,47°40′43.17″N),试验样地长26 m、宽14 m,分为9块样地,每块样地之间间隔1 m。选择生长良好的大豆植株幼苗,将植物根系与大块土壤轻轻分离,以黏附在根上的土壤为根际土壤。每块样地中随机挑选7株大豆,每株取5 g根际土壤。使用镊子从土壤中去除所有杂质,并放在无菌自封袋中,冷藏保存并带回实验室,置-80 ℃冰箱存放。
培养基。解磷菌和溶磷菌的分离分别采用蒙金娜培养基[11]、Pikovaskaia’s(PKO)培养基[12];自生固氮菌和联合固氮菌的分离分别采用阿须贝培养基[13]、联合固氮培养基[14];解钾菌的分离采用亚历山大罗夫培养基[15]。
1.2 方法
1.2.1 菌株的分离纯化
在带有玻璃珠并装有9 mL无菌水的试管中加入1 g供试土壤,在漩涡震荡仪上震动10 min,然后依次进行稀释。采用稀释涂布法分别涂布在蒙金娜培养基、亚历山大罗夫培养基、阿须贝培养基、联合固氮培养基、PKO培养基上,30 ℃培养。根据菌株在选择培养基上的生长情况,挑选生长较快、较好的单菌落,利用平板划线法反复纯化,接入对应的液体培养基中培养,3 d后取菌液离心,-40 ℃保藏备用。
1.2.2 菌株鉴定
采用细菌基因组DNA提取试剂盒(天根,北京)提取DNA,选择通用引物27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGYTACCTTGTTACGACTT-3′)扩增16S rDNA序列,PCR扩增产物送生工生物工程(上海)股份有限公司测序。将测序结果在NCBI数据库进行BLAST序列比对,使用MEGA 11软件构建系统发育树。
1.2.3 溶血试验
将鉴定出的菌株在血平板培养基(博赛,郑州)上点样,置于30 ℃培养箱中培养20~24 h,判断其是否有溶血性。
1.2.4 菌株的促生能力测定
将细菌接种于阿须贝培养基、联合固氮培养基、蒙金娜培养基、PKO培养基上,通过菌株在选择培养基上的生长情况和有无透明圈来判断其固氮、解磷和溶磷的活性[16]。
将解钾菌接种于亚历山大罗夫培养基(添加溴百里酚蓝),在30 ℃培养箱中培养3~5 d后,观察菌落是否变成黄色,判断菌株解钾的能力。
自生固氮菌、联合固氮菌按体积分数1%的接种量接种于阿须贝液体培养基中,培养7 d,其中CK处理不加菌。每个样品取300 μL,加入碳氮分析仪,经过系统计算,得出测定数值[17]。
碳氮分析仪原理:高温催化氧化反应生成的氮氧化物可以通过外部的化学发光检测器(CLD)或者电化学检测器(ChD)测定。其反应方程式如下:

(1)

(2)
以氮氧化物浓度为信号源,获得不同时间点的峰面积。使用标定标准方程计算样品中的氮含量。
1.2.5 菌株的促生特性测定
将200 μg·mL-1的IAA标准液梯度稀释为0、25、50、75、100、125和150 μg·mL-1。采用Salkowski显色法,取标准液与比色液按1∶1的比例定容至25 mL,避光静置30 min,530 nm处测定吸光度,绘制标准曲线[18]。将菌株接种到牛肉膏蛋白胨培养基中活化24 h后,按1%接种量接种到含有200 mg·L-1色氨酸的牛肉膏蛋白胨液体培养基中,30 ℃,120 r·min-1培养48 h。采用Salkowski比色法,在530 nm处测定吸光度并计算菌液的IAA分泌量。每组3个平行。
将分析纯GA溶于体积分数70%乙醇中,配置100 μg·mL-1标准液,按照浓度梯度进行稀释。取各浓度的标准液0.5 mL与4.5 mL体积分数98%浓硫酸充分混匀,定容至20 mL,测定412 nm处的吸光度,绘制标准曲线[19]。按1%的接种量将种子液转接到牛肉膏蛋白胨液体培养基中,30 ℃,120 r·min-1振荡培养48 h。取0.5 mL上清液与4.5 mL浓硫酸充分混匀,定容至20 mL,在412 nm处测定吸光度并计算菌株的GA分泌量。每组3个平行。
1.2.6 大豆植株促生试验
将健康饱满的大豆(贺豆6号)种子依次浸泡于体积分数70%乙醇(4 min)、质量分数5% NaClO溶液(3 min),用无菌水冲洗4~6次。将洗净的大豆种子置于各菌株悬浮液(108CFU·mL-1)中浸泡1 h。再将种子分别播于装满灭菌蛭石与灭菌土(分离菌株的大豆田土)(体积比为1∶1)的试管中,试管规格为200 mm×200 mm,每个处理共设10个平行试验。培养条件:26 ℃光照12 h,22 ℃黑暗12 h。10 d后将大豆幼苗取出,测量株高、根长、地上鲜重和地下鲜重,并利用根系扫描仪分析其总根长和根表面积。
1.3 数据分析
采用Excel 2019软件整理数据,采用MEGA 11软件构建菌株系统发育树,采用SPSS Statistics 22软件处理与分析数据,采用Origin 2021软件作图[20]。
2 结果与分析
2.1 功能性菌株的分离纯化、鉴定与溶血性评价
通过蒙金娜培养基、亚历山大罗夫培养基、阿须贝培养基、联合固氮培养基、PKO培养基分离纯化并筛选解磷菌、解钾菌、自生固氮菌、联合固氮菌、溶磷菌,共105株。通过溶血性试验对菌株安全性进行了评价,发现共有12株细菌的菌落周围产生了溶血圈,判断这12株菌株具有溶血性,没有用于后续试验。
如图1所示,通过选择性培养基和16S rDNA基因分析筛选出的93株PGPR,其中解磷菌28株、解钾菌19株、溶磷菌9株、自生固氮菌18株、联合固氮菌19株。菌属分类结果显示,寡养单胞菌属(Stenotrophomonas)3株,假单胞菌属(Pseudomonas)3株,巨大普里斯特氏菌属(Priestia)10株,克雷伯氏菌属(Klebsiella)17株,肠杆菌属(Enterobacteria)2株,芽孢杆菌属(Bacillus)43株,节杆菌属(Arthrobacter)4株和不动杆菌属(Acinetobacter)11株。
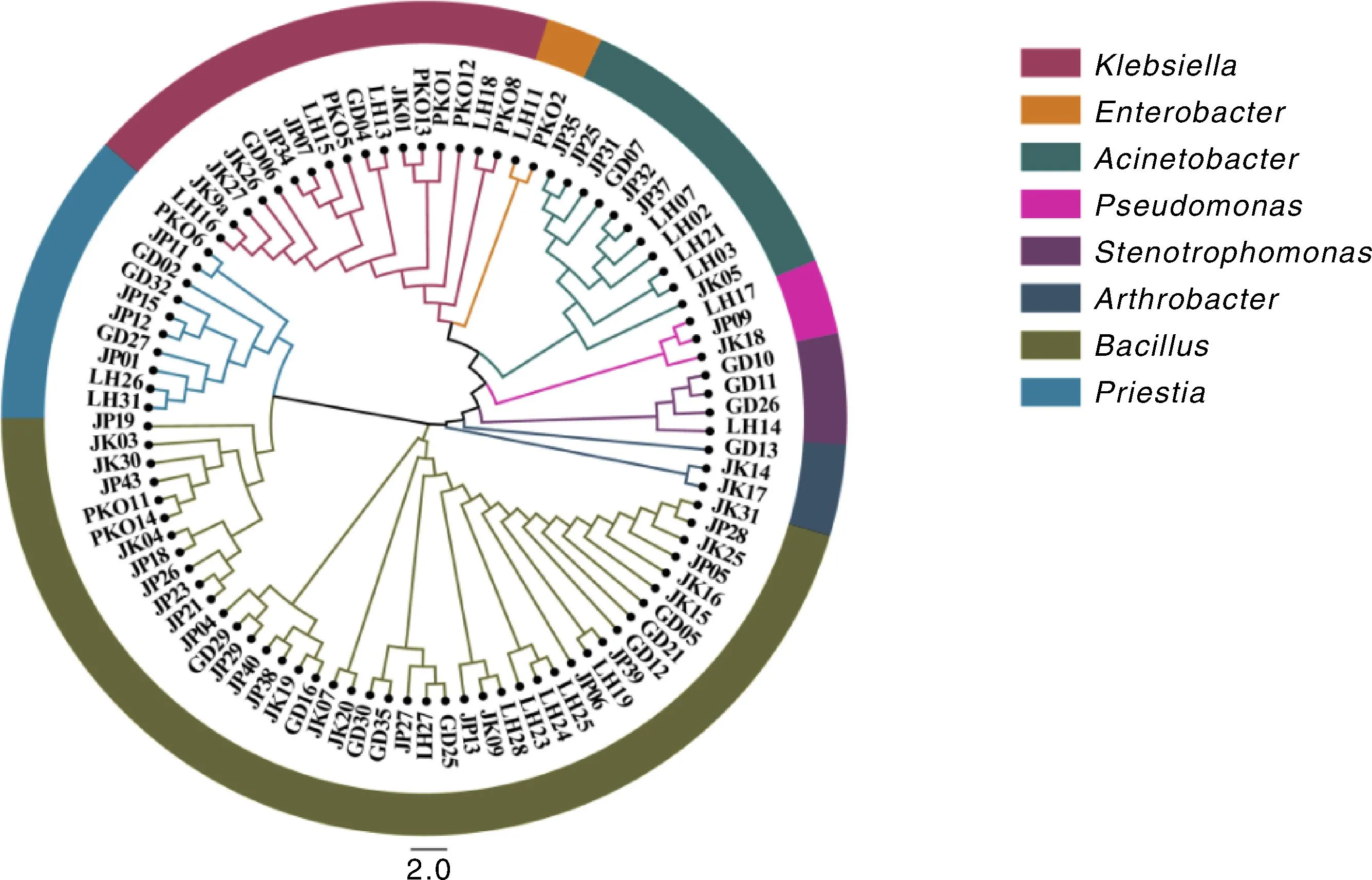
JP、JK、PKO、GD、LH分别代表解磷菌、解钾菌、溶磷菌、自生固氮菌、联合固氮菌。JP, JK, PKO, GD and LH represent phosphate dissolving bacteria, potassium dissolving bacteria, phosphate solubilizing bacteria, autotrophic nitrogen fixing bacteria and combined nitrogen fixing bacteria, respectively.图1 菌株16S rDNA基因序列系统发育树Fig.1 Phylogenetic tree of 16S rDNA gene sequence of strain
2.2 功能性菌株的初筛
如图2所示,将解磷菌在蒙金娜固体培养基上分别划线,产生促生圈的有11个菌株,分别是JP7、JP11、JP13、JP21、JP27、JP28、JP29、JP32、JP34、JP35和JP37;将溶磷菌在PKO固体培养基上分别划线,产生促生圈的有3个菌株,分别是PKO1、PKO8和PKO13;把解钾菌在亚历山大罗夫培养基(添加溴百里酚蓝)上点样,有3个菌株变成黄色,分别是JK1、JK9和JK32。

图2 根际促生菌的解磷(a)、溶磷(b)和解钾(c)的能力测定结果Fig.2 Results of determination of phosphate dissolving (a), phosphate solubilizing (b) and potassium dissolving (c) of rhizosphere growth-promoting bacteria
图3所示,利用碳氮分析仪测定菌株的固氮能力,其中CK不加菌。固氮能力测定中自生固氮菌GD6、GD4和GD32的固氮能力较强(图3-a),发酵液中总氮含量平均值分别是11.80、11.48、9.71 mg·L-1;联合固氮菌中LH26、LH25、LH8、LH18和LH17固氮能力强(图3-b),发酵液中总氮含量平均值分别是9.83、6.20、6.17、6.17、5.39 mg·L-1。

误差线上无相同字母表示差异显著(P<0.05)。下同。The error line marked without the same lower letters indicated significant differences at P<0.05. The same as below.图3 自生固氮菌(a)与联合固氮菌(b)的固氮能力Fig.3 Nitrogen fixation ability of autotrophic nitrogen fixing bacteria (a) and combined nitrogen fixing bacteria (b)
2.3 功能性菌株的促生功能特性
选择上述试验中解磷、溶磷、解钾、自生固氮、联合固氮能力强的45株功能性菌株进行IAA分泌量和GA分泌量测定。根据标准曲线y=0.006 8x-0.007 9(R2=0.995 8),计算菌株的IAA分泌量。由图4可知,菌株IAA分泌量为39.28~111.59 mg·L-1,不同菌株间IAA分泌量差异显著。其中LH11菌株的IAA分泌量最高,平均值为111.59 mg·L-1;其次是PKO13、JK1和GD4菌株的IAA分泌量,平均值分别为101.79、90.51、89.04 mg·L-1。

图4 联合固氮菌(a)、溶磷菌(b)、自生固氮菌(c)、解钾菌(d)、解磷菌(e)分泌IAA和GA的能力Fig.4 The ability of combined nitrogen fixing bacteria (a), phosphate solubilizing bacteria (b), autotrophic nitrogen fixing bacteria (c), potassium solubilizing bacteria (d) and phosphate dissoloving bacteria (e) strains to secrete IAA and GA
根据标准曲线y=0.060 5x+0.03(R2=0.994 8),计算菌株的GA分泌量。由图4可知,菌株GA的分泌量为1.79~13.66 mg·L-1,其中PKO8菌株的GA分泌量最高,平均值为13.66 mg·L-1,其次是LH13和JP32菌株,平均值分别为12.78、11.98 mg·L-1。
2.4 接种PGPR对大豆植株促生效果的验证
对2.3节中IAA和GA分泌能力强的29个PGPR菌株进行试管苗试验,结果如图5所示。菌株JK32、GD6、PKO13、GD32、GD3、JP34、JP7这7株PGPR能显著(P<0.05)促进大豆植株的生长。与CK相比,菌株JK32促进大豆植株根长、地上鲜重、地下鲜重、根表面积和总根长发育,分别提高36.37%、34.1%、61.1%、47.86%和58.10%;菌株GD6接种的大豆植株根长、地上鲜重、地下鲜重、根表面积和总根长分别提高34.42%、28.30%、58.22%、42.93%和52.63%;菌株PKO13接种的大豆植株根长、地上鲜重、地下鲜重和根表面积分别显著提高34.42%、30.06%、57.14%和54.69%;菌株GD32接种的大豆植株株高、根长、地上鲜重、地下鲜重和根表面积分别显著提高27.79%、34.2%、29.63%、55.41%和48.67%;菌株GD3接种的大豆植株株高、根长、地下鲜重和根表面积分别显著提高32.12%、34.93%、58.75%和50.44%;菌株JP34促进大豆植株株高、根长、地上鲜重和根表面积发育,分别提高42.53%、32.63%、30.06%和53.04%;菌株JP7接种的大豆植株株高、地上鲜重和根表面积分别显著提高47.54%、35.23%、48.41%。

图5 根际促生菌对大豆幼苗的促生效应Fig.5 Promoting effect of rhizosphere growth promoting bacteria on soybean seedlings
3 讨论
由于化肥在农业生产中过量使用,导致农田土壤营养成分减少,生态环境遭受破坏,迫切需要研发绿色高效可持续的生物肥料。因此,PGPR菌肥应运而生[21]。PGPR菌肥可以通过代谢活动提高土壤中有效氮、磷、钾的含量,有效提高土壤肥力,合成或分解土壤中的有机质为植物提供养分,并促进作物对肥料的吸收与利用;同时,PGPR可以分泌GA、细胞分裂素、生长素等活性物质,调控作物生长与发育,从而促进作物生长,并提高作物产量与品质[22-23]。PGPR在水稻[24]、玉米[25]、番茄[26]等作物中有良好的促生效果,在农业生产中已有很好的发展前景。因此,开展大豆根际促生细菌对大豆产量和品质影响的研究,可为实际生产中提高大豆产量、改进品质,以及开发大豆专用菌肥提供理论依据。
本研究利用解磷、解钾、固氮等选择性培养基,筛选出93株PGPR,其中包括单胞菌属、假单胞菌属、普里斯特氏菌属、克雷伯氏菌属、肠杆菌属、芽孢杆菌属、节杆菌属和不动杆菌属。杨婉秋等[27]以高寒草甸植物根际土壤为材料,利用解磷、溶磷、固氮、解钾选择性培养基共分离鉴定出44株PGPR,发现它们分属于6个菌属,分别是不动杆菌属、沙雷氏菌属、假单胞菌属、芽孢杆菌属、戴尔福特菌属和寡养单胞菌属。江美彦等[28]利用固氮、溶磷、解钾培养基从白芷根际分离筛选得到31株PGPR,其中64.52%均属于芽孢杆菌属,其他菌属为肠杆菌、类芽孢杆菌、假单胞菌、克雷伯氏菌、假芽孢杆菌。以上研究所筛选的菌种中芽孢杆菌占比最多,其次是克雷伯氏菌。在已有的研究报道中,芽孢杆菌耐受性强,实际应用广泛,所以大豆根际中的芽孢杆菌具有巨大应用潜力[29]。
在植物激素中,IAA对植物的生命活动影响最大,主要体现在对植物根系的促进[30]。GA是一种天然的植物生长调节剂,参与植物生长发育。GA处理可缩短萌芽的时间,提高种子的萌发率,促进植物生长,以及提高作物产量和品质等[31]。张垚等[32]从辣椒根际中筛选出溶磷菌、解磷菌和固氮菌,分别测定IAA和GA的分泌量,将IAA、GA分泌量高的PGPR进行种子萌发和辣椒幼苗促生效果的试验验证。柴加丽等[33]通过测定PGPR分泌IAA、GA和玉米素的能力,综合判定12株PGPR具有促生特性。刘泽平等[34]发现,筛选的PGPR普遍具有分泌IAA的能力,其中BacillussubtilisLZP06的IAA分泌量最高,为92.26 mg·L-1;GA分泌量最高的为BacillussubtilisLZP06号菌株,其分泌量为24.91 mg·L-1。以上结果表明,PGPR可能主要是通过固氮、解磷、产IAA和GA促进植物生长。
本研究中JK32、GD6、PKO13、GD32、GD3、JP34和JP7对大豆生长和根形态表现出积极的促进作用。杨淼泠等[35]证明,接种克雷伯氏菌属对病原菌具有拮抗作用,同时对番茄种子萌发,以及幼苗的株高、根长、地上部生物量有促进作用。王丹丹等[36]发现,克雷伯氏菌和芽孢杆菌对花生种子萌发,以及幼苗的株高、根长等的促生效果明显。以上研究证实了克雷伯氏菌属可以在根际定殖并且促进作物生长,在功能开发上具有较大的潜力。
4 结论
从大豆根际分离并筛选得到93株PGPR,其中46.23%均属于芽孢杆菌。有45株PGPR有较强的解磷、溶磷、解钾和固氮的能力;29株PGPR产IAA和GA能力较强;7株PGPR对大豆株高、根长、总根长、根表面积等有显著的促进作用,其中4株为克雷伯氏菌属,2株为芽孢杆菌属,1株为普里斯特氏菌属。
