肾素前体和成熟肾素的原核表达及纯化
2024-01-02张超汪静李小鹏张江涛张传宝
张超,汪静,李小鹏,张江涛,张传宝
北京医院国家老年医学中心国家卫生健康委临床检验中心中国医学科学院老年医学研究院,北京 100730
目前,体外诊断试剂发展迅速,但大多数项目缺乏标准化,且能够独立生产高质量校准品和质控品的厂家较少。70%以上的项目无标准物质,能够购买到的标准物质大部分依赖于进口,价格昂贵,如蛋白质、氨基酸、痕量激素等,其中对心血管疾病、高血压、慢性肾病、内分泌疾病等大病、慢病发生发展有重要指示意义的蛋白类项目,其标准物质更是极为匮乏。国家卫生健康委临床检验中心负责全国临床检验质量评价、参考系统建立与标准化工作,用于室间质量评价(external quality assessment,EQA)项目的蛋白类质控品大部分通过购买,质量参差不齐,且诸多项目尚无质控品。近年基因工程技术发展飞速,重组蛋白体外诱导表达和融合标签纯化在蛋白质晶体结构解析、药物研发、蛋白功能研究等领域发挥重要作用[1-5],该技术取材不受限制、生产周期短、纯度高、基质稳定、可量产,能够满足日益增长的临床检验实际需求。
肾素又称血管紧张素原酶,是由球旁复合体颗粒细胞释放的一种蛋白水解酶,是肾素-血管紧张素系统的重要组成部分,而肾素释放是决定血浆中血管紧张素浓度的关键条件[6-8]。肾素可催化血管紧张素原转变成血管紧张素Ⅰ(10 肽),血管紧张素Ⅰ在转换酶作用下降解为血管紧张素Ⅱ(8肽),血浆中血管紧张素Ⅱ的生物活性最强[9-10]。肾素在心血管系统疾病,如高血压等诊断中较为重要。肾素前体(renin,REN)由406 个氨基酸残基组成,相对分子质量约为46 000,包含20 和46 个氨基酸的前后片段;成熟肾素(REN-340)包含340个氨基酸残基,相对分子质量为34 000[11]。本研究通过构建REN和REN-340的原核表达质粒,于E.coli中表达后,经Ni-NTA镍离子亲和层析纯化,以期获得高浓度重组REN 和REN-340蛋白,用于制备标准物质及质控品。
1 材料与方法
1.1 菌株及质粒 感受态E.coliDH5α及BL21(DE3)均购自北京擎科生物基因科技有限公司;质粒pET-28a(+)由清华大学结构生物学高精尖创新中心惠赠。
1.2 主要试剂及仪器 限制性核酸内切酶EcoRⅠ、NheⅠ、MluⅠ、XhoⅠ及T4 DNA 连接酶均购自英国NEB 公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;LB 培养基、卡那霉素、IPTG 及咪唑均购自美国Sigma公司;肾素ELISA 检测试剂盒购自武汉华美生物工程有限公司;Ni-NTA 镍离子亲和树脂及镍离子亲和层析柱购自生工生物工程(上海)股份有限公司。
1.3REN基因的合成 从NCBI数据库中检索获得人REN基因序列(5972),根据E.coli密码子偏好进行优化,委托北京擎科生物科技股份有限公司合成REN及REN-340基因序列,并于REN基因的N-末端和C-末端分别添加NheⅠ和EcoRⅠ酶切位点,REN-340基因的N-末端和C-末端分别添加NcoⅠ和XhoⅠ酶切位点。
1.4 重组表达质粒的构建 将REN及REN-340基因分别经NheⅠ、EcoRⅠ和NcoⅠ、XhoⅠ双酶切后,与经相同双酶切的载体pET-28a(+),以T4 DNA连接酶于25 ℃连接2 h;连接产物转化至感受态E.coliDH5α,经50 μg/mL Kan+抗性筛选后,挑取阳性克隆,进行相应双酶切鉴定,选择鉴定正确的克隆送北京擎科生物科技股份有限公司测序。将测序正确的重组表达质粒分别命名为6×His-REN-pET和6×His-REN-340-pET。
1.5 重组蛋白的初步诱导表达 将重组表达质粒6×His-REN-pET 和6×His-REN-340-pET 分别转化至感受态E.coliBL21(DE3),挑取单克隆,接种至5 mL LB培养基,37 ℃,200 r/min 培养过夜;按1∶500 的体积分数接种至250 mL LB 培养基,继续培养至A600=0.6 ~ 0.8,分别加入终浓度为0.2 和0.5 mmol/L的IPTG,于16 及37 ℃,160 r/min 诱导6 h;取菌液,5 500 ×g离心5 min,收集菌体,用20 mL 裂解液(150 mmol/L NaCl,50 mmol/L Na3PO4,pH 8.0)重悬,冰浴超声破碎15 min(超声2 s,间隔3 s);裂解产物经4 ℃,5 500 ×g离心15 min,取上清液,与2 mL Ni-NTA 亲和树脂于4 ℃充分混匀2 h;用20 mmol/L咪唑洗涤非特异性结合,再用250 mmol/L咪唑洗脱重组人6×His-REN蛋白,进行10%SDS-PAGE分析。
1.6 重组蛋白诱导表达条件的优化
1.6.1 诱导温度 在终浓度为0.5 mmol/L的IPTG,160 r/min 的条件下,分别于20、25、30、37 ℃下诱导6 h,其他条件同1.5项。
1.6.2 IPTG 浓度 于终浓度分别为0.1、0.2、0.4、0.5 mmol/L 的IPTG,160 r/min 的条件下,37 ℃诱导6 h,其他条件同1.5项。
1.7 重组蛋白浓度的检测 用ddH2O将人肾素ELISA检测试剂盒中的肾素标准品稀释为0、15.6、31.2、62.5、125、250、500、1 000 mIU/mL 的溶液(编号为S0 ~S7),采用该试剂盒进行检测,以标准品A450的lg值为横坐标,标准品浓度的lg 值为纵坐标,建立回归曲线,获得回归方程,并计算R2。应用该试剂盒检测经Ni-NTA 亲和层析纯化的样品,将其A450带入回归方程,获得纯化样品浓度。
1.8 数据采集及分析 应用Excel 2019 软件进行数据采集、分析及作图。
2 结果
2.1 重组表达质粒的鉴定 重组表达质粒6 × His-REN-pET 和6 × His-REN-340-pET 双酶切(分别为EcoRⅠ、MluⅠ及MluⅠ、XhoⅠ)产物经1%琼脂糖凝胶电泳分析,分别可见约2 100 和1 800 bp 目的基因片段,见图1。测序结果表明,重组表达质粒中的目的基因序列与NCBI 中登录的基因序列完全一致。表明原核表达质粒构建正确。
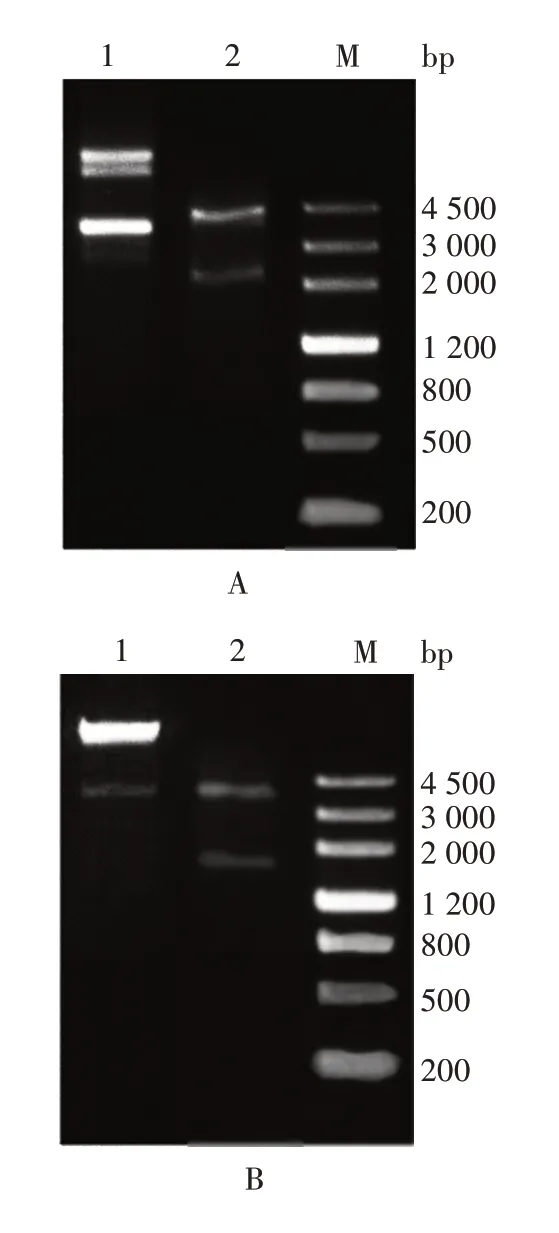
图1 重组表达质粒的双酶切鉴定Fig. 1 Identification of recombinant expression plasmids by double enzyme digestion
2.2 重组蛋白的初步诱导表达 重组蛋白REN 和REN-340 相对分子质量分别约为48 000 和34 000,大小与预期相符。诱导温度为16 ℃时,虽蛋白表达量较少,但与37 ℃比较,低温条件下诱导REN 和REN-340 的杂蛋白更少。在相同条件下,REN-340的表达量明显多于REN,且温度越高蛋白的表达量越高;IPTG 终浓度变化对蛋白表达量影响较小。见图2。为更精确诱导表达温度及IPTG 终浓度,需对其进行进一步优化。
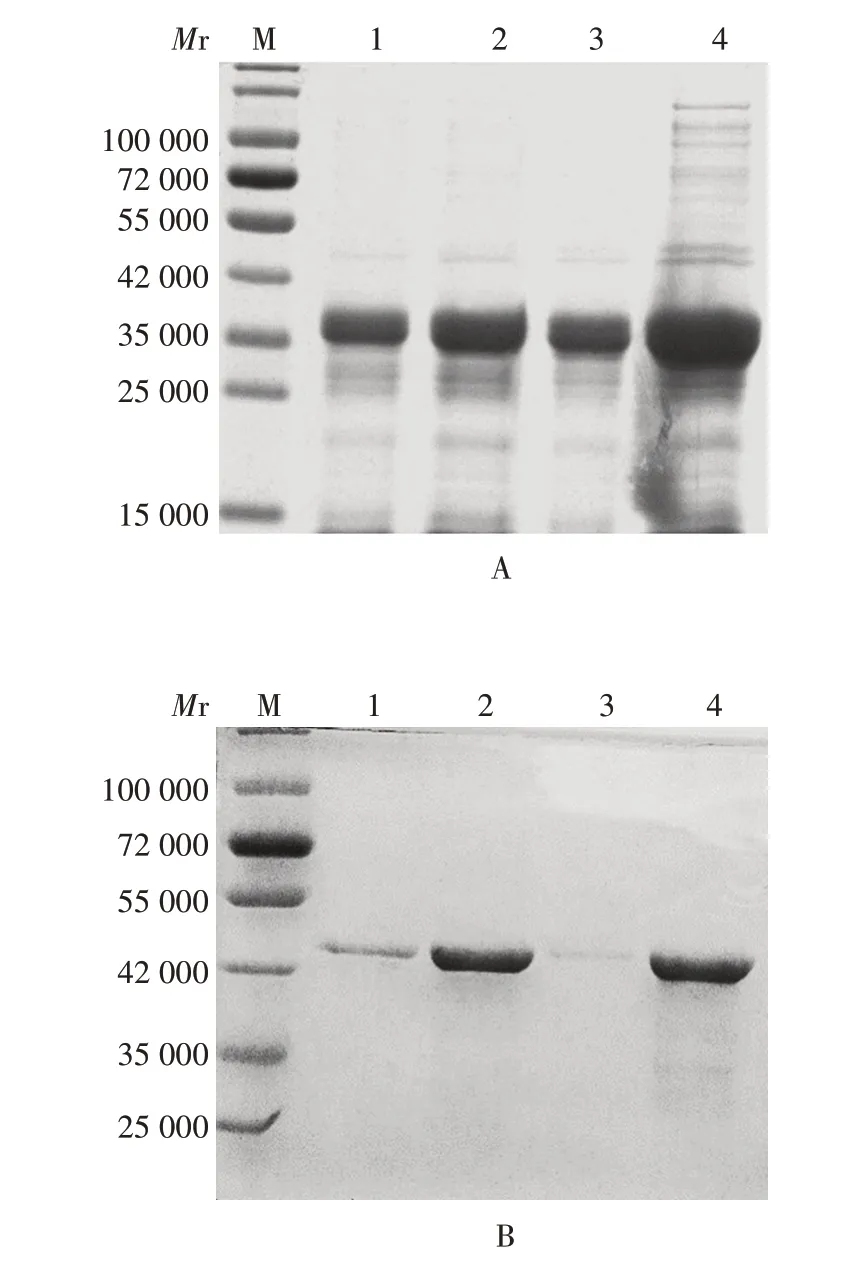
图2 初步诱导纯化产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of preliminarily induced purified products
2.3 重组蛋白的最佳诱导表达条件
2.3.1 最佳诱导温度 诱导温度为37 ℃时,REN 表达量最高,因此确定REN 最佳诱导温度为37 ℃。随着温度的升高,REN-340 浓度呈增加趋势,但差异较小,且杂蛋白含量相应增加,因此,确定REN-340 的最佳诱导温度为20 ℃。见图3。
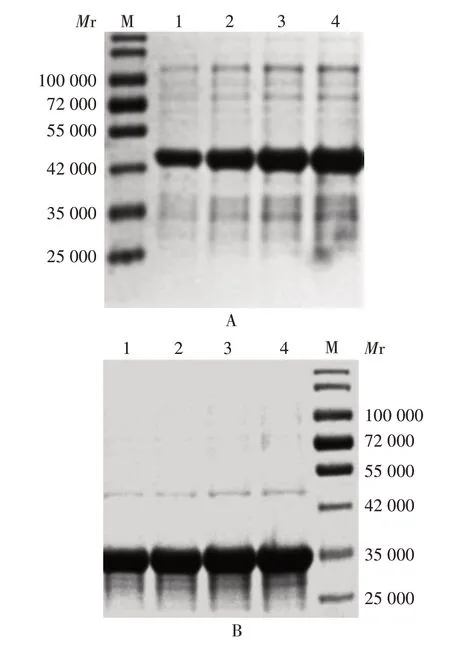
图3 不同诱导温度对REN(A)及REN-340(B)表达的影响Fig. 3 Effects of different induction temperatures on expression of REN(A)and REN-340(B)
2.3.2 最佳IPTG 的浓度 IPTG 终浓度为0.1、0.2、0.4、0.5 mmol/L时,REN的表达量变化较小,考虑到IPTG 本身的毒性及试剂成本,因此确定诱导REN 的IPTG最佳终浓度为0.1 mmol/L。IPTG为0.1 mmol/L时,REN-340表达量较少;浓度为0.2 ~0.5 mmol/L时,REN-340 的浓度升高,但差异较小,因此确定诱导REN-340的IPTG最佳终浓度为0.2 mmol/L。见图4。
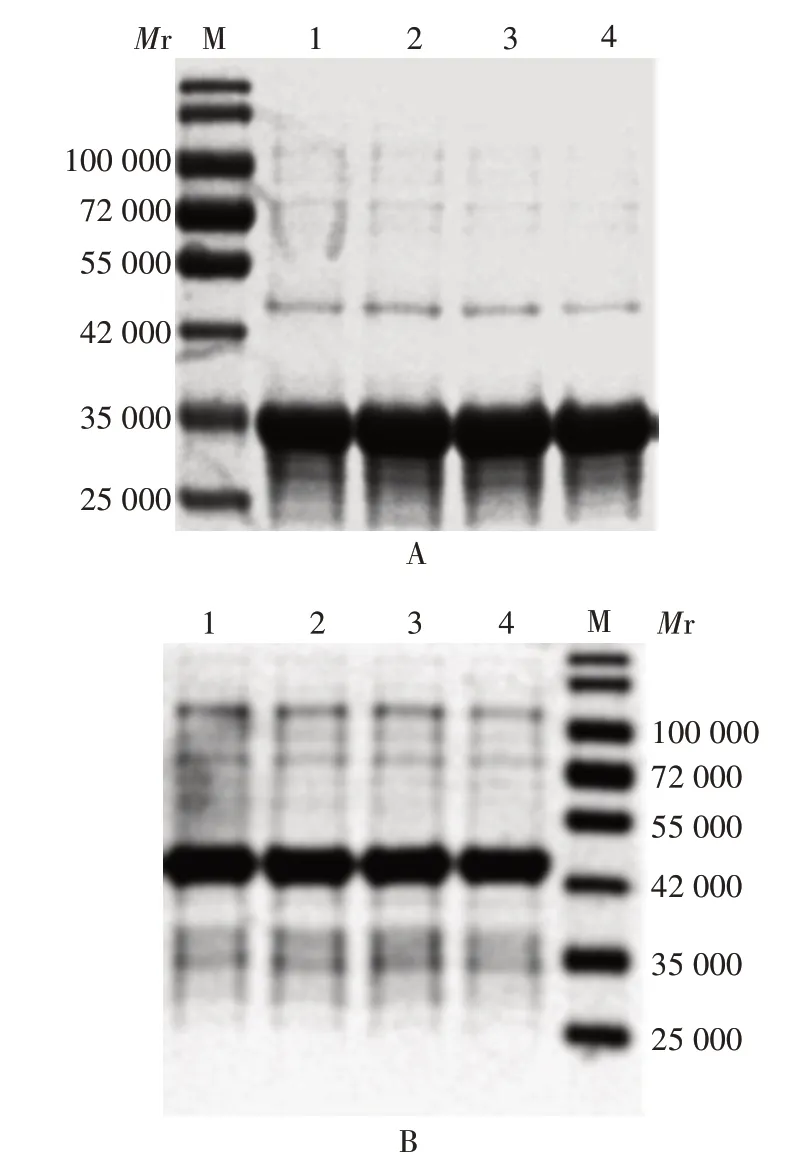
图4 不同IPTG终浓度对REN-340(A)及REN(B)表达的影响Fig. 4 Effects of different IPTG final concentrations on expression of REN-340(A)and REN(B)
2.4 重组蛋白的浓度 肾素标准品回归曲线见图5,获得回归方程为:y=1.502 6x+2.403 1,R2=0.998 2,见图5。经计算,REN 和REN-340 的浓度分别为9 148.21和15 115.31 mIU/mL。
3 讨论
目前,高血压等慢病是影响健康老龄化的重要疾病之一,肾素水平测定在高血压诊断和分型中具有重要意义[12-13]。《原发性醛固酮增多症诊断治疗的专家共识》中明确建议,血浆醛固酮与肾素活性比值是首选筛查指标,而肾性高血压和原发性高血压等用药指导也均需检测肾素水平[14-15]。实验室检测体系中直接肾素浓度包括μIU/mL和pg/mL两种单位,两者间无统一换算系数,给醛固酮肾素的检验结果互认和高血压诊疗带来极大困难,因此亟需开展肾素-醛固酮的标准化和一致化工作,标准物质是必需品。
临床肾素检测范围为0.5~500 ng/mL,以REN为例计算1 次纯化所得的纯品蛋白可制备质控品的数量,本研究从250 mL 培养基中可获得3 mL 纯化的重组REN,浓度较高,稀释20~2 000倍后,以1 mL为单位进行分装,可制作60~6 000支(浓度约5 500 μg/L)质控品,而从菌液培养至蛋白提取纯化仅需2 个工作日,可满足目前参加肾素浓度EQA 计划的需求。原核表达技术可快速、高效、高浓度生产标准物质和质控品,纯化后的REN-340蛋白浓度更高,从250 mL培养基中可获得3 mL 纯化的重组REN-340,稀释30~3 000 倍后,以1 mL 为单位进行分装,则可制作90~9 000支(浓度约5 500 μg/L)质控品。若能够成功转化,将大幅度降低肾素-醛固酮EQA计划的成本,对于国家临床检验中心的标本制备及各地三级公立医院参与肾素-醛固酮EQA计划均可提供极大便利。
本研究后续将对REN 和REN-340 纯化样品按ISO Guide 35要求进行均匀性、稳定性、基质效应及互通性评价[16-21]。定值方式采用多中心联合定值,用质谱方法为所纯化的REN 和REN-340 蛋白定值,然后将制备的候选标准物质和质控品在短时间内送多个临床实验室进行适用性评价,收集回报结果,计算不确定度。目前,国家卫生健康委员会临床检验中心已开展醛固酮和肾素的EQA计划,检测直接肾素浓度。使用标本类型为新鲜冰冻人血清,人血清的收集涉及伦理、人力成本、运输成本等诸多问题,且费用较高,本研究制备的重组REN 和REN-340 蛋白可大幅降低成本,使EQA工作能更好地为临床检测服务。
